Experiment de Rutherford
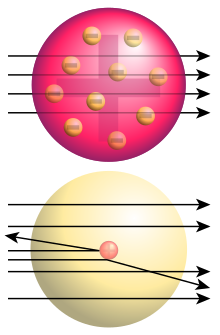
L'experiment de Rutherford, anomenat també experiment de Geiger-Marsden o experiment de la làmina d'or, és el nom que reben un conjunt d'experiments realitzats pel físic alemany Hans Geiger (1882–1945) i el britànic Ernest Marsden (1889–1970), sota la direcció del britànic Ernest Rutherford (1871–1937), en els Laboratoris de Física de la Universitat de Manchester, Regne Unit, entre 1908 i 1913. En aquests experiments es llançaven feixos molt fins de partícules α (nuclis d'heli, ), emeses per productes de desintegració del radi (radó 222, poloni 218 o bismut 214), contra làmines molt fines de diferents metalls (or, argent, coure…) i s'observava la dispersió que es produïa darrera d'elles en travessar-les, o davant si rebotaven, mitjançant un microscopi que permetia veure els minúsculs impactes damunt d'una pantalla fosforescent de sulfur de zinc. Els resultats obtinguts no concordaren amb el model de l'àtom vigent fins aquell moment, el model de Thomson, i Rutherford realitzà la hipòtesi de l'existència del nucli atòmic que concentrava tota la càrrega elèctrica positiva i gairebé tota la massa de l'àtom, mentre que els electrons orbitaven envoltant el nucli. Les dimensions d'aquest nucli havien de ser 10 000 vegades inferiors a les de l'àtom. Les prediccions de Rutherford foren plenament confirmades en el darrer experiment realitzat per Geiger i Marsden el 1913 i que és el que habitualment se cita com experiment de Rutherford, malgrat ni el realitzà ell ni donà resultats inesperats.
Antecedents[modifica]

El 1906, després d'haver descobert que la radioactivitat natural és un procés de transmutació d'elements químics amb emissió de partícules α i β a Mont-real, Canadà, el físic neozalendès Ernest Rutherford (1871–1937) dirigí el seu programa de recerca cap a l'estudi de la interacció de les partícules α amb la matèria mitjançant un mètode fotogràfic. Ben prest descobrí que quan aquestes partícules travessen la matèria, algunes d'elles es desvien de la seva direcció inicial i es dispersen. L'aparell emprat per Rutherford estava fet d'un vas dins del qual es podia fer el buit, una font de radiació α, una pantalla amb una estreta escletxa per col·limar el feix de radiació α, i una placa fotografica per detectar les partícules α. Tot l'aparell el situà dins d'un camp magnètic, el sentit del qual l'invertia cada 10 minuts. El temps d'exposició fou de 2 hores.[1]
Rutherford descobrí que la imatge de l'escletxa produïda pel feix de partícules α tenia les vores definides quan l'experiment es realitzava en el buit. Si, per contra, l'aire omplia l'aparell, o si l'escletxa estava coberta amb una fina làmina de matèria (una mica, de 3x10–3 cm de gruix), s'ampliava el rastre fotogràfic dels raigs α i la intensitat de l'efecte fotogràfic s'esvaïa lentament a banda i banda del centre. La conclusió era una indubtable dispersió dels raigs. Després d'aquest experiment, que per primera vegada demostrà l'existència de la dispersió de partícules α, Rutherford ja no treballà en aquest tema específic, sinó que continuà bregant amb la naturalesa i les propietats de les partícules α. Com més tard recordà Rutherford, "un examen detallat de la quantitat i el caràcter de la dispersió de les partícules α en el pas per la matèria fou fet primer per Hans Geiger" (1882–1945), el jove estudiant alemany de doctorat de Rutherford a la Universitat de Manchester, més tard assistit per Ernest Marsden (1889–1970), encara un estudiant de postgrau. El gran salt en la qualitat dels experiments de Geiger i Geiger i Marsden fou degut a la introducció d'un mètode molt més precís per detectar les partícules, el mètode de centelleig. Es basà en un efecte descobert per primera vegada pel químic anglès William Crookes (1832–1919) i pels físics alemanys Julius Elster (1854–1920) i Hans Geitel (1855–1923) el 1903: si un petit cristall de sulfur de zinc , fosforescent, s'exposa als raigs α i s'observa amb lupa, es veuen breument punts de llum brillants sobre la superfície del cristall. El físic alemany Erich Regener (1881–1955) fou el primer a idear, el 1908, un mètode quantitatiu per detectar i comptabilitzar partícules α d'aquest efecte mitjançant un microscopi.[1]
L'experiment de Geiger del 1908[modifica]


El 1908, Hans Geiger publicà un article[2] on explicava l'experiment que dugué a terme per estudiar la magnitud de la dispersió de les partícules α en travessar la matèria mitjançant l'ús del mètode de centelleig i el mètode de Regener de comptar els centellejos. La part principal de l'aparell de Geiger consistia en un tub de vidre d'uns 2 metres de longitud i 4 cm de diàmetre. Les partícules α emeses per una font intensa de radó 222, col·locada dins del tub cònic R de la figura, passaven per una estreta escletxa S, a 114 cm de la font, i produïen una imatge d'aquesta escletxa en una pantalla fosforescent Z, situada al final del tub de vidre, a 54 cm de l'escletxa. El nombre de centelleigs en diferents punts de la pantalla els comptabilitzà directament mitjançant un microscopi M adequat, de 50 augments.[3]
Mitjançant aquest experiment, Geiger descobrí que, si es feia el buit dins del tub, gairebé no s'observaven centelleigs fora de la imatge geomètrica de l'escletxa. Per contra, quan entrava una mica d'aire en el tub, la zona on s'observaven els centelleigs augmentava molt. Resultats similars s'obtenien si es feia el buit dins del tub, però posant un full d'or o alumini tapant l'escletxa a AA. I encara s'ampliava més aquesta zona si el posaven dos fulls d'or o d'alumini. Segons Geiger, aquest experiment proporciona una confirmació directa que les partícules α són dispersades per la matèria, gasos o sòlids, i que aquesta dispersió pot assolir un angle apreciable.[3]

Els experiments de Geiger i Marsden del 1909[modifica]

Malgrat que la dispersió que experimenten les partícules α es limita a un petit angle (uns pocs mm d'ampliació a una distància de 54 cm després de travessar un fi full d'or o alumini), Geiger i Marsden decidiren investigar-la detalladament. El 1909 publicaren un article[4] on explicaren un descobriment sorprenent. Inspirats en les recents observacions de Heinrich Willi Schmidt, que quan les partícules β xoquen contra una placa, la radiació emergeix del mateix costat de la placa en què xoquen, Geiger i Marsden es qüestionaren si podria passar també amb les partícules α, malgrat els experiments precedents de Rutherford i Geiger indicaven que era un fenomen poc probable.[3]

En una sèrie d'experiments, Geiger i Marsden comptabilitzaren partícules α reflectides per diversos metalls (or, argent, platí, coure, estany, alumini, ferro i plom), i també el nombre reflectit per diferents gruixos d'or (fàcilment disponible en làmines uniformement fines). En aquests experiments, es col·locà una placa de plom P entre la font de radiació α AB i la pantalla de detecció S, de manera que l'únic camí disponible d'origen a detector era per reflexió d'una làmina metàl·lica RR. L'observació es feia amb un microscopi M. Primer demostraren que la quantitat de reflexió augmentava segons la massa atòmica del reflector. A continuació, comprovaren que el nombre de centelleigs depenia del gruix del reflector, d'una manera similar als experiments de reflexió utilitzant raigs β. Això suposà una evidència clara per a la dispersió extrema no només a la superfície, sinó també dins del volum del material.[1]
| Metall | Or | Platí | Estany | Argent | Coure | Ferro | Alumini |
|---|---|---|---|---|---|---|---|
| Massa atòmica relativa, Ar | 197 | 195 | 119 | 108 | 64 | 56 | 27 |
| Nombre d'impactes per minut, N | 67 | 63 | 34 | 27 | 14,5 | 10,2 | 3,4 |
| Ar/N | 34 | 33 | 28 | 25 | 23 | 18,5 | 12,5 |
En un altre experiment empraren un aparell que consistia en una font de partícules α (radi dipositat sobre la placa A), un reflector de platí R d'un cm² de superfície, una pantalla de sulfur de zinc S. L'arranjament era tal que les partícules α que arribaven a S no provenien directament d'A, sinó que havien de ser desviades a R. Amb aquest experiment Geiger i Marsden descobriren que de cada unes 8 000 partícules α que incidien a R, una d'elles rebotava. A més d'això, mitjançant l'estudi de la quantitat relativa de reflexió a partir de diferents gruixos, també descobriren que la dispersió posterior no es produeix a la superfície sinó que té lloc dins del volum de la placa de platí; i que aquest efecte es limita a una capa relativament fina com per requerir la presència dins de l'àtom de forces molt intenses (aproximadament la meitat de les partícules reflectides es reflectien a partir d'una capa ,equivalent a uns 2 mm d'aire). Si es té en compte l'alta velocitat i massa de les partícules α, semblava sorprenent que algunes d'elles poguessin girar dins d'una capa de 6 x 10–5 cm d'or amb un angle de 90°, o superior.[3]
L'experiment de Geiger del 1910[modifica]

El 1910, Geiger en solitari, publicà[5] els resultats del seu treball realitzat amb l'objectiu d'obtenir una mesura quantitativa de la dispersió mitjançant la determinació de l'angle més probable a través del qual es reflecteix una partícula α passant per un gruix determinat de matèria. Atès que la quantitat de partícules α disperses és comparativament petita, Geiger emprà una font intensa de radó pur per evitar emissions d'altres radionúclids, dipositat al tub de vidre cònic A.[3] El feix era col·limat per una escletxa D i xocava contra un full d'or situat a E. Les partícules dispersades s'observaven en xocar contra la pantalla de sulfur de zinc S a 13 cm del full a E. Els fulls també es podien situar just darrera de l'escletxa D o, amb fulls de major capacitat de dispersió, damunt el suport R a qualsevol distància de la pantalla.[5]
A partir d'aquest experiment, Geiger trobà que per a petits gruixos d'or l'angle més probable de dispersió augmenta a un ritme proporcional a l'arrel quadrada del gruix de la matèria travessada, d'acord amb la teoria de múltiples dispersions, segons la qual la dispersió d'un feix de partícules a través d'una fina capa metàl·lica es deu a moltes petites dispersions produïdes per cada àtom travessat.[3]
Sobre la base d'aquestes noves dades pogué arribar a una interpretació dels resultats dels experiments precedents (1 de cada 8 000 partícules α reflectides d'un angle superior a 90° per una capa d'or de gruix equivalent a 5 mm d'aire). L'angle més probable de dispersió Φ era d'aproximadament 1°. Un càlcul senzill, assumint la llei ordinària de probabilitat, mostra que la probabilitat que una partícula α sigui dispersada un angle superior a 90° és extremadament petita, molt inferior a 1 de cada 8 000 partícules α. Segons la llei de probabilitat, la probabilitat que una partícula alfa fos dispersa d'angle β més de 90° era . La probabilitat esperada era de 8 x 10–40, extremadament petita. L'anàlisi de Geiger demostrà que la interpretació estàndard, basada en la teoria de la dispersió múltiple, no funcionava per a grans angles de dispersió i calia un mecanisme diferent. Tanmateix Geiger no realitzà cap hipòtesi i deixà aquest problema a Rutherford.[3]
La teoria de Rutherford[modifica]

Davant la impossibilitat de conciliar els grans angles de dispersió de partícules α amb la teoria de la dispersió múltiple, Rutherford suggerí el 1911 una nova teoria de la dispersió basada en el supòsit que els grans angles de dispersió eren produïts per una única col·lisió atòmica. Un avanç d'aquesta teoria fou comunicada per primera vegada per Rutherford a la Societat Literària i Filosòfica de Manchester en la reunió ordinària del 7 de març de 1911. La teoria completa fou publicada a la Philosophical Magazine l'abril de 1911.[6]

Segons aquest model, l'àtom es compon d'un nucli molt petit, situat al centre de l'àtom i carregat positivament envoltat d'una esfera de càrrega negativa igual però uniformement distribuïda, per la qual cosa el seu efecte sobre la dispersió de les partícules α és insignificant. Les grans desviacions de les partícules α es deuen principalment al seu pas per l'intens camp elèctric central. Els ordres de magnitud per al radi nuclear són d'uns 10–12 cm, i per a tot l'àtom d'uns 10–8 cm. El nombre de partícules α escampades per diferents làmines que contenen el mateix nombre d'àtoms hauria de ser proporcional a , on és la massa atòmica del metall de la làmina. En el model de Rutherford, si , i són la càrrega, massa i velocitat inicial d'una partícula α, el nombre total de partícules α que impacten sobre el material de dispersió, és la càrrega central de l'àtom dispersant i si és el nombre d'àtoms per unitat de volum del material, el nombre de partícules escampades per unitat d'àrea de la pantalla de sulfur de zinc col·locades en un angle a la direcció original de les partícules són donades per:[3]
L'experiment definitiu[modifica]

El 1913, la teoria de Rutherford fou provada detalladament per una sèrie d'experiments duts a terme per Geiger i Marsden.[7] En aquests experiments Geiger i Marsden utilitzaren una plataforma giratòria A per observar les partícules α dispersades per un full d'or F en diferents direccions, i que impactaven sobre la pantalla S de sulfur de zinc. El feix de partícules α s'obtenien a partir d'un radionúclid (radó 222, poloni 218 o bismut 214) situat a R i eren col·limades per una escletxa D. Aquest dispositiu estava ubicat dins d'un cilindre metàl·lic B tapat amb una tapadora de vidre P. Pel tub T es feia el buid dins del cilindre.[3]

Es feren observacions per a angles de dispersió entre 5° i 150°. Modificant adequadament aquest aparell, Geiger i Marsden estudiaren també com la dispersió depèn del gruix del material, de la seva massa atòmica i de la velocitat de les partícules α. Trobaren que el nombre de partícules α que emergeixen d'una làmina dispersa en un angle amb el feix original varia segons el i és directament proporcional al gruix del material que les dispersa. A més, la quantitat de dispersió és proporcional al quadrat de la massa atòmica i a la quarta potència inversa de la velocitat de les partícules α incidents. En definitiva, tots els resultats de la investigació estaven d'acord amb les deduccions teòriques de Rutherford, i apportaven una forta evidència de l'existència d'una intensa càrrega positiva al centre, de dimensions molt petites en comparació amb el diàmetre de l'àtom.[3]
Rutherford era conscient que aquest model d'àtom era inestable, però optà per ignorar aquesta dificultat. Per a Rutherford, "la qüestió de l'estabilitat de l'àtom proposat no ha de seren aquesta etapa, òbviament dependrà de l'estructura minuciosa de l'àtom, i de la moció de les parts acusades". De fet, la sortida d'aquesta dificultat requeria una interpretació mecànica quàntica,emergent. El mateix any dels experiments de Geiger i Marsden (1913), el físic danès Niels Bohr (1885–1962) aconseguí assegurar l'estabilitat del model de Rutherford dins de la mecànica quàntica i la idea d'un nucli obtingué ràpidament una acceptació total en la comunitat científica.[3]
Referències[modifica]
- ↑ 1,0 1,1 1,2 Baily, C. «Early atomic models – from mechanical to quantum (1904–1913)» (en anglès). The European Physical Journal H, 38, 1, 01-01-2013, pàg. 1–38. DOI: 10.1140/epjh/e2012-30009-7. ISSN: 2102-6467.
- ↑ Geiger, H.; Rutherford, E. «On the scattering of the α-particles by matter». Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character, 81, 546, 27-08-1908, pàg. 174–177. DOI: 10.1098/rspa.1908.0067.
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 Leone, M; Robotti, N; Verna, G «‘Rutherford’s experiment’ on alpha particles scattering: the experiment that never was» (en anglès). Physics Education, 53, 3, 05-02-2018, pàg. 035003. DOI: 10.1088/1361-6552/aaa353. ISSN: 0031-9120.
- ↑ 4,0 4,1 4,2 4,3 Geiger, H.; Marsden, E.; Rutherford, E. «On a diffuse reflection of the α-particles». Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character, 82, 557, 31-07-1909, pàg. 495–500. DOI: 10.1098/rspa.1909.0054.
- ↑ 5,0 5,1 Geiger, Hans; Rutherford, Ernest «The scattering of α-particles by matter». Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character, 83, 565, 14-04-1910, pàg. 492–504. DOI: 10.1098/rspa.1910.0038.
- ↑ Rutherford, E. «LXXIX. The scattering of α and β particles by matter and the structure of the atom». The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 21, 125, 01-05-1911, pàg. 669–688. DOI: 10.1080/14786440508637080. ISSN: 1941-5982.
- ↑ Geiger, H.; Marsden, E. «LXI. The laws of deflexion of a particles through large angles». The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 25, 148, 01-04-1913, pàg. 604–623. DOI: 10.1080/14786440408634197. ISSN: 1941-5982.















