Mixoma virus
| Myxoma virus | |
|---|---|
 Imatge amb microscopia electrònica d'un Mixoma virus | |
| Genoma | virus d'ADN bicatenari, virus d'ADN bicatenari i virus d'ADN bicatenari |
| Taxonomia | |
| Regne | Bamfordvirae |
| Fílum | Nucleocytoviricota |
| Classe | Pokkesviricetes |
| Ordre | Chitovirales |
| Família | Poxviridae |
| Gènere | Leporipoxvirus |
| Espècie | Myxoma virus |
El Mixoma virus és un virus del gènere Leporipoxvirus, pertanyent a la família Poxiviridae, sobretot conegut per causar mixomatosi en conills. Hi ha cinc espècies al gènere Leporipoxvirus però només el Mixoma virus té importància veterinària.[1]
El virus de la mixomatosi va ser observat per primer cop per Aragao (1927), sent classificat a la família Poxviridae, gènere Leporipoxvirus, el qual comprèn tres virus altament relacionats entre si amb conills americans del gènere Sylvilagus, dos virus trobats en esquirols nortamericans i el virus fibroma de la llebre (Lepus europaeus).
Constitueix un greu risc als criaders de conills europeus d'Europa i Califòrnia.
La majoria dels Poxvirus tenen forma de maó amb una mida 250 x 200 x 200 nanòmetres.[2] El virió del Mixoma virus és una de les partícules virals més gran coneguda per a virus animals, entre 270-350 nm, podent-se veure amb el microscopi òptic.
A diferència d'altres virus, en el Mixoma virus existeixen dues formes infectives, anomenades virus intracel·lular madur i virus extracel·lular amb coberta que s'identifiquen clarament mitjançant el microscopi electrònic.
Estructura
[modifica]Els virions de la majoria de Poxvirus estan compostos per una capa externa d'estructures tubulars, ordenades de manera irregular donant-los una aparença característica.
Un punt interessant és que estudis recents fets amb microscopi crioelectrònic suggereixen que totes aquestes estructures de superfície dels virions que han sigut utilitzats per identificar Poxvirus des del desenvolupament de microscopis electrònics contrast-negatius, poden ser artefactes causats per la deshidratació.
La capa exterior envolta un interior en forma de pes de gimnàs i dos cossos laterals de naturalesa desconeguda. El centre conté ADN viral juntament amb algunes proteïnes. Els virions són alliberats per contacte entre cèl·lules més que per ruptura cel·lular. Tenen un embolcall extra que conté lípids cel·lulars i algunes proteïnes virus-específiques.
El genoma consisteix en una sola molècula lineal d'ADN de doble cadena que pot variar de mida des de 130 kpb (Parapoxvirus), 280 kbp (Fowlpox virus), fins a 375 kpb (Entomopoxvirus). Els genomes de Vaccinia virus (191.636 bp) i molts altres Poxvirus han sigut seqüenciats completament. Els genomes dels Poxvirus tenen enllaços que uneixen les dues cadenes d'ADN a ambdós costats; els finals de cada cadena d'ADN tenen loops de nucleòtids repetits.
Els genomes dels Poxvirus tenen la capacitat de codificar 200 proteïnes, 100 dels quals es troben en els virions. Només una petita part de les proteïnes virals tenen funcions assignades, la majoria amb funcions conegudes són enzims involucrats en la síntesi d'àcids nucleics i en els components estructurals dels virions.
Molts gens de Poxvirus codifiquen proteïnes que són secretades de cèl·lules infectades i afecten la resposta de l'hoste a la infecció. Entre aquestes viroquines es troba un homòleg d'un factor de creixement epidèrmic, una proteïna que regula a la baixa el sistema complement, viroquines conferint resistència a l'interferó i suprimint la resposta immunològica inhibint certes citocines de l'hoste.[2]
Síntesi
[modifica]Durant el seu cicle de replicació, els virions produeixen proteïnes extracel·lulars i intracel·lulars. Les proteïnes extracel·lulars s'utilitzen principalment per suprimir o eludir les respostes immunitàries de l'hoste, per tant, no són essencials. La infecció també s'inicia per virions extracel·lulars. El virus del Mixoma virus madura per gemmació naturalment a través de la membrana cel·lular de l'hoste.
Transmissió
[modifica]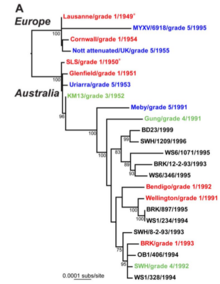
Per a entendre la propagació del virus i, per tant, la producció de la malaltia, és necessari conèixer els mecanismes de transmissió, i entendre com el virus s'estén als teixits de l'hoste i com evita els mecanismes de defensa cel·lular. Durant el procés infectiu s'expressen una sèrie de gens virals que tenen l'objectiu d'apoderar-se de la maquinària cel·lular en benefici propi i evadir els mecanismes de defensa de l'organisme. S'ha demostrat que molts d'aquests gens resideixen en la regió terminal invertida en tàndem situada en ambdós extrems del genoma viral.[3]
Es produeix transmissió mecànica. La transmissió és passiva, el virus s'adhereix a les peces bucals del vector però no es replica dins el vector. El rol de certes espècies de mosquit com a vectors es va fer aparent quan van aparèixer els primers episodis epizoòtics a Austràlia el 1950. Més tard al Regne Unit el 1971 es va trobar que diverses espècies Aedes, Culiseta, Culex i Anopheles eren els vectors més comuns.
La puça es va introduir a Austràlia l'any 1966 per actuar com a vector permanent de la mixomatosi dins de la població de conill. Es pensava que la puça tendia a seleccionar soques de Mixoma virus de major virulència que les dels mosquits que actuen de vectors.[4]
Resistència natural del virus
[modifica]El virus del mixoma té diversos mètodes que utilitza per evadir el sistema immunitari. Una ruta de protecció implica el bloqueig de l'activitat de la caspasa en les cèl·lules hoste. La proteïna viral E13L és capaç d'inhibir les caspases mitjançant la unió a la proteïna CARD, que és part de la caspasa-1 activador del complex inflamasoma. A més, el virus utilitza el gen viral Serp-2 per inhibir una varietat d'altres capsases. El gen Serp-2 també és capaç d'inhibir la granzima B, una cisteïna proteasa.
El Mixoma virus també és capaç de produir imitacions de receptors del factor de necrosi tumoral per tal de reduir la resposta natural de l'hoste a TNF.
Resistència a agents físics
[modifica]La resistència natural del virus a agents físics és notable. El fred el conserva perfectament, sent capaç de resistir congelat durant almenys 3 mesos; per contra, una temperatura de 55-60 °C altera en pocs minuts les propietats biològiques d'aquest, sobretot si a més està exposat a radiacions ultraviolades. El mateix succeeix amb variacions brusques de temperatura, pel que l'estabilitat i l'aïllament tèrmic dels caus els converteix en refugis adequats per la seva pervivència (Joubert y cols. 1972). La llum solar és capaç d’inactivar el virus en una o dues setmanes d’exposició, mentre que la dessecació té poca influència en la seva viabilitat, sobretot en presència de matèria orgànica. En els cadàvers, la resistència vírica s’ha avaluat en uns 8 dies aproximadament, mentre que en la pell pot arribar a romandre almenys 220 dies (Joubert y cols. 1972).[5]
Etiopatogènia
[modifica]Des de l'interior cap enfora, en el Mixoma virus destaca la presència d’un nucli que conté la majoria de l'ADN viral i que es revela com una zona central densa, amb la forma d’un disc bicòncau i invaginat en el seu centre. A la doble membrana d’aquest nucli i en la zona d’invaginació, s’uneixen els cossos laterals, que són masses proteiques mal definides i que sembla constituir l'antigen intern, comú a la família Poxviridae. Finalment tot el conjunt es rodeja d’una membrana externa perfectament visible, tant en talls sagitals com en transversals. S’ha demostrat l'existència d’un antigen intern comú del grup, així com la presència d’antígens de superfície i altres antígens solubles, que mostren relacions serològiques creuades amb el virus del fibroma.[6]
Classificació del virus per la seva virulència
[modifica]Totes les soques de virus de la mixomatosi conegudes actualment i que afecten les poblacions d’Oryctolagus cuniculus (conill silvestre) procedeixen únicament de dues soques originals brasileres.[5] Una d’elles, denominada soca “Moses” o “Standard Laboratory Strain” (SLS) va ser aïllada d’un conill de laboratori infectat naturalment a Rio de Janeiro (Mose 1911), sent la soca de virus que posteriorment va ser alliberada a Australia, després de 40 anys de successius contagis en conills de laboratori. L'altra soca, denominada “Laussanne” va ser aïllada el 1949 (Bouvier 1954) i va sofrir molt pocs contagis al laboratori abans de ser alliberada a França a 1952 i propagar-se a tota Europa, sent aquesta última soca més virulenta que l'anterior.
Alguns anys després del seu establiment entre conills silvestres a Australia i Europa, es va observar una disminució de la virulència del virus i en la mortalitat causada en les poblacions silvestres, si bé encara causaven mortalitats entre el 50 i el 95% en conills testats al laboratori. La virulència d’aquestes noves variants de virus, denominades soques, mesurada en termes de letalitat, es va considerar inversament correlacionada amb el temps mesurat de supervivència dels conills inoculats al laboratori, el qual va possibilitar el desenvolupament de tests de laboratori per a la caracterització d’aquestes soques en funció de la seva virulència. D’aquesta manera, i encara que l'espectre de virulència és de naturalesa continua, a efectes analítics Fenner i Marshall (1957) van establir una sèrie de “graus de virulència” (I, II, IIIA, IIIB, IV i V) en ordre decreixent, oscil·lant des de les soques de grau V, amb una mortalitat inferior al 50%.
Aquest sistema de gradació de la virulència va ser dissenyat per poder comparar al laboratori la virulència de diferents soques de virus d’una forma estandarditzada, però no per poder estimar l'evolució de la virulència del virus al llarg del temps, tal com s’ha fet en nombrosos treballs. Aquesta confusió a la utilització d’aquest mètode de gradació ha provocat una percepció distorsionada pel que fa a la virulència i la seva evolució al llarg del temps. Això ha sigut així perquè Fenner i Marshall (1957) van definir la virulència en termes de supervivència, i el sistema de gradació ideat és, per tant, una escala de taxes de supervivència, les quals es van reduint a mesura que la virulència augmenta. L'error, amplificat posteriorment en altres treballs, va ser suposar que aquesta correlació entre taxa i temps mesurat de supervivència es dona sempre i en totes les soques, el que ha portat a dues conseqüències: la primera és que cap dels treballs realitzats posteriorment va estar dirigit a la recerca de soques que produïssin llargs temps de supervivència i elevades taxes de mortalitat simultàniament, i la segona és que les soques s’han classificat pel temps mitjà de supervivència dels conills, quan existeixen proves suficients per creure que aquest tipus de classificació és totalment erroni, i que soques classificades com a Grau III en funció del temps de supervivència, són en realitat classificades com Grau I per les taxes de mortalitat.[5]
Mixomatosi
[modifica]
La mixomatosi és una malaltia causada pel Mixoma virus. És endèmica en les poblacions de conills de Sud-amèrica i va ser introduïda a Austràlia en els anys 50 per ajudar al control de la població de conills, propagant-se ràpidament. El virus va ser introduït aleshores accidentalment a Europa, on quasi va erradicar totes les poblacions de conill silvestre (Oryctolagus cuniculus).[6] La malaltia encara és endèmica en les poblacions silvestres de conills en Europa, encara que la seva virulència és variable.[6]
És una malaltia infecciosa, altament contagiosa. És fàcilment inoculable, epizoòtica i endèmica. Provoca secreció nasal i ocular, edemes i tumefaccions a la pell i sovint, desenvolupen pasteurel·losi secundària. Destaca la dermatosi que produeix, de fet, és la dermatosi vírica més important.[6] En casos aguts els conills estan letàrgics, febrils i deprimits. La malaltia és ràpidament fatal en animals susceptibles. Alguns animals poden tenir un curs més crònic de la malaltia.
La malaltia es dissemina per insectes hematòfags, aquests inclouen els mosquits i la puça del conill, Spilopsyla cuniculi. La malaltia s’ha observat en conills de casa sense accés a l'exterior, i per això tots els conills de companyia s’haurien de considerar susceptibles.[7]
L'hoste natural del virus de la mixomatosi a Sud Amèrica és Sylvilagus brasiliensis, mentre que a Nord Amèrica, concretament a Califòrnia, una soca diferent del virus va ser aïllada de Sylvilagus bachmani, encara que aquesta última soca ha estat introduïda en poblacions d’Orytolagus cuniculus.[8]
Es considera que les fonts del virus són per una banda els mateixos conills malalts, els portadors del virus, i els cadàvers i restes de conills morts per la malaltia.[5]
Patogènia
[modifica]La patogènia de la mixomatosi a Oryctolagus cuniculus segueix un patró similar a les infeccions produïdes per altres poxvirus. El virus realitza la seva primera replicació en el punt d’inoculació, produint el mixoma primari, que normalment sol passar desapercebuda, i en el gangli limfàtic regional corresponent. Cap al quart dia té lloc la virèmia i la generalització a la resta de l’organisme (Strayer i Sell 1983). En tractar-se d’un virus ectodermotrop, les lesions se centren sobretot en el teixit nerviós i epitelial, especialment en la pell, on té lloc l'aparició de tumors nodulars, especialment en cara, orelles, genitals i extrems dels membres.[5]
Les soques virulentes inoculades intradèrmicament sempre causen la mort en 9-13 dies de conills no seleccionats genèticament, si bé encara no està molt clar el mecanisme exacte que la desencadena, ja que les lesions observades no són suficients per provocar-la. Se suposa que aquesta té lloc per inanició i les complicacions secundàries produïdes sobretot per l'efecte immunosupressor de la mixomatosi, provocat per la replicació del virus en els limfòcits (Heard i cols. 1990), cosa que sol afavorir l'aparició d’infeccions bacterianes secundàries Gram (-) (Joubert i cols. 1972; Graham i cols. 1992).
Un altre aspecte important de la mixomatosi són les seqüeles d’infertilitat total o parcial que pateixen aquells animals que s’han recuperat de la malaltia. En laboratori, Sobey i Turnbull (1956) van demostrar que tant en mascles com en femelles que havien patit quadres severs de mixomatosi, una proporció considerable sofrien seqüeles de completa esterilitat o fertilitat reduïda. Això no obstant, la qüestió és saber si aquest fet té importància en la naturalesa, ja que aquests animals greument infectats no sobreviuen en les condicions naturals, i aquells que sobreviuen per patir quadres menys severs no presenten aquestes seqüeles d’infertilitat, així, alguns autors australians han fracassat en detectar aquests efectes sobre la fecunditat en grans mostres de femelles silvestres recuperades de la malaltia (Sobey i Turnbull 1956).
Quadre clínic
[modifica]En els hostes naturals del gènere Sylvilagus, el virus produeix únicament un petit fribroma, sovint localitzat en la base de l’orella (Regnery y Miller 1972), sense que normalment hagi tingut lloc la malaltia en forma generalitzada. Tanmateix, en Oryctolagus cuniculus la malaltia acostuma a cursar de manera generalitzada i freqüentment és mortal.
Simptomatologia
[modifica]El període d’incubació dura entre 3 i 4 dies de mitja, i pot oscil·lar entre els 2 i els 18 dies, segons la virulència del virus i la quantitat inoculada.
La mixomatosi es presenta principalment sota les següents formes clíniques: aguda, subaguda, crònica i amixomatòsica.
Forma aguda
[modifica]És una forma freqüent en poblacions que no han tingut contacte previ amb el virus. La fase d’inici compren les primeres 24-48 hores durant les quals es desenvolupa el mixoma primari en el punt d'inoculació que molt aviat evoluciona a un edema cefàlic dolorós, associat a blefaroconjuntivitis aguda amb llagrimeig i flux nasal abundant que passa a ser purulent. Posteriorment es produeix la generalització anusgenital dels mixomes secundaris i en 2 o 3 dies els mixomes envaeixen l'anus i la vulva en la femella, i l'anus, escrot i prepuci en el mascle.
Vint-i-quatre hores després de l'aparició de les primeres manifestacions anus-genitals 4 o 5 dies després de l'aparició dels primers símptomes clínics, té lloc la fase terminal, en la qual té lloc la generalització dels mixomes secundaris per tota la pell, l'aprimament és ràpid i la mort sobrevé després d’una postració completa, uns 12 dies després d’haver-se produït la infecció.[5]
Referències
[modifica]- ↑ «Mixomatosis: OIE - World Organisation for Animal Health» (en castellà). [Consulta: 21 gener 2020].
- ↑ 2,0 2,1 Murphy, Frederick A. Veterinary virology (en anglès). 3a ed.. San diego, California: Serie: investigación, 1999, p. 278.
- ↑ Kerr and Best, P.J. and S.M. «Myxoma virus in rabbits». Rev. sci. tech., 1998, pàg. 256-268.
- ↑ Shepherd and Edmonds, R.C and J. W. «Myxomatosis: the transmission of a highly virulent strain of myxoma virus by the European rabbit flea Sphilopsyllus cuniculi (Dale) in the Mallee region of Victoria.». PMC, 1977, pàg. 405.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 Calvete, Carlos. Epidemiologia de enferemedad hemorrágica (VHD) y myxomatosis en el conejo silvestre en el valle medio del Ebro (en castellà). Aragón: Serie: Investigación, 2000, p. 18-20.
- ↑ 6,0 6,1 6,2 6,3 Rosell, Juan María. Enfermedades del conejo tomo II enfermedades (en castellà). Barcelona: Ediciones mundi-prensa, 2000, p. 305.
- ↑ Flecknell, Paul A. Manual de medicina y cirugía del conejo (en castellà). Hospitalet de Llobregat: Ediciones S, 2002, p. 77, 90.
- ↑ Calvete, Carlos. Epidemiologia de enferemedad hemorrágica (VHD) y myxomatosis en el conejo silvestre en el valle medio del Ebro (en castellà). Aragón: Serie: Investigación, 2000, p. 18-20.
Bibliografia
[modifica]- Garcia Bocanegra, Ignacio «Lluitar contra la mixomatosi». UAB Divulga, Juliol 2010, pàg. 1-2.
- Kerr, PJ; Best, SM «Myxoma virus in rabbits». Revue scientifique et technique OIE, 1998, pàg. 256-268.
- Varga, Molly. Textbook of Rabbit Medicine (en anglès). 2a. Nova York: Elsevier Health, 2013. ISBN 9780702054198 [Consulta: 22 gener 2020].
