Força intermolecular: diferència entre les revisions
retocs |
Nou text amb referències, eliminació d'informació duplicada |
||
| Línia 1: | Línia 1: | ||
{{ |
{{Editant|Antoni Salvà|juny de 2021}} |
||
Les ''' forces intermoleculars ''' es produeixen quan els [[àtom]]s poden formar una unitat estable anomenada [[molècula]] mitjançant el compartiment d'[[electrons]]. |
Les ''' forces intermoleculars ''' es produeixen quan els [[àtom]]s poden formar una unitat estable anomenada [[molècula]] mitjançant el compartiment d'[[electrons]]. |
||
| Línia 9: | Línia 10: | ||
Un exemple clar d'això, és per exemple el que passa entre els extrems carboxil <math> (-COO^-) </math> i Amino <math> (-NH_3^+) </math> d'un [[aminoàcid]], pèptid, polipèptid o proteïna amb un altre. |
Un exemple clar d'això, és per exemple el que passa entre els extrems carboxil <math> (-COO^-) </math> i Amino <math> (-NH_3^+) </math> d'un [[aminoàcid]], pèptid, polipèptid o proteïna amb un altre. |
||
== Forces de van der Waals == |
|||
[[Fitxer:Dipole-dipole-interaction-in-HCl-2D.png|miniatura|Representació esquemàtica de la força d'atracció dipol-dipol en dues molècules de [[clorur d'hidrogen]], HCl, (línia discontínua).]] |
|||
Les forces de London es presenten en totes les substàncies moleculars. Són el resultat de l'atracció entre els extrems positiu i negatiu de dipols induïts en molècules adjacents. |
|||
Les forces de van der Waals són forces atractives o repulsives febles entre [[Entitat molecular|entitats moleculars]], o entre grups dins d'una mateixa entitat molecular, diferents de les de formació d'[[enllaç químic]] ([[covalent]], [[Enllaç iònic|iònic]] o [[Enllaç metàl·lic|metàl·lic]]) o de les interaccions electroestàtiques entre [[ions]] o grups d'ions i molècules neutres. Es divideixen en tres tipus: |
|||
# [[Interacció dipol-dipol|Forces dipol-dipol]]. |
|||
Quan els electrons d'una molècula adquireixen momentàniament una distribució no uniforme, provoquen que en una molècula veïna es formi momentàniament un dipol induït. A la figura 4 s'il·lustra com una molècula amb una falta d'uniformitat momentània en la distribució de la seva càrrega elèctrica pot induir un dipol en una molècula veïna per un procés anomenat polarització. |
|||
# [[Interacció dipol-dipol induït|Forces dipol-dipol induït]]. |
|||
# [[Forces de dispersió de London|Forces dipol instantani-dipol induït]].<ref>{{ref-llibre|cognom=McNaught|nom=A.D.|cognom2=Wilkinson|nom2=A.|títol=IUPAC. Compendium of Chemical Terminology, the "Gold Book"|url=http://goldbook.iupac.org/V06597.html|consulta=30-novembre-11|llengua=anglès|edició=2a edició|editorial=Blackwell Scientific Publications|lloc=Oxford|data=1997|isbn=0-9678550-9-8|doi=10.1351/goldbook.V06597}}</ref> |
|||
{{TOC_dreta}}Les forces de van der Waals són més febles que els enllaços químics que uneixen àtoms en els composts químics. Tanmateix, juguen un paper fonamental en moltes substàncies, per exemple, determinen el caràcter químic dels composts orgànics i la seva solubilitat en dissolvents polars i no polars. Són emprades a molts camps de la ciència i de la tecnologia: [[química orgànica]], [[química inorgànica]], [[química supramolecular]], biologia estructural, [[ciència dels materials]], ciència de les superfícies, [[nanotecnologia]], [[física de la matèria condensada]], etc. |
|||
=== Interaccions dipol-dipol === |
|||
Fins i tot els àtoms dels [[Gas noble|gasos nobles]], les molècules de gasos diatòmics com l'[[oxigen]], el [[nitrogen]] i el [[clor]] (que han de ser no polars) i les molècules d'[[hidrocarbur]]s no polars com el [[CH4|CH<sub>4</sub>]], [[C2H6|C<sub>2</sub>H<sub>6</sub>]] tenen com dipols instantanis. |
|||
[[Fitxer:Dipole_interactions.png|esquerra|miniatura|Dues configuracions de dipols que interaccionen: a) antiparal·lela; b) cap-cua]] |
|||
[[Fitxer:Acetona.jpg|miniatura|L'[[acetona]] és líquida a temperatura ambient degut a interaccions dipol-dipol. S'empra com a [[dissolvent]]]] |
|||
{{Principal|Interacció dipol-dipol}} |
|||
El químic holandès [[Johannes Diderik van der Waals]] (1837–1923) en la seva [[tesi doctoral]] sobre la compressió dels gasos descobrí que els gasos reals no seguien el comportament predit per la [[llei dels gasos ideals]]. Atribuí el desviament al volum de les molècules de gas, considerades puntuals en els gasos ideals, i a l'existència d'algun tipus de forces intermoleculars,<ref>{{ref-publicació|cognom=Van der Waals|nom=J.D|enllaçautor=Johannes Diderik van der Waals|títol=Over de Continuiteit van den Gas- en Vloeistoftoestand|url=http://www.scs.illinois.edu/~mainzv/exhibit/vanderwaals.htm|publicació=Tesi doctoral|lloc=[Universitat de Leiden]|data=1873}}</ref> per la qual cosa avui s'anomenen forces de van der Waals. |
|||
El 1912 el físic neerlandès [[Willem Hendrik Keesom]] (1876–1956), deixeble de van der Waals, presentà un estudi teòric per explicar les interaccions entre [[Molècula polar|molècules polars]], això és, les que presenten [[Dipol|dipols]] permanents, com ara el [[clorur d'hidrogen]], HCl,<ref>{{ref-publicació|cognom=Keesom|nom=W.H|enllaçautor=Willem Hendrik Keesom|títol=|url=|publicació=Proc. K. Akad. Wetenschappen Amsterdam|volum=15|exemplar=|pàgines=417|data=1912}}</ref> que després amplià en un article el 1921,<ref>{{ref-publicació|cognom=Keesom|nom=W.H|enllaçautor=Willem Hendrik Keesom|títol=Die van der waalsschen Kohäsionskräfte|url=|publicació=Physikalische Zeitschrift|volum=22|exemplar=129-41|pàgines=643-644|data=1921}}</ref> per la qual cosa aquestes interaccions s'anomenen sovint ''forces de Keesom''. |
|||
La intensitat de les forces de London depèn de la facilitat amb què es polaritzen els electrons d'una molècula, i això depèn del nombre d'electrons en la molècula i de la força amb què els subjecta l'atracció nuclear. En general, com més electrons hi hagi en una molècula més fàcilment podrà polaritzar. Així, les molècules més grans amb molts electrons són relativament polaritzats. En contrast, les molècules més petites són menys polaritzats perquè tenen menys electrons. Les forces de London varien entre aproximadament 0,05 i 40 kJ/mol. |
|||
Són interaccions d'atracció i repulsió entre molècules polars, molècules que tenen un [[moment dipolar]]. Si un dipol se situa dintre d'un [[camp elèctric]], intenta orientar-se i alinear-se d'acord amb el [[Gradient (matemàtiques)|gradient]] del camp. Si el camp és produït per un altre dipol molecular, el dipol s'orientarà de forma que quedin enfrontats els extrems de densitat de càrrega oposada. Hi ha dues maneres, anomenades configuració "cap-cua" i configuració antiparal·lela. Són interaccions direccionals, d'elles depenen l'associació i estructura dels líquids i sòlids polars, com ara el [[clorur d'hidrogen]], HCl. En estat gasós i a temperatures elevades, el moviment dels dipols a causa de l'energia tèrmica impedeix una orientació ordenada. És una interacció dèbil que disminueix ràpidament amb la distància (1/r³). |
|||
Figura 4. Origen de les forces de London. |
|||
L'energia d'aquesta interacció és expressada per:<center><math> E =- \frac{1}{4 \pi \epsilon_0} {{2 \mu_1 \mu_2 } \over { r^3}} </math></center>on: |
|||
Quan examinem els punts d'ebullició de diversos grups de molècules no polars aviat es fa evident l'efecte del nombre d'electrons (Taula 2). Aquest efecte també es correlaciona amb la [[massa molar]]: com més pesat és un àtom o molècula més electrons té: És interessant que la forma molecular també pot tenir un paper en la formació de les forces de London. |
|||
* '''{{mida|120%|μ<sub>1</sub>}}''' : moment dipolar del dipol 1. |
|||
Dos dels [[isòmer]]s del [[pentà]]-el pentà de cadena lineal i el 2,2-dimetilpropano (tots dos amb la fórmula molecular C5H12) - difereixen en el seu [[punt d'ebullició]] a 27 °C. La forma lineal de la molècula de n-pentà, per la seva linealitat, permet un contacte estret amb les molècules adjacents, mentre que la molècula de 2,2-dimetilpropano, més esfèrica no permet aquest contacte. |
|||
* '''{{mida|120%|μ<sub>2</sub>}}''' : moment dipolar del dipol 2. |
|||
Taula 2. Efecte del nombre d'electrons sobre el punt d'ebullició de substàncies no polars |
|||
* '''{{mida|120%|ε<sub>0</sub>}}''' = 8,854·10<sup>-12</sup> C<sup>2</sup>·J<sup>-1</sup>·m<sup>-1</sup> : [[Permitivitat]] dielèctrica del buit. |
|||
Gasos nobles Halògens Hidrocarburs |
|||
N º Elec PA PE °C N º Elec PM PE °C N º Elec PM PE °C |
|||
He 2 4 -269 F2 18 38 -188 CH4 10 16 -161 |
|||
Ne 10 20 -246 Cl2 34 71 -34 C2H6 18 30 -88 |
|||
Ar 18 40 -186 Br2 70 160 59 C3H8 26 44 -42 |
|||
Kr 36 84 -152 I2 106 254 184 C4H10 34 58 0 |
|||
* '''{{mida|120%|r}}''' : Distància mitjana entre els dipols (m).<ref name="Huheey">{{ref-llibre|cognom=Huheey|nom=J.E|títol=Química Inorgànica. Principios de estructura y reactividad|editorial=Harla|lloc=México|data=1981|isbn=968-6034-13-7}}</ref> |
|||
=== Atraccions dipol-dipol === |
|||
{{AP|Interacció dipol-dipol}} |
|||
Una atracció dipol-dipol és una interacció no covalent entre dues molècules polars o dos grups polars de la mateixa molècula si aquesta és gran. A la secció anterior expliquem com es formen molècules que contenen dipols permanents quan s'enllacen simètricament amb àtoms amb electronegativitat diferent. Les molècules que són dipols s'atreuen entre si quan la regió positiva d'una és a prop de la regió negativa de l'altra. |
|||
=== Interaccions dipol-dipol induït === |
|||
En un [[líquid]] les molècules estan molt properes entre si i s'atreuen per les seves forces intermoleculars. Les molècules han de tenir suficient [[energia]] per vèncer aquestes forces d'atracció, i fer que el líquid pugui entrar en [[ebullició]]. Si es requereix més energia per vèncer les atraccions de les molècules del líquid A que aquelles entre les molècules del líquid B, el punt d'ebullició de A és més alt que el de B. Recíprocament, menors atraccions intermoleculars donen peu a punts d'ebullició més baixos. |
|||
[[Fitxer:ExAntiseptic.jpg|miniatura|La [[tintura de iode]] és una dissolució de iode (apolar) en etanol (polar). Per augmentar la solubilitat s'addiciona també iodur de potassi que produeix una interacció ió-dipol induït]] |
|||
{{Principal|Interacció dipol-dipol induït}} |
|||
El científic neerlandès [[Peter Debye|Peter J. W. Debye]] (1884–1966) explicà les interaccions dipol-dipol induït el 1920.<ref>{{ref-publicació|cognom=Debye|nom=P.J.W|enllaçautor=Peter Debye|títol=Die van der Waalsschen Kohäsionskräfte|url=http://www.chemteam.info/Chem-History/Debye-1920/Debye-1920.html|publicació=Physikalische Zeitschrift|volum=21|pàgines=178-187|data=1920}}</ref> Són forces entre molècules que presenten un dipol permanent i molècules apolars (Cl<sub>2</sub>, CO<sub>2</sub>...) Debye imaginà que les molècules podien desplaçar la seva distribució electrònica en l'[[escorça atòmica]] en un principi homogènia (esfèrica) per efecte de la interacció d'una molècula dipolar. S'anomenen també ''forces de Debye''. |
|||
Si una molècula amb [[moment dipolar]] s'aproxima a una molècula apolar, sense moment dipolar, deformarà el seu nigul electrònic. La polarització de l'espècie neutra dependrà de la seva capacitat de polarització o [[polaritzabilitat]], α, i del moment dipolar, μ, del dipol. és una interacció molt dèbil, a causa del fet que les polaritzabilitats són baixes. Només són importants a distàncies molt curtes, ja que la seva energia depèn d'1/r<sup>6</sup>. La seva importància química es veu limitada a situacions de dissolucions de composts polars en dissolvents apolars. L'energia d'aquesta interacció és expressada per l'equació:<center><math> E =- {{\mu^2 \alpha } \over { r^6}} </math></center>on: |
|||
=== Ponts d'hidrogen === |
|||
{{AP|Pont d'hidrogen}} |
|||
És un tipus especial d'interacció dipol-dipol entre l'àtom d'hidrogen que està formant un enllaç polar, tal com N-H, O-H, o F-H, i un àtom electronegatiu com O, N o F. Aquesta interacció es representa de la manera següent: |
|||
* '''{{mida|120%|μ}}''' : moment dipolar del dipol. |
|||
A-H • • • B A-H • • • A |
|||
* '''{{mida|120%|α}}''' : polaritzabilitat de la molècula apolar. |
|||
A i B representen O, N o F; A-H és una molècula o part d'una molècula i B és part d'una altra. La línia de punts representa l'enllaç d'hidrogen. |
|||
* '''{{mida|120%|r}}''' : Distància mitjana entre els dipols (m).<ref name="Huheey" /> |
|||
L'energia mitjana d'un enllaç d'hidrogen és prou gran per ser una interacció dipol-dipol (major de 40 [[KJ]]/[[mol]]). Això fa que l'enllaç d'hidrogen sigui una de gran importància a l'hora de l'adopció de determinades estructures i en les propietats de molts compostos. |
|||
=== Interaccions dipol instantani-dipol induït === |
|||
Les primeres evidències de l'existència d'aquest tipus d'interacció van venir de l'estudi dels punts d'ebullició. Normalment, els punts d'ebullició de compostos que contenen elements del mateix grup augmenten amb el pes molecular. Però, com es pot observar a la Figura 6, els compostos dels elements dels grups 15, 16 i 17 no segueixen aquesta norma. Per a cada un dels grups, els compostos de menys pes molecular (NH3, H₂O, HF) tenen el punt d'ebullició més alt, en contra del que es podria esperar en principi. Això és degut al fet que hi ha algun tipus d'interacció entre les molècules en estat líquid que s'oposa al pas a l'estat de vapor. Aquesta interacció és l'enllaç d'hidrogen, i afecta els primers membres de la sèrie, ja que són els més electronegatius, i per això l'enllaç XH és el més polaritzat, el que indueix la major interacció per pont d'hidrogen. |
|||
[[Fitxer:Liquidnitrogen.jpg|miniatura|Nitrogen líquid. El nitrogen pot presentar-se en estat líquid gràcies a les interaccions dipol instantani-dipol induït entre molècules apolars de dinitrogen, N<sub>2</sub>]] |
|||
{{Principal|Forces de dispersió de London}} |
|||
Les forces més febles, les dipol instantani-dipol induït, foren descrites pels físics alemanys [[Robert Karl Eisenschitz]] (1898–1968) i [[Fritz London]] (1900–1954) el 1930.<ref>{{Cita publicació|nom=R|cognom=Eisenschitz|nom2=F|cognom2=London|enllaçautor2=Fritz London|títol=Über das Verhältnis der van der Waalsschen Kräfte zu den homöopolaren Bindungskräften|url=http://www.springerlink.com/content/r7q28m356l722151/|publicació=Zeitschrift für Physik A Hadrons and Nuclei|volum=60|pàgines=491–527|llengua=alemany|data=1930|doi=10.1007/BF01341258}}{{Enllaç no actiu|bot=InternetArchiveBot|data=2021}}</ref><ref>{{Cita publicació|nom=F|cognom=London|enllaçautor=Fritz London|títol=Zur Theorie und Systematik der Molekularkräfte|url=http://www.springerlink.com/content/rx775241231700w0/|publicació=Zeitschrift für Physik A Hadrons and Nuclei|volum=63|exemplar=3-4|pàgines=245-279|llengua=alemany|data=1930|doi=10.1007/BF01421741}}{{Enllaç no actiu|bot=InternetArchiveBot|data=2021}}</ref><ref>{{Cita publicació|nom=F|cognom=London|enllaçautor=Fritz London|títol=Über einige Eigenschaften und Anwendungen der Molekularkräften|url=|publicació=Zeitschrift für Physikalische Chemie|volum=B11|exemplar=|pàgines=222-251|llengua=alemany|data=1930|doi=}}</ref><ref>{{Cita publicació|nom=F|cognom=London|enllaçautor=Fritz London|títol=The general theory of molecular forces|url=http://pubs.rsc.org/en/content/articlelanding/1937/tf/tf937330008b|publicació=Transactions of the Faraday Society|volum=33|exemplar=0|pàgines=8b-26|llengua=|data=1937|doi=10.1039/TF937330008B}}</ref> i pel rus [[Ievgueni Lífxits]] (1915–1985).<ref>{{ref-publicació|cognom=Lifshitz|nom=E.M|publicació=J. Expl. Theor. Phys. USSR|volum=29|pàgines=94|data=1955}}</ref><ref>{{ref-publicació|cognom=Lifshitz|nom=E.M|títol=The Theory Of Molecular Attractive Forces Between Solids|url=http://www.osti.gov/energycitations/product.biblio.jsp?osti_id=4359646|publicació=J. Expl. Theor. Phys. USSR|volum=2|pàgines=73-83|data=1956}}</ref> Generalment s'anomenen ''forces de London''. |
|||
En les molècules apolars es poden produir dipols instantanis com a resultat d'un desequilibri momentani en la distribució electrònica. Aquests dipols instantanis poden induir un dipol en una molècula veïna també inicialment apolar i produir-se una atracció electroestàtica. Són les forces intermoleculars més dèbils, només són eficaces a distàncies molt curtes, ja que depenen d'1/r<sup>6</sup>. Augmenta la seva intensitat amb la [[massa molecular]], car també augmenta el volum molecular i, per tant, la [[polaritzabilitat]] de la molècula. L'energia es pot representar per l'equació:<center><math> E =- \frac{3}{4}{{I \alpha^2 } \over { r^6}} </math></center>on: |
|||
Els ponts d'hidrogen són especialment fortes entre les molècules d'[[aigua]] i són la causa de moltes de les singulars propietats d'aquesta substància. Els compostos d'hidrogen d'elements veí a l'oxigen i dels membres de la seva família a la taula periòdica, són gasos a la temperatura ambient: CH4, NH3, H2S, H2Te, PH3, HCl. En canvi, el H2O és líquida a la temperatura ambient, el que indica un alt grau d'atracció intermolecular. A la figura 6 es pot veure que el punt d'ebullició de l'aigua és 200 °C més alt del que es podria predir si no hagués ponts d'hidrogen. Els ponts d'hidrogen juguen també un paper crucial en l'estructura de l'[[ADN]], la molècula que emmagatzema l'[[herència genètica]] de tots els éssers vius. |
|||
* '''{{mida|120%|I}}''' : [[energia d'ionització]] de les molècules. |
|||
== Forces ió-dipol == |
|||
{{AP|Interacció ió-dipol}} |
|||
* '''{{mida|120%|α}}''' : polaritzabilitat de les molècules. |
|||
Aquestes són interaccions que tenen lloc entre espècies amb càrrega. Les càrregues similars es repelen, mentre que les oposades s'atreuen. |
|||
* '''{{mida|120%|r}}''' : Distància mitjana entre els dipols (m).<ref name="Huheey" /> |
|||
És la força que hi ha entre un ió i una molècula polar neutra que té un moment dipolar permanent. Les molècules polars són dipols: tenen un extrem positiu i un extrem negatiu. Els ions positius són atrets a l'extrem negatiu d'un dipol, mentre que els ions negatius són atrets a l'extrem positiu. |
|||
Aquestes interaccions són importants per explicar la condensació de gasos en líquids i la formació de sòlids de substàncies amb molècules apolars, com ara els [[gasos nobles]], els [[halògens]], el [[diòxid de carboni]], l'[[oxigen]] i el [[nitrogen]]. |
|||
La magnitud de l'energia de la interacció depèn de la càrrega sobre l'ió (Q), el moment dipolar del dipol (μ), i de la distància del centre de l'ió al punt mitjà del dipol (d). |
|||
== Ponts d'hidrogen == |
|||
Les forces ió-dipol són importants en les solucions de les substàncies iòniques en líquids. |
|||
== Enllaç d'hidrogen == |
|||
{{AP|Pont d'hidrogen}} |
{{AP|Pont d'hidrogen}} |
||
És un tipus especial d'interacció dipol-dipol entre l'àtom d'hidrogen que està formant un enllaç polar, tal com N-H, O-H, o F-H, i un àtom electronegatiu com O, N o F. Aquesta interacció es representa de la manera següent: |
|||
A-H • • • B A-H • • • A |
|||
L{{'}}'''enllaç d'hidrogen''' passa quan un àtom d'[[hidrogen]] és enllaçat a un àtom fortament electronegatiu com el [[nitrogen]], l'[[oxigen]] o el [[fluor]]. L'àtom d'hidrogen té una càrrega positiva parcial i pot interaccionar amb altres àtoms electronegatius en una altra molècula (novament, amb N, O o F). Així mateix, es produeix una certa superposició entre l'H i l'àtom amb què s'enllaça (N, O o F) donada la petita mida d'aquestes espècies. D'altra banda, com més gran sigui la diferència d'electronegativitat entre l'H i l'àtom interaccionant, més fort serà l'enllaç. Fruit d'aquests pressupostos obtenim un ordre creixent d'intensitat de l'enllaç d'hidrogen: el format amb el F serà de major intensitat que el format amb el O, i aquest al seu torn serà més intens que el format amb el N. |
|||
Aquests fenòmens resulten en una interacció estabilitzant que manté les dues molècules unides. Un exemple clar de l'enllaç d'hidrogen és l'[[aigua]]: |
|||
A i B representen O, N o F; A-H és una molècula o part d'una molècula i B és part d'una altra. La línia de punts representa l'enllaç d'hidrogen. |
|||
Els enllaços d'hidrogen es troben en tota la natura. Proveeixen a l'aigua de les seves propietats particulars, les quals permeten el desenvolupament de la vida a la Terra. Els enllaços d'hidrogen proveeixen també la força intermolecular que manté unides les dues fils en una molècula d'[[ADN]] .. |
|||
L'energia mitjana d'un enllaç d'hidrogen és prou gran per ser una interacció dipol-dipol (major de 40 [[KJ]]/[[mol]]). Això fa que l'enllaç d'hidrogen sigui una de gran importància a l'hora de l'adopció de determinades estructures i en les propietats de molts compostos. |
|||
== Atraccions dipol-dipol == |
|||
{{AP|Interacció dipol-dipol}} |
|||
Les atraccions dipol-dipol, és a dir l'Keeson, per [[Willem Hendrik Keesom]], que va produir la seva primera descripció [[matemàtica]] a [[1921]], són les forces que tenen lloc entre dues molècules amb dipols permanents. Aquestes funcionen de forma similar a les interaccions iòniques, però són més febles perquè posseeixen només càrregues parcials. Un exemple d'això pot ser vist en l'[[àcid clorhídric]]: |
|||
(+)(-) (+)(-) |
|||
H-Cl ---- H-Cl |
|||
(-)(+) (-)(+) |
|||
Cl-H ---- Cl-H |
|||
== Força de Van der Waals == |
|||
{{AP|Forces de Van der Waals}} |
|||
També conegudes com a forces de dispersió, de London o forces dipol-transitives, es presenten en totes les substàncies moleculars. Aquestes involucren l'atracció entre dipols temporalment induïts en molècules no polars. Aquesta polarització pot ser induïda tant per una molècula polar o per la repulsió de núvols electròniques amb càrregues negatives en molècules no polars. Un exemple del primer cas és el clor dissolt perquè són pures puntes (-) (+) |
|||
<nowiki> [dipol permanent] HOH ---- Cl-Cl [dipol transitiu] </nowiki> |
|||
Un exemple del segon cas es troba en la molècula de clor: |
|||
Les primeres evidències de l'existència d'aquest tipus d'interacció van venir de l'estudi dels punts d'ebullició. Normalment, els punts d'ebullició de compostos que contenen elements del mateix grup augmenten amb el pes molecular. Però, com es pot observar a la Figura 6, els compostos dels elements dels grups 15, 16 i 17 no segueixen aquesta norma. Per a cada un dels grups, els compostos de menys pes molecular (NH3, H₂O, HF) tenen el punt d'ebullició més alt, en contra del que es podria esperar en principi. Això és degut al fet que hi ha algun tipus d'interacció entre les molècules en estat líquid que s'oposa al pas a l'estat de vapor. Aquesta interacció és l'enllaç d'hidrogen, i afecta els primers membres de la sèrie, ja que són els més electronegatius, i per això l'enllaç XH és el més polaritzat, el que indueix la major interacció per pont d'hidrogen. |
|||
Els ponts d'hidrogen són especialment fortes entre les molècules d'[[aigua]] i són la causa de moltes de les singulars propietats d'aquesta substància. Els compostos d'hidrogen d'elements veí a l'oxigen i dels membres de la seva família a la taula periòdica, són gasos a la temperatura ambient: CH4, NH3, H2S, H2Te, PH3, HCl. En canvi, el H2O és líquida a la temperatura ambient, el que indica un alt grau d'atracció intermolecular. A la figura 6 es pot veure que el punt d'ebullició de l'aigua és 200 °C més alt del que es podria predir si no hagués ponts d'hidrogen. Els ponts d'hidrogen juguen també un paper crucial en l'estructura de l'[[ADN]], la molècula que emmagatzema l'[[herència genètica]] de tots els éssers vius. |
|||
(+) (-) (+) (-) |
|||
<nowiki> [dipol transitiu] Cl-Cl ---- Cl-Cl [dipol transitiu] </nowiki> |
|||
== Vegeu també == |
== Vegeu també == |
||
| Línia 104: | Línia 89: | ||
{{Commonscat}} |
{{Commonscat}} |
||
{{Autoritat}} |
|||
== Referències == |
|||
{{Referències}}{{Autoritat}} |
|||
{{ORDENA:Forca Intermolecular}} |
{{ORDENA:Forca Intermolecular}} |
||
Revisió del 12:30, 4 juny 2021
|
|
Aquest article o secció s'està elaborant i està inacabat. L'usuari Antoni Salvà hi està treballant i és possible que trobeu defectes de contingut o de forma. Comenteu abans els canvis majors per coordinar-los. Aquest avís és temporal: es pot treure o substituir per {{incomplet}} després d'uns dies d'inactivitat. Fou afegit el juny de 2021. |
Les forces intermoleculars es produeixen quan els àtoms poden formar una unitat estable anomenada molècula mitjançant el compartiment d'electrons.
Les forces d'atracció entre molècules reben el nom d'enllaços intermoleculars i són considerablement més febles que els enllaços iònics, covalents i metàl·lics. Les principals forces intermoleculars són: enllaç per pont d'hidrogen i les forces de Van der Waals.
Interaccions iòniques
Són interaccions que ocorren a nivell de catió-anió, entre diferents molècules carregades, i que per això mateix tendiran a formar una unió electroestàtica entre els extrems de càrregues oposades a causa de l'atracció entre elles.
Un exemple clar d'això, és per exemple el que passa entre els extrems carboxil i Amino d'un aminoàcid, pèptid, polipèptid o proteïna amb un altre.
Forces de van der Waals
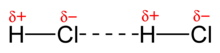
Les forces de van der Waals són forces atractives o repulsives febles entre entitats moleculars, o entre grups dins d'una mateixa entitat molecular, diferents de les de formació d'enllaç químic (covalent, iònic o metàl·lic) o de les interaccions electroestàtiques entre ions o grups d'ions i molècules neutres. Es divideixen en tres tipus:
Les forces de van der Waals són més febles que els enllaços químics que uneixen àtoms en els composts químics. Tanmateix, juguen un paper fonamental en moltes substàncies, per exemple, determinen el caràcter químic dels composts orgànics i la seva solubilitat en dissolvents polars i no polars. Són emprades a molts camps de la ciència i de la tecnologia: química orgànica, química inorgànica, química supramolecular, biologia estructural, ciència dels materials, ciència de les superfícies, nanotecnologia, física de la matèria condensada, etc.
Interaccions dipol-dipol


El químic holandès Johannes Diderik van der Waals (1837–1923) en la seva tesi doctoral sobre la compressió dels gasos descobrí que els gasos reals no seguien el comportament predit per la llei dels gasos ideals. Atribuí el desviament al volum de les molècules de gas, considerades puntuals en els gasos ideals, i a l'existència d'algun tipus de forces intermoleculars,[2] per la qual cosa avui s'anomenen forces de van der Waals.
El 1912 el físic neerlandès Willem Hendrik Keesom (1876–1956), deixeble de van der Waals, presentà un estudi teòric per explicar les interaccions entre molècules polars, això és, les que presenten dipols permanents, com ara el clorur d'hidrogen, HCl,[3] que després amplià en un article el 1921,[4] per la qual cosa aquestes interaccions s'anomenen sovint forces de Keesom.
Són interaccions d'atracció i repulsió entre molècules polars, molècules que tenen un moment dipolar. Si un dipol se situa dintre d'un camp elèctric, intenta orientar-se i alinear-se d'acord amb el gradient del camp. Si el camp és produït per un altre dipol molecular, el dipol s'orientarà de forma que quedin enfrontats els extrems de densitat de càrrega oposada. Hi ha dues maneres, anomenades configuració "cap-cua" i configuració antiparal·lela. Són interaccions direccionals, d'elles depenen l'associació i estructura dels líquids i sòlids polars, com ara el clorur d'hidrogen, HCl. En estat gasós i a temperatures elevades, el moviment dels dipols a causa de l'energia tèrmica impedeix una orientació ordenada. És una interacció dèbil que disminueix ràpidament amb la distància (1/r³).
L'energia d'aquesta interacció és expressada per:
on:
- μ1 : moment dipolar del dipol 1.
- μ2 : moment dipolar del dipol 2.
- ε0 = 8,854·10-12 C2·J-1·m-1 : Permitivitat dielèctrica del buit.
- r : Distància mitjana entre els dipols (m).[5]
Interaccions dipol-dipol induït

El científic neerlandès Peter J. W. Debye (1884–1966) explicà les interaccions dipol-dipol induït el 1920.[6] Són forces entre molècules que presenten un dipol permanent i molècules apolars (Cl2, CO2...) Debye imaginà que les molècules podien desplaçar la seva distribució electrònica en l'escorça atòmica en un principi homogènia (esfèrica) per efecte de la interacció d'una molècula dipolar. S'anomenen també forces de Debye.
Si una molècula amb moment dipolar s'aproxima a una molècula apolar, sense moment dipolar, deformarà el seu nigul electrònic. La polarització de l'espècie neutra dependrà de la seva capacitat de polarització o polaritzabilitat, α, i del moment dipolar, μ, del dipol. és una interacció molt dèbil, a causa del fet que les polaritzabilitats són baixes. Només són importants a distàncies molt curtes, ja que la seva energia depèn d'1/r6. La seva importància química es veu limitada a situacions de dissolucions de composts polars en dissolvents apolars. L'energia d'aquesta interacció és expressada per l'equació:
on:
- μ : moment dipolar del dipol.
- α : polaritzabilitat de la molècula apolar.
- r : Distància mitjana entre els dipols (m).[5]
Interaccions dipol instantani-dipol induït

Les forces més febles, les dipol instantani-dipol induït, foren descrites pels físics alemanys Robert Karl Eisenschitz (1898–1968) i Fritz London (1900–1954) el 1930.[7][8][9][10] i pel rus Ievgueni Lífxits (1915–1985).[11][12] Generalment s'anomenen forces de London.
En les molècules apolars es poden produir dipols instantanis com a resultat d'un desequilibri momentani en la distribució electrònica. Aquests dipols instantanis poden induir un dipol en una molècula veïna també inicialment apolar i produir-se una atracció electroestàtica. Són les forces intermoleculars més dèbils, només són eficaces a distàncies molt curtes, ja que depenen d'1/r6. Augmenta la seva intensitat amb la massa molecular, car també augmenta el volum molecular i, per tant, la polaritzabilitat de la molècula. L'energia es pot representar per l'equació:
on:
- I : energia d'ionització de les molècules.
- α : polaritzabilitat de les molècules.
- r : Distància mitjana entre els dipols (m).[5]
Aquestes interaccions són importants per explicar la condensació de gasos en líquids i la formació de sòlids de substàncies amb molècules apolars, com ara els gasos nobles, els halògens, el diòxid de carboni, l'oxigen i el nitrogen.
Ponts d'hidrogen
És un tipus especial d'interacció dipol-dipol entre l'àtom d'hidrogen que està formant un enllaç polar, tal com N-H, O-H, o F-H, i un àtom electronegatiu com O, N o F. Aquesta interacció es representa de la manera següent:
A-H • • • B A-H • • • A
A i B representen O, N o F; A-H és una molècula o part d'una molècula i B és part d'una altra. La línia de punts representa l'enllaç d'hidrogen.
L'energia mitjana d'un enllaç d'hidrogen és prou gran per ser una interacció dipol-dipol (major de 40 KJ/mol). Això fa que l'enllaç d'hidrogen sigui una de gran importància a l'hora de l'adopció de determinades estructures i en les propietats de molts compostos.
Les primeres evidències de l'existència d'aquest tipus d'interacció van venir de l'estudi dels punts d'ebullició. Normalment, els punts d'ebullició de compostos que contenen elements del mateix grup augmenten amb el pes molecular. Però, com es pot observar a la Figura 6, els compostos dels elements dels grups 15, 16 i 17 no segueixen aquesta norma. Per a cada un dels grups, els compostos de menys pes molecular (NH3, H₂O, HF) tenen el punt d'ebullició més alt, en contra del que es podria esperar en principi. Això és degut al fet que hi ha algun tipus d'interacció entre les molècules en estat líquid que s'oposa al pas a l'estat de vapor. Aquesta interacció és l'enllaç d'hidrogen, i afecta els primers membres de la sèrie, ja que són els més electronegatius, i per això l'enllaç XH és el més polaritzat, el que indueix la major interacció per pont d'hidrogen.
Els ponts d'hidrogen són especialment fortes entre les molècules d'aigua i són la causa de moltes de les singulars propietats d'aquesta substància. Els compostos d'hidrogen d'elements veí a l'oxigen i dels membres de la seva família a la taula periòdica, són gasos a la temperatura ambient: CH4, NH3, H2S, H2Te, PH3, HCl. En canvi, el H2O és líquida a la temperatura ambient, el que indica un alt grau d'atracció intermolecular. A la figura 6 es pot veure que el punt d'ebullició de l'aigua és 200 °C més alt del que es podria predir si no hagués ponts d'hidrogen. Els ponts d'hidrogen juguen també un paper crucial en l'estructura de l'ADN, la molècula que emmagatzema l'herència genètica de tots els éssers vius.
Vegeu també
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Força intermolecular |
Referències
- ↑ McNaught, A.D.; Wilkinson, A. IUPAC. Compendium of Chemical Terminology, the "Gold Book" (en anglès). 2a edició. Oxford: Blackwell Scientific Publications, 1997. DOI 10.1351/goldbook.V06597. ISBN 0-9678550-9-8 [Consulta: 11 novembre 2030].
- ↑ Van der Waals, J.D «Over de Continuiteit van den Gas- en Vloeistoftoestand». Tesi doctoral Universitat de Leiden, 1873.
- ↑ Keesom, W.H Proc. K. Akad. Wetenschappen Amsterdam, 15, 1912, pàg. 417.
- ↑ Keesom, W.H «Die van der waalsschen Kohäsionskräfte». Physikalische Zeitschrift, 22, 129-41, 1921, pàg. 643-644.
- ↑ 5,0 5,1 5,2 Huheey, J.E. Química Inorgànica. Principios de estructura y reactividad. México: Harla, 1981. ISBN 968-6034-13-7.
- ↑ Debye, P.J.W «Die van der Waalsschen Kohäsionskräfte». Physikalische Zeitschrift, 21, 1920, pàg. 178-187.
- ↑ Eisenschitz, R; London, F «Über das Verhältnis der van der Waalsschen Kräfte zu den homöopolaren Bindungskräften» (en alemany). Zeitschrift für Physik A Hadrons and Nuclei, 60, 1930, pàg. 491–527. DOI: 10.1007/BF01341258.[Enllaç no actiu]
- ↑ London, F «Zur Theorie und Systematik der Molekularkräfte» (en alemany). Zeitschrift für Physik A Hadrons and Nuclei, 63, 3-4, 1930, pàg. 245-279. DOI: 10.1007/BF01421741.[Enllaç no actiu]
- ↑ London, F «Über einige Eigenschaften und Anwendungen der Molekularkräften» (en alemany). Zeitschrift für Physikalische Chemie, B11, 1930, pàg. 222-251.
- ↑ London, F «The general theory of molecular forces». Transactions of the Faraday Society, 33, 0, 1937, pàg. 8b-26. DOI: 10.1039/TF937330008B.
- ↑ Lifshitz, E.M J. Expl. Theor. Phys. USSR, 29, 1955, pàg. 94.
- ↑ Lifshitz, E.M «The Theory Of Molecular Attractive Forces Between Solids». J. Expl. Theor. Phys. USSR, 2, 1956, pàg. 73-83.





