Força intermolecular

Les forces intermoleculars són interaccions d'atracció electroestàtica que es produeixen entre molècules. Són considerablement més febles que els enllaços iònics, covalents i metàl·lics, però tenen gran importància en les propietats físiques de moltes substàncies (punts de fusió i ebullició, volatilitat, duresa, solubilitat…). Hom troba diferents tipus de forces intermoleculars: ió-dipol, ió-dipol induït, forces de van der Waals (dipol-dipol o forces de Keesom, dipol-dipol induït o forces de Debye, dipol instantani-dipol induït o forces de London) i enllaç per pont d'hidrogen.
| Tipus d'interacció | Intensitat | Funció energia-distància | |
|---|---|---|---|
| Ió-dipol | Forta | , de curt abast | |
| Forces de van der Waals | Dipol-dipol o forces de Keesom | Moderadament forta | , de curt abast |
| Ió-dipol induït | Feble | , de molt curt abast | |
| Forces de van der Waals | Dipol-dipol induït i forces de Debye | Molt feble | , extremadament de curt abast |
| Dipol instantani-dipol induït o forces de London | Molt feble | , extremadament de curt abast | |
Totes aquestes interaccions són d'atracció i serien infinitament elevades a distància zero. Existeixen també forces de repulsió i les molècules s'aproximen fins que les forces d'atracció s'igualen amb les de repulsió. Aquestes forces de repulsió provenen de la repulsió electroestàtica dels nuclis atòmics i, més importants, de la interacció dels electrons de les capes internes dels àtoms. A distàncies interatòmiques molt petites, els niguls electrònics interns comencen a superposar-se i comença a tenir efecte la repulsió deguda al principi d'exclusió de Pauli que impedeix que electrons amb els mateixos nombres quàntics ocupin el mateix lloc de l'espai. L'energia de repulsió pot expressar-se com:[1]
on és una constant, i l'exponent és sempre major que els exponents de les energies d'atracció i agafa diferents valors alts, com ara 12 (). Això indica que actua a distàncies extremadament curtes.[1]
Interaccions iòniques[modifica]

Interacció ió-dipol[modifica]
Si un dipol se situa dins d'un camp elèctric, intentarà orientar-se i alinear-se amb el gradient del camp. Si el camp és produït per un ió, la molècula dipolar s'orientarà de manera que el cap que exerceix atracció (el cap amb càrrega oposada a la de l'ió) es dirigirà cap a l'ió, mentre que el cap que produeix repulsió s'allunyarà de l'ió. Les interaccions ió-dipol són semblants a les interaccions ió-ió presents a l'enllaç iònic, però són més sensibles a la distància ( front a l'enllaç iònic) i són un poc més febles degut a que les càrregues de la molècula dipolar són considerablement inferiors a una càrrega electrònica completa. L'energia potencial en una interacció ió-dipol ve donada per l'expressió:[1]

on:
- és la càrrega del catió (+) o de l'anió (–) en valor absolut.
- és el moment dipolar de la molècula, (càrregues oposades dins de la molècula per la seva separació ).
- distància entre el centre de l'ió i el centre del dipol.
Les forces ió-dipol són importants en les dissolucions de composts iònics en dissolvents polars, on hi ha presents espècies solvatades com i , corresponents a dissolucions de fluorur de sodi en aigua.[1]
Interacció ió-dipol induït[modifica]
Si un catió o anió s'aproxima a una molècula no polar, sense càrrega (com ara un àtom de gas noble com el xenó o una molècula diatòmica homoatòmica com dioxigen, diclor…) deformarà el nigul electrònic i es formarà un dipol, un dipol induït. La polarització de l'espècie neutra dependrà de la seva capacitat de polarització o polaritzabilitat , i el camp elèctric produït per l'ió de càrrega . L'energia d'interacció ió-dipol induït ve donada per:[1]
Forces de van der Waals[modifica]
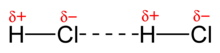
Les forces de van der Waals són forces atractives o repulsives febles entre entitats moleculars, o entre grups dins d'una mateixa entitat molecular, diferents de les de formació d'enllaç químic (covalent, iònic o metàl·lic) o de les interaccions electroestàtiques entre ions o grups d'ions i molècules neutres. Es divideixen en tres tipus:
Les forces de van der Waals són més febles que els enllaços químics que uneixen àtoms en els composts químics. Tanmateix, tenen un paper fonamental en moltes substàncies, per exemple, determinen el caràcter químic dels composts orgànics i la seva solubilitat en dissolvents polars i no polars. Són emprades a molts camps de la ciència i de la tecnologia: química orgànica, química inorgànica, química supramolecular, biologia estructural, ciència dels materials, ciència de les superfícies, nanotecnologia, física de la matèria condensada, etc.
Interaccions dipol-dipol[modifica]


El químic holandès Johannes Diderik van der Waals (1837–1923), en la seva tesi doctoral sobre la compressió dels gasos, descobrí que els gasos reals no seguien el comportament predit per la llei dels gasos ideals. Atribuí el desviament al volum de les molècules de gas, considerades puntuals en els gasos ideals, i a l'existència d'algun tipus de forces intermoleculars,[3] per la qual cosa avui s'anomenen forces de van der Waals.
El 1912 el físic neerlandès Willem Hendrik Keesom (1876–1956), deixeble de van der Waals, presentà un estudi teòric per explicar les interaccions entre molècules polars, això és, les que presenten dipols permanents, com ara el clorur d'hidrogen, HCl,[4] que després amplià en un article el 1921,[5] per la qual cosa aquestes interaccions s'anomenen sovint forces de Keesom.
Són interaccions d'atracció i repulsió entre molècules polars, molècules que tenen un moment dipolar. Si un dipol se situa dintre d'un camp elèctric, intenta orientar-se i alinear-se d'acord amb el gradient del camp. Si el camp és produït per un altre dipol molecular, el dipol s'orientarà de forma que quedin enfrontats els extrems de densitat de càrrega oposada. Hi ha dues maneres, anomenades configuració "cap-cua" i configuració antiparal·lela. Són interaccions direccionals, d'elles depenen l'associació i estructura dels líquids i sòlids polars, com ara el clorur d'hidrogen, HCl. En estat gasós i a temperatures elevades, el moviment dels dipols a causa de l'energia tèrmica impedeix una orientació ordenada. És una interacció dèbil que disminueix ràpidament amb la distància ().
L'energia d'aquesta interacció és expressada per:
on:
- i són els moments dipolars en C·m (coulomb per metre) de cadascuna de les molècules que interactuen ( i ).
- = 8,854·10–12 C²·J–1·m–1 és la permitivitat dielèctrica del buit.
- : Distància mitjana entre els centres d'ambdós dipols (m).[1]
Interaccions dipol-dipol induït[modifica]

El científic neerlandès Peter J. W. Debye (1884–1966) explicà les interaccions dipol-dipol induït el 1920.[6] Són forces entre molècules que presenten un dipol permanent i molècules apolars (Cl₂, CO₂...) Debye imaginà que les molècules podien desplaçar la seva distribució electrònica en l'escorça atòmica en un principi homogènia (esfèrica) per efecte de la interacció d'una molècula dipolar. S'anomenen també forces de Debye.
Si una molècula amb moment dipolar s'aproxima a una molècula apolar, sense moment dipolar, deformarà el seu nigul electrònic. La polarització de l'espècie neutra dependrà de la seva capacitat de polarització o polaritzabilitat, α, i del moment dipolar, μ, del dipol. és una interacció molt dèbil, a causa del fet que les polaritzabilitats són baixes. Només són importants a distàncies molt curtes, ja que la seva energia depèn d'. La seva importància química es veu limitada a situacions de dissolucions de composts polars en dissolvents apolars. L'energia d'aquesta interacció és expressada per l'equació:
on:
- és el moment dipolar del dipol.
- és la polaritzabilitat de la molècula apolar.
- és la distància mitjana entre els dipols (m).[1]
Interaccions dipol instantani-dipol induït[modifica]

Les forces més febles, les dipol instantani-dipol induït, foren descrites pels físics alemanys Robert Karl Eisenschitz (1898–1968) i Fritz London (1900–1954) el 1930.[7][8][9][10] i pel rus Ievgueni Lífxits (1915–1985).[11][12] Generalment s'anomenen forces de London.
En les molècules apolars es poden produir dipols instantanis com a resultat d'un desequilibri momentani en la distribució electrònica. Aquests dipols instantanis poden induir un dipol en una molècula veïna també inicialment apolar i produir-se una atracció electroestàtica. Són les forces intermoleculars més dèbils, només són eficaces a distàncies molt curtes, ja que depenen d'. Augmenta la seva intensitat amb la massa molecular, car també augmenta el volum molecular i, per tant, la polaritzabilitat de la molècula. L'energia es pot representar per l'equació:
on:
- és l'energia d'ionització de les molècules.
- és la polaritzabilitat de les molècules.
- és la distància mitjana entre els dipols (m).[1]
Aquestes interaccions són importants per explicar la condensació de gasos en líquids i la formació de sòlids de substàncies amb molècules apolars, com ara els gasos nobles, els halògens, el diòxid de carboni, l'oxigen i el nitrogen.
Ponts d'hidrogen[modifica]

És un tipus especial d'interacció dipol-dipol entre l'àtom d'hidrogen que està formant un enllaç polar, tal com N–H, O–H, o F–H, i un àtom electronegatiu com O, N o F. Aquesta interacció es representa de la manera següent:
A-H • • • B A-H • • • A
A i B representen O, N o F; A-H és una molècula o part d'una molècula i B és part d'una altra. La línia de punts representa l'enllaç d'hidrogen.
L'energia mitjana d'un enllaç d'hidrogen és prou gran per ser una interacció dipol-dipol (major de 40 kJ/mol). Això fa que l'enllaç d'hidrogen sigui una de gran importància a l'hora de l'adopció de determinades estructures i en les propietats de molts compostos.

Les primeres evidències de l'existència d'aquest tipus d'interacció van venir de l'estudi dels punts d'ebullició. Normalment, els punts d'ebullició de compostos que contenen elements del mateix grup augmenten amb la massa molecular. Però, com es pot observar a la figura, els compostos dels elements dels grups 15, 16 i 17 no segueixen aquesta norma. Per a cada un dels grups, els compostos de menys pes molecular (NH₃, H₂O, HF) tenen el punt d'ebullició més alt, en contra del que es podria esperar en principi. Això és degut al fet que hi ha algun tipus d'interacció entre les molècules en estat líquid que s'oposa al pas a l'estat de vapor. Aquesta interacció és l'enllaç per pont d'hidrogen, i afecta els primers membres de la sèrie, ja que són els més electronegatius, i per això l'enllaç XH és el més polaritzat, el que indueix la major interacció per pont d'hidrogen.
Els ponts d'hidrogen són especialment forts entre les molècules d'aigua i són la causa de moltes de les singulars propietats d'aquesta substància. Els compostos d'hidrogen d'elements veí a l'oxigen i dels membres de la seva família a la taula periòdica, són gasos a la temperatura ambient: metà, amoníac, sulfur d'hidrogen, tel·lurur d'hidrogen, fosfà i clorur d'hidrogen. En canvi, l'aigua és líquida a la temperatura ambient, el que indica un alt grau d'atracció intermolecular. A la figura es pot veure que el punt d'ebullició de l'aigua és 200 °C més alt del que es podria predir si no hagués ponts d'hidrogen. Els ponts d'hidrogen juguen també un paper crucial en l'estructura de l'ADN, la molècula que emmagatzema l'herència genètica de tots els éssers vius.
Experiments recents han mostrat que un àtom d’ hidrogen enllaçat a un àtom de carboni, el qual és lleugerament més electronegatiu que l’H, però molt menys que el N, l’O o el F, pot formar ponts d’hidrogen en certes circumstàncies. D’aquesta manera, la nova definició de pont d’hidrogen indica que un àtom enllaçat a l’H només cal que sigui més electronegatiu que ell per tal de poder crear un pont d’hidrogen. Després d’aquesta definició, les simulacions computacionals acaben de corroborar si, davant d’un cas concret, ens trobem davant d’un pont d’hidrogen. Per exemple, mesurant les distàncies o angles d’enllaç i comparant els resultats amb les mesures característiques dels ponts d’hidrogen.[13]
Vegeu també[modifica]
Referències[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Força intermolecular |
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 Huheey, James E. Química inorgánica : principios de estructura y reactividad. 2d ed. Mexico [D.F.]: HARLA, 1981. ISBN 968-6034-13-7.
- ↑ McNaught, A.D.; Wilkinson, A. IUPAC. Compendium of Chemical Terminology, the "Gold Book" (en anglès). 2a edició. Oxford: Blackwell Scientific Publications, 1997. DOI 10.1351/goldbook.V06597. ISBN 0-9678550-9-8 [Consulta: 11 novembre 2030].
- ↑ Van der Waals, J.D «Over de Continuiteit van den Gas- en Vloeistoftoestand». Tesi doctoral Universitat de Leiden, 1873.
- ↑ Keesom, W.H Proc. K. Akad. Wetenschappen Amsterdam, 15, 1912, pàg. 417.
- ↑ Keesom, W.H «Die van der waalsschen Kohäsionskräfte». Physikalische Zeitschrift, 22, 129-41, 1921, pàg. 643-644.
- ↑ Debye, P.J.W «Die van der Waalsschen Kohäsionskräfte». Physikalische Zeitschrift, 21, 1920, pàg. 178-187.
- ↑ Eisenschitz, R; Londres, F «Über das Verhältnis der van der Waalsschen Kräfte zu den homöopolaren Bindungskräften» (en alemany). Zeitschrift für Physik A Hadrons and Nuclei, 60, 1930, pàg. 491–527. DOI: 10.1007/BF01341258.[Enllaç no actiu]
- ↑ Londres, F «Zur Theorie und Systematik der Molekularkräfte» (en alemany). Zeitschrift für Physik A Hadrons and Nuclei, 63, 3-4, 1930, pàg. 245-279. DOI: 10.1007/BF01421741.[Enllaç no actiu]
- ↑ Londres, F «Über einige Eigenschaften und Anwendungen der Molekularkräften» (en alemany). Zeitschrift für Physikalische Chemie, B11, 1930, pàg. 222-251.
- ↑ Londres, F «The general theory of molecular forces». Transactions of the Faraday Society, 33, 0, 1937, pàg. 8b-26. DOI: 10.1039/TF937330008B.
- ↑ Lifshitz, E.M J. Expl. Theor. Phys. USSR, 29, 1955, pàg. 94.
- ↑ Lifshitz, E.M «The Theory Of Molecular Attractive Forces Between Solids». J. Expl. Theor. Phys. USSR, 2, 1956, pàg. 73-83.
- ↑ «Redefinim el pont d’hidrogen», 29-07-2011. [Consulta: 4 juny 2021].

































