Usuari:Mcapdevila/Embriogènesi de la Drosophila

La embriogènesi en Drosophila és el conjunt de processos biològics que controlen la transformació d'una única cèl·lula, el zigot, en un individu madur de Drosophila melanogaster , animal model conegut popularment com «mosca de la fruita». Com que es coneixen millor els detalls moleculars d'aquest fenomen en D. melanogaster que en cap altre animal, [1] s'ha aconseguit una comprensió científica no menyspreable del procés en conjunt, procés que abasta les disciplines de la genètica molecular i del desenvolupament i la biologia molecular i cel·lular.
Visió global[modifica]


Com a humans, cada nou individu de mosca de la fruita és producte de la fecundació per part d'un espermatozoide procedent d'un mascle al òvul madur d'una femella. Tots dos gàmeta s, haploides, s'entremesclen seu material genètic donant lloc a un zigot diploide que conté la informació genètica característica del nou ésser. Després de la fecundació, el zigot inicia una successió de divisions gairebé sincròniques a les regions centrals de l'ou que donen lloc a l'aparició d'un sincitio, després, després de noves divisions, s'estableix una monocapa de cèl·lules en la perifèria de l'agregat que alberguen al vitel central, però encara no tenint membranes plasmàtiques que defineixin les cèl·lules individualment; aquesta estructura, típica d'insectes, s'anomena blastoderma sincitial. [2] Abans que sorgeixi aquesta separació, es parla que les cèl·lules tenen un caràcter totipotent, és a dir, que cada futura cèl·lula posseeix la potencialitat de generar qualsevol tipus cel·lular; després que es produeixi la transició a un estat no sincitial, en canvi, els seus nuclis s'han determinat, la qual cosa vol dir que cadascuna es diferenciarà en un determinat tipus de teixit de la mosca adulta. La naturalesa d'aquesta capa cel·lular, el blastoderma, ja determinat, produeix que el desenvolupament primerenc sigui essencialment bidimensional, però, el caràcter tridimensional de la larva requereix un increment en complexitat volumètric, que passa posteriorment, a la gastrulació. [2]
La simetria bilateral de Drosophila suposa l'aparició de dos eixos, anteroposterior i dorsoventral, ortogonals entre ells, que han de ser definits molecularment. Al llarg de l'eix anteroposterior la larva posseeix una segmentació regular: anteriorment apareix la cap, després tres segments toràcics i finalment vuit segments abdominals, cadascun dels quals té la seva pròpia identitat tant per aspecte extern com intern. En els extrems d'aquest eix apareixen dues estructures especialitzades, el acron i el tèlson. Quant a l'eix dorsoventral, aquest defineix quatre regions en el cos larval. [2]
Establiment dels eixos[modifica]
L'establiment dels eixos en Drosophila està mediat per gens materns, és a dir, ARN missatger si proteïnas preformades i procedents de la mare però també per gens zigòtics, és a dir, aquells produïts per expressió del genoma de l'embrió en desenvolupament. Uns i altres intervenen tant en la delimitació de l'eix dorsoventral com en el anteroposterior.
L'expressió diferencial de gens el productes són elements reguladors del desenvolupament repercuteixen en la morfologia cel·lular, morfologia que queda modificada donant lloc, en conjunt, a un o més eixos de simetria. Per exemple, es requereix d'una xarxa de microtúbuls intacta i polaritzada dins de l'oòcit per tal d'establir els eixos de l'ou, d'aquesta manera, els senyals entre les cèl·lules fol·liculars i les de l'oòcit (com els factors semblants al TGF-alfa) provoquen la reorganització dels microtúbuls situant el seu extrem menys a la zona anterior de l'oòcit, el que polaritza l'estructura i comporta l'aparició d'un eix anterior-dorsal. [3]
Eix dorsoventral[modifica]
L'eix dorsoventral s'estableix en l'embrió de Drosophila mitjançant la proteïna Dorsal, que, a l'inici de l'embriogènesi, es troba dispersa per tot l'embrió. Tanmateix, després de la migració dels nuclis a la perifèria i la constitució del blastoderma, la proteïna Dorsal penetra en els nuclis cel·lulars de les regions ventral i laterals, si bé roman al citoplasma a la regió dorsal. Aquest mecanisme de transport de Dorsal està regulat per una proteïna senyal anomenada Spätzle, que, al seu torn, es distribueix de forma heterogènia per l'embrió: concretament, posseeix un gradient ventral a dorsal entre la matriu extracel·lular presentin entre la membrana plasmàtica de l'ou sense fertilitzar i la coberta d'aquest. Spätzle és un lligant de receptors Toll, i, ja que s'activa depenent de l'abundància de la seva lligant, està actiu a la zona ventral de l'embrió, i decreix progressivament a les regions més laterals. Toll, quan inicia la seva cascada de senyalització, ocasiona la degradació d'un inhibidor citoplasmàtic denominat Cactus (que afecta Dorsal), la qual cosa provoca l'activació d'aquest últim. D'aquesta manera, s'instaura el gradient de Dorsal, especialment abundant a la zona ventral i més diluït en les regions laterals. [2]
Dorsal afecta l'activitat d'altres proteïnes depenent del llindar de sensibilitat: per a algunes, és actiu com a estimulant a baixes concentracions, per a altres, requereix d'altes dosis. D'aquesta manera, pot definir un reguitzell de llindars en l'eix dorsoventral que permetin una fina regulació a través d'aquest. D'aquesta manera, després de la celularización l'embrió, que passa unes dues hores després de la fertilització, s'instauren 1 sumbrales que iniciaran la diferenciació de tres teixits diferents: mesoderm, endoderm i ectoderm, que, com totes les bestioles triblàstic, definiran la histologia i anatomia de l'individu adult. [1]
L'establiment de l'esmentat gradient de Dorsal repercuteix en la regulació de tres gens diana diferents, activats per altes, intermèdies i baixes concentracions de la proteïna Dorsal: aquestes són twist , rhomboid i SOG . Aquesta regulació es produeix: mitjançant l'afinitat diferencial de enhancers en la seqüència de DNA limítrofa a cada gen, per l'existència repressors, ia causa de la intervenció de activadors. [1]
twist [modifica]
Els nivells més alts de Dorsal, propis de la zona ventral de l'embrió, estimulen l'expressió de twist a les 18 cèl·lules més ventrals que formen el mesoderm. Inactiu a les regions laterals i ectoderm neurogènic malgrat les concentracions intermèdies de Dorsal, twist no és estimulat pel fet que en la seva regió reguladora 5 'té dos llocs d'unió de baixa afinitat per Dorsal; d'aquesta manera, tots dos han d'enllaçar a Dorsal, per a això la seva concentració ha de ser molt alta, la qual cosa no succeeix en les regions laterals. [1] Té un paper crucial en el desenvolupament del mesoderm, i, per això, l'miotomo , un dels derivats, el múscul, ha estat molt estudiat. [4]
rhomboid [modifica]
rhomboid és activat, en canvi, per nivells intermedis de la proteïna Dorsal, concretament en l'ectoderm neurogènic ventral. La seva regió reguladora en el 5 'conté un enhancer que conté un clúster de llocs de uión a Dorsal, la majoria dels quals són semblants als descrits pra twist , és a dir, de baixa afinitat. Tanmateix, un d'ells és d'alta afinitat, la qual cosa permet la unió eficaç i tot a concentracions intermèdies de Dorsal, les presents en les regions laterals. D'aquesta manera, el enhancer de rhomboid ' es veuria activat tant pels alts nivells de la proteïna Dorsal en el mesoderm com mitjançant les intermèdies de les zones laterals, però, això no passa pel fet que en el mesoderm ha un repressor transcripcional anomenat Snail, que no existeix en l'ectoderm neurogènic. [1] [5]
SOG [modifica]
SOG , el tercer element sensible a Dorsal, aquesta vegada a baixa concentració, té, per això, quatre llocs d'unió a Dorsal amb una afinitat òptima; concretament, aquests se situen en un enhancer intern al gen, prop del primer intró. D'aquesta manera, s'expressa més àmpliament que els dos gens abans esmentats, pel fet que, com en el cas de rhomboid , la presència del repressor Snail descarta la seva expressió en els llocs on la concentració de Dorsal és màxima; d'aquesta manera, s'estableix un equilibri dinàmic entre la presència de Snail i l'alta afinitat de Dorsal per la regió reguladora de SOG . [1]
Eix anteroposterior[modifica]
Durant els primers estadis del desenvolupament, són els gens materns els que defineixen un eix anteroposterior, abans de la fertilització de l'ou, aquestes diferències s'accentuen delimitant una futura cap i un futur element distal. Per conveniència, s'agrupen aquests gens materns en tres grups: primer, aquells que afecten la regió anterior, segon, els equivalents per a la regió posterior, i, finalment, aquells que es veuen representats en ambdues regions terminals. Per exemple, bicoid pertany al primer grup, nanos al segon i tors al tercer. [2]
bicoid [modifica]

bicoid és un gen matern acumulat específicament a la regió cefàlica, és a dir, anterior de l'embrió, de manera que genera un gradient en la larva, fins no estar representat en l'extrem posterior. La seva ARN missatger ja mostra aquesta distribució diferencial en l'ou abans de la fecundació. Un cop es produeix aquesta, el RNA missatger es tradueix a proteïna, la qual forma un gradient amb la màxima concentració a la zona més anterior de l'embrió, al lloc de síntesi, a més, la seva relativament curta vida mitjana, de trenta minuts, contribueix a la permanència d'aquest gradient, ja que, de ser més estable, per simple difusió l'esmentat gradient desapareixeria. Aquesta proteïna té activitat de factor de transcripció. [2] [6]
nanos [modifica]

nanos és un altre gen matern que mostra una pauta de distribució recíproca a la de bicoid : en aquest cas, s'acumula especialment en l'extrem posterior, i la seva concentració va disminuint a mesura que s'avança al futur extrem cefàlic. Aquesta distribució peculiar es troba regulada per un grup de gens posteriors, com Oskar , que localitza l'ARN missatger de nanos en la seva posició quan l'ou està sense fecundar. Més endavant, la traducció de nanos genera, com en el cas de bicoid , una proteïna que també respon al gradient definit pel seu ARNm. Tanmateix, hi ha una diferència pel que fa a bicoid , i és que nanos no és un morfogen per se , ja que actua per inhibició de la traducció de l'ARNm d'un altre gen, aquest sí amb activitat de morfogen, denominat Hunchback . [2] [7]
Hunchback [modifica]
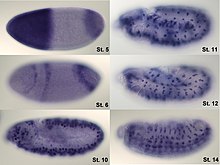
Hunchback és un gen matern que, en l'ou sense fertilitzar, es distribueix com ARNm al llarg de tot l'ou, però, quan procedeix de l'expressió del gen pertanyent al propi embrió, és especialment expressat en l'extrem anterior a causa que bicoid promou la seva transcripció. [8] No obstant això, cal silenciar d'alguna manera l'ARNm procedent de la mare i, d'aquesta manera, definir un gradient morfogenètic: per això, nanos impedeix la traducció d'aquest mRNA allà on el propi nanos és més abundant, és a dir, a l'extrem posterior, la qual cosa repercuteix en una menor concentració de Hunchback en aquest lloc. [2]
Cabal [modifica]
cabal és un altre element matern que defineix l'eix anteroposterior en l'embrió de Drosophila . El seu ARNm d'origen matern està distribuït al llarg de tot l'ou sense fertilitzar, però, al llarg de l'embriogènesi, s'estableix un gradient a causa que bicoid inhibeix la síntesi de la seva proteïna allà on aquest, bicoid , és més abundant, és a dir, en l'extrem anterior, d'aquesta manera, cabal és menys abundant en aquesta zona, la qual en el futur correspondrà al capdavant. [2] [9]
Sistema terminal[modifica]
La configuració dels dos extrems de l'embrió, el acron, al cap, i el tèlson, a la zona cabal, es deuen a components materns. Un gen, tors , que possiblement es tracta d'un receptor tirosín kinasa de la membrana plasmàtica, es considera responsable de la recepció d'un senyal, un lligant , que l'activa especialment en ambdós extrems de l'ou, de forma conjunta. Per tant, el receptor, tors , es troba distribuït homogèniament per la membrana plasmàtica, la qual cosa trasllada el paper de senyalitzador topogràfic a l'esmentat lligant, que, es postula, es tracta d' trunk , el qual posseiria una distribució irregular en el vitel·le al voltant del ou. [10]
Segmentació[modifica]


Dins de la classe dels insectes, una característica molt representativa és la presència d'una sèrie de segments corporals amb una entitat clara i una diferenciació variable depenent de la seva posició. Aquesta metameria, regular respecte de l'eix anteroposterior, es presenta també en estadis anteriors a l'adult, i s'ha d'establir durant el desenvolupament embrionari. Tanmateix, els elements repetits visibles en les larvas madures no són estrictament les primeres unitats de segmentació de l'individu, sinó que corresponen a àrees corporals definides pels solcs apareguts en superfície després de la gastrulació, àrees que s'anomenen parasegment s. [10] La identitat de cada parasegment es defineix mitjançant l'acció de gens de la regla dels parells [11] cada un dels quals s'expressa en sèries de set elements transversals l'eix anteroposterior, de manera alternada a un altre o altres gens que ho fan amb un desfasament d'un parasegment. És a dir: hi ha gens expressats en els parasegments parells (el 2, 4, 6, 8, 10, 12 i 14) i altres que ho fan en els imparells (això això, l'1, 3, 5, 7, 9 10, 11 i 13). [2] D'aquesta manera, la pauta de desenvolupament de la larva es refina enormement, doncs es defineix un patró consistent en el nombre correcte de segments però, també, un altre grup de gens modula què identitat té cadascun.
El grup de gens que controlen l'establiment de la identitat de segment es denominen complexos de gens homeòtics, presents també en vertebrats. [10] Drosophila posseeix dos d'aquests complexos, que reben el nom de Antennapedia i bithorax . [12] Antennapedia modula en bona part la identitat dels segments cefàlics i del tòrax anterior, mentre que bithorax està relacionat amb la identitat dels segments del tòrax posterior i el abdomen. A causa de la seva elevada posició en la jerarquia de gens reguladors del patró corporal, mutacions en aquests dos grups de gens poden provocar canvis dràstics en el fenotip de les larves, aquest fet, denominat homeosis, es defineix com la conversió d'una part del cos en una altra. Tres exemples de canvis homeòtics, que afecten a la identitat del segment però al nombre total d'aquests, són: [11]
- Mutacions de pèrdua de funció en bithorax : produeixen la conversió del tercer segment toràcic en el segon segment toràcic, obtenint mosques amb quatre ales, en lloc de les dues normals (descomptant els halterio s).
- Mutacions de guany de funció Tab : provoquen la transformació del segon segment toràcic en el sisè abdominal, en l'adult.
- Mutacions de guany de funció Antennapedia: converteixen les antenes a potes.
Complex Antennapedia[modifica]

En Drosophila , el complex Antennapedia comprèn cinc gens homeobox: labial ( lab ), Proboscidea ( pb ), deformed ( DFD ), Sex Combs reduced ( SCR ) i Antennapedia ( Antp ). La seva disposició en el genoma manté una correlació amb la pauta d'expressió espacial i temporal: els elements més propers al 3 'són expressats de manera més primerenca i en l'extrem més cefàlic. deformed afecta les estructures d'origen ectodèrmic dels parasegments 0 i 1, Sex Combs reduced ho fa en els parasegments 2 i 3, i Antennapedia , als 4 i 5. [2]
Complex bithorax[modifica]
El complex bithorax agrupa a tres gens amb homeobox: Ultrabithorax ( UBX ), abdominal-A ( abd_A ) i Abdominal-B ( Abd -B ). S'expressen de forma combinatòria en els diferents parasegments per determinar la seva identitat: Ultrabithorax ho fa del 5 al 12; abdominal-A , del 7 al 13, i Abdominal-B , del parasegment 10 cap a l'extrem posterior. Les seves activitats, però, poden combinar-se per dotar d'una especificitat biològica al parasegment, seguint les regles dels gens gap i de la regla dels parells. [10]
Apèndix[modifica]
Llista d'alguns gens implicats en el desenvolupament de D. melanogaster : [11]
| Símbol del gen | Nom del gen | Funció de la proteïna | Implicació |
|---|---|---|---|
| hb-z | Hunchback-zygotic | Factor de transcripció tipus dit de zinc | Gen gap |
| Kr | Krüpel | Factor de transcripció tipus dit de zinc | Gen gap |
| kni | knirps | Factor de transcripció tipus dit de zinc | Gen gap |
| eve | even-skipped | Factor de transcripció, amb homeodomini | Regla dels parells |
| FTZ | futshi tarazu | Factor de transcripció, amb homeodomini | Regla dels parells |
| opa | odd-Paired | Factor de transcripció tipus dit de zinc | Regla dels parells |
| PRD | Paired | Factor de transcripció | Regla dels parells |
| a | Engrailed | Factor de transcripció, amb homeodomini | Regla dels parells |
| ci | cubitus interruptus | Factor de transcripció tipus dit de zinc | Polaritat de segment |
| wg | Wingless | Proteïna de senyalització WG | Polaritat de segment |
| hh | hedgehog | Proteïna de senyalització HH | Polaritat de segment |
| fu | fused | Serín-treonín kinasa citoplasmàtica | Polaritat de segment |
| PTC | patched | Proteïna transmembrana | Polaritat de segment |
| arm | armadillo | Proteïna d'adhesió cèl·lula-cèl·lula | Polaritat de segment |
| lab | labial | Factor de transcripció, amb homeodomini | Identitat de segment |
| DFD | deformed | Factor de transcripció, amb homeodomini | Identitat de segment |
| Antp | Antennapedia | Factor de transcripció, amb homeodomini | Identitat de segment |
| UBX | Ultrabithorax | Factor de transcripció, amb homeodomini | Identitat de segment |
| dl | dorsal | Factor de transcripció | Eix dorsoventral |
| cact | cactus | Unió a la proteïna Dorsal | Eix dorsoventral |
| spz | spaetzle | Molècula senyal | Eix dorsoventral |
| Tl | Toll | Receptor del lligand de Spaetzle | Regulació de l'expressió de Dorsal |
| SNK | snake | Serín proteasa | Activació de spaetzle |
| dpp | decantaplegic | Molècula senyal | Gen cardinal per al ectoderm dorsal |
| Sax | Saxophone | Receptor seríntreonínquinasa | Patró de ectoderm dorsal |
| TKV | thick veins | Receptor seríntreonínquinasa | Patró de ectoderm dorsal |
| PNT | punt | Receptor seríntreonínquinasa | Patró de ectoderm dorsal |
| SOG | short gastrulation | Senyal, lligant SOG | Patrons generals de ectoderm |
| cat | Spitz | Senyal, lligant SCI | Patró de ectoderm ventral |
Vegeu també[modifica]
Referències[modifica]
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 Watson, J, D.; Baker, T. A.; Bell, S. P.; Gann, A.; Levine, M. et Losick, R. Molecular Biology of the General. Fifth edition. San Francisco: Benjamin Cummings, 2004. ISBN 0-321-22368-3.
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 2,11 2,12 Wolpert, Lewis; Beddington, R.; Jessell, T.; Lawrence, P.; Meyerowitz, E. i Smith, W.. Principles of Development. Second edition. Oxford: Oxford University Press, 2002. ISBN 0-19-879291-3.
- ↑ ; Stjohnston, Van Eeden «The polarisation of the anterior-posterior and dorsal-ventral Axes during Drosophila oogenesis». Current Opinion in Genetics & Development, 9, 1999, p. 396-404. DOI: 10.1016/S0959-437X (99) 80.060-4.
- ↑ Mary K. Baylies and Michael Bat. twist: A Myogenic Switch in Drosophila. 272, 7 juny 1996, p. 1481 - 1484. DOI: 10.1126/science.272.5267.1481.
- ↑ D Brentrup, H Lerch, H Jackle and M Noll. Regulation of Drosophila wing vint patterning: net encodes a bHLH protein repressing rhomboid and is repressed by rhomboid-dependent EGFR signalling. 127, 2000, p. 4729-4741.
- ↑ T Berleth, M Burri, G Thoma, D Bopp, S Richstein, G Frigerio, M Noll, i C Nüsslein-Volhard. The role of localització of bicoid RNA in organizing the anterior pattern of the Drosophila embryo. 7, 1998, p. 1749-1756. PMCID: PMC457163.
- ↑ Robin P. Wharton i Gary Struhl. RNA regulatory Elements mediate control of Drosophila body pattern by the posterior morphogen nanos. 67, 1991, p. 955-967.
- ↑ Wolfgang Driever & Christiane Nüsslein-Volhard. The bicoid protein is a positive Regulator of Hunchback transcription in the early Drosophila embryo. 337, 1989, p. 138-143. doi: 10.1038/337138a0.
- ↑ Mlodzik M, Fjose A, Gehring WJ.. Isolation of cabal, a Drosophila homeo box-containing general with maternal expression, whose transcripts form a concentration gradient at the pre-blastoderm estada. 4, 1985, p. 2961-2969.
- ↑ 10,0 10,1 10,2 10,3 Lawrence, Peter A.. The Making of a Fly. Blackwell Science Ltd, 1992. ISBN 0-632-03048-8.
- ↑ 11,0 11,1 11,2 Griffiths, J. F. A. et al. . Genètica. McGraw-Hill Interamericana, 2002. ISBN 84-486-0368-0.
- ↑ Michael Regulski, Katherine Harding, Richard Kostriken, François Karch, Michael Levine i William McGinnis. homeo box gens of the Antennapedia and bithorax complexes of Drosophila. 43, 1985, p. 71-80.
Enllaços externs[modifica]
- Patrons d'expressió d'alguns gens implicats en l'embriogènesi de Drosophila, mitjançant hibridació in situ (en anglès).
- Animació de l'embriogènesi de Drosophila


