Cel·la electroquímica

Una cel·la electroquímica és un dispositiu capaç d'obtenir energia elèctrica a partir de reaccions químiques, o bé, de produir reaccions químiques a través de la introducció d'energia elèctrica. Un exemple comú de cel·la electroquímica és la "pila" estàndard d'1,5 volts. En realitat, una "pila" és una cel·la galvànica simple, mentre una bateria consta de diverses cel·les connectades en sèrie.
Tipus de cel·les electroquímiques[modifica]
Hi ha dos tipus fonamentals de cel·la i en ambdues té lloc una reacció redox, i la conversió o transformació d'un tipus d'energia en una altra:
- La cel·la voltaica transforma una reacció química espontània en un corrent elèctric, com en el cas d'una pila o una bateria. També reb el nom de cel·la galvànica , pila galvànica o pila voltaica . Són molt utilitzades per la qual cosa la majoria dels exemples i imatges d'aquest article estan referits a elles.
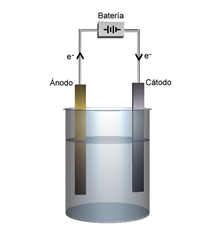
- La cel·la electrolítica transforma un corrent elèctric en una reacció química d'oxidació-reducció que no té lloc de manera espontània. En moltes d'aquestes reaccions es descompon una substància química per la qual cosa aquest procés rep el nom d'electròlisi. També pot rebre els noms de cel·la electrolítica o cub electrolític . A diferència de la cel·la voltaica, en la cel·la electrolítica, els dos elèctrodes no necessiten estar separats, de manera que hi ha un sol recipient en què tenen lloc les dues semireaccions.
Les semicel·les o semireaccions en una cel·la voltaica[modifica]

Una cel·la galvànica o cel·la voltaica consta de dues semicel·les o semicèl·lules connectades elèctricament mitjançant un conductor metàl·lic, o també mitjançant un pont salí. Cada semicel·la consta d'un elèctrode i un electròlit. Les dues semicèl·lules poden utilitzar el mateix electròlit, o poden utilitzar electròlits diferents. Les reaccions químiques a la cel·la poden implicar l'electròlit, els elèctrodes o una substància externa (com en les piles de combustible que pot utilitzar l'hidrogen gasós com a reactiu). En una cel·la voltaica completa, les espècies químiques d'una semicel·la perden electrons (oxidació) cap al seu elèctrode, mentre que les espècies de l'altra semicel·la guanyen electrons (reducció) des del seu elèctrode. Sovint es fa servir un pont salí per a proporcionar un contacte iònic entre les dues mitjançant cel·les amb electròlits diferents, per evitar que les solucions es barregin i provoquin reaccions col·laterals no desitjades.[1] Aquest pont salí pot ser simplement una tira de paper de filtre amarat en solució saturada de nitrat de potassi. Altres dispositius per aconseguir la separació de les dissolucions són atuells porosos i dissolucions gelificades. Un recipient porós s'utilitza a la pila de Bunsen (dreta).
També se'ls anomena semireaccions, ja que en cadascuna d'elles té lloc una part de la reacció redox:
Reacció d'equilibri[modifica]
Cada semicel·lada té una tensió característica anomenada potencial de semicel·la o potencial de reducció. Les diferents substàncies que poden ser escollides per a cada semicel·la donen lloc a diferents diferències de potencial de la cel·la completa, que és el paràmetre que pot ser mesurat. No es pot mesurar el potencial de cada semicel·la, sinó la diferència entre els potencials d'ambdues. Cada reacció està experimentant una reacció d'equilibri entre els diferents estats d'oxidació dels ions, quan s'assoleix l'equilibri, la cel·la no pot proporcionar més tensió. A la semicel·la que està patint l'oxidació, com més a prop de l'equilibri es troba l'ió/àtom amb l'estat d'oxidació més positiu, més potencial donarà aquesta reacció. De la mateixa manera, en la reacció de reducció, com més lluny de l'equilibri es troba l'ió/àtom amb l'estat d'oxidació més negatiu, més alt és el potencial.
Potencials d'elèctrode i força electromotriu d'una pila[modifica]
El potencial o força electromotriu d'una pila es pot predir a través de la utilització dels potencials d'elèctrode, amb les tensions de cada semicel·la. (Veure taula dels potencials estàndards d'elèctrode). La diferència de voltatge entre els potencials de reducció de cada elèctrode dona una predicció per al potencial que tindrà la pila.
Els potencials de pila tenen un rang possible des de 0 fins a 6 volts. Les piles que fan servir electròlits dissolts en aigua generalment tenen potencials de cel·la menors de 2,5 volts, ja que els oxidants i reductors més potents, que es requeririen per produir un major potencial, tendeixen a reaccionar amb l'aigua.
Tipus de cel·les galvàniques[modifica]
Principals tipus[modifica]
Les cel·les o cel·les galvàniques es classifiquen en dues grans categories:
- Les cel·les primàries transformen l'energia química en energia elèctrica, de manera irreversible (dins d'uns límits pràctics). Quan s'esgota la quantitat inicial de reactius presents a la pila, l'energia no pot ser fàcilment restaurada o tornada a la cel·la electroquímica per mitjans elèctrics.[2]
- Les cel·les secundàries poden ser recarregades, és a dir, que poden revertir les seves reaccions químiques mitjançant el subministrament d'energia elèctrica a la cel·la, fins al restabliment de la seva composició original.[3]

Cel·les galvàniques primàries[modifica]
Lcel·les galvàniques primàries poden produir corrent immediatament després de la seva connexió. Les piles recarregables estan destinades a ser utilitzades una sola vegada i són rebutjades posteriorment. Les piles recarregables no poden ser recarregades de manera fiable, ja que les reaccions químiques no són fàcilment reversibles i els materials actius no poden tornar a la seva forma original.
Generalment, tenen densitats d'energia més altes que les piles recarregables,[4] però les cel·les un sol ús no van bé en aplicacions d'alt drenatge amb càrregues menors de 75 ohms (75 Ω).[5]
Cel·les galvàniques secundàries[modifica]

Lcel·les galvàniques secundàries ha de ser carregades abans del seu ús, de manera general són ensamblades amb materials i objectes actius en l'estat de baixa energia (descàrrega). Lcel·les galvàniques recarregables o piles galvàniques secundàries es poden regenerar (col·loquialment, recarregar) mitjançant l'aplicació d'un corrent elèctric, que inverteix la reaccions químiques que es produeixen durant el seu ús. Els dispositius per al subministrament adequat d'aquests corrents que regeneren les substàncies actives que contenen la pila o bateria es diuen, de manera inapropiada, carregadors o recarregadors.
La forma més antiga de pila recarregable és la bateria de plom-àcid.[6] Aquesta cel·la electroquímica és notable, ja que conté un líquid àcid en un recipient segellat, la qual cosa requereix que la cel·la es mantingui en posició vertical i la zona d'estar ben ventilada per garantir la seguretat de la dispersió del gas hidrogen produït per aquestes cel·les durant la sobrecàrrega. La cel·la de plom-àcid és també molt pesada per la quantitat d'energia elèctrica que pot subministrar. Tot i això, el seu baix cost de fabricació i els seus nivells de corrent de gran augment fan que la seva utilització sigui comú quan es requereix una gran capacitat (més de 10 A·h) o quan no importen el pes i l'escassa facilitat de maneig.

Un tipus millorat de la cel·la d'electròlit líquid és la cel·la de plom-àcid regulada per vàlvula de segellat (VRLA, per les seves sigles en anglès), popular a la indústria de l'automòbil com un substitut per a la cel·la humida de plom-àcid, perquè no necessita manteniment. La cel·la VRLA utilitza àcid sulfúric immobilitzat com electròlit, reduint la possibilitat de fuites i ampliant la vida útil.[7] S'ha aconseguit immobilitzar l'electròlit, generalment per alguna d'aquestes dues formes:
- cel·les de gel que contenen un electròlit semi-sòlid per evitar vessaments.
- cel·les de feltre de fibra de vidre absorbent, que absorbeixen l'electròlit en un material absorbent realitzat amb fibra de vidre especial.
Altres cel·les portàtils recarregables són (en ordre de densitat de potència i, per tant, de cost cada vegada més grans): cel·la de níquel-cadmi (Ni-Cd), cel·la de níquel metall hidrur (NiMH) i cel·la d'ions de liti (Li-ió).[8] De moment, les cel·les d'ió liti tenen la major quota de mercat entre les piles seques recarregables.[9] Mentrestant, les piles de NiMH han substituït les de Ni-Cd en la majoria de les aplicacions per la seva major capacitat, però les de NiCd segueixen usant-se en eines elèctriques, radis de dues vies, i equips mèdics.[9]
Alguns tipus de cel·les galvàniques[modifica]
Cubes electrolítiques[modifica]

El segon gran tipus de cel·les electroquímiques converteix l'energia d'un corrent elèctric en l'energia química dels productes d'una reacció que no es dona de manera espontània en les condicions de treball d'aquesta cuba. El voltatge d'aquest corrent ha de ser més gran que el que tindria la cel·la galvànica en què es produís el procés invers, de manera que també s'han de conèixer els potencials de reducció.
Exemple: Els potencials de reducció del coure (II)/coure i del zinc (II)/Zinc són respectivament+0,34 V i -0,76 V. Una pila o cel·la galvànica que aprofités la reacció espontània Zn+Cu 2+ → Zn 2++Cu proporcionaria una força electromotriu de; +0,34 V - (- 0,76 V) = 1,10 volts.
Si ara volem provocar la reacció contrària Cu+Zn 2+ → Cu 2++Zn per exemple per dipositar Zn sobre un objecte metàl·lic, haurem d'introduir una font d'alimentació que generi un corrent elèctric de més de 1,10 volts
Per tant, en la cel·la electrolítica existeix igualment una reacció redox però ara és provocada per l'energia elèctrica de les càrregues que travessen la cuba. Encara que ara hi ha un únic recipient, també hi ha dos semireaccions, una a cada elèctrode, ja que en cadascuna d'elles hi té lloc una part de la reacció redox:
- La pèrdua d'electrons (oxidació) té lloc en l'ànode.
- El guany d'electrons (reducció) es produeix en el càtode.
Un exemple és l'electròlisi de l'aigua quan se li fa passar un corrent elèctric.
Referències[modifica]
- ↑ Martínez Álvarez, Roberto; Rodríguez Yunta, María Josefa. American Chemical Society. Química: un proyecto de la American Chemical Society. Reverte, 2005, p. 680. ISBN 9788429170016.
- ↑ Dingrando 675.
- ↑ Fink, Ch 11, Sec "Batteries and Fuel Cells. "
- ↑ Alkaline Manganès Dioxide Handbook and Application Manual Arxivat 2010-12-16 a Wayback Machine. (PDF). Energizer . Retrieved 25 August 2008.
- ↑ Buchmann, Isidor. Will secondary batteries replace primàries? Arxivat 2010-04-14 a Wayback Machine.. Battery University . Darrer accés: 6 Gener 2008.
- ↑ Buchmann, Isidor. Can the lead-acid battery competeix in modern times? Arxivat 2010-03-10 a Wayback Machine.. Battery University . Darrer accés: 2 set 2007.
- ↑ Dynasty VRLA Batteries and their Application Arxivat 2008-05-11 a Wayback Machine.. C & D Technologies, Inc Darrer accés: 26 agost 2008.
- ↑ What's the best battery? Arxivat 2010-03-06 a Wayback Machine.. Battery University . Darrer accés: 26 agost 2008.
- ↑ 9,0 9,1 Buchmann, Isidor. Battery statistics Arxivat 2010-03-15 a Wayback Machine.. Battery University . Darrer accés: 11 agost 2008.
Enllaços externs[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Cel·la electroquímica |





