Volatilitat: diferència entre les revisions
m Robot: Reemplaçament automàtic de text (-[[Imatge: +[[Fitxer:, -[[Image: +[[Fitxer:, -[[File: +[[Fitxer:) |
m Robot: Reemplaçament automàtic de text (-[[ +, - +]]) |
||
| Línia 1: | Línia 1: | ||
[[Fitxer:Vapor Pressure Chart.png|thumb|301px|Diagrama de la pressió de vapor per a diversos líquids |
[[Fitxer:Vapor Pressure Chart.png|thumb|301px|Diagrama de la pressió de vapor per a diversos líquids]] |
||
La '''volatilitat''', en [[química física]] és la qualitat a ser volàtil o la tendència que té una substància a [[vapor]]itzar-se. La [[destil·lació]] és una tècnica de separació que aprofita la diferent volatilitat de les [[substàncies]] d'una [[mescla homogènia]] per separar-les en els seus components. La [[cromatografia de gasos]] també aprofita la diferent volatilitat dels components de la mescla per la seva separació. |
La '''volatilitat''', en [[química física]] és la qualitat a ser volàtil o la tendència que té una substància a [[vapor]]itzar-se. La [[destil·lació]] és una tècnica de separació que aprofita la diferent volatilitat de les [[substàncies]] d'una [[mescla homogènia]] per separar-les en els seus components. La [[cromatografia de gasos]] també aprofita la diferent volatilitat dels components de la mescla per la seva separació. |
||
La volatilitat està directament relacionada amb la [[pressió de vapor]] d'una substància. A una temperatura donada, una substància amb una alta pressió de vapor es vaporitza més ràpidament que una substància amb una pressió de vapor menor.<ref>[http://www.bae.uky.edu/~snokes/BAE549thermo/gasesvapor.htm Gases and Vapor] (University of Kentucky website)</ref><ref>[http://www.coop.engr.uvic.ca/engrweb/whmis/terms.html#V Definition of Terms] (University of Victoria website)</ref><ref>{{ref-llibre| autor = James G. Speight| títol = The Chemistry and Technology of Petroleum| url = http://books.google.com/?id=ymL2S9RWzx4C| edició = 4th Edition| any = 2006| editorial = CRC Press| isbn = 978-0-8493-9067-8 }}</ref><ref>{{ref-llibre| autor = Kister, Henry Z.| títol = Distillation Design | url = http://books.google.com/?id=0M1TAAAAMAAJ| edició = 1st Edition| data = 1992-02-01| editorial = McGraw-hill| isbn = 978-0-07-034909-4 }}</ref> |
La volatilitat està directament relacionada amb la [[pressió de vapor]] d'una substància. A una temperatura donada, una substància amb una alta pressió de vapor es vaporitza més ràpidament que una substància amb una pressió de vapor menor.<ref>[http://www.bae.uky.edu/~snokes/BAE549thermo/gasesvapor.htm Gases and Vapor] (University of Kentucky website)</ref><ref>[http://www.coop.engr.uvic.ca/engrweb/whmis/terms.html#V Definition of Terms] (University of Victoria website)</ref><ref>{{ref-llibre| autor = James G. Speight| títol = The Chemistry and Technology of Petroleum| url = http://books.google.com/?id=ymL2S9RWzx4C| edició = 4th Edition| any = 2006| editorial = CRC Press| isbn = 978-0-8493-9067-8 }}</ref><ref>{{ref-llibre| autor = Kister, Henry Z.| títol = Distillation Design | url = http://books.google.com/?id=0M1TAAAAMAAJ| edició = 1st Edition| data = 1992-02-01| editorial = McGraw-hill| isbn = 978-0-07-034909-4 }}</ref> |
||
Revisió del 13:58, 26 oct 2014
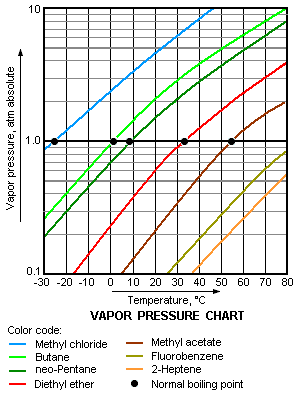
La volatilitat, en química física és la qualitat a ser volàtil o la tendència que té una substància a vaporitzar-se. La destil·lació és una tècnica de separació que aprofita la diferent volatilitat de les substàncies d'una mescla homogènia per separar-les en els seus components. La cromatografia de gasos també aprofita la diferent volatilitat dels components de la mescla per la seva separació. La volatilitat està directament relacionada amb la pressió de vapor d'una substància. A una temperatura donada, una substància amb una alta pressió de vapor es vaporitza més ràpidament que una substància amb una pressió de vapor menor.[1][2][3][4] El terme volatilitat principalment s'aplica als líquids; tanmateix, es pot usar per descriure el procés de sublimació el qual està associat a les substàncies sòlides, com el gel sec (diòxid de carboni sòlid) i clorur d'amoni, els quals poden passar directament de l'estat sòlid al vapor sense passar per l'estat líquid.
Referències
- ↑ Gases and Vapor (University of Kentucky website)
- ↑ Definition of Terms (University of Victoria website)
- ↑ James G. Speight. The Chemistry and Technology of Petroleum. 4th Edition. CRC Press, 2006. ISBN 978-0-8493-9067-8.
- ↑ Kister, Henry Z.. Distillation Design. 1st Edition. McGraw-hill, 1992-02-01. ISBN 978-0-07-034909-4.

