Glicosilfosfatidilinositol

El glicosilfosfatidilinositol (ancoratge GPI) és un glicolípid que es pot ajuntar amb l'extrem C-terminal d'una proteïna durant una modificació post-traduccional. Està formada per un grup fosfatidilinositol unit a un carbohidrat (enllaç format per una glucosamina i una manosa glicosilada al residu inositol) el qual està unit a l'extrem C-terminal d'un aminoàcid d'una proteïna madura. Els dos àcids grassos sense el grup hidròfob fosfatidilinositol ancora la proteïna a la membrana cel·lular.
Les proteïnes que s'uneixen als GPI contenen un pèptid senyal, que les condueix al reticle endoplasmàtic (RE). L'extrem C-terminal està compost d'aminoàcids hidròfobs que romanen inserits a la membrana del reticle endoplasmàtic. L'extrem hidrofòbic és llavors escindit i substituït per l'ancoratge GPI. A mesura que la proteïna avança per la via secretora, és transmesa a través de vesícules a l'aparell de Golgi, i finalment a l'espai extracel·lular on roman unida a la monocapa extracel·lular. Aquest procés d'unió és l'únic que permet la unió d'aquestes proteïnes a la membrana, i l'escissió del grup de fosfolipases es traduirà en l'alliberació controlada de la proteïna de la membrana. Aquest darrer mecanisme és utilitzat in vitro, és a dir, les proteïnes de membrana són alliberades de les membranes en l'assaig enzimàtic.
La fosfolipasa C (PLC) és un enzim que és conegut per trencar l'enllaç fosfoglicerol trobat a l'ancoratge GPI-proteïnes. El tractament amb PLC causarà l'alliberament de la unió GPI-proteïnes des de l'exterior de la membrana cel·lular. El marcador de cèl·lules T Thy-1, la acetilcolinesterasa, així com l'alcalina fosfatasa de l'intestí i de la placenta se sap que formen part d'unions GPI i són alliberades per tractament amb PLC.
Es creu que les unions GPI-proteïnes estan preferentment localitzades als lípids raft, suggerint un alt nivell d'organització dins els microdominis de la membrana plasmàtica.
Els defectes dels ancoratges de GPI produeixen la malaltia Hemoglobinúria paroxística nocturna. En aquesta malaltia el DAF (decay accelerating factor) i el CD59, probablement no estan ancorats als glòbuls rojos a causa d'una unió GPI defectuosa. Sense aquestes proteïnes vinculades a la superfície de la cèl·lula, el sistema del complement provoca la lisi de la cèl·lula i un gran nombre de RBC's són destruïts i condueixen a l'hemoglobinúria. Altres cèl·lules no es veuen afectades perquè tenen formes transmembrana de DAF i CD59.
Antecedents i descobriment[modifica]
Els ancoratges de proteïna fosfatidilinositol es van postular per primera vegada durant la dècada de 1970 basant-se en la capacitat de certs enzims bacterians específiques, tals com la fosfatasa-alcalina i la 5'-nucleotidasa, per alliberar proteïnes a partir de la membrana plasmàtica de les cèl·lules dels mamífers.
Cap a 1985, els primers indicis de l'existència d'aquest tipus d'ancoratges van ser revelats en diferents estudis en què es va investigar sobre la composició i l'estructura de molècules com l'acetilcolinesterasa del peix Torpede californica, l'acetilcolinesterasa d'eritròcits humans i bovins, el Thy-1 en rates, i la proteïna VSG (Variant Surface Glycoprotein) del Trypanosoma brucei, paràsit responsable de la malaltia de la son.
Finalment, el 1988, es van obtenir les primeres estructures GPI completes, concretament la de la proteïna VSG del Trypanosoma brucei i la de Thy-1 de rata.
Estructura i diversitat[modifica]
Diversitat de proteïnes amb ancoratges GPI[modifica]

Fins a la data, s'han identificat centenars de proteïnes amb ancoratge GPI en molts eucariotes, que van des dels protozous i fongs fins als éssers humans (Taula 1). La gamma de proteïnes ancorades mitjançant GPI suggereix que aquest tipus d'ancoratge és bastant freqüent entre els eucariotes i particularment abundant en protozous[1] les proteïnes amb ancoratge GPI són, funcionalment, molt diverses i inclouen enzims hidrolítics, molècules d'adhesió, proteïnes del sistema del complement, etc.
Estructura dels ancoratges GPI[modifica]
Pràcticament totes les proteïnes lligades amb ancoratge GPI comparteixen una estructura bàsica i comuna a totes elles que es conserva a la totalitat de les espècies que han estat investigades fins al moment (Taula 2).
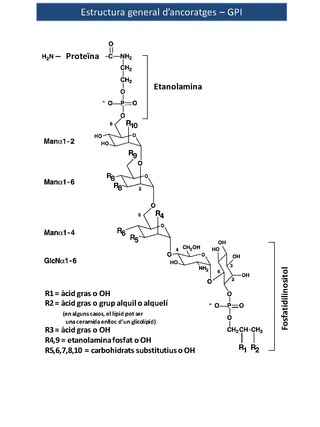
Les estructures d'aquests ancoratges són úniques entre les associacions proteïna - carbohidrat en què l'extrem reductor de l'oligosacàrid de la GPI no està unit a la proteïna. En canvi, el residu terminal reductor de glucosamina està enllaçat mitjançant un enllaç α1 - 6 glicosídic al grup fosfatidilinositol (PI). Un residu de manosa no reductor i que es troba a certa distància s'uneix a la proteïna a través d'un pont fosfat d'etanolamina (EtNP) entre el grup hidroxil del carboni 6 de la manosa i el grup carboxil de l'aminoàcid carboxi - terminal. Les glicosilfosfatidilinositol (GPI) són un dels casos poc freqüents a la natura on la glucosamina es troba tant sense un grup acetil (com en la majoria dels glicoconjugats) o amb un sulfat (com en els proteoglicans) modificant el grup amino del carboni 2. La subestructura Manα1 - 4GlcNα1 - 6mioinositol - 1- P - lípid és una característica universal dels ancoratges GPI i de les seves estructures relacionades. En el llevat Saccharomyces cerevisiae, les restes de diacilglicerol dels ancoratges GPI se substitueixen extensament amb ceramides després de la fixació de l'ancoratge GPI a la proteïna.[2]
Les estructures dels ancoratges GPI són molt diverses, depenent de la proteïna a la qual estan units i de l'organisme en què se sintetitzen. Amb una excepció coneguda, els nuclis de les proteïnes lligades mitjançant ancoratges GPI contenen un mínim de tres residus de manosil en la seqüència de EtNP - 6Manαl - 2Manα1 - 6Manα1 - 4GlcNα1 -6 (PI), on EtNP es refereix al pont fosfat d'etanolamina, ' Man' a manosa, i ' GlcN ' a glucosamina Hi ha una considerable variació en la meitat PI. De fet, GPI és un terme bastant fluix, ja que, en concret, PI es refereix a D - mioinositol - 1- P -3 (sn -1,2 - diacilglicerol), mentre que molts GPI contenen altres tipus de fosfolípids d'inositol, com ara la inositol fosfoceramida. De la mateixa manera, també hi ha altres variacions, com la caracteritzada per la presència d'un àcid gras unit mitjançant un enllaç [ [ èster ] ] a l'hidroxil del carboni 2 del residu d'inositol. La presència d'aquesta modificació fa l'ancoratge resistent a l'acció del PLC bacterià específic per a PI. Les dades estructurals disponibles de lípids suggereixen que els enllaços de proteïnes amb GPI mitjançant inositol fosfoceramida només es troben en els eucariotes més senzills, com ara Saccharomyces cerevisiae , Aspergillus niger , Dictyostelium discoideum , i T. cruzi . Per exemple, en el llevat Saccharomyces cerevisiae , les restes de diacilglicerol dels ancoratges GPI són àmpliament substituïts amb ceramides després de la fixació de l'ancoratge de GPI a la proteïna.
Els factors que controlen la síntesi d'un ancoratge de glicosilfosfatidilinositol madur trobat en una proteïna donada semblen ser similars als d'altres modificacions posteriors a la traducció com ara la N-glicosilació i la O-glicosilació. Per tant, el control primari és a escala cel·lular, de manera que seran els enzims específics biosintètics els que decidiran el ventall definitiu de les estructures. El control secundari és a nivell de l'estructura terciària / quaternària de la proteïna que porta l'ancoratge GPI, i això afecta l'accessibilitat dels enzims de processament. Un exemple de control primari es troba en les diferències en les cadenes laterals de glicans a les GPI a l'enzim membrana dipeptidasa entre humans i bovins. I un exemple de control secundari és la diferència entre les cadenes laterals de glicà de VSG (Variant Surface Glicoprotein) quan alguns d'aquests enzims amb diferents seqüències carboxi - terminals s'expressen en el mateix Trypanosoma.[3]
Estructures GPI no lligades[modifica]
En cèl·lules de mamífers, algunes GPI lliures es troben a la superfície cel·lular, però la seva importància funcional és desconeguda. D'altra banda, diversos protozous, sobretot tripanosomàtids, expressen números alts (més de 10 ^ 7 còpies per cèl·lula) de GPI lliures en la seva superfície cel·lular com a productes metabòlics finals. Aquests inclouen els fosfolípids de glicoinositol (GIPLs) i lipofosfoglicans (GLP) de la Leishmania.
-
Imatge 1. Estructura general dels ancoratges GPI
-
Taula 2. Estructures representatives d'ancoratges GPI conegudes
La química dels ancoratges GPI[modifica]
Els ancoratges glicosilfosfatidilinositol són molècules complexes que inclouen enllaços amida, glicosídics, fosfodièster i els vincles hidroxièster entre els seus diversos components. El repte de la seva síntesi orgànica total va reunir grups de diversos països, incloent-hi Japó, Estats Units, Alemanya i el Regne Unit. L'estructura d'aquests ancoratges es pot separar de forma selectiva mitjançant diversos reactius químics i enzimàtics. Aquests es van utilitzar al principi per tal de determinar la morfologia de les GPI i ara s'apliquen per confirmar la seva presència. Una reacció clau, des d'una perspectiva analítica, és la desaminació (és a dir, la ruptura d'un grup amino) per àcid nitrós del residu de glucosamina. A través d'aquesta reacció obtenim una escissió molt específica de l'enllaç glucosídic entre la glucosamina i l'inositol. La reacció allibera el PI (fosfatidilinositol), que es pot aïllar i ser analitzat per espectrometria de masses,[4] i genera un extrem reductor lliure al glicà de GPI en forma de anhidromanosa (aMan). Una vegada que aquest residu es marca radioactivament o fluorescentment i es desfosforila, el glicà pot ser convenientment seqüenciat utilitzant exoglicosidases (enzims que tallen els enllaços glucosídics dels sucres terminals).
El fet d'obtenir la disposició completa dels ancoratges GPI és un procés ardu que requereix relativament grans quantitats de material de partida. En aquest treball s'avalua el grau d'informació estructural que es pot obtenir a partir d'una glicoproteïna ancorada a GPI prèviament ben caracteritzada, que generalment és la VSG de "Trypanosoma brucei".
Biosíntesi[modifica]
La biosíntesi de l'ancoratge GPI es dona en gran part en el reticle endoplasmàtic (tant en la seva membrana com en el lumen) i en menor part a l'aparell de Golgi.
Aquesta biosíntesi és iniciada a la cara citoplasmàtica de la membrana del reticle endoplasmàtic amb la transferència de la N-acetilglucosamina de UDP-GlcNac a un fosfoinositol (una de les parts principals de la molècula de GPI) gràcies a una glucosiltransferasa. D'aquesta transferència es forma GlcNac-P. Seguidament el GlcNac-P pateix una N-deacetilació i es forma GlcN-PI.
Arribat aquest punt la molècula segueix la seva síntesi al lumen del reticle endoplasmàtic on es dona una acilació del grup inositol, alguns estudis han suggerit que el donant d'aquest grup acil és l'acil coenzim A. A part, i de nou a la cara citoplasmàtica de la membrana del reticle endoplasmàtic, se sintetitza dolicol-fosfat-manosa que donarà les manoses a la molècula de GPI.
Seguidament les dues primeres manoses són transferides a la molècula des del dolicol-fosfat-manosa i s'afegeix una fosfatetanolamina a la primera manosa. Seguidament s'afegeix una tercera manosa i en segons quines espècies una quarta i s'acaba afegint una fosfatetanolamina a la segona i tercera manoses.
Un cop el GPI està sintetitzat, aquest s'uneix a una proteïna prèviament sintetitzada pel seu extrem C-terminal. Aquesta proteïna a la qual s'uneix el GPI ha de tenir tres característiques bàsiques:
- Posseir un senyal peptídic que la faci entrar al lumen del reticle endoplasmàtic
- Posseir un senyal peptídic a l'extrem C-terminal que la uneixi amb la membrana del reticle endoplasmàtic mentre el GPI s'uneix
- Posseir un triplet d'aminoàcids que permeti la unió del GPI
La unió entre la proteïna i el GPI es dona a través d'una reacció de transamidació, en la qual la proteïna s'uneix al GPI pel grup amino de la fosfatetanolamina, a més s'escindeix el senyal indicat com a segona característica essencial de la proteïna per unir-se al GPI.
En aquest moment, el GPI pot patir alguns canvis que no sempre es donen, com l'addicció d'una nova manosa, la deacilació de l'inositol o canvis en els àcids grassos del fosfatidilinositol.
Una vegada la proteïna i el GPI estan units, s'inicia el transport d'aquests a la membrana cel·lular mitjançant un transport vesicular, passant primer per l'aparell de Golgi on es donen uns últims canvis per poder adaptar l'ancoratge GPI al microdomini destí (habitualment balses lipídiques). Una vegada arriba a la membrana, la proteïna s'uneix quedant el GPI a la cara extracel·lular.
Funcions biològiques del GPI[modifica]
Funcions en les cèl·lules dels mamífers[modifica]
Originalment, es creia que les principals funcions dels ancoratges de GPI eren augmentar la mobilitat de les proteïnes per la membrana cel·lular i convertir-les en proteïnes solubles. Això no obstant, actualment s'ha pogut advertir que l'augment de mobilitat de les proteïnes ancorades al GPI no és degut per aquest directament, sinó que és causat per les seves interaccions amb la bicapa lipídica. Aquestes interaccions, a la vegada, poden augmentar o disminuir la mobilitat d'aquestes proteïnes per la membrana.[5] També s'ha pogut posar en manifest que la conversió a proteïnes solubles és un procés que succeeix molt poques vegades i que, per tant, no pot ser considerat una funció principal. D'altra banda, la majoria de proteïnes ancorades al GPI són enriquides en vesícules creades per senyals físiques o químiques, motiu pel qual el GPI té un paper crucial a l'hora de classificar que han de madurar.[6] Tot i així, aquests ancoratges tenen moltes altres funcions, com actuar de receptors de membrana, defensar del sistema del complement i protegir la cèl·lula.[7][8] Així mateix, s'ha pogut observar que les proteïnes ancorades a GPI s'acumulen principalment en rafts lipídics de la membrana cel·lular. Per aquest motiu, es creu que el GPI es troba associat amb la rigidesa d'aquests dominis i amb la classificació de les proteïnes que s'han de transportar des del reticle endoplasmàtic. [9]
Tot i aquesta gran funcionalitat, s'han pogut crear soques de cèl·lules de mamífers que no disposen de GPI. Per consegüent, el GPI no es considera vital per a la supervivència de la cèl·lula.[10] Malgrat aquest fet, a través d'experiments amb ratolins modificats genèticament, també s'ha pogut demostrar la seva gran importància en la creació i el desenvolupament de teixits en els embrions, ja que els ratolins amb deficiència de GPI solen ser més propensos a malformacions i imperfeccions en els teixits.[11]
Funcions en altres espècies[modifica]
Les diverses funcions del GPI i de les proteïnes ancorades a ell varien segons l'espècie, però en els protozous paràsits i en molts fongs presenta una major transcendència.
Per exemple, en estudis del llevat Saccharomyces cerevisiae, s'ha pogut observar que aquests ancoratges de GPI són utilitzats per senyalitzar algunes proteïnes en particular per la seva posterior incorporació a la paret cel·lular. Aquestes proteïnes, que contenen manoses, s'incorporen a la paret en zones on proliferen polisacàrids β-Glucans, perquè el GPI reacciona amb aquests cedint un residu de manosa. Aquest procés és fonamental per a la supervivència de Saccharomyces cerevisiae, ja que deficiències en el GPI poden provocar la incorrecta síntesi de la paret cel·lular.[12]
Altres estudis sobre el paràsit Trypanosoma brucei han permès descobrir la importància del GPI en el seu procés d'infecció parasitària. Aquest paràsit presenta dues formes: una quan es troba a l'interior dels insectes i l'altra quan es troba en el torrent sanguini. El GPI no és de gran importància en la primera, però en la seva segona forma utilitza receptors de transferrina que es troben ancorats a GPI.[13] A més a més, els ancoratges de GPI també són utilitzats per Trypanosoma brucei per crear cobertes molt denses de proteïnes en la membrana amb el fi de protegir-la del sistema del complement.[14]
Patologies relacionades amb el GPI[modifica]
Una de les malalties més conegudes causada per un defecte dels ancoratges de GPI és l'anomenada hemoglobinúria paroxística nocturna, que causa una anèmia hemolítica. L'origen d'aquesta malaltia es troba en una mutació somàtica en el gen PIG-A, localitzat en el cromosoma X. Aquest gen és l'encarregat de codificar un enzim, la fosfatidilinositol N-acetilglucosaminiltransferasa subunitat A, que és l'encarregada de catalitzar una part de la biosíntesi del GPI. A causa d'aquesta deficiència en l'enzim, els ancoratges de GPI no es poden sintetitzar correctament i les proteïnes de membrana dels eritròcits no es poden ancorar. Consegüentment, els eritròcits dels pacients afectats per aquesta malaltia no disposen de protecció contra el sistema del complement, el qual porta a terme la lisi dels glòbuls vermells.[10]
D'altra banda, els ancoratges de GPI són essencials per molts paràsits en el seu procés d'infecció parasitària. Per exemple, el protist Trypanosoma brucei, causant de la tripanosomosi humana africana, fa ús de receptors de transferrina ancorats a GPI, com s'ha mencionat anteriorment.[13] També s'han pogut trobar altres patògens, com el Toxoplasma gondii i el Protozoario Plasmodium, en els quals algunes de les seves principals proteïnes es troben ancorades a GPI.[15] Aquestes proteïnes són les encarregades de provocar canvis en el sistema immunitari de l'hoste. De la mateixa manera, es creu que molts d'aquests ancoratges de GPI són els causants d'efectes inflamatoris, com és el cas de la febre en la malaria.[16]
Així mateix, les proteïnes ancorades GPI també poden funcionar com receptors de toxines i paràsits. Per exemple, són receptors de toxines com l'aerolisina, provinent del bacteri Aeromonas hydrophila.[17] Actualment, també es creu que moltes malalties causades per prions, com la malaltia de les vaques boges o l'Alzheimer, són causades per endosomes amb prions ancorats al GPI. Això no obstant, s'ha pogut associar l'absència d'ancoratges GPI amb una acceleració de la formació i la propagació dels prions.[18]
Referències[modifica]
- ↑ M J McConville and M A Ferguson. The structure, biosynthesis and function of glycosylated phosphatidylinositols in the parasitic protozoa and higher eukaryotes, 09/1993.
- ↑ C Fankhauser, S W Homans, J E Thomas-Oates, M J McConville, C Desponds, A Conzelmann and M A Ferguson. «Structures of glycosylphosphatidylinositol membrane anchors from Saccharomyces cerevisiae.», 15-12-1993.
- ↑ Yeonchul Hong, Taroh Kinoshita. Trypanosome Glycosylphosphatidylinositol Biosynthesis, 28/08/2009.
- ↑ Isabelle R.E. Nett, Angela Mehlert, Douglas Lamont, and Michael A.J. Ferguson. «Application of electrospray mass spectrometry to the structural determination of glycosylphosphatidylinositol membrane anchors», 24-01-2010. [Consulta: 18 octubre 2013].
- ↑ Fein M, Unkeless J, Chuang FY, Sassaroli M, da Costa R, Väänänen H, et al. Lateral mobility of lipid analogues and GPI-anchored proteins in supported bilayers determined by fluorescent bead tracking. J Membr Biol. 1993 Jul;135(1):83-92.
- ↑ Deborah A. Brown, John K. Rose. Sorting of GPI-anchored proteins to glycolipid-enriched membrane subdomains during transport to the apical cell surface[Enllaç no actiu]. Cell. 1992 Feb; 68 (3): 533-544.
- ↑ Lucero HA, Robbins PW. Lipid rafts-protein association and the regulation of protein activity. Arch Biochem Biophys. 2004 June; 426 (2): 208-224.
- ↑ Anja Nohe, Eleonora Keating, Marc Fivaz, F. Gisou van der Goot, Nils O. Petersen. Dynamics of GPI-anchored proteins on the surface of living cells Arxivat 2013-10-29 a Wayback Machine.. Nano Med Journal. 2006 March; 2 (1): 1-7.
- ↑ Rajat Varma, Satyajit Mayor. GPI-anchored proteins are organized in submicron domains at the cell surface. Nature. 1998 Aug; 394 (6695): 198-801.
- ↑ 10,0 10,1 Kinoshita T, Ohishi K, Takeda J. GPI-anchor synthesis in mammalian cells: genes, their products, and a deficiency. J Biochem. 1997 Aug; 122 (2): 251-257.
- ↑ Wang Y, Murakami Y, Yasui T, Wakana S, Kikutani H, Kinoshita T, et al. Significance of glycosylphosphatidylinositol-anchored protein enrichment in lipid rafts for the control of autoimmunity. J Biol Chem. 2013 Aug; 288 (35): 25490-25499.
- ↑ I Flury (2001) Glycosylphosphatidylinositol Membrane Anchors in Saccharomyces cerevisiae: Characterization of Proteins Involved in Side Chain Modifications Arxivat 2014-10-24 a Wayback Machine..
- ↑ 13,0 13,1 Amy F. Savage, Gustavo C. Cerqueira, Sandesh Regmi, Yineng Wu, Najib M. El Sayed, and Serap Aksoy. Transcript expression analysis of putative Trypanosoma brucei GPI-anchored surface proteins during development in the tsetse and mammalian hosts. PLoS Negl Trop Dis. 2012 June; 6 (6): e1708.
- ↑ Warren G. Transport through the Golgi in Trypanosoma brucei. Histochem Cell Biol. 2013 Sep; 140 (3): 235-238.
- ↑ Tsai YH, Götze S, Azzouz N, Hahm HS, Seeberger PH, Varon Silva D. A general method for synthesis of GPI anchors illustrated by the total synthesis of the low-molecular-weight antigen from Toxoplasma gondii. Angew Chem Int Ed Engl. 2011 Oct; 50 (42): 9961-9964.
- ↑ Bautista JM, Marín-García P, Diez A, Azcárate IG, Puyet A. Malaria proteomics: Insights into the parasite-host interactions in the pathogenic space. J Proteomics. 2013 Oct; Forthcoming 2013.
- ↑ Abrami L, Fivaz M, van der Goot FG. Surface dynamics of aerolysin on the plasma membrane of living cells. Int J Med Microbiol. 2000 Oct; 290 (4-5): 363-367.
- ↑ Dvorakova E, Vranac T, Janouskova O, Ernilec M, Koren S, Lukan A, et al. Detection of the GPI-anchorless prion protein fragment PrP226* in human brain. BMC Neurol. 2013 Sep; 13 (1): 126.
Bibliografia[modifica]
- Fundamentos de Bioquímica: La vida a nivel molecular. Autores: Donald Voet / Judith G. Voet / Charlotte W. Pratt ISBN 9789500623148
- Biología celular y molecular. Autores: Jiménez, L. Felipe / Merchant, Horacio. México, 2003. ISBN 970-26-0387-0
- Post-translational modifications of the Dictyostelium discoideum glycoprotein PsA. Autores: Haynes, P. A., Gooley, A. A., Ferguson, M. A. J., Redmond, J. W. and Williams, K. L. (1993),. European Journal of Biochemistry, 216: 729–737. doi: 10.1111/j.1432-1033.1993.tb18192.x
- Essentials of Glycobiology. 2nd edition. Autores: Varki A, Cummings RD, Esko JD, et al., editors. Cold Spring Harbor (NY): Cold Spring Harbor Laboratory Press; 2009.
- Inositol lipids in cell signalling. Autors: H. Michell, Alan H. Drummond, C. Peter Downes. London [etc.]: Academic Press, 1989. ISBN 0124938604
Vegeu també[modifica]
- Glicolípid
- Manosa
- Membrana cel·lular
- Retícle endoplasmàtic
- Aparell de Golgi
- Saccharomyces cerevisiae
- Trypanosoma brucei
- Sistema del complement
- Hemoglobinúria paroxística nocturna
Enllaços externs[modifica]
- Estructura d'un ancoratge Glicosilfosfatidilinositol d'un VSG d'un tripanosoma. RCSB Protein Data Bank.
- Hemoglobinúria paroxística nocturna. MedlinePlus.