Hormona estimulant dels melanòcits: diferència entre les revisions
m neteja i estandardització de codi |
|||
| Línia 104: | Línia 104: | ||
== Aplicacions mèdiques == |
== Aplicacions mèdiques == |
||
<big>S'han desenvolupat molècules sintètiques anàlogues a les alfa-MSH per a l’ús dels humans. Dues de les molècules sintètiques més conegudes i ben estudiades són la afamelanotide i la [[bremelanotide]], però n’existeixen d’altres com ara la modimelanotide i la setmelanotide.</big> |
|||
L’afamelanotide o [[melanotan I]], venuda i testada per l’empresa farmacèutica Clinuvel Pharmaceuticals sota el nom de SCENESSE ®, ha demostrat ser eficaç en diferents malalties dermatològiques com ara la protoporfiria eritropètica (EEP), la urticària solar, l’erupció de llum polifòrmica (PMLE), vitiligo, acne, entre d’altres. En el cas de la protoporfiria eritropètica, l’afamelanotide va ser aprovada el 2015 per la Unió Europea com a medicament per a la prevenció de la fototoxicitat en pacients adults. L’afamelanotide, que s’administra de manera subcutània com a implant biodegradable de 16 mg, permet als pacients estar més hores exposats al sol sense dolor i també millores en la seva qualitat de vida. |
<big>L’afamelanotide o [[melanotan I]], venuda i testada per l’empresa farmacèutica Clinuvel Pharmaceuticals sota el nom de SCENESSE ®, ha demostrat ser eficaç en diferents malalties dermatològiques com ara la protoporfiria eritropètica (EEP), la urticària solar, l’erupció de llum polifòrmica (PMLE), vitiligo, acne, entre d’altres. En el cas de la protoporfiria eritropètica, l’afamelanotide va ser aprovada el 2015 per la Unió Europea com a medicament per a la prevenció de la fototoxicitat en pacients adults. L’afamelanotide, que s’administra de manera subcutània com a implant biodegradable de 16 mg, permet als pacients estar més hores exposats al sol sense dolor i també millores en la seva qualitat de vida.</big><ref>{{Ref-publicació|article=The Impact of Sunlight on Skin Aging|cognom=Kaddurah|nom5=Henry W.|cognom4=Nahhas|nom4=Amanda F.|cognom3=Vellaichamy|nom3=Gautham|cognom2=Braunberger|nom2=Taylor L.|nom=Hisham|url=http://dx.doi.org/10.1007/s13670-018-0262-0|doi=10.1007/s13670-018-0262-0|exemplar=4|volum=7|pàgines=228–237|issn=2196-7865|data=2018-10-29|publicació=Current Geriatrics Reports|cognom5=Lim}}</ref><ref>{{Ref-publicació|article=Afamelanotide for Erythropoietic Protoporphyria|cognom=Langendonk|nom5=Alexander V.|cognom4=Bonkovsky|nom4=Herbert L.|cognom3=Anderson|nom3=Karl E.|cognom2=Balwani|nom2=Manisha|nom=Janneke G.|url=http://www.nejm.org/doi/10.1056/NEJMoa1411481|llengua=en|doi=10.1056/NEJMoa1411481|exemplar=1|volum=373|pàgines=48–59|issn=0028-4793|data=2015-07-02|publicació=New England Journal of Medicine|cognom5=Anstey}}</ref> |
||
La bremelanotide, testada i venuda per l’empresa Palatin Techonologies sota el nom de Vyleesi™, és un actiu metabòlic de la melanotan II (molècula sintètica anàloga a l’alfa-MSH) amb una alta afinitat als receptors de tipus 4 de la melanocortina, coneguts per ser importants en les funcions sexuals en les dones. La bremelanotide, ha estat recentment aprovada als Estats Units per l’Administració de menjar i drogues (FDA) com a teràpia pel trastorn hipoactiu del desig sexual (HSDD) en dones premenopàusiques i menopàusiques amb baix desig sexual. Cal remarcar que aquest baix desig sexual no és resultat de cap problema ginecològic, trastorn psicològic o problemes de parella. La bremelanotide s’autoadministra amb una injecció subcutània a l’abdomen o a la cuixa, 45 minuts abans de mantenir relacions sexuals. Tot i que té alguns efectes secundaris, com per exemple nàusees i mal de cap, ha demostrat incrementar el desig sexuals en dones premenopàsiques i menopàusiques.<ref>{{Ref-publicació|article=Bremelanotide for the Treatment of Hypoactive Sexual Desire Disorder: Two Randomized Phase 3 Trials|cognom=Kingsberg|nom5=Julie|cognom4=Williams|nom4=Laura A.|cognom3=Portman|nom3=David|cognom2=Clayton|nom2=Anita H.|nom=Sheryl A.|url=http://journals.lww.com/10.1097/AOG.0000000000003500|llengua=en|doi=10.1097/AOG.0000000000003500|exemplar=5|volum=134|pàgines=899–908|issn=0029-7844|data=2019-11|publicació=Obstetrics & Gynecology|cognom5=Krop}}</ref> |
<big>La bremelanotide, testada i venuda per l’empresa Palatin Techonologies sota el nom de Vyleesi™, és un actiu metabòlic de la melanotan II (molècula sintètica anàloga a l’alfa-MSH) amb una alta afinitat als receptors de tipus 4 de la melanocortina, coneguts per ser importants en les funcions sexuals en les dones. La bremelanotide, ha estat recentment aprovada als Estats Units per l’Administració de menjar i drogues (FDA) com a teràpia pel trastorn hipoactiu del desig sexual (HSDD) en dones premenopàusiques i menopàusiques amb baix desig sexual. Cal remarcar que aquest baix desig sexual no és resultat de cap problema ginecològic, trastorn psicològic o problemes de parella. La bremelanotide s’autoadministra amb una injecció subcutània a l’abdomen o a la cuixa, 45 minuts abans de mantenir relacions sexuals. Tot i que té alguns efectes secundaris, com per exemple nàusees i mal de cap, ha demostrat incrementar el desig sexuals en dones premenopàsiques i menopàusiques.<ref>{{Ref-publicació|article=Bremelanotide for the Treatment of Hypoactive Sexual Desire Disorder: Two Randomized Phase 3 Trials|cognom=Kingsberg|nom5=Julie|cognom4=Williams|nom4=Laura A.|cognom3=Portman|nom3=David|cognom2=Clayton|nom2=Anita H.|nom=Sheryl A.|url=http://journals.lww.com/10.1097/AOG.0000000000003500|llengua=en|doi=10.1097/AOG.0000000000003500|exemplar=5|volum=134|pàgines=899–908|issn=0029-7844|data=2019-11|publicació=Obstetrics & Gynecology|cognom5=Krop}}</ref></big><ref>{{Ref-publicació|article=Bremelanotide for Female Sexual Dysfunctions in Premenopausal Women: A Randomized, Placebo-Controlled Dose-Finding Trial|cognom=Clayton|nom5=Robin|cognom4=DeRogatis|nom4=Leonard R|cognom3=Kingsberg|nom3=Sheryl|cognom2=Althof|nom2=Stanley E|nom=Anita H|url=http://journals.sagepub.com/doi/10.2217/whe-2016-0018|llengua=en|doi=10.2217/whe-2016-0018|exemplar=3|volum=12|pàgines=325–337|issn=1745-5065|data=2016-06|publicació=Women's Health|cognom5=Kroll}}</ref><ref>{{Ref-publicació|article=Bremelanotide: First Approval|url=http://link.springer.com/10.1007/s40265-019-01187-w|publicació=Drugs|data=2019-09|issn=0012-6667|pàgines=1599–1606|volum=79|exemplar=14|doi=10.1007/s40265-019-01187-w|llengua=en|nom=Sohita|cognom=Dhillon|nom2=Susan J.|cognom2=Keam}}</ref> |
||
<big>També s’està investigant les alfa-MSH com a potencials candidates per al diagnòstic del melanoma. Per tal de poder detectar amb exactitud els melanomes cutanis, les possibles metàstasis i lesions del pacient, es pot fer servir la tècnica de la gammagrafia. Aquesta tècnica requereix radiofàrmacs altament específics per poder detectar els tumors i lesions en el pacient. Tant els melanomes melanòtics com els amelanòtics sobreexpressen els receptors de la melanocortina-1 (MC1R), aleshores si s’obtenen derivats a partir de les alfa-MSH, que són els lligands de les MC1R, es podria detectar els tumors. S’ha demostrat a partir d’experiments amb ratolins, que octapèptids derivats de les alfa-MSH, tenen una alta afinitat a les MC1R, una biodistribució favorable en el tumor, és a dir que s’acumulaven preferentment a les lesions del melanoma, i finament un ràpida eliminació de la sang a través dels ronyons. Al cap de 4 hores després d’haver injectat l’octapèptid, es poden veure imatges del melanoma.</big> |
|||
== Referències == |
== Referències == |
||
Revisió del 13:16, 2 nov 2020
| Substància química | grup o classe de proteïnes |
|---|---|
| Trobat en el tàxon | |
| Rol | hormona |
L'Hormona estimulant dels melanòcits (HMS), o també hormona estimulant dels melanòfors, és una hormona de la família de les melanocortines.
Estructura
| Tipus | Seqüència d’aminoàcids | Nom IUAPC | Fórmula molecular | Massa Molar |
|---|---|---|---|---|
| α-MSH[1] | Ac-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val-NH2 | N-acetil-L-seril-L-tirosil-L-seril-L-metionil-L-alfa-glutamil-L-histidil-L-fenilalanil-L-arginil-L-triptofil-glicil-L-lisil-L- prolil-L-valinamida | C77H109N21O19S | 1664,884 g/mol |
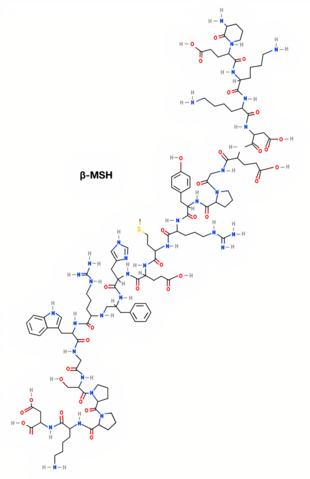
| β-MSH[2] | H-Ala-Glu-Lys-Lys-Asp-Glu-Gly-Pro-Tyr-Arg-Met-Glu-His-Phe-Arg-Trp-Gly-Ser-Pro-Pro-Lys-Asp-OH | DL-alanil-DL-alfa-glutamil-DL-lisil-DL-lisil-DL-alfa-aspartil-DL-alfa-glutamil-glicil-DL-prolil-DL-tirosil-DL-arginil-DL-metionil-DL- àcid alfa-glutamil-DL-histidil-DL-fenilalanil-DL-arginil-DL-triptofil-glicil-DL-seril-DL-prolil-DL-prolil-DL-lisil-DL-aspàrtic | C118H174N34O35S | 2660,91596 g/mol |
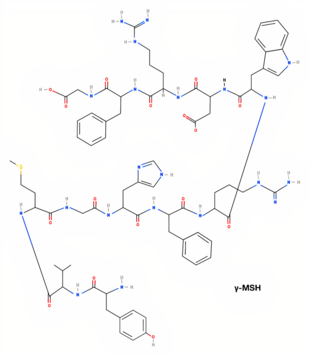
| γ-MSH[3] | H-Tyr-Val-Met-Gly-His-Phe-Arg-Trp-Asp-Arg-Phe-Gly-OH | DL-tirosil-DL-valil-DL-metionil-glicil-DL-histidil-DL-fenilalanil-DL-arginil-DL-triptofil-DL-alfa-aspartil-DL-arginil-DL-fenilalanil-glicina | C74H99N21O16S | 1570,77396 g/mol |
| Estructura 2D (α-MSH)[1] | Estructura 2D (β-MSH)[2] | Estructura 2D (ɣ-MSH)[3] |
|---|---|---|
 |
 |
 |
Biosíntesi
On se sintetitza

El precursor de la MSH, la POMC, es troba en la hipòfisi, l’hipotàlem, el sistema nerviós central, la placenta i la pell. El POMC és sotmès a un extens processament post-traduccional en què s'eliminen seqüències d'aminoàcids irrellevants. D'aquesta manera, el seu trencament difereix segons el tipus de teixit i genera, en cada cas, diferents tipus de pèptids implicats en diverses funcions biològiques, entre ells l'hormona estimulant dels melanòcits (MSH).[5][7]
La POMC és sintetitzada per: cèl·lules corticòtropes de l'adenohipòfisi, cèl·lules melanotropes del lòbul intermedi de la hipòfisi, a prop de 3000 neurones en el nucli arcuat de l'hipotàlem, les poblacions més petites de les neurones en l'hipotàlem dorsomedial i el tronc cerebral i finalment els melanòcits a la pell[8]. Cada teixit aprofita segments de tall del POMC per originar diferents pèptids. Així, la regulació de la seva expressió és específica de cèl·lules i teixits. Concretament la α-MSH se sintetitza a la glàndula pituïtària en el glòbul intermedi i l’hipotàlem. L'ACTH (producte de la POMC) també és sintetitzada a la hipòfisi però per un altre tipus de cèl·lula.[7]
Cèl·lules de la pell on és manifestada la α-MSH: queratinòcits, melanòcits, monòcits de cèl·lules Langerhans, macròfags, cèl·lules endotelials, fibroblasts i mastòcits.[4]
Procediment
La síntesi de pèptids derivats de POMC comença amb el procés de traducció de l'ARNm en un polipèptid precursor inactiu, seguit de proteòlisi post-traduccional per alliberar diferents productes. En el cas de POMC, s'aconsegueix mitjançant l'acció de diferents convertases prohormona (PC). Un cop codificada a partir de l'ARNm, la POMC segueix el trànsit intracel·lular d'una proteïna secretada a través del complex de Golgi, i finalment arriba als grànuls secretors on s'emmagatzemen els productes finals abans de ser secretats per exocitosi o aprofitats per la cèl·lula. Durant aquest procediment, POMC es processa proteolíticament en una sèrie de pèptids fisiològicament diferents, que inclouen α-MSH, β-MSH i ɣ-MSH entre altres.[5][7]
El processament post-traduccional hipotalàmic de la POMC consta de 3 exons dels quals es dona la traducció de l’exó 2 i 3. Les convertases prohormones PC 1 / 2 / 3 trenquen la POMC original en pèptids successius mitjançant l'escissió d’aminoàcids dibàsics emparellats (carregats positivament) que consisteixen en lisina (K) i / o arginina (R). És a dir poden fer talls: lys-arg, lys-lys, arg-lys o arg-arg. Depenent del teixit, la proteòlisi de la POMC s’atura en un pas o un altre aconseguint diferents concentracions dels productes del precursor segons el tipus de cèl·lula i teixit.[9][7][10]

Un cop transcrits els exons de l’ADN per donar lloc a l’ARNm es dona la traducció i s’obté la prePOMC, per l’acció de PC 1 / 3 es forma la Proopiomelanocortina (POMC) que podrà seguir tres vies proteolítiques diferents per arribar a formar α-MSH, β-MSH o ɣ-MSH. Així, la POMC inicial és trencada per P1 per obtenir N-POMC (Pro-ɣ-MSH), corticotropina (ACTH) i β-lipotropina (LPH).
En la síntesi de la ɣ-MSH, sobre el segment N-POMC (Pro-ɣ-MSH) actua la PC 2 obtenint N-POMC i JP. Addicionalment, gràcies a l’acció de PC 2 es forma l'hormona estimulant dels melanòcits gamma (ɣ-MSH).
En la síntesi de la β-MSH, sobre el segment β-lipotropina (LPH) actua la PC 2 per obtenir ɣ-lipotropina i β-endorfina. La PC 2 trenca la ɣ-lipotropina arribant així a l'hormona estimulant dels melanòcits beta (β-MSH).
En la síntesi de la α-MSH la POMC és escindida inicialment per PC1 per generar corticotropina (ACTH). L'ACTH s'escindeix encara més per generar ACTH (1-17) i CLIP. Després, l'enzim carboxipeptidasa E (CPE) elimina els aminoàcids bàsics C-terminals d'ACTH (1-17) obtenint α-MSH (1-14) i l’enzim peptidil α-monooxigenasa amidant (PAM) amida el pèptid per generar desacetil α-MSH (1-13), un pèptid de 13 aminoàcids. Finalment, es dona l'acetilació de desacetil α-MSH (1-13) a acetil α-MSH (1-13) (la forma més activa de α-MSH) per un enzim N-acetiltransferasa (NAT). Per una altra banda, la prolilcarboxipeptidasa (PRCP) convertirà acetil α-MSH (1-13) en el producte inactiu acetil-α-MSH (1–12).[12][11]
Síntesi
Factor inhibidor de MSH
Les hormones de l’escorça suprarenal (cortisol, adrenalina, noradrenalina) inhibeixen la secreció de la MSH així com per la neurohormona hipotalàmica (MIF) també coneguda com a Pro-Leu-Gly-NH2, melanostatina o hormona inhibidora de l'alliberament de MSH.[13]
La MSH és obtinguda pel precursor POMC, per tant, la inhibició de la proopiomelanocortina té efectes directes sobre l'hormona estimulant dels melanòcits. La síntesi i activitat de la POMC augmenta durant l’alimentació i en dejú s’inhibeix. Aquesta activació està regulada per hormones com la leptina i insulina i nutrients com la glucosa. L’activació de la POMC per la leptina desencadena la producció i alliberació de l’hormona estimulant dels melanòcits α-MSH i també l’activació dels receptors de melanocortina MC3R i MC4R, cosa que comporta una supressió de la ingesta d’aliments i un augment de la despesa energètica. Una producció inadequada de α-MSH pot induir l’aparició d’obesitat. L’alteració d’enzims implicats en la maduració d’α-MSH (per exemple les prohormones convertases) afecta la regulació del metabolisme.[11]
Per una altra banda, així com es coneixen els passos que segueix la síntesi de la α-MSH, també se sap que la seva inhibició és, en part, responsabilitat de l’enzim prolilcarboxipeptidasa (PRCP) que catalitza l’eliminació del residu de valina C-terminal, produint un pèptid de 12 aminoàcids inactiu α-MSH (1-12). L’enzim PRCP pertany a la família de les carboxipeptidases i conté en el seu centre actiu residus de serina, histidina i asparagina, aminoàcids essencials per la seva activitat catalítica. En gen PRCP es troba en els cromosomes 11 i 7 en els humans i el producte codificat és una proteïna de cadena única d’aproximadament 58 kD.[11]
Regulació i transport
L’hormona estimulant dels melanòcits (MSH) se sintetitza a la hipòfisi mitjana, que queda per sota de l’hipotàlem. Quan ens exposem a la radiació solar l’hipotàlem s’activa i estimula la hipòfisi mitjançant senyals elèctrics perquè produeixi l’MSH, que s’encarregarà d’activar la resposta pertinent a aquest estímul. La síntesi de la MSH comença amb la divisió de les proopiomelanocortines i el seu target seran els melanòcits, als quals estimularà per tal que alliberin melanina.
Un cop la MSH arriba al melanòcit activa una proteïna receptora de membrana: el receptor de melanocortina tipus I (MC1R). Així doncs, la MSH actua de lligand de la MC1R i el seu reconeixement es produeix gràcies al tetrapèptid (His-Phe-Arg-Trp) que presenta. Aquesta seqüència particular d'aminoàcids és la principal reguladora de la pigmentació i per això no és exclusiva de la MSH. Altres molècules involucrades en processos similars també la presenten com, per exemple, la proteïna Agouti (AgRP) o la corticotropina (ACTH). Malgrat això, existeixen algunes diferències funcionals entre aquestes biomolècules. Per exemple, mentre que la funció de la AgRP i la MSH és activar la producció de la feomelanina en els melanòcits, la de la cysteinyldopa és activar la producció de l'eumelanina, un pigment amb diferent protecció vers l'exposició solar.
Per altra banda, la MC1R pot presentar polimorfismes genètics que són els responsables de les diferències ètniques en la pigmentació i també per les diferents respostes produïdes per l’exposició a la radiació ultraviolada.[14]
La MSH també està relacionada amb altres processos com per exemple estímuls d’estrès, ansietat i de l’apetit. En el cas de l'estrès es creu que el control i regulació de l’hormona pot ser duta a terme a partir de la reacció amb els autoantígens IgG autoAbs. La connexió entre aquestes dues biomolècules és que amb l’exposició a situacions d’estrès el nivell d’afinitat entre les dues incrementa. D'aquesta manera, quan ens trobem en situacions d'estrès, els IgG autoAbs augmenten la capacitat per reaccionar amb la MSH i activar-la per tal que produeixi una resposta a l’estímul.[15] Pel que fa a la regulació de l’apetit, la MSH és considerada una hormona anorexigènica (causa pèrdua de la gana) i en aquesta via metabòlica es torna a trobar relacionada amb la proteïna Agouti (AgRP), que presenta una funció antagònica (augmenta la gana).[16]
Finalment, cal dir que la producció a la glàndula pituïtària de la MSH resulta insuficient per l’activació de la melanogènesi. Per això, segurament existeixen altres vies de senyalització involucrades en l’estimulació dels melanòcits. A més a més, la síntesi de la MSH es podria produir també en altres localitzacions com passa, per exemple, en els queratinòcits. Aquest fet també ens permet entendre que els nivells normals de MSH (i ACTH) circulants en sang siguin baixos ja que els queratinòcits són limítrofs amb els melanòcits i la MSH no cal que sigui transportada a través de la sang. Aquesta via de producció de MSH es regula gràcies al gen p53 que indueix la transformació de les POMC a MSH.
[1] (Mechanisms regulating melanogenesis, 2013)
El receptors de melanocortines (MCR)
Els MCR són receptors acoblats a proteïnes G, proteïnes que travessen set vegades la membrana i que estan unides a una proteïna transductora de senyal anomeda proteïna G. S'han detectat cinc tipus diferents de MCR en humans. Els seus agonistes són els HMS i una quarta hormona anomenada ACTH, també derivada de la POMC. La principal funció dels MSH és induir la melanogènesi en melanòcits. Aquest fet té un importància cabdal en la protecció de l'epidermis contra la radiació ultraviolada i la coloració de cabell i ulls en humans. En certs animals, els MSH permet un canvi ràpid de color gràcies a l'activació dels melanòfors[17], els equivalents del melanòcits en amfibis, peixos i alguns tipus de cefalòpodes i crustacis. El sistema de les melanocortines també regula l'homestasi energètica, però encara no s'ha pogut deteminar tots els derivats de la POMC que hi interactuen[18]. Són especialment relevants l' α-MSH i la β-MSH, agonistes dels receptors MC4R.
El receptor de melanocortines 3, MC3R, a part de trobar-se en el tracte gastrointestinal i en el sistema nerviós central, s'ha localitzat en les cèl·lules del ronyó per tal de regular la natriuresis. Aquest receptor té especial afinitat amb ɣ-MSH[19].
S'ha estudiat la relació de l’α-MSH amb la nocicepció.
Aplicacions mèdiques
S'han desenvolupat molècules sintètiques anàlogues a les alfa-MSH per a l’ús dels humans. Dues de les molècules sintètiques més conegudes i ben estudiades són la afamelanotide i la bremelanotide, però n’existeixen d’altres com ara la modimelanotide i la setmelanotide.
L’afamelanotide o melanotan I, venuda i testada per l’empresa farmacèutica Clinuvel Pharmaceuticals sota el nom de SCENESSE ®, ha demostrat ser eficaç en diferents malalties dermatològiques com ara la protoporfiria eritropètica (EEP), la urticària solar, l’erupció de llum polifòrmica (PMLE), vitiligo, acne, entre d’altres. En el cas de la protoporfiria eritropètica, l’afamelanotide va ser aprovada el 2015 per la Unió Europea com a medicament per a la prevenció de la fototoxicitat en pacients adults. L’afamelanotide, que s’administra de manera subcutània com a implant biodegradable de 16 mg, permet als pacients estar més hores exposats al sol sense dolor i també millores en la seva qualitat de vida.[20][21]
La bremelanotide, testada i venuda per l’empresa Palatin Techonologies sota el nom de Vyleesi™, és un actiu metabòlic de la melanotan II (molècula sintètica anàloga a l’alfa-MSH) amb una alta afinitat als receptors de tipus 4 de la melanocortina, coneguts per ser importants en les funcions sexuals en les dones. La bremelanotide, ha estat recentment aprovada als Estats Units per l’Administració de menjar i drogues (FDA) com a teràpia pel trastorn hipoactiu del desig sexual (HSDD) en dones premenopàusiques i menopàusiques amb baix desig sexual. Cal remarcar que aquest baix desig sexual no és resultat de cap problema ginecològic, trastorn psicològic o problemes de parella. La bremelanotide s’autoadministra amb una injecció subcutània a l’abdomen o a la cuixa, 45 minuts abans de mantenir relacions sexuals. Tot i que té alguns efectes secundaris, com per exemple nàusees i mal de cap, ha demostrat incrementar el desig sexuals en dones premenopàsiques i menopàusiques.[22][23][24]
També s’està investigant les alfa-MSH com a potencials candidates per al diagnòstic del melanoma. Per tal de poder detectar amb exactitud els melanomes cutanis, les possibles metàstasis i lesions del pacient, es pot fer servir la tècnica de la gammagrafia. Aquesta tècnica requereix radiofàrmacs altament específics per poder detectar els tumors i lesions en el pacient. Tant els melanomes melanòtics com els amelanòtics sobreexpressen els receptors de la melanocortina-1 (MC1R), aleshores si s’obtenen derivats a partir de les alfa-MSH, que són els lligands de les MC1R, es podria detectar els tumors. S’ha demostrat a partir d’experiments amb ratolins, que octapèptids derivats de les alfa-MSH, tenen una alta afinitat a les MC1R, una biodistribució favorable en el tumor, és a dir que s’acumulaven preferentment a les lesions del melanoma, i finament un ràpida eliminació de la sang a través dels ronyons. Al cap de 4 hores després d’haver injectat l’octapèptid, es poden veure imatges del melanoma.
Referències
- ↑ 1,0 1,1 PubChem. «alpha-MSH» (en anglès). [Consulta: 31 octubre 2020].
- ↑ 2,0 2,1 PubChem. «beta-Melanocyte-stimulating hormone» (en anglès). [Consulta: 31 octubre 2020].
- ↑ 3,0 3,1 PubChem. «g-Melanotropin» (en anglès). [Consulta: 31 octubre 2020].
- ↑ 4,0 4,1 Luger, Thomas; Grabbe, Stephan; Scholzen, Thomas «The Role of -Melanocyte-Stimulating Hormone in Cutaneous Biology». Journal of Investigative Dermatology Symposium Proceedings, 1997, pàg. 87-93 [Consulta: 31 octubre 2020].
- ↑ 5,0 5,1 5,2 Raffin-Sanson, Ml; de Keyzer, Y; Bertagna, X «Proopiomelanocortin, a polypeptide precursor with multiple functions: from physiology to pathological conditions». European Journal of Endocrinology, 149, 2, 01-08-2003, pàg. 79–90. DOI: 10.1530/eje.0.1490079. ISSN: 0804-4643.
- ↑ Cawley, Niamh X; Li, Zhaojin; Loh, Y Peng «60 YEARS OF POMC: Biosynthesis, trafficking, and secretion of pro-opiomelanocortin-derived peptides». Journal of Molecular Endocrinology, 56, 4, 2016-05, pàg. T77–T97. DOI: 10.1530/JME-15-0323. ISSN: 0952-5041.
- ↑ 7,0 7,1 7,2 7,3 Millington, George WM «The role of proopiomelanocortin (POMC) neurones in feeding behaviour». Nutrition & Metabolism, 4, 1, 2007, pàg. 18. DOI: 10.1186/1743-7075-4-18. PMC: PMC2018708. PMID: 17764572.
- ↑ «Proopiomelanocortina» (en castellà). Wikipedia, 11-09-2020.
- ↑ Raffin-Sanson, ML; Keyzer, Y; Bertagna, X «Proopiomelanocortin, a polypeptide precursor with multiple functions: from physiology to pathological conditions». European Journal of Endocrinology, 2003, pàg. 79-90 [Consulta: 31 octubre 2020].
- ↑ Alberts, Bruce, et altera. «13». A: Molecular Biology of THE CELL. 6th Edition. Garland Science, 2015, p. 744.
- ↑ 11,0 11,1 11,2 11,3 D’Agostino, Giuseppe; Diano, Sabrina «alpha-Melanocyte stimulating hormone: production and degradation» (en anglès). Journal of Molecular Medicine, 88, 12, 2010-12, pàg. 1195–1201. DOI: 10.1007/s00109-010-0651-0. ISSN: 0946-2716. PMC: PMC3936413. PMID: 20617297.
- ↑ Li, Qing; Jia, Yang; Burris, Walter R; Bridges, Phillip J; Matthews, James C «Forms of selenium in vitamin–mineral mixes differentially affect the expression of genes responsible for prolactin, ACTH, and α-MSH synthesis and mitochondrial dysfunction in pituitaries of steers grazing endophyte-infected tall fescue1» (en anglès). Journal of Animal Science, 97, 2, 01-02-2019, pàg. 631–643. DOI: 10.1093/jas/sky438. ISSN: 0021-8812.
- ↑ «Wikiwand». [Consulta: 1r novembre 2020].
- ↑ Videira, IF; Moura, DF; Magina, S «Mechanisms regulating melanogenesis.». Anais brasileiros de dermatologia, 88, 1, gener 2013, pàg. 76-83. DOI: 10.1590. PMID: 23539007.
- ↑ Sinno, Maria Hamze; Rego, Jean Claude Do; Coëffier, Moïse; Bole-Feysot, Christine; Ducrotté, Philippe; Gilbert, Danièle; Tron, François; Costentin, Jean; Hökfelt, Tomas; Déchelotte, Pierre; Fetissov, Sergueï O. «Regulation of feeding and anxiety by α-MSH reactive autoantibodies». Psychoneuroendocrinology, 34, 1, gener 2009, pàg. 140–149. DOI: 10.1016/j.psyneuen.2008.08.021.
- ↑ Vehapoğlu, Aysel; Türkmen, Serdar; Terzioğlu, Şule «Alpha-Melanocyte-Stimulating Hormone and Agouti-Related Protein: Do They Play a Role in Appetite Regulation in Childhood Obesity?». Journal of Clinical Research in Pediatric Endocrinology, 8, 1, 01-03-2016, pàg. 40–47. DOI: 10.4274/jcrpe.2136. PMID: 13085727.
- ↑ Hadley, M. E.; Heward, C. B.; Hruby, V. J.; Sawyer, T. K.; Yang, Y. C. «Biological actions of melanocyte-stimulating hormone». Ciba Foundation Symposium, 81, 1981, pàg. 244–262. DOI: 10.1002/9780470720646.ch14. ISSN: 0300-5208. PMID: 6268380.
- ↑ «Central administration of β-MSH reduces body weight in obese male Pomctm1/tm1 mice» (en anglès). Biochimica et Biophysica Acta (BBA) - General Subjects, 1864, 10, 01-10-2020, pàg. 129673. DOI: 10.1016/j.bbagen.2020.129673. ISSN: 0304-4165.
- ↑ Ni, Xi-Ping; Kesterson, Robert A.; Sharma, Shubh D.; Hruby, Victor J.; Cone, Roger D. «Prevention of reflex natriuresis after acute unilateral nephrectomy by melanocortin receptor antagonists». American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 274, 4, 01-04-1998, pàg. R931–R938. DOI: 10.1152/ajpregu.1998.274.4.R931. ISSN: 0363-6119.
- ↑ Kaddurah, Hisham; Braunberger, Taylor L.; Vellaichamy, Gautham; Nahhas, Amanda F.; Lim, Henry W. «The Impact of Sunlight on Skin Aging». Current Geriatrics Reports, 7, 4, 29-10-2018, pàg. 228–237. DOI: 10.1007/s13670-018-0262-0. ISSN: 2196-7865.
- ↑ Langendonk, Janneke G.; Balwani, Manisha; Anderson, Karl E.; Bonkovsky, Herbert L.; Anstey, Alexander V. «Afamelanotide for Erythropoietic Protoporphyria» (en anglès). New England Journal of Medicine, 373, 1, 02-07-2015, pàg. 48–59. DOI: 10.1056/NEJMoa1411481. ISSN: 0028-4793.
- ↑ Kingsberg, Sheryl A.; Clayton, Anita H.; Portman, David; Williams, Laura A.; Krop, Julie «Bremelanotide for the Treatment of Hypoactive Sexual Desire Disorder: Two Randomized Phase 3 Trials» (en anglès). Obstetrics & Gynecology, 134, 5, 2019-11, pàg. 899–908. DOI: 10.1097/AOG.0000000000003500. ISSN: 0029-7844.
- ↑ Clayton, Anita H; Althof, Stanley E; Kingsberg, Sheryl; DeRogatis, Leonard R; Kroll, Robin «Bremelanotide for Female Sexual Dysfunctions in Premenopausal Women: A Randomized, Placebo-Controlled Dose-Finding Trial» (en anglès). Women's Health, 12, 3, 2016-06, pàg. 325–337. DOI: 10.2217/whe-2016-0018. ISSN: 1745-5065.
- ↑ Dhillon, Sohita; Keam, Susan J. «Bremelanotide: First Approval» (en anglès). Drugs, 79, 14, 2019-09, pàg. 1599–1606. DOI: 10.1007/s40265-019-01187-w. ISSN: 0012-6667.
