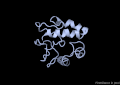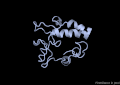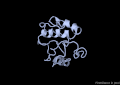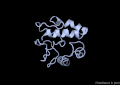VAP-B
Les VAP-B (Vesicle-associated membrane protein-associated protein B/C) són un tipus de proteïnes integrals de membrana pertanyents a la família de les VAPs (VAMP-associated protein), un conjunt de proteïnes integrals de membrana de seqüència conservada, localitzades al reticle endoplasmàtic i presents a totes les cèl·lules eucariotes. Les sigles VAP signifiquen proteïna associada a VAMP,[4] on VAMP significa proteïna de membrana associada a vesícules. En l'espècie humana trobem tres tipus de VAPs: VAP-A, VAP-B i MOSPD2.
Aquesta família de proteïnes està implicada en diverses funcions cel·lulars com ara la regulació del transport de lípids i la homeòstasi, el tràfic de membranes, l'alliberació de neurotransmissors, l'estabilització dels microtúbuls presinàptics i la resposta protèica desplegada, entre d'altres.[5]
Estructura[modifica]
La proteïna VAP-B està formada per 243 aminoàcids agrupats en 3 dominis diferents. El primer, i el més gran, el domini MSP (Major Sperm Protein) N-terminal de 125 residus, seguidament un domini central CC (coiled-coil) de 38 residus i finalment un domini TMB (transmembrane) C-terminal de 20 residus.[6]

A nivell d'estructura secundària, només s'ha cristal·litzat el domini MSP, i consta de les següents estructures:

| Tipus d'estructura | Quantitat | Posició |
|---|---|---|
| Gir | 4 | 4-7
49-51 82-84 104-108 |
| Làmina beta | 9 | 8 - 20
26 – 33 36 – 38 40 – 47 52 – 61 66 – 73 88 – 94 111 – 113 115 – 124 |
| Hèlix alfa | 0 |
Per altra banda, aquesta proteïna presenta dues isoformes:
- Isoforma VAP-B: és la isoforma clàssica i més estudiada.
- Isoforma VAP C: es diferencia de la isoforma B per la seqüència d'aminoàcids entre el 71 i el 99 de la següent manera:
A la isoforma VAP-B la seqüència és : VMLQPFDYDPNEKSKHKFMVQSMFAPTDT.
En canvi a la isoforma VAP-C és: GRRWTADEEDSAEQQPHFSISPNWEGRRP
Localització[modifica]
En referència a la localització subcel·lular, les proteïnes VAPB es troben a la membrana del reticle endoplasmàtic. Atenent la seva estructura, l'extrem N-terminal d'aquestes proteïnes es troba a la zona citosòlica de la membrana i l'extrem C-terminal, proper al domini transmembranal de les proteïnes, serveix d'arrelament d'aquestes a la membrana citosòlica del reticle. També consta d'un domini central, com s'explicita a l'apartat anterior.[7][8] Cal remarcar que, tot i trobar-se a la membrana del reticle endoplasmàtic, en ser proteïnes de membrana, poden trobar-se puntualment en altres punts de la cèl·lula com ara l'aparell de Golgi, la membrana plasmàtica, el citosol,etc., a conseqüència del moviment vesicular.
A nivell cromosòmic, el gen que codifica per a les VAPB en humans es troba en el braç q del cromosoma 20, del qual es prediu que conté entre 500 i 600 gens que participen en la codificació proteica,[9] concretament a la posició (locus) 13.32 d'aquest (20q13.32).[10] Aquest gen s'expressa en cèl·lules de 27 teixits diferents, és a dir, en cèl·lules de 27 tipus diferents (localització tissular)[11] i és de tipus protein coding, és a dir, com és evident, que donarà lloc a una proteïna (la VAPB).[12]
Interaccions[modifica]
Les proteïnes VAP-B presenten nombroses interaccions de molts tipus, les quals es relacionen intrínsecament amb la seva funció:
Interaccions per a l'activitat de dimerització[modifica]
Les VAP-B, en la seva conformació quaternària a la membrana reticular, són dímers i, per tant, les trobarem associades a altres proteïnes:
VAP-B[modifica]
Interaccionen amb altres VAP-B en la formació d'homodímers, dímers formats per monòmers iguals.
VAP-A[modifica]
Interaccionen amb VAP-A (altres proteïnes associades a VAMP) en la formació d'heterodímers, dímers formats per monòmers diferents.
Interaccions via FFAT motifs[modifica]
Les proteïnes VAP-B interaccionen amb nombroses proteïnes a través dels anomenats motius seqüencials FFAT, consistents de dues fenilalanines en un tracte acídic i presents majoritàriament en proteïnes citosòliques de la membrana reticular i nuclear.[13] Alguns exemples de proteÏnes amb les quals interaccionen VAP-B a través d'aquest motiu són:
FIP200, ULK1 i WIPI2[14][modifica]
Les VAP-B interaccionen directament amb FIP200 i ULK1 per tal d'estabilitzar el complex que formen juntes quan se situen al lloc de formació d'autofagosomes al reticle endoplasmàtic (els autofagosomes es creen a partir de la separació de part del reticle endoplasmàtic).[15] Hem de tenir en compte que les VAP-B, en trobar-se a la membrana reticular, formaran inevitablement part de processos produïts a la mateixa, com ara la formació d'autofagosomes. A més, les VAP-B també facilitaran la formació del complex WIPI2/FIP200, el qual és essencial en el contacte entre la membrana del reticle endoplasmàtic i de l'autofagosoma immadur.
STARD3 i STARD3NL[16][modifica]
Aquestes dues proteïnes (StAR related lipid transfer domain-3 i STARD3 N-terminal like, respectivament) es troben a la membrana dels late endosomes i, en interaccionar amb les VAP-B, que es troben ancorades a la membrana del reticle endoplasmàtic, creen un lloc de contacte membranal (MCS, segons les inicials en anglès).
Interaccions amb proteïnes víriques (factor hoste) [17][modifica]
NS5B/NS5A[modifica]
Proteïnes properes a l'extrem C-terminal del virus de la Hepatitis C (HCV) per a formar un complex dinàmic de replicació, útil per al virus.
Interaccions amb proteïnes amb funció de quinases[modifica]
ERN1/IRE1[modifica]
Les proteïnes VAP-B interactuen amb proteïnes que actuen com a quinases i/o endoribonucleases i tenen un paper important en la resposta a proteïnes mal plegades.
Interaccions amb quinasines[modifica]
KIF5A [18][modifica]
Les VAP-B interaccionen amb la proteïna KIF5A, essencial en el tràfic vesicular (gran correlació de les vesícules amb el reticle endoplasmàtic, on es troben les VAP-B), ja que pertany a la família de les quinesines, encarregades del transport anterògrad (això és cap enfora del cos cel·lular)de partícules sobre els microtúbuls cel·lulars. En el cas concret de KIF5A, regula el tràfic vesicular de proteïnes i organels en neurones principalment. La interacció de KIF5A i VAPB ve mediada per la proteïna adaptadora Protrudina, la qual ve codificada pel gen ZFYVE27 i es troba en el domini MSP.
Interacció per a la regulació de l'homeòstasi del calci[19][modifica]
PTPIP51/RMDN3[modifica]
Les proteïnes VAP-B interactuen amb la proteïna PTPIP51 (també coneguda com a RMDN3), que es troba a la membrana mitocondrial. Com que les VAP-B es troben a la membrana reticular, es genera un punt de contacte membranal (MCS), a través del qual es produirà el pas d'ions de Ca2+, regulant-se així el manteniment homeòstasic de la seva concentració.
Interaccions amb VAMPs[20][modifica]
Les VAP-B interaccionen amb VAMP1 (synaptobrevin 1), VAMP2 (synaptobrevin 2) i VAMP8.
Interaccions amb altres proteïnes[modifica]
Les proteïnes VAP-B estableixen interaccions amb un nombre molt gran de proteïnes. Alguns exemples poden ser la que estableix amb la proteïna MTNR1A (melatonin receptor 1A) o amb la proteïna STX4 (syntaxin 4A). Ambdues proteïnes mencionades s'encarreguen de la comunicació cel·lular a través de la transducció de senyals. Com s'ha mencionat, les VAP-B estableixen moltes interaccions amb diferents proteïnes i partícules, i a continuació s'exposen diverses pàgines web que recullen les interaccions que té VAP-B i al costat s'explicita el nombre d'interaccions que presenta cadascuna:
- National Center for Biotechnology Information (NCBI): 171 interaccions
- BioGRID: 170 interaccions
- IntAct: 149 interaccions
- STRING: 10 interaccions
Funcions[modifica]
Les proteïnes VAP-B són un tipus de Membrane Contact Sites (proteïnes que connecten dos orgànuls de manera molt propera i que es reconeixen i estableixen connexions) que es troben a la membrana del Reticle Endoplasmàtic.[16] Per tant, els principals processos en què participen venen determinats per la seva localització i les seves interaccions amb altres molècules.
Resposta a proteïnes mal plegades[modifica]
Quan es concentren proteïnes desplegades o mal plegades al lumen, és a dir quan l'estructura proteica s'ha modificat i, per tant, es veu afectada la capacitat funcional de la proteïna, el reticle es troba en situació d'estrés i desencadena la UPR, o resposta a proteïnes mal plegades per retornar la cèl·lula al seu estat normal.
En condicions normals, les proteïnes IRE1 i XBP1, que tenen un rol important en la UPR, no es troben expressades quan es marquen amb la proteïna fluorescent Venus (derivada de la GFP). En canvi, quan es produeix l'estrés al reticle endoplasmàtic, la proteïna IRE 1 s'expressa i es fusionen les proteÏnes XBP1 i Venus (es talla el codó de stop que impedia la seva expressió). Així doncs, s'ha comprovat que, quan se sobreexpressa la proteïna VAP-B en situacions d'estrés cel·lular, s'indueix l'expressió de les proteïnes IRE1 i XBP1, de tal manera que s'inicia la UPR. En canvi, quan hi ha una mutació a l'RNA de les VAP-B, com ara la mutació P56S, es redueix a la meitat l'expressió de la proteïna i, per tant, s'inhibeix la resposta.[21]
Homeòstasi del calci[modifica]
Les proteïnes VAP-B interaccionen pel seu amino-terminal amb el carboxil-terminal de la Protein Tyrosine Phosphatase-interacting Protein 51 (PTPIP51), que es troba als mitocondris. Tant el mitocondri com el reticle són llocs d'emmagatzematge de calci a la cèl·lula i la connexió que s'estableix entre aquests dos orgànuls permet la creació d'uns canals proteics que regulen l'intercanvi de calci. De fet, la mutació P56S altera el lligam entre aquestes proteïnes de tal manera que el nivell de calci a la mitocòndira disminueix dràsticament i augmenta al reticle. L'homeòstasi del calci és molt important, ja que, en excés, és una substància molt tòxica per la cèl·lula. Aquestes pertorbacions s'expressen en malalties com el Parkinson.[19]
Interaccions amb partícules virals[modifica]
Les proteïnes VAP, en general, participen en l'entrada de virus a les cèl·lules, la seva replicació i la sortida. Un dels principals exemples és la replicació del virus de l'Hepatitis C, en el qual participen les proteïnes VAP-A, NS5A i NS5B. Les proteïnes VAP-B interaccionen amb la proteïna NS5A, per 70 residus (aminoàcids) que es troben a l'amino-terminal de les VAP-B amb la seqüència d'aminoàcids compresa entre el 341 i el 344 del l'extrem citosòlic de la NS5A. També s'uneix a les VAP-A per un domini transmembrana. Si se sobreexpressa la proteïna VAP-B s'amillora l'expressió de les altres proteïnes i, per tant, s'incrementa la replicació del virus.[22]
Altres funcions [1][modifica]
- Regulació de potasi en la interacció amb els canals Kv2.[23]
- Modulació de la biogènesi d'autofagosomes.[14]
- Transport d'oxiesterols i ceràmides des del reticle fins a l'Aparell de Golgi per interacció amb proteïnes associades a lípids: OSBP (oxysterol binding protein) i CERT (Ceramide binding protein).
Mutacions[modifica]
En aquest tipus de proteïna poden produir-se mutacions a causa de canvis seqüencials, és a dir, una modificacions en la seqüència d'aminoàcids. En el cas de la VAP-B, aquestes mutacions es produeixen de manera natural.
Mutació VAR_067964[modifica]
Es dona lloc a la posició de l'aminoàcid 46, on hi ha una treonina quan la VAP-B es troba en la seva forma no mutada, la qual se substitueix per una isoleucina en cas de produir-se la mutació.
Aquesta substitució provoca la formació d'agragacions de proteïnes insolubles al citoplasma a causa d'una impossibilitat d'activar-se una resposta cel·lular a la proteïna desplegada, de la qual s'encarreguen els gens ERN1 i IRE1. Això, per tant, comporta com a conseqüència una acumulació excessiva d'aquest tipus d'agregacions a la cèl·lula, cosa que pot implicar la mort cel·lular.[24]
Mutació P56S[modifica]
Aquesta mutació té una gran importància en molts aspectes cel·lulars i del desenvolupament de malalties neurodegeneratives, motores i musculars. Es produeix en el domini MSP, més concretament en l'aminoàcid 56. La mutació consisteix en la substitució d'una prolina per una serina.
Alguns dels efectes cel·lulars que provoca aquesta mutació són:
- Formació d'agregats insolubles al citosol.
- Inhibició de la UPR (de l'anglès Unfolded Protein Response): no es produeix una resposta cel·lular a l'excés de proteïnes desplegades acumulades al lumen del reticle endoplasmàtic.
- Canvis en la interacció amb la RMDN3.
- Canvis en l'homeòstasi del calci.
- Deslocalització de la proteïna a altres compartiments.
- Homodimerització: unió de dues proteïnes idèntiques.
Les malalties provocades per aquesta mutació són l'Esclerosi Lateral Amiotròfica i l'Atròfia Muscular Espinal del tipus proximal, adulta i autosòmica dominant.[25]
-
Estructura del domini MSP-P56S (mutació)
Malalties associades[modifica]
Les malalties relacionades amb una proteïna acostumen a produir-se a causa d'una mutació d'aquesta. En cas de mutació de les VAP-B, hi ha dues malalties que poden porduïr-se i una que es produeix per la interacció amb una altra proteïna:
- Esclerosi Lateral Amiotròfica tipus 8 (coneguda com a ALS8, de l'anglès Amyotrophic Lateral Sclerosis): anteriorment només se sabia que els mecanismes de pèrdua de funció que provoquen aquesta malaltia es produïen a causa de la VAP-B, però actualment s'ha identificat una nova mutació a l'al·lel V234I de la proteïna. Es va dur a terme un estudi en Drosophila, l'al·lel causant de les quals és el DVAP-V260I. Van poder-se observar anomalies tant a nivell intracel·lular com extracel·lular:
- Intracel·lular: defectes en l'estructura sinàptica de les neurones i en la dels microtúbuls, formació d'agragacions de proteïnes, anomalies nuclears i neurodegeneració.
- Extracel·lular: reducció de la visibilitat, postura defectuosa de les ales, anomalies locomotores i augment dels nivells d'estrés.
Aquests resultats són bastant similars a les característiques de la ALS8 en humans, cosa que confirma que la VAP-B és la causant d'aquesta malaltia.[26]
- Atròfia muscular espinal del tipus proximal, adulta i autosòmica dominant (coneguda com a SMAPAD, de l'anglès Spinal muscular atrophy, proximal, adult, autosomal dominant): una mutació en la seqüència d'aminoàcids de la VAP-B que implicava la substitució d'una prolina en posició 56 per una serina va ser detectada en diverses families del Brasil, la major part dels membres de les quals patien les anomalies següents:
- Debilitat i atròfia muscular proximal, insuficiència respiratòria, nivells baixos de reflexes, tremolor, estrenyiment intestinal crònic i disfunció sexual, entre d'altres.
Mitjançant l'electromiografia es va poder comprovar que aquest tipus d'atròfia muscular era causada per una disfunció a nivell neuronal, la qual estaba produïda per aquesta mutació de la VAP-B.[27][28]
- Hepatitis C: en la replicació del VHC (virus que provoca aquesta malaltia) hi estan implicades proteïnes de membrana com la NS5A. Actualment s'ha identificat que aquesta proteïna s'associa a les VAP (incloent, per tant, la VAP-B) per tal de facilitar aquesta replicació. Això implica, per tant, que la VAP-B tingui un paper important en la manifestació d'hepatitis C.[29][30]
Referències[modifica]
- ↑ 1,0 1,1 1,2 GRCm38: Ensembl release 89: ENSMUSG00000054455 - Ensembl, May 2017
- ↑ «Human PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ «Mouse PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ Weir, M L; Klip, A; Trimble, W S «Identification of a human homologue of the vesicle-associated membrane protein (VAMP)-associated protein of 33 kDa (VAP-33): a broadly expressed protein that binds to VAMP.». Biochemical Journal, 333, Pt 2, 15-07-1998, pàg. 247–251. ISSN: 0264-6021. PMC: PMC1219579. PMID: 9657962.
- ↑ «The VAP protein family: from cellular functions to motor neuron disease» (en anglès). Trends in Cell Biology, 18, 6, 01-06-2008, pàg. 282–290. DOI: 10.1016/j.tcb.2008.03.006. ISSN: 0962-8924.
- ↑ «Domain organization and crystal structure of VAPB.(A) 2 | Open-i» (en anglès). [Consulta: 19 octubre 2018].
- ↑ «VAPB - Vesicle-associated membrane protein-associated protein B/C - Homo sapiens (Human) - VAPB gene & protein» (en anglès). [Consulta: 21 octubre 2018].
- ↑ «VAPB Protein, Human, Recombinant (His Tag) | SinoBiological». [Consulta: 21 octubre 2018].
- ↑ Reference, Genetics Home. «Chromosome 20» (en anglès). [Consulta: 21 octubre 2018].
- ↑ Reference, Genetics Home. «VAPB gene» (en anglès). [Consulta: 21 octubre 2018].
- ↑ «VAPB VAMP associated protein B and C [Homo sapiens (human) - Gene - NCBI]» (en anglès). [Consulta: 21 octubre 2018].
- ↑ «VAPB Symbol Report | HUGO Gene Nomenclature Committee». [Consulta: 21 octubre 2018].
- ↑ EMBL-EBI. «QuickGO». [Consulta: 22 octubre 2018].
- ↑ 14,0 14,1 Zhao, Yan G.; Liu, Nan; Miao, Guangyan; Chen, Yong; Zhao, Hongyu «The ER Contact Proteins VAPA/B Interact with Multiple Autophagy Proteins to Modulate Autophagosome Biogenesis» (en anglès). Current Biology, 28, 8, 2018-04, pàg. 1234–1245.e4. DOI: 10.1016/j.cub.2018.03.002. ISSN: 0960-9822.
- ↑ «La célula. 5. Tráfico vesicular. Autofagia. Atlas de Histología Vegetal y Animal». [Consulta: 22 octubre 2018].
- ↑ 16,0 16,1 Alpy, Fabien; Rousseau, Adrien; Schwab, Yannick; Legueux, François; Stoll, Isabelle «STARD3/STARD3NL and VAP make a novel molecular tether between late endosomes and the ER» (en anglès). J Cell Sci, 01-01-2013, pàg. jcs.139295. DOI: 10.1242/jcs.139295. ISSN: 0021-9533. PMID: 24105263.
- ↑ Gupta, Garvita; Song, Jianxing «C-Terminal Auto-Regulatory Motif of Hepatitis C Virus NS5B Interacts with Human VAPB-MSP to Form a Dynamic Replication Complex». PloS One, 11, 1, 2016, pàg. e0147278. DOI: 10.1371/journal.pone.0147278. ISSN: 1932-6203. PMC: PMC4718513. PMID: 26784321.
- ↑ Matsuzaki, Fumiko; Shirane, Michiko; Matsumoto, Masaki; Nakayama, Keiichi I. «Protrudin serves as an adaptor molecule that connects KIF5 and its cargoes in vesicular transport during process formation». Molecular Biology of the Cell, 22, 23, 01-12-2011, pàg. 4602–4620. DOI: 10.1091/mbc.E11-01-0068. ISSN: 1059-1524. PMC: PMC3226478. PMID: 21976701.
- ↑ 19,0 19,1 De Vos, Kurt J.; Mórotz, Gábor M.; Stoica, Radu; Tudor, Elizabeth L.; Lau, Kwok-Fai «VAPB interacts with the mitochondrial protein PTPIP51 to regulate calcium homeostasis». Human Molecular Genetics, 21, 6, 15-03-2012, pàg. 1299–1311. DOI: 10.1093/hmg/ddr559. ISSN: 0964-6906. PMC: PMC3284118. PMID: 22131369.
- ↑ «VAPB - Vesicle-associated membrane protein-associated protein B/C - Homo sapiens (Human) - VAPB gene & protein» (en anglès). [Consulta: 22 octubre 2018].
- ↑ Kanekura, Kohsuke; Nishimoto, Ikuo; Aiso, Sadakazu; Matsuoka, Masaaki «Characterization of Amyotrophic Lateral Sclerosis-linked P56S Mutation of Vesicle-associated Membrane Protein-associated Protein B (VAPB/ALS8)» (en anglès). Journal of Biological Chemistry, 281, 40, 06-10-2006, pàg. 30223–30233. DOI: 10.1074/jbc.M605049200. ISSN: 0021-9258. PMID: 16891305.
- ↑ Hamamoto, I.; Nishimura, Y.; Okamoto, T.; Aizaki, H.; Liu, M. «Human VAP-B Is Involved in Hepatitis C Virus Replication through Interaction with NS5A and NS5B» (en anglès). Journal of Virology, 79, 21, 13-10-2005, pàg. 13473–13482. DOI: 10.1128/JVI.79.21.13473-13482.2005. ISSN: 0022-538X.
- ↑ Kirmiz, Michael; Vierra, Nicholas C.; Palacio, Stephanie; Trimmer, James S. «Identification of VAPA and VAPB as Kv2 Channel-Interacting Proteins Defining Endoplasmic Reticulum–Plasma Membrane Junctions in Mammalian Brain Neurons» (en anglès). Journal of Neuroscience, 38, 35, 29-08-2018, pàg. 7562–7584. DOI: 10.1523/JNEUROSCI.0893-18.2018. ISSN: 0270-6474. PMID: 30012696.
- ↑ «VAPB - Vesicle-associated membrane protein-associated protein B/C - Homo sapiens (Human) - VAPB gene & protein» (en anglès). [Consulta: 18 octubre 2018].
- ↑ Nishimura, Agnes L.; Mitne-Neto, Miguel; Silva, Helga C. A.; Richieri-Costa, Antônio; Middleton, Susan «A mutation in the vesicle-trafficking protein VAPB causes late-onset spinal muscular atrophy and amyotrophic lateral sclerosis». American Journal of Human Genetics, 75, 5, 2004-11, pàg. 822–831. DOI: 10.1086/425287. ISSN: 0002-9297. PMC: PMC1182111. PMID: 15372378.
- ↑ Sanhueza, Mario; Zechini, Luigi; Gillespie, Trudy; Pennetta, Giuseppa «Gain-of-function mutations in the ALS8 causative gene VAPB have detrimental effects on neurons and muscles». Biology Open, 3, 1, 10-12-2013, pàg. 59–71. DOI: 10.1242/bio.20137070. ISSN: 2046-6390. PMC: PMC3892161. PMID: 24326187.
- ↑ Marques, Vanessa D.; Barreira, Amilton A.; Davis, Mary B.; Abou-Sleiman, Patrick M.; Silva, Wilson A. «Expanding the phenotypes of the Pro56SerVAPB mutation: Proximal SMA with dysautonomia» (en anglès). Muscle & Nerve, 34, 6, 2006, pàg. 731–739. DOI: 10.1002/mus.20657. ISSN: 0148-639X.
- ↑ «A Mutation in the Vesicle-Trafficking Protein VAPB Causes Late-Onset Spinal Muscular Atrophy and Amyotrophic Lateral Sclerosis» (en anglès). The American Journal of Human Genetics, 75, 5, 01-11-2004, pàg. 822–831. DOI: 10.1086/425287. ISSN: 0002-9297.
- ↑ «VAP-B Protein - ACROBiosystems» (en anglès). [Consulta: 18 octubre 2018].
- ↑ Gupta, Garvita; Qin, Haina; Song, Jianxing «Intrinsically Unstructured Domain 3 of Hepatitis C Virus NS5A Forms a “Fuzzy Complex” with VAPB-MSP Domain Which Carries ALS-Causing Mutations» (en anglès). PLoS ONE, 7, 6, 13-06-2012, pàg. e39261. DOI: 10.1371/journal.pone.0039261. ISSN: 1932-6203. PMC: PMC3374797. PMID: 22720086.