Virus de l'hepatitis C
| Hepatitis C virus | |
|---|---|
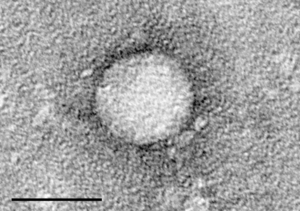 Ultramicrografia mostrant una partícula del virus de l'hepatitis C virus purificades a partir d'un cultiu cel·lular. La barra negra indica una longitud de 50 nanòmetres | |
| Dades | |
| Genoma | Grup IV ((+)ssRNA) |
| Malaltia | hepatitis C |
| Taxonomia | |
| Família | Flaviviridae |
| Gènere | Hepacivirus |
| Espècie | Hepatitis C virus |
El virus de l'hepatitis C (VHC o HCV per les seves sigles angleses) és un virus d'ARN de la família Flaviviridae petit (55–65 nm de mida), embolcallat, de sentit positiu i de cadena simple. El virus de l'hepatitis C és l'agent causal d'alguns càncers com carcinoma hepatocel·lular i limfomes en éssers humans.[1][2]
Taxonomia[modifica]
El virus de l'hepatitis C pertany al gènere Hepacivirus, dins de la família membre del família Flaviviridae. Fins fa poc es considerava l'únic membre d'aquest gènere. Tanmateix s'ha descobert un membre d'aquest gènere que infecta els gossos—l'hepacivirus caní.[3] Hi ha també com a mínim un virus en aquest gènere que infecta cavalls.[4] S'han descrit altres virus del gènere ha estat descrit en ratpenats i rosegadors.[5][6]
Estructura[modifica]

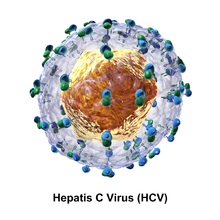
La partícula vírica de l'hepatitis C consisteix d'un nucli de material genètic (ARN), envoltat per una càpsula icosaèdrica de proteïna, envoltada per una bicapa lipídica d'origen cel·lular. Dues menes de glicoproteïnes víriques d'embolcall, E1 i E2, estan embegudes en aquesta membrana lipídica.[7]
Genoma[modifica]
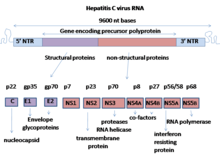
El virus de l'hepatitis C té un genoma d'ARN de cadena simple i sentit positiu.[8] El genoma consisteix d'un marc obert de lectura amb una longitud de 9.600 bases de nucleòtid. Aquest marc obert de lectura és traduït per tal de produir un únic producte proteic, que més tard és processat per a produir les proteïnes actives més petites.

Als extrems 5' i 3' de l'ARN hi ha els UTR, que no són traduïts a proteïnes però que tenen rellevància durant la traducció i replicació de l'ARN víric. L'extrem 5' UTR té un lloc intern d'entrada al ribosoma [9] (IRES — lloc d'entrada de ribosoma intern) que comença la traducció d'una proteïna molt llarga amb uns tres milers d'aminoàcids de longitud. El domini nuclear del virus de l'hepatitis C (VHC) IRES conté una unió de quatre trams d'hèlixs que és integrat dins d'un pseudonús predit.[10] La conformació d'aquest domini nuclear constreny l'orientació del marc obert de lectura per col·locar en la subunitat ribosòmica 40S. L'enorme pre-proteïna és més tard tallat per proteases cel·lulars i virals en les 10 proteïnes més petites que permeten la replicació dins de la cèl·lula hoste, o formar les noves partícules virals.[11]
Biologia molecular[modifica]
Les proteïnes d'aquest virus són arranjades al llarg del genoma en l'ordre següent: N terminal-nucli-sobre (E1)–E2–p7-proteïna no estructural 2 (NS2)–NS3–NS4A–NS4B–NS5A–NS5B–C terminal. La generació de les proteïnes madures no estructurals (NS2 a NS5B) depèn de l'activitat de les proteases virals.[12] La unió NS2/NS3 és trencada per una proteasa metall-dependent autocatalítica codificada entre el gen NS2 i el N-terminal de NS3. La resta de punts de trencament downstream d'aquest lloc és catalitzat per una serina proteasa també continguda dins de la regió N-terminal de NS3.
La proteïna del nucli té 191 aminoàcids i s'hi poden distingir tres dominis segons la seva hidrofobicitat: Domini 1 (residus 1 a 117) conté principalment residus bàsics amb dues regions hidrofòbiques curtes; domini 2 (residus 118 a 174) és menys bàsic i més hidrofòbic i el seu C-terminal és al final de p21; domini 3 (residus 175 a 191) és altament hidrofòbic i actua com a seqüència de senyal per a E1 proteïna de l'embolcall.
Ambdues proteïnes de l'embolcall (E1 i E2) són altament glucosades i importants per a la subsegüent l'entrada del virus a la cèl·lula. E1 serveix com a subunitat que media en la fusió i E2 actua com a proteïna d'unió. E1 té 4–5 N-glicans i E2 té 11 llocs de N-glucosilació.
La proteïna p7 proteïna és dispensable per a la replicació del genoma viral però juga una funció clau en la morfogènesi de virus. Aquesta és una proteïna transmembrana de 63 d'aminoàcid que es troba al reticle endoplasmàtic. L'escissió de p7 és mediada per les peptidases senyalitzadores del reticle endoplasmàtic. Dos dominis transmembrana de p7 estan units per un bucle citoplasmàtic orientat a l'interior del lumen del reticle endoplasmàtic.
NS2 és una proteïna de 21–23 kiloDalton (kDa) proteïna transmembrana amb activitat proteasa.
NS3 és una proteïna de 67 kDa amb activitat serina proteasa N-terminal activitat i activitat ha NTPasa/helicasa C-terminal. Es localitza dins del reticle endoplasmàtic i forma un complex heterodimèric amb NS4A—una proteïna de membrana amb 54 aminoàcid que actua com a cofactor de la proteasa.
NS4B és una petita (27 kDa) proteïna integral de membrana hidrofòbica amb 4 dominis transmembrana. És a l'interior del reticle endoplasmàtic i juga una funció important en el reclutament d'altres proteïnes virals. Indueix canvis morfològics al reticle endoplasmàtic formant una estructura anomenada “xarxa membranosa”.
NS5A és una fosfoproteïna hidròfila que juga funcions important en la replicació viral, modulació de les vies de senyalització cel·lular i la resposta a l'interferó. Hi ha constància que s'uneix al reticle endoplasmàtic ancorant-se a proteïnes VAP humanes.[13]
La proteïna NS5B (65 kDa) és la l'ARN polimerasa dependent d'ARN del virus. NS5B té la funció clau de replicar l'ARN viral usant la cadena positiva d'ARN com a motlle i catalitza la polimerització de ribonucleòsids trifosfats (rNTP) durant la replicació de l'ARN.[14][15][16] S'han determinat diverses estructures cristal·lines de la polimerasa NS5B en diverses formes cristal·lines basades en la mateixa seqüència consens BK (HCV-BK, genotip 1).[17] L'estructura pot ser representada com una forma de mà dreta amb dits, palmell, i polze. El lloc actiu central, pròpia de NS5B, és contingut dins de l'estructura del palmell de la proteïna. Recents estudis estructurals sobre la proteïna NS5B genotip 1b soca J4 (HC-J4) indiquen la presència d'un lloc actiu on seria possible el control del nucleòtids unint-s'hi i iniciant la síntesi ex novo d'ARN. la síntesi ex novo requereix encebadors per a la iniciació de al replicació de l'ARN.[18] La recerca actual intenta unir estructures a aquest lloc actiu per tal d'alterar la seva funcionalitat impedir la replicació viral de l'ARN.[19]
S'ha descrit una onzena proteïna. Aquesta proteïna és codificada per un desplaçament de marc de +1 al gen de la càpsida. Aquest pèptid de caràcter antigènic té una funció desconeguda.[20][21]
Replicació[modifica]
La replicació del VHC implica diversos passos. El virus es replica principalment als hepatòcits del fetge, on s'estima que diàriament cada cèl·lula infectada genera una cinquantena de virions (partícules virals) amb un total calculat d'un bilió de virions generats. El virus pot també replicar-se en cèl·lules mononuclears en la sang perifèrica, potencialment responsables dels nivells alts de trastorns immunològics ocorreguts en poblacions de pacients infectats crònicament pel VHC. El VHC té una àmplia varietat de genotips i muta ràpidament degut a l'elevat índex d'error en l'ARN polimerasa dependent d'ARN.[22]La taxa de mutació produeix tantes variants del virus és considerat un quasiespècies més que una espècie de virus convencional. L'entrada dins de les cèl·lules hostes succeeix per interaccions complexes entre virions i molècules de superfície de les cèl·lules entre ells CD81, receptor de LDL, SR-BI, DC-SIGN, claudin-1 i occludin.[23][24]

Un cop dins l'hepatòcit el VHC pren el control de la maquinària intracel·lular per a replicar-se.[25] El genoma del VHC és traduït per a produir una única proteïna d'uns 3.011 aminoàcids. La poliproteïna és llavors processada proteolíticament per proteases virals i cel·lulars produint tres proteïnes estructurals (associades a virions) i set de no estructurals (NS). Alternativament pot ocórrer un desplaçament del marc a la regió nuclear per a produir una proteïna de marc de lectura alternatiu (Alternate Reading Frame Protein, ARFP).[26] El VHC codifica dues proteases, l'autoproteasa NS2 cisteïna i el NS3-4A serina proteasa. Les proteïnes NS llavors s'uneixen al genoma viral genoma formant un complex de replicació de l'ARN, el qual s'associa amb membranes citoplasmàtiques. La replicació de l'ARN ocorre per l'acció de NS5B, l'ARN polimerasa viral dependent d'ARN-NS, que produeix un ARN de cadena negativa intermèdia. L'ARN de cadena negativa llavors serveix com a motlle per la producció de noves cadenes positives de genomes virals. Els genomes generats poden traduir-se, replicar-se o empaquetar-se dins de noves partícules virals. Les noves partícules virals són enviades a la via secretora i són alliberades a la superfície cel·lulars.
El virus es replica a dins de les membranes lipídiques intracel·lular.[27] El reticle endoplasmàtic en particular es deforma en unes característiques estructures de membrana anomenades xarxes membranoses. Aquestes estructures poden induir-se només per l'expressió de la proteïna vírica NS4B.[28] La proteïna nuclear s'associa amb gotetes de lípid lipid droplet i utilitza microtúbuls i dineines per traslladar-se prop del nucli.[29] L'alliberament de l'hepatòcit pot implicar la via secretora de lipoproteïnes de molt baixa densitat la lipoprotein.[30]
Genotips[modifica]
Basant-se en les diferències genètiques entre els aïllaments de VHC, les espècies del virus de l'hepatitis C es classifiquen en sis genotips (numerats de l'1 al 6) amb diversos subtipus dins de cada genotip (representat per lletres minúscules acompanyant al número del genotip).[31][32] Els subtipus es subdivideixen en quasiespècies segons la seva diversitat genètica. Els genotips difereixen entre un 30–35% de les posicions dels nucleòtids sobre el genoma complet.[33] La diferència en composició genòmica dels subtipus d'un genotip és normalment d'un 20–25%. Els subtipus 1a i 1b són els responsables del 60% de tots els casos d'hepatitis C a nivell mundials.
Importància clínica[modifica]
El genotip té importància clínica a l'hora de determinar la resposta potencial a la teràpia basada en interferó i la duració d'aquesta teràpia. Els genotips 1 i 4 són menys sensibles al tractament basat en interferó que és els altres genotips (2, 3, 5 i 6).[34] La duració d'una teràpia basada en l'interferó estàndard per als genotips 1 i 4 és 48 setmanes, mentre que el tractament per als genotips 2 i 3 és completat en unes 24 setmanes. Les respostes sostingudes ocorren en un 70% dels casos infectats per genotips 1, ~90% en els genotips 2 i 3, ~65% en els genotip 4 i ~80% en els genotips 6.[35] A més en les persones d'ascendència africana és molt menys probable eliminar la infecció quan s'infecta amb els genotips 1 o 4 [36] i una proporció substancial d'aquesta manca de la resposta al tractament ha estat associada a un polimorfisme de nucleòtid sol (SNP) sobre el cromosoma 19 que és predictiu de l'èxit del tractament.[37] Els genotips 1 i 4 del VHC s'ha distribuït endèmicament en àrees solapades de l'Àfrica Occidental i Central, infectant durant segles les poblacions humanes que tenen el polimorfisme genètic en qüestió. Això ha fet pensar als científics que la persistència prolongada dels genotips 1 i 4 del VHC en persones d'origen africà és una adaptació evolutiva durant segles a les respostes immunogenètiques d'aquestes poblacions.[38]
La infecció amb un genotip no confereix immunitat contra d'altres, i la co-infecció amb dues soques és possible. En la majoria d'aquests casos una de les soques elimina l'altra de l'hoste en poc temps. Aquesta descoberta obre la porta a reemplaçar soques no sensibles a la medicació amb altres més sensibles als tractaments disponibles.[39]
Epidemiologia[modifica]
El virus de l'hepatitis C és predominantment un virus de transmissió sanguínia, amb un risc molt baix de transmissió sexual o vertical.[40] Degut a la seva via de transmissió els grups claus en risc elevat de ser infectats es troben entre els usuaris de drogues injectades, persones receptores de transfusions sanguínies, destinataris d'hemoderivats i de vegades pacients d'hemodiàlisi. Un altre cas típic de transmissió del VHC és de tipus nosocomial, quan les pràctiques d'higiene i l'esterilització són insuficients en la pràctica clínica.[41] S'ha proposat que algunes menes de pràctiques culturals o rituals com la via de transmissió històrica abans de l'aparició d'aquestes tecnologies mèdiques, incloent la circumcisió, altres classes de mutilació genital, l'escarificació ritual, tatuatges i l'acupuntura.[40] També s'ha argumentat que degut als extremadament prolongats períodes de persistència de la infecció per VHC en els éssers humans, les picades d'artròpodes podrien ser suficients per a mantenir la infecció endèmica al tròpic, on les persones reben un gran nombre de picades d'insectes.[42]
Evolució[modifica]
Ha estat difícil identificar l'origen d'aquest virus però els genotips 1 i 4 semblen compartir un origen comú.[43] Una anàlisi bayesiana suggereix que els genotips importants van divergir fa uns tres o quatre segles del virus comú.[44] Els genotips menors van divergir aproximadament fa 200 anys d'aquests dos genotips. De tots els genotips existents semblen haver derivat del genotip 1 subtipus 1b.
Un estudi de soques del genotip 6 suggereix una divergència més antiga: ~1.100 a 1.350 anys abans del present (95% regió creïble, de 600 a >2.500 anys).[45] L'índex calculat de mutació era 1,8 × 10-4 (95% regió creïble 0,9 × 10-4 a 2,9 × 10-4). Aquest genotip pot ser l'avantpassat dels altres genotips.[45]
Un estudi basat en aïllaments europeus, estatunidencs i japonesos suggereix que la data d'origen del genotip 1b fou ~1925.[46] Les dates estimades d'origen dels tipus 2a i 3a era 1917 i 1943 respectivament. El moment de divergència dels tipus 1a i 1b s'estimà en 200–300 anys.
Un estudi dels genotips 1a i 1b va calcular les dates d'origen entre 1914–1930 (95% interval creïble: 1802–1957) per tipus 1a i 1911–1944 (95% interval creïble: 1806–1965) pel tipus 1b.[47] Ambdós tipus 1a i 1b va experimentar expansions massives en la seva mida de població efectiva entre 1940 i 1960. L'expansió del subtipus 1b va precedir la del subtipus 1a com a mínim 16 anys (95% interval creïble: 15–17 anys). Ambdós tipus semblen haver-se estès del món desenvolupat cap al món en desenvolupament.
Les soques del genotip 2 d'Àfrica poden ser dividides a quatre clades que es correlacionen amb el seu país d'origen: (1) Camerun i República Centreafricana (2) Benín, Ghana i Burkina Faso (3) Gàmbia, Guinea, Guinea Bissau i el Senegal (4) Madagascar.[48]Hi ha també forta evidència ara per la disseminació del genotip 2 del virus de l'hepatitis C des de l'Àfrica Occidental cap al Carib a través del comerç d'esclaus transatlàntic.[49]
Es creu que el genotip 3 té el seu origen al sud-est asiàtic.[50]
Aquestes dates d'aquests diversos països suggereix que aquest virus podria evolucionat al sud-est asiàtic i que s'estengué a l'Àfrica Occidental per comerciants de l'Europa Occidental.[51] Més tard fou introduït al Japó un cop desaparegut l'aïllament autoimposat d'aquell país. Un cop introduït a un país la seva difusió ha estat influïda per diversos factors locals incloent transfusions de sang, programes de vaccinació, ús de fàrmacs intravenosos i règims de tractament. Donada la reducció en l'índex d'extensió un cop implementats sistemes de deteccció de l'hepatitis C en productes sanguinis als anys 1990 sembla que la transfusió de sang en temps recents ha sigut una de les vies de transmissió principals d'aquest virus.
Vaccinació[modifica]
Tot i que es disposa de vacunes per a les hepatitis A i B, no es disposa de cap vacuna per a impedir la infecció per a l'hepatitis C.[52]
Recerca actual[modifica]
L'estudi del VHC ha estat dificultat per l'estret rang d'hostes del VHC.[53] L'ús de replicons ha estat exitós però aquests només han estat recentment descobert.[54] VHC, mentre amb la majoria de virus d'ARN, existeix com a viral quasiespècies, fent-lo molt difícil d'aïllar una sola soca o tipus de receptor per a l'estudi.[55]
La recerca actual s'enfoca en petites molècules inhibidores de la proteasa viral, ARN polimerasa i altres gens no estructurals. Dos agents — Boceprevir comercialitzat per Merck [56] i Telaprevir per Vertex Pharmaceuticals Inc—ambdós inhibidors de la proteasa NS3 foren aprovats el 13 de maig del 2011 i el 23 de maig de 2011 respectivament.
S'ha descrit una possible associació entre baixos nivells de vitamina D i una resposta pobra a tractament ha estat informada.[57][58][59][60] Treballs In vitro han mostrat que la vitamina D pot reduir la replicació vírica.[61] Tot i que aquest treball presenta un escenari prometedor [62][63] encara s'esperen els resultats d'assaigs clínics.[64][65] Tanmateix s'ha proposat que la suplement amb vitamina D és important a més del tractament estàndard, per a incrementar la resposta al tractament.[66]
Naringenin ha mostrat ser eficient a l'hora de bloquejar l'assemblatge de les partícules virals a l'interior de les cèl·lules sense afectar els nivells intracel·lulars de l'ARN o proteïnes del virus. Tot i que la recerca és relativament nova, naringenin pot oferir una nova via d'aproximació a teràpies contra el VHC.[66]
Altres agents sota investigació inclouen inhibidors de l'ARN polimerasa ARN dependent com ara anàlegs de nucleòtid o nucleòsid i no nucleòsid, inhibidors de la proteïna no estructural 5a i altres compostos com inhibidors de la ciclofilina i la silibinin.[67]
L'ús del sofosbuvir contra la infecció per hepatitis C crònica va ser aprovada per la FDA el 6 de desembre del 2013. És el primer fàrmac que ha demostrat seguretat i eficàcia a l'hora de tractar alguns tipus de virus de l'hepatitis C sense la necessitat de la co-administració d'interferó.[68] El 22 de novembre la FDA aprovà el simeprevir per a usar-se en combinació amb peginterferó alfa-2a i ribavirina.[69] Simeprevir Ha estat aprovat al Japó per al tractament de l'hepatitis C crònica, genotip 1.[70]
També hi ha recerca experimental en teràpies no basades en productes farmacèutics sintètics. Oxymatrine, per exemple, és un extracte d'arrel trobat al continent asiàtic del que hi ha certa sospita de tenir activitat antiviral contra el VHC en cultius cel·lulars i estudis en animals no humans. Alguns prometedors i petits estudis clínics en humans han mostrat pocs efectes no desitjats seriosos i resultats beneficiosos, però eren massa petits de generalitzar conclusions.[66]
Vegeu també[modifica]
Notes[modifica]
- ↑ Ferri, Clodoveo «HCV syndrome: A constellation of organ- and non-organ specific autoimmune disorders, B-cell non-Hodgkin's lymphoma, and cancer». World Journal of Hepatology, 7, 3, 2015, pàg. 327. DOI: 10.4254/wjh.v7.i3.327. ISSN: 1948-5182.
- ↑ «Mechanisms of HCV-induced liver cancer: what did we learn from in vitro and animal studies?». Cancer Lett., 345, 2014, pàg. 210-5. DOI: 10.1016/j.canlet.2013.06.028. PMC: 3844040. PMID: 23871966.
- ↑ Kapoor A, Simmonds P, Gerold G, Qaisar N, Jain K, Henriquez JA, Firth C, Hirschberg DL, Rice CM; Gerold; Qaisar; Jain; Henriquez; Firth; Hirschberg; Rice; and others «Characterization of a canine homolog of hepatitis C virus». Proc Natl Acad Sci U S A, 108, 28, 2011, pàg. 11608–13. Bibcode: 2011PNAS..10811608K. DOI: 10.1073/pnas.1101794108. PMC: 3136326. PMID: 21610165.
- ↑ «Serology-enabled discovery of genetically diverse hepaciviruses in a new host». J. Virol., 86, 11, juny 2012, pàg. 6171–8. DOI: 10.1128/JVI.00250-12. PMC: 3372197. PMID: 22491452.
- ↑ «Bats are a major natural reservoir for hepaciviruses and pegiviruses». Proc. Natl. Acad. Sci. U.S.A., 110, 20, maig 2013, pàg. 8194–9. DOI: 10.1073/pnas.1303037110. PMC: 3657805. PMID: 23610427.
- ↑ «Identification of rodent homologs of hepatitis C virus and pegiviruses». MBio, 4, 2, 2013, pàg. e00216–13. DOI: 10.1128/mBio.00216-13. PMC: 3622934. PMID: 23572554.
- ↑ Op De Beeck A, Dubuisson J; Dubuisson «Topology of hepatitis C virus envelope glycoproteins». Rev. Med. Virol., 13, 4, 2003, pàg. 233-41. DOI: 10.1002/rmv.391. PMID: 12820185.
- ↑ Kato N «Genome of human hepatitis C virus (HCV): gene organization, sequence diversity, and variation». Microb. Comp. Genomics, 5, 3, 2000, pàg. 129–51. DOI: 10.1089/mcg.2000.5.129. PMID: 11252351.
- ↑ Jubin R «Hepatitis C IRES: translating translation into a therapeutic target». Curr. Opin. Mol. Ther., 3, 3, 2001, pàg. 278–87. PMID: 11497352.
- ↑ Berry KE, Waghray S, Mortimer SA, Bai Y, Doudna JA; Waghray; Mortimer; Bai; Doudna «Crystal structure of the HCV IRES central domain reveals strategy for start-codon positioning». Structure, 19, 10, octubre 2011, pàg. 1456–66. DOI: 10.1016/j.str.2011.08.002. PMC: 3209822. PMID: 22000514.
- ↑ Dubuisson J «Hepatitis C virus proteins». World J. Gastroenterol., 13, 17, 2007, pàg. 2406–15. DOI: 10.3748/wjg.v13.i17.2406. PMC: 4146758. PMID: 17552023.
- ↑ De Francesco R «Molecular virology of the hepatitis C virus». J Hepatol, 31, Suppl 1, 1999, pàg. 47–53. DOI: 10.1016/S0168-8278(99)80374-2. PMID: 10622560.
- ↑ Gupta G, Qin H, Song J; Qin; Song «Intrinsically unstructured domain 3 of hepatitis C Virus NS5A forms a "fuzzy complex" with VAPB-MSP domain which carries ALS-causing mutations». PLoS ONE, 7, 6, 2012, pàg. e39261. DOI: 10.1371/journal.pone.0039261. PMC: 3374797. PMID: 22720086.
- ↑ ; Leveque, V; Ma, H; Johnson, K. A.; Klumpp, K «Assembly, purification, and pre-steady-state kinetic analysis of active RNA-dependent RNA polymerase elongation complex». Journal of Biological Chemistry, 287, 13, 2012, pàg. 10674–83. DOI: 10.1074/jbc.M111.325530. PMC: 3323022. PMID: 22303022.
- ↑ Moradpour D, Penin F, Rice CM; Penin; Rice «Replication of hepatitis C virus». Nat. Rev. Microbiol., 5, 6, juny 2007, pàg. 453–63. DOI: 10.1038/nrmicro1645. PMID: 17487147.
- ↑ «Ligand-induced changes in hepatitis C virus NS5B polymerase structure». Antiviral Res., 88, 2, novembre 2010, pàg. 197–206. DOI: 10.1016/j.antiviral.2010.08.014. PMID: 20813137.
- ↑ «Crystal structures of the RNA-dependent RNA polymerase genotype 2a of hepatitis C virus reveal two conformations and suggest mechanisms of inhibition by non-nucleoside inhibitors». J. Biol. Chem., 280, 18, maig 2005, pàg. 18202–10. DOI: 10.1074/jbc.M413410200. PMID: 15746101.[Enllaç no actiu]
- ↑ O'Farrell D, Trowbridge R, Rowlands D, Jäger J; Trowbridge; Rowlands; Jäger «Substrate complexes of hepatitis C virus RNA polymerase (HC-J4): structural evidence for nucleotide import and de-novo initiation». J. Mol. Biol., 326, 4, febrer 2003, pàg. 1025–35. DOI: 10.1016/s0022-2836(02)01439-0. PMID: 12589751.
- ↑ «Non-nucleoside inhibitors binding to hepatitis C virus NS5B polymerase reveal a novel mechanism of inhibition». J. Mol. Biol., 361, 1, agost 2006, pàg. 33–45. DOI: 10.1016/j.jmb.2006.05.074. PMID: 16828488.
- ↑ Walewski JL, Keller TR, Stump DD, Branch AD; Keller; Stump; Branch «Evidence for a new hepatitis C virus antigen encoded in an overlapping reading frame». RNA, 7, 5, 2001, pàg. 710–721. DOI: 10.1017/S1355838201010111. PMC: 1370123. PMID: 11350035.
- ↑ «Expression and characterization of Escherichia coli derived hepatitis C virus ARFP/F protein». Mol Biol (Mosk), 46, 2, 2012, pàg. 251–9. DOI: 10.1134/S0026893312020033. PMID: 22670521.
- ↑ Bartenschlager R, Lohmann V; Lohmann «Replication of hepatitis C virus». J. Gen. Virol., 81, Pt 7, juliol 2000, pàg. 1631–48. Arxivat de l'original el 2009-12-03. PMID: 10859368 [Consulta: 10 desembre 2016].
- ↑ Zeisel, M.; Barth, H.; Schuster, C.; Baumert, T. «Hepatitis C virus entry: molecular mechanisms and targets for antiviral therapy». Frontiers in Bioscience, 14, 8, 2009, pàg. 3274–3285. Bibcode: 2009CNSNS..14.3274H. DOI: 10.1016/j.cnsns.2008.11.006. PMC: 3235086. PMID: 19273272.
- ↑ Kohaar, I.; Ploss, A.; Korol, E.; Mu, K.; Schoggins, J.; O'Brien, T.; Rice, C.; Prokunina-Olsson, L. «Splicing diversity of the human OCLN gene and its biological significance for hepatitis C virus entry». Journal of Virology, 84, 14, 2010, pàg. 6987–6994. DOI: 10.1128/JVI.00196-10. PMC: 2898237. PMID: 20463075.
- ↑ Lindenbach B, Rice C; Rice «Unravelling hepatitis C virus replication from genome to function». Nature, 436, 7053, 2005, pàg. 933–8. Bibcode: 2005Natur.436..933L. DOI: 10.1038/nature04077. PMID: 16107832.
- ↑ Branch, A. D.; Stump, D. D.; Gutierrez, J. A.; Eng, F.; Walewski, J. L. «The Hepatitis C Virus Alternate Reading Frame (ARF) and Its Family of Novel Products: The Alternate Reading Frame Protein/F-Protein, the Double-Frameshift Protein, and Others». Seminars in Liver Disease, 25, 1, 2005, pàg. 105–117. DOI: 10.1055/s-2005-864786. PMID: 15732002.
- ↑ Dubuisson J, Penin F, Moradpour D; Penin; Moradpour «Interaction of hepatitis C virus proteins with host cell membranes and lipids». Trends Cell Biol, 12, 11, 2002, pàg. 517–523. DOI: 10.1016/S0962-8924(02)02383-8. PMID: 12446113.
- ↑ Egger D, Wölk B, Gosert R, Bianchi L, Blum HE, Moradpour D, Bienz K; Wölk; Gosert; Bianchi; Blum; Moradpour; Bienz «Expression of hepatitis C virus proteins induces distinct membrane alterations including a candidate viral replication complex». J Virol, 76, 12, 2002, pàg. 5974–84. DOI: 10.1128/JVI.76.12.5974-5984.2002. PMC: 136238. PMID: 12021330.
- ↑ Boulant S, Douglas MW, Moody L, Budkowska A, Targett-Adams P, McLauchlan J; Douglas; Moody; Budkowska; Targett-Adams; McLauchlan «Hepatitis C virus core protein induces lipid droplet redistribution in a microtubule- and dynein-dependent manner». Traffic, 9, 8, 2008, pàg. 1268–82. DOI: 10.1111/j.1600-0854.2008.00767.x. PMID: 18489704.
- ↑ Syed GH, Amako Y, Siddiqui A; Amako; Siddiqui «Hepatitis C virus hijacks host lipid metabolism». Trends Endocrinol Metab, 21, 1, 2010, pàg. 33–40. DOI: 10.1016/j.tem.2009.07.005. PMC: 2818172. PMID: 19854061.
- ↑ «Classification of hepatitis C virus into six major genotypes and a series of subtypes by phylogenetic analysis of the NS-5 region». J. Gen. Virol., 74, Pt 11, novembre 1993, pàg. 2391–9. DOI: 10.1099/0022-1317-74-11-2391. PMID: 8245854.[Enllaç no actiu]
- ↑ Nakano, Tatsunori; Lau, Gillian M. G.; Lau, Grace M. L.; Sugiyama, Masaya; Mizokami, Masashi «An updated analysis of hepatitis C virus genotypes and subtypes based on the complete coding region». Liver International, 32, 2, 09-10-2011, pàg. 339–45. DOI: 10.1111/j.1478-3231.2011.02684.x. PMID: 22142261.
- ↑ «New hepatitis C virus (HCV) genotyping system that allows for identification of HCV genotypes 1a, 1b, 2a, 2b, 3a, 3b, 4, 5a, and 6a». J Clin Microbiol, 35, 1, 2007, pàg. 201–7. PMC: 229539. PMID: 8968908.
- ↑ Simmonds P, Bukh J, Combet C, Deléage G, Enomoto N, Feinstone S, Halfon P, Inchauspé G, Kuiken C, Maertens G, Mizokami M, Murphy D, Okamoto H, Pawlotsky J, Penin F, Sablon E, Shin-I T, Stuyver L, Thiel H, Viazov S, Weiner A, Widell A; Bukh; Combet; Deléage; Enomoto; Feinstone; Halfon; Inchauspé; Kuiken «Consensus proposals for a unified system of nomenclature of hepatitis C virus genotypes». Hepatology, 42, 4, 2005, pàg. 962–73. DOI: 10.1002/hep.20819. PMID: 16149085.
- ↑ Yu ML, Chuang WL; Chuang «Treatment of chronic hepatitis C in Asia: when East meets West». J Gastroenterol Hepatol, 24, 3, 2009, pàg. 336–345. DOI: 10.1111/j.1440-1746.2009.05789.x. PMID: 19335784.
- ↑ Muir, AJ; Bornstein, JD; Killenberg, PG; Atlantic Coast Hepatitis Treatment Group «Peginterferon alfa-2b and ribavirin for the treatment of chronic hepatitis C in blacks and non-Hispanic whites.». N Engl J Med, 350, 2004, pàg. 2265–71. DOI: 10.1056/NEJMoa032502. PMID: 15163776. Erratum: doi:10.1056/nejm200409163511229
- ↑ Ge, D; Fellay, J; Thompson, AJ; Simon, SJ; Shianna, KV; Urban, TJ; Heinzen, EL; et, al. «Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance». Nature, 461, 7262, 2009, pàg. 399–401. DOI: 10.1038/nature08309. PMID: 19684573.
- ↑ Rose, R; Markov, PV; Lam, TT; Pybus, OG «Viral evolution explains the associations among hepatitis C virus genotype, clinical outcomes, and human genetic variation». Infect Genet Evol, 20, 2013, pàg. 418–21. DOI: 10.1016/j.meegid.2013.09.029. PMID: 24140473.
- ↑ Laskus T, Wang LF, Radkowski M, Vargas H, Nowicki M, Wilkinson J, Rakela J.; Wang; Radkowski; Vargas; Nowicki; Wilkinson; Rakela «Exposure of hepatitis C virus (HCV) RNA-positive recipients to HCV RNA-positive blood donors results in rapid predominance of a single donor strain and exclusion and/or suppression of the recipient strain». Journal of Virology, 75, 5, 2001, pàg. 2059–66. DOI: 10.1128/JVI.75.5.2059-2066.2001. PMC: 114790. PMID: 11160710.
- ↑ 40,0 40,1 Shepard, CW; Finelli, L; Alter, MJ «Global epidemiology of hepatitis C virus infection.». Lancet Infect Dis, 5, 9, Sep 2005, pàg. 558–67. DOI: 10.1016/S1473-3099(05)70216-4. PMID: 16122679.
- ↑ Alter, MJ «HCV routes of transmission: what goes around comes around». Semin Liver Dis, 31, 4, Nov 2011, pàg. 340–6. DOI: 10.1055/s-0031-1297923. PMID: 22189974.
- ↑ Pybus, OG; Markov, PV; Wu, A; Tatem, AJ «Investigating the endemic transmission of the hepatitis C virus». Int J Parasitol, 37, 8–9, Jul 2007, pàg. 839–49. DOI: 10.1016/j.ijpara.2007.04.009. PMID: 17521655.
- ↑ Salemi M, Vandamme AM; Vandamme «Hepatitis C virus evolutionary patterns studied through analysis of full-genome sequences». J Mol Evol, 54, 1, 2002, pàg. 62–70. DOI: 10.1007/s00239-001-0018-9. PMID: 11734899.
- ↑ Sarwar MT, Kausar H, Ijaz B; Ijaz; Ahmad; Ansar; Sumrin; Ashfaq; Asad; Gull; and others «Viral Hepat. 1997;4 Suppl 1:69–74. Investigation of the pattern of diversity of hepatitis C virus in relation to times of transmission. Simmonds P, Smith DB.//317 NS4A protein as a marker of HCV history suggests that different HCV genotypes originally evolved from genotype 1b». Virol. J., 8, 2011, pàg. 317. DOI: 10.1186/1743-422X-8-317. PMC: 3145594. PMID: 21696641.
- ↑ 45,0 45,1 «Genetic history of hepatitis C virus in East Asia». J Virol, 83, 2, 2009, pàg. 1071–82. DOI: 10.1128/JVI.01501-08. PMC: 2612398. PMID: 18971279.
- ↑ Simmonds P, Smith DB; Smith «Investigation of the pattern of diversity of hepatitis C virus in relation to times of transmission». J Viral Hepat, 4, Suppl 1, 1997, pàg. 69–74. DOI: 10.1111/j.1365-2893.1997.tb00163.x. PMID: 9097281.
- ↑ «The global spread of hepatitis C virus 1a and 1b: a phylodynamic and phylogeographic analysis». PLoS Med., 6, 12, desembre 2009, pàg. e1000198. DOI: 10.1371/journal.pmed.1000198. PMC: 2795363. PMID: 20041120.
- ↑ Markov PV, Pepin J, Frost E, Deslandes S, Labbé AC, Pybus OG; Pepin; Frost; Deslandes; Labbé; Pybus «Phylogeography and molecular epidemiology of hepatitis C virus genotype 2 in Africa». J. Gen. Virol., 90, Pt 9, setembre 2009, pàg. 2086–96. Arxivat de l'original el 2014-03-10. DOI: 10.1099/vir.0.011569-0. PMID: 19474244 [Consulta: 10 desembre 2016]. Arxivat 2014-03-10 at Archive.is
- ↑ Markov, PV; van de Laar, TJ; Thomas, XV; Aronson, SJ; Weegink, CJ; van den Berk, GE; Prins, M. «Colonial History and Contemporary Transmission Shape the Genetic Diversity of Hepatitis C Virus Genotype 2 in Amsterdam». J Virol, 86, 14, 2012, pàg. 7677–7687. DOI: 10.1128/JVI.06910-11. PMID: 22573865.
- ↑ Simmonds P «Genetic diversity and evolution of hepatitis C virus—15 years on». J. Gen. Virol., 85, Pt 11, novembre 2004, pàg. 3173–88. Arxivat de l'original el 2014-03-10. DOI: 10.1099/vir.0.80401-0. PMID: 15483230 [Consulta: 10 desembre 2016]. Arxivat 2014-03-10 at Archive.is
- ↑ Simmonds P «Reconstructing the origins of human hepatitis viruses». Philos Trans R Soc Lond B Biol Sci, 356, 1411, 2001, pàg. 1013–26. DOI: 10.1098/rstb.2001.0890. PMC: 1088496. PMID: 11516379.
- ↑ Yu CI, Chiang BL; Chiang «A new insight into hepatitis C vaccine development». J. Biomed. Biotechnol., 2010, 2010, pàg. 548280. DOI: 10.1155/2010/548280. PMC: 2896694. PMID: 20625493.
- ↑ Rauch, A.; Gaudieri, S.; Thio, C.; Bochud, P. Y. «Host genetic determinants of spontaneous hepatitis C clearance». Pharmacogenomics, 10, 11, 2009, pàg. 1819–1837. DOI: 10.2217/pgs.09.121. PMID: 19891557.
- ↑ Meier V, Ramadori G; Ramadori «Hepatitis C virus virology and new treatment targets». Expert Rev Anti Infect Ther, 7, 3, abril 2009, pàg. 329–50. DOI: 10.1586/eri.09.12. PMID: 19344246 [Consulta: 16 abril 2009].
- ↑ Manns MP, Foster GR, Rockstroh JK, Zeuzem S, Zoulim F, Houghton M; Foster; Rockstroh; Zeuzem; Zoulim; Houghton «The way forward in HCV treatment—finding the right path». Nat Rev Drug Discov, 6, 12, desembre 2007, pàg. 991–1000. DOI: 10.1038/nrd2411. PMID: 18049473.
- ↑ «FDA approves Victrelis for Hepatitis C» (press release). FDA, 13-05-2011.
- ↑ Gutierrez JA, Parikh N, Branch AD; Parikh; Branch «Classical and emerging roles of vitamin d in hepatitis C virus infection». Semin Liver Dis, 31, 4, 2011, pàg. 387–398. DOI: 10.1055/s-0031-1297927. PMC: 4107414. PMID: 22189978.
- ↑ «Vitamin D deficiency and a CYP27B1-1260 promoter polymorphism are associated with chronic hepatitis C and poor response to interferon-alfa based therapy». J Hepatol, 54, 5, 2011, pàg. 887–893. DOI: 10.1016/j.jhep.2010.08.036. PMID: 21145801.
- ↑ «The vitamin D receptor gene bAt (CCA) haplotype impairs the response to pegylated-interferon/ribavirin-based therapy in chronic hepatitis C patients». Antivir. Ther. (Lond.), 17, 3, 2012, pàg. 541–7. DOI: 10.3851/IMP2018. PMID: 22300961.
- ↑ «Complementary role of vitamin D deficiency and the interleukin-28B rs12979860 C/T polymorphism in predicting antiviral response in chronic hepatitis C». Hepatology, 53, 4, 2011, pàg. 1118–26. DOI: 10.1002/hep.24201. PMID: 21480318.
- ↑ Gal-Tanamy M, Bachmetov L, Ravid A, Koren R, Erman A, Tur-Kaspa R, Zemel R; Bachmetov; Ravid; Koren; Erman; Tur-Kaspa; Zemel «Vitamin D: an innate antiviral agent suppressing hepatitis C virus in human hepatocytes». Hepatology, 54, 5, 2011, pàg. 1570–9. DOI: 10.1002/hep.24575. PMID: 21793032.
- ↑ Abu-Mouch S, Fireman Z, Jarchovsky J, Zeina AR, Assy N; Fireman; Jarchovsky; Zeina; Assy «Vitamin D supplementation improves sustained virologic response in chronic hepatitis C (genotype 1)-naïve patients». World J Gastroenterol, 17, 47, 2011, pàg. 5184–90. DOI: 10.3748/wjg.v17.i47.5184. PMC: 3243885. PMID: 22215943.
- ↑ «Vitamin D supplementation improves response to antiviral treatment for recurrent hepatitis C». Transpl Int, 24, 1, 2011, pàg. 43–50. DOI: 10.1111/j.1432-2277.2010.01141.x. PMID: 20649944.
- ↑ Cholongitas E, Theocharidou E, Goulis J, Tsochatzis E, Akriviadis E, Burroughs K; Theocharidou; Goulis; Tsochatzis; Akriviadis; Burroughs «Review article: the extra-skeletal effects of vitamin D in chronic hepatitis C infection». Aliment. Pharmacol. Ther., 35, 6, març 2012, pàg. 634–46. DOI: 10.1111/j.1365-2036.2012.05000.x. PMID: 22316435.
- ↑ «Diagnostic and therapeutical role of vitamin D in chronic hepatitis C virus infection». Front Biosci (Elite Ed), 1, 4, 2012, pàg. 1276–1286.
- ↑ 66,0 66,1 66,2 Halegoua-De Marzio, Dina; Fenkel, Jonathan «Alternative medications in Hepatitis C infection». World Journal of Hepatology, 6, 1, 27-01-2014, pàg. 9–16. DOI: 10.4254/wjh.v6.i1.9. PMC: 3953807. PMID: 24653790.
- ↑ Sarrazin C, Hézode C, Zeuzem S, Pawlotsky JM; Hézode; Zeuzem; Pawlotsky «Antiviral strategies in hepatitis C virus infection». J. Hepatol., 56, Suppl 1, 2012, pàg. S88–100. DOI: 10.1016/S0168-8278(12)60010-5. PMID: 22300469.
- ↑ Press announcement, FDA, December 6 2013
- ↑ «FDA approves new treatment for hepatitis C virus». Food and Drug Administration, Nov 22, 2013.
- ↑ «Medivir: Simeprevir has been approved in Japan for the treatment of genotype 1 chronic hepatitis C infection». The Wall Street Journal, 27-09-2013.
Enllaços externs[modifica]
- «Hepatitis C virus». NCBI Taxonomy Browser.
- http://www.hivandhepatitis.com/hep_c/hepc_news_genotype.html Arxivat 2020-10-11 a Wayback Machine.
- http://hcv.lanl.gov/
- http://www.viprbrc.org/brc/home.do?decorator=flavi Arxivat 2019-09-19 a Wayback Machine.
