Estafilococ daurat
| Staphylococcus aureus | |
|---|---|
 | |
| Dades | |
| Malaltia | Infecció estafilocòccica |
| Tinció de Gram | Positiu |
| Taxonomia | |
| Regne | Bacillati |
| Fílum | Bacillota |
| Classe | Bacilli |
| Ordre | Caryophanales |
| Família | Staphylococcaceae |
| Gènere | Staphylococcus |
| Espècie | Staphylococcus aureus Rosenbach, 1884 |
L'estafilococ daurat (Staphylococcus aureus) és un bacteri grampositiu aerobi i anaerobi facultatiu en forma de coc individual d'unes dimensions de 0,5 - 1,5 µm de diàmetre, que es divideix en més d'un pla donant lloc a una estructura en forma de raïm (d'aquí la seva arrel “Staphylo”, raïm en grec antic i modern) i genera unes colònies de color groc.[1] Creix mitjançant processos com la fermentació làctica o la respiració aeròbica.[1] La majoria d'espècies tenen un requisit de nutrients complex, però generalment necessiten una font orgànica de nitrogen que poden trobar en diversos aminoàcids essencials, com són l'arginina, valina i en la vitamina B, incloent-hi la tiamina i la nicotinamida.[2] No forma espores i no presenta mobilitat, però pot formar càpsula com a mecanisme de defensa.[1] És capaç de créixer tolerant altes concentracions de clorur de sodi (fins a un 10%) i a temperatures d'entre 18 °C i 40 °C.[1] Dona negatiu en el test de l'oxidasa i positiu en el test de la catalasa i de la coagulasa.[1] En aquest últim només S. aureus i S. intermedius són positius dintre del gènere Staphylococcus.[1] Actualment es coneixen 53 espècies i 28 subespècies dins del gènere d'Staphylococcus, la majoria dels quals prefereixen colonitzar el cos humà.[3] Les més caracteritzades i estudiades són S. aureus i S. epidermidis.
Aproximadament un 30% de la població global es troba colonitzada per aquest bacteri.[4] Pot causar una gran varietat d'infeccions en determinades circumstàncies. Pot ser causa d'infeccions menors de la pell (furóncols i pústules) i abscessos cutanis, o malalties més greus com pneumònia, meningitis, osteomielitis, endocarditis, síndrome de xoc tòxic (SST) i sèpsies.[5] És un patogen important en les infeccions i malalties nosocomials, i és perillós a causa de la resistència que presenta a diversos antibiòtics, com la meticil·lina, β-lactàmics, penicil·lina, tetraciclina, etc.[5] El seu reservori és l'ésser humà i altres mamífers, on es troba com a sapròfit de la pell i de la mucosa.[6] i té una dosi infectiva mínima (DIM) de 100.000 unitats.[6] Es transmet mitjançant la ingesta del propi microorganisme en aliments, per contacte directe entre individus i per la contaminació de ferides.[5]
Epidemiologia[modifica]
Staphylococcus aureus es caracteritza per ser comensal i un patogen oportunista.[1] La microbiota nasal humana n'és un reservori natural; el 2018 el bacteri es trobava en fins a un 30 per cent de la població global.[4] Les colonitzacions asimptomàtiques són més freqüents que les infeccions, però en persones immunodeprimides o que es trobin en condicions desfavorables pot resultar perillós, i per això hi ha un augment en el risc d'infecció en pacients hospitalitzats, sobretot en aquells que passen per una operació quirúrgica.[4] Per aquest motiu aquestes infeccions són més freqüents en hospitals. La manera d'eliminar la colonització d'aquest microorganisme és mitjançant l'administració d'antibiòtics, desinfectants, o fins i tot soques atenuades de la mateixa espècie.[7]
La penicil·lina va ser el primer antibiòtic emprat contra infeccions causades per S. aureus, tot i que durant la dècada de 1940 van començar a aparèixer soques de S. aureus resistents a la penicil·lina.[8] Durant finals de la dècada de 1960 un 80 per cent de les soques aïllades, tant a l'àmbit hospitalari com a l'exterior, presentaven aquesta resistència.[8]
Com aquest antibiòtic començava a ser ineficaç, es van buscar altres antibiòtics i es va descobrir la meticil·lina, un altre β-lactàmic del grup de les penicil·lines.[9] Es va introduir a l'àmbit clínic el 1961, però poc temps després ja es van identificar soques que n'eren resistents (MRSA, de l'anglès methicillin-resistant Staphylococcus aureus), que portaven el casset gènic mecA (SCCmecA).[9] Durant les següents dècades van aparèixer molts casos d'infeccions provocades per soques resistents a la meticil·lina, totes en hospitals.[9] En dades recollides en National Nosocomial Infections Surveillance (NNIS) pels Centres per al Control i Prevenció de Malalties dels Estats Units (CDC, de l'anglès Centers for Disease Control and Prevention) durant els primers anys de la dècada de 1980 les soques MRSA estaven restringides en grans centres hospitalaris amb unes taxes del 5 al 10 per cent.[10] En hospitals petits les taxes eren inferiors al 5 per cent.[10] Durant la dècada de 1990 aquestes taxes van pujar a un 20 per cent en hospitals petits i fins a un 40 per cent en centres hospitalaris grans. Aquestes dades van anar pujant i el 1998 eren ja del 50 per cent.[9]
Les persones més susceptibles a aquestes infeccions que no fossin pacients eren treballadors de l'àmbit hospitalari o contactes propers dels pacients.[11] Més endavant, l'any 1999, a Chicago van morir quatre nens a causa d'una infecció per soques MRSA.[11][12] L'estudi d'aquests casos va revelar que es tractava de soques susceptibles a diversos antibiòtics però no a β-lactàmics, i es va determinar que les soques estaven relacionades entre elles, però que diferien de les típiques soques aïllades en infeccions nosocomials.[11][12] Això demostrava que aquestes infeccions ja no eren només un problema a escala intrahospitalària, sinó que també començava a generar problemes en persones que no estaven relacionades amb els hospitals.[11][12]
Patogènia[modifica]
Staphylococcus aureus és un patogen oportunista capaç de colonitzar l'ésser humà, sent la principal causa d'una àmplia gamma d'infeccions clíniques greus com la sèpsia i l'endocarditis.[13][14][15] Produeix una alta diversitat de factors de virulència com ara toxines, enzims, adhesines i altres proteïnes superficials que li permeten sobreviure en condicions extremes i són essencials per a la capacitat del bacteri de propagar-se pels diferents teixits i òrgans, com ara la pell, el tracte gastrointestinal, el cor i els ossos.[13][14][15]
El seu procés d'infecció comença amb la colonització de les cèl·lules del teixit hoste, on utilitza una sèrie de factors associats a la paret cel·lular que li permeten unir-se a proteïnes de la matriu extracel·lular, fibrina i plaquetes.[16][17] Després d'aquesta adhesió es produeix la interiorització del bacteri dins de les cèl·lules on S.aureus podrà créixer i activar la seva producció de toxines, controlada en gran manera pels sistemes de detecció de quòrum.[16][17] Aquestes toxines produeixen la destrucció de les cèl·lules hoste i permeten l'entrada del patogen a estructures de teixits profunds, a més de proporcionar una defensa contra el sistema immunitari.[16][17] Un cop finalitzada aquesta fase aguda i destructiva, S.aureus disminueix i regula la producció de toxines, fet que li permetrà l'evasió del sistema immunitari i la supervivència i persistència dins de l'hoste.[16][17]
| Determinant de patogenicitat | Propietats |
|---|---|
Components de la paret cel·lular
|
|
Enzims
|
|
Toxines
|
|
Components de la paret cel·lular[modifica]
La paret cel·lular està constituïda de peptidoglicans, les cadenes laterals dels quals estan unides mitjançant ponts pentapeptídics de pentaglicina i àcids teïcoics. [20]
Peptidoglicà[modifica]
Proporciona estabilitat osmòtica, desencadena la inflamació per activació del complement, és capaç d'atraure leucòcits polimorfonuclears (PMN), estimula la producció d'anticossos opsonitzats i té activitat similar a les endotoxines de gramnegatius.[20]
Àcids teïcoics[modifica]
Constitueixen el voltant del 40% del pes de la paret. Aquests àcids són polímers de ribitol fosfat i estan units de forma covalent al peptidglicà. Són components importants per l'adherència a la fibronectina; estimulen la producció de pirogen endogen.[20]
Càpsula[modifica]
La presència de la càpsula és variable, però és rellevant a escala patogènica, ja que té propietats antifagocítiques. Les soques que tenen càpsula són més virulentes en models animals.[20] Es coneix que l'adherència del patogen a les vàlvules cardíaques i cossos estranys està regulada, en part, pels receptors de fibronectina en la seva superfície. Les soques que tenen grans quantitats de receptors per aquesta glicoproteïna, solen ser més invasius i més hàbils per adherir-se. A més, impedeix la quimiotaxi i la proliferació de cèl·lules mononuclears.[20]
Proteïna A[modifica]
Té l'habilitat d'unir-se a la porció Fc de les molècules d'Immunoglobulina G (IgG) i, per tant, funciona com un factor de virulència, ja que interfereix en l'opsonització i la ingestió dels microorganismes per les PMN, activant el complement i donant lloc a reaccions d'hipersensibilitat immediata. Aquesta proteïna és immunògena i es troben anticossos contra ella en pacients amb infeccions greus de S.aureus.
[20]
| Enzims | |
|---|---|
| Coagulasa | Actua cobrint la cèl·lula de fibrina provocant un augment de la resistència a l'opsonització i fagocitosi |
| Estafiloquinasa | Degrada la fibrina i contribueix a la invasió dels teixits veïns |
| Hialuronidasa | Hidrolitza la matriu intracel·lular de mucopolisacàrids dels teixits i contribueix a la disseminació dels teixits adjacents |
| Lipasa | Ajuden al microorganisme a disseminar-se pels teixits cutanis i subcutanis |
A més a més, totes les soques de S.aureus produeixen una sèrie d'enzims, com DNAses, proteases i fosfatases, que col·laboren en el procés infecciós i en la producció de lesions.[19]
Toxines[modifica]
Una de les característiques importants de S.aureus és la capacitat de secretar toxines que danyen les membranes de les cèl·lules de l'hoste, ja que formen porus que provoquen l'alliberació del contingut i la mort cel·lular.[21] Per tant, no totes les soques són patògenes, només aquelles que siguin capaces de produir toxines, com per exemple les enterotoxines (secretades a la zona intestinal), que donen lloc a una infecció alimentària.[21]
| Toxines | |
|---|---|
| α hemolisina | Es troba codificada pel gen hla. Té efecte letal sobre una varietat de membranes cel·lulars eucariotes, incloent-hi les PMN d'humans, així com els eritròcits de diferents espècies humanes. És dermonecròtica si s'injecta de forma subcutània i és letal per animals si s'administra de forma intravenosa. És responsable de la zona d'hemòlisi observada al voltant de les colònies de S.aureus, ja que forma un porus, el qual és el responsable de la lisi cel·lular. |
| β hemolisina | És una esfingomielinasa activa sobre diferents cèl·lules: Leucòcits, eritròcits, fibroblasts... |
| δ hemolisina | Es troba en algunes soques i lisen una varietat de cèl·lules diferents. |
| Leucocidina | És una exotoxina amb efecte tòxic directe sobre les membranes de PMN humans, causant desgranulació del citoplasma, inflament cel·lular i lisi. El mode d'acció d'aquesta toxina és similar al de l'enterotoxina CytK de Bacillus cereus: comprèn la formació de porus que alteren la permeabilitat cel·lular pel potassi i altres cations. Una injecció d'aquesta toxina en models animals produeix una disminució del nombre de leucòcits. |
| Exfoliatina | Són produïdes per algunes soques i consisteixen en dues proteïnes, bioquímica i immunològicament diferents, però amb funcions biològiques similars. L'exfoliatina A és un producte de gens cromosòmics, termoestable i és inactivada pel EDTA; mentre l'exfoliatina B és d'origen plasmídic, és inactivada per calor i estable enfront l'EDTA. Ambdues tenen activitat proteolítica, actuen com a superantígens, i dissolen la matriu mucopolisacàrida de l'epidermis, resultant en la separació intraepitelial de les unions en l'estrat granulós. |
| Enterotoxines | Es tracta de molècules termoestables secretades, per part del microorganisme, a la zona intestinal responsables de la intoxicació alimentària produïda per algunes soques. El mode d'acció d'aquestes toxines no és gaire conegut, però se sap que augmenta el peristaltisme. A més, algunes enterotoxines són capaces de produir alteracions en la zona intestinal. Per tant, després d'identificar la presencia de Staphylococcus aureus, s'ha d'anar a identificar, mitjançant altres tècniques d'identificació aquelles soques productores de toxines.[21][23]
Si es consumeixen aliments on trobem soques de S.aureus no productores de toxines, no ocasionaran patogenicitat en el cas de la seva ingesta. |
| Toxina del xoc tòxic (TSST) | També denominada com a enterotoxina F. Està implicada en la patogènia de la síndrome del xoc tòxic. Tot i que el seu rol és poc clar, té una gran quantitat d'activitats biològiques.
Les últimes tres toxines esmentades actuen com a superantígens, el que significa que poden activar limfòcits T directament (alta afinitat pel complex major d'histocompatibilitat tipus II), sense la mediació de cèl·lules presentadores d'antigen, resultant en l'alliberament de citocines. Això pot desembocar en importants efectes sistèmics com febre, hipotensió, lesions a la pell, xoc, fallada multiorgànica, i la mort.[24][25] |
Malalties[modifica]
Tot i que S. aureus sol actuar com a bacteri comensal, colonitzant asimptomàticament un 30% de la població, de vegades pot actuar com a patogen, causant processos infecciosos que van des d'infeccions cutànies fins a malalties sistèmiques mortals.[2][26][1]
Infeccions de la pell[modifica]

Staphylococcus aureus és la causa gairebé universal dels furóncols i abscessos de la pell i a escala mundial, és l'agent que més freqüentment es relaciona amb infeccions cutànies i de teixits tous. Les infeccions de la pell i teixit tou de S. aureus comencen sovint amb ferides o abscessos menors i poden progressar a infeccions severes que impliquen els músculs o els ossos i poden acabar difonent-se als pulmons o a les vàlvules cardíaques.[27]
Infeccions en teixits superficials[modifica]
Les infeccions causades per aquest bacteri són molt freqüents i solen tenir aspecte de grans o furóncols; a més, acostumen a ser d'un color vermellós, sovint acompanyat de pus i supuracions.
Un exemple seria l'impetigen, una infecció cutània localitzada i caracteritzada per la presència de pústules sobre la base eritematosa que acaba donant lloc a crostes. Destaca també l'ectima, una afecció cutània similar a l'impetigen una mica més profund i d'evolució més lenta. D'altra banda, la fol·liculitis és una inflamació aguda de la zona més superficial del fol·licle pilós i de les glàndules apocrines.[28]
Infeccions en teixits profunds[modifica]
Com a afeccions cutànies més greus destaca la furunculosi; aquesta es tracta d'un procés inflamatori més profund que la fol·liculitis, en el qual es pot veure afectat el greix subcutani i la glàndula sebàcia associada. Normalment, només ocorre en un sol fol·licle, tot i que de vegades en trobem varis compromesos.
L'endocarditis és la principal complicació de les bacterièmies i pot arribar a causar danys en el teixit del cor, o afectacions a les vàlvules cardíaques. Destaca també l'osteomielitis, una infecció que resulta en una inflamació, destrucció i necrosi òssia que afecta majoritàriament a la metàfisi dels ossos llargs dels nens i la columna vertebral d'adults.[2]
Malalties nosocomials[modifica]
Actualment S. aureus és considerat un dels principals agents causants d'infeccions nosocomials i sol atacar a les persones més vulnerables, entre les quals es troben aquelles que presenten sistemes immunitaris debilitats.[29] Aquest tipus d'infecció també es pot veure afavorida pel fet que aquesta espècie habita tant en les mucoses com en la pell dels humans, permetent que a través de ferides quirúrgiques o cremades pugui penetrar al torrent sanguini del pacient per contacte directe o indirecte amb el personal sanitari, amb un objecte contaminat o inclús amb un altre pacient.[29]
Endocarditis[modifica]
L'endocarditis és la invasió de l'endocardi. Un dels causant més importants i agressius en la endocarditis infecciosa es S. aureus. En els darrers anys s'ha incrementat l'ús de dispositius en clínica com marcapassos i vàlvules i amb aquests també ha augmentat la incidència de casos d'endocarditis estafilocòccia. L'endocarditis estafilocòccia té una alta mortalitat.[30]
Pneumònia[modifica]
És causada per soques de S.aureus resistents a la meticil·lina (MRSA) i tot i que solia ser una malaltia poc freqüent, actualment la seva incidència està en augment i té una important morbiditat i mortalitat.[31][32]
Síndrome de xoc tòxic[modifica]
Staphylococcus aureus pot expressar dos tipus diferents de toxines amb activitat superantigènica. Les enterotoxines, de les quals trobem sis serotips (A, B, C, D, E i G) i la toxina de la síndrome de xoc tòxic (TSST-1).[1] Les primeres causen diarrea i vòmits quan s'ingereixen i són responsables de la intoxicació alimentària estafilocòccia. Quan s'expressen sistèmicament, les enterotoxines poden causar la síndrome del xoc tòxic (TSS), de fet, les enterotoxines B i C causen un 50% de les síndromes no menstruals. La TSST-1 està relacionada amb les enterotoxines i no té activitat emètica. És responsable del 75% de les TSS. La síndrome del xoc tòxic pot produir-se com una seqüela de qualsevol infecció estafilocòccia si es produeix una enterotoxina o TSST-1 que s'allibera sistemàticament i l'hoste manca d'anticossos neutralitzants adients.[1] La síndrome del xoc tòxic es caracteritza per provocar febre, erupcions eritematoses, baixa tensió arterial i pelat de pell, entre altres.
Alimentació[modifica]
Pel que fa a la microbiologia dels aliments, trobem microorganismes que són perjudicials i d'altres que són beneficiosos.[23] Dintre dels microorganismes perjudicials podem classificar-los en aquells que són ianolèptics i els patògens.[23] En cas dels microorganismes patògens trobem els que són productors de toxines i els que no. Aquestes poden ser preformades i no preformades (toxogènics).[21]
Staphylococcus aureus pot contaminar una gran varietat d'aliments, multiplicar-s'hi i produir enterotoxines que, en última instància, podran causar malaltia en el consumidor.[33]
Intoxicació alimentària[modifica]
Al voltant del 25% de persones i animals presenten Staphylococcus aureus a la pell i al nas. En general, no causa malaltia en persones sanes, però pot contaminar aliments i sintetitzar toxines que poden arribar a causar intoxicacions alimentàries.[21] En el cas de les intoxicacions alimentàries per S.aureus, no només és de gran importància saber si hi ha presència o no del patogen en l'aliment, sinó que també és important saber la quantitat d'aquest per a poder concloure la gravetat de la higiene deficient en la manipulació de l'aliment.[21]
Els bacteris poden ser eliminats quan es cuina l'aliment, però les seves toxines no són destruïdes i seran els principals agents causants de malalties.[21][34] Els símptomes solen desenvolupar-se en un termini d'entre 30 minuts i 8 hores després de menjar o beure algun aliment que conté la toxina, i no dura més d'un dia. Rarament provoca malalties greus.[34]
Una intoxicació alimentària greu produïda per aquest bacteri es va donar l'any 1975 a bord d'un Boeing 747 operat per la companyia Japan Airlines. En aquest vol un total de 197 persones van patir una toxiinfecció alimentària a causa de la ingestió d'una truita que contenia pernil contaminat amb Staphylococcus aureus. El pernil va ser contaminat per un dels xefs encarregats de l'elaboració de les truites en qüestió el qual presentava ferides als dits de la mà dreta infectades per aquest patogen.
Aliments sovint implicats en la intoxicació[modifica]
Els aliments que més sovint causen una intoxicació varien en cada país. Acostumen a ser aliments que requereixen un alt grau de manipulació durant la seva elaboració i que no són consumits de manera immediata.[35] Entre aquests aliments es troben els productes carnis, amanides, entrepans farcits, llet i productes làctics, productes de brioixeria farcits, productes precuinats de peix etc.[35]
Control i mesures de prevenció[modifica]
Durant la cadena de producció, transport i distribució de l'aliment o del producte és imprescindible aplicar unes bones tècniques a més d'unes bones mesures higièniques. Si es detecta la presència de S.aureus en l'aliment, indica que aquest no ha estat manipulat de forma correcta; és a dir, que es tracta d'un microorganisme indicador, que ens manifesta una mala praxi durant el procés de manipulació dels aliments.[21][36]
S'ha de garantir l'ordre i la neteja del lloc de manipulació i treball a més de la desinfecció de l'equip, utensilis i establiment on es donen a terme aquestes pràctiques.[21]
El personal implicat en la praxi de l'aliment ha de tenir una bona higiene: rentat de mans, higiene corporal, evitar el contacte de la cara i/o mucoses amb les mans o els guants, cobriment de ferides i ús de roba adequada i indicada per la manipulació d'aliments.[37]
Normativa UNE[modifica]
ISO 6888-1:2022: Microbiologia de la cadena alimentària. Mètode horitzontal de recompte d'estafilococs coagulasa positius (Staphylococcus aureus i altres). Part 1. S'utilitza el medi d'agar Baird-Parker.[38]
ISO 6888-2:2022: Microbiologia de la cadena alimentària. Mètode horitzontal de recompte d'estafilococs coagulasa positius (Staphylococcus aureus i altres). Part 2. S'utilitza un medi d'agar amb plasma de conill amb fibrinogen.[39]
Ambdues normes s'apliquen a productes per al consum humà, alimentació animal, mostres ambientals d'àrees de producció i manipulació d'aliments i pinsos i també les mostres que procedeixen de les primeres etapes de la producció primària.[38][39]
Aquestes dues normatives no es consideren totalment adequades per l'anàlisi de productes fermentats amb contingut en un flora basada en Staphylococcus spp. com formatges elaborats amb llet crua o alguns productes carnis.[38] [39]Aquests podrien estar contaminats d'estafilococs formadors de colònies atípiques en medi Baird-Parker o amb flora basal que podria emmascarar les colònies que es volen identificar.[38][39]
Límits legals[modifica]
Les empreses de la indústria alimentària han de complir els criteris microbiològics que estan establerts en vers a les enterotoxines estafilocòccies en productes que siguin de major risc com llet i formatges de llet crua seguint el reglament (CE) 2073/2003 amb les posteriors modificacions i versions consolidades.[40]A més d'aquests criteris també hi ha altres reglaments relatives a l'higiene dels productes i altres recomanacions.[40]
Els límits establerts permesos en formatge a base de llet crua es de 10.000-100.000 ufc/g. Aquest criteri s'estableix en el moment del procés de fabricació quan s'estima que hi haurà el màxim nº d'estafilococs.[40] Si aquests valors resulten ser superiors al llindar de 100.000 ufc/g s'hauran de sotmetre a proves per detecció d'enterotoxines estafilocòccies a més de l'aplicació de millores en la higiene del procés i la selecció de matèria primera.[40]
En formatges de llet sotmesa a un tractament tèrmic inferior a la pasteurització o formatges curats de llet pasteuritzada límit microbiològic és de 100-1000 ufc/g d'aliment.[40]
En formatges frescs (no madurats) fets amb llet pasteuritzada el límit microbiològic permès és de 10-100 ufc/g d'aliment.[40]
Diagnòstic, identificació i quantificació[modifica]
En infeccions cutànies cal una avaluació mèdica, mentre que pels altres tipus d'infecció cal fer un cultiu de sang o del líquid infectat (LCR…).[23]
Les infeccions estafilocòccies cutànies se solen diagnosticar pel seu aspecte. Les altres infeccions requereixen fer un cultiu[41] i veure el creixement de bacteris. Les analítiques determinen un diagnòstic i quins antibiòtics es poden fer servir per eliminar el bacteri (test de sensibilitat/resistència).[41]
Per la identificació de S. aureus i poder fer el diagnòstic, se solen fer servir 3 mètodes: microscòpia, cultius i proves bioquímiques. Per tots 3 cal un pas previ d'obtenció de la mostra.[23]
Obtenció de la mostra[modifica]
Mostra clínica[modifica]
Les mostres clíniques es poden obtenir de diverses formes, les més aconsellades són mitjançant un exsudat nasal, un exsudat de la pell de la zona perineal, secrecions respiratòries en pacient amb ventilació mecànica, urocultius amb pacients que tinguin una sonda vesical i cultiu d'exsudat d'úlceres o ferides.[42]
La triple mostra d'exsudat nasal conjuntament amb faríngic i perirectal és la que té major sensibilitat.[42]
Mostra d'aliment / ambient industrial[modifica]
En cas de la indústria alimentària l'obtenció de la mostra dependrà del que es vulgui analitzar: en cas que es vulgui analitzar una mostra d'aliment, mitjançant instruments estèrils es pren una mostra significativa de l'aliment a analitzar. Si aquestes són sòlides s'heterogeïnitzen i s'enriqueixen amb medi de cultiu dins d'una bossa estèril mitjançant un Stomacher.[43]
Per l'estudi microbiològic de microorganismes en maquinària industrial que pugui estar en contacte amb el producte: mitjançant un hisop estèril es frega la superfície de maquinàries, cargols, i peces de màquines; es tracta d'un escombrat que ens serveix tant per mirar presència o absència, però també per fer recompte.[44] També es poden utilitzar plaques de contacte RODAC amb medi Baird Parker.[45] Per superfícies com superfícies de treball, parets, rajoles etc. (mostra d'ambient) s'utilitza també un hisop estèril o també es pot posar directament en contacte amb una placa RODAC amb Medi Baird Parker.[45][44] Altres alternatives per agilitzar el procés i tenir els resultats de forma més ràpida és amb altres tècniques com els laminocultius, la cinta adhesiva estèril i els Histops Patch-Check, que detecten tant presència com absència.[46][36]
Cal dir també que el control de neteja de superfícies també es pot fer de forma indirecta, gràcies a la detecció d'ATP i a la detecció de proteïnes.
Tècniques[modifica]
Cultius i quantificació[modifica]
Primer se sol fer un diagnòstic provisional, basant-se en els símptomes dels pacients i l'historial clínic. Per donar el diagnòstic definitiu de la infecció per S. aureus, però, és necessari obtenir aïllat en un cultiu pur del microorganisme de l'àrea afectada.[23]

Per a poder quantificar aquest microorganisme i després fer el recompte, es realitza un banc de dilucions amb aigua de peptona, que porta tots els nutrients necessaris per al creixement de S.aureus, i sense sals per tal que el recompte no es vegi afectat.[21][36] A partir de les dilucions, es sembraran aquelles que es cregui convenient en plaques de petri amb un medi com el Baird-Parker; i aquestes plaques s'incuben durant 24-48 hores a 37 °C.[38] El medi de cultiu ha de proporcionar una font de carboni i nitrogen, així com d'energia.[21] A més, en molts casos s'afegeix ou al medi de cultiu, que aporta proteïnes i greixos els quals S.aureus es capaç de degradar, tant les proteïnes com les lipases de l'ou; això serveix principalment per diferenciar S.aureus d'altres Staphylococcus.[23][36]
El medi Baird-Parker es un medi selectiu que presenta els components bàsics, selenite, tel·lurit, i clorur de liti, que s'encarrega d'inhibir la flora gramnegativa i altres cocs grampositius; i per tant únicament creixen cocs grampositius sensibles al tel·lurit i d'altres bacils grampositius.[38][36] Després de la incubació es poden observar colònies negres que representen cocs grampositius, i molt probablement són Staphylococcus; i també es pot observar que algunes de les colònies negres presenten dos halos, un opac i l'altre transparent.[21][38][36] Aquelles que siguen negres i estiguin envoltades pels dos halos, molt probablement corresponguin a Staphylococcus aureus.[21][38] [36] Per tant, únicament ens seran d'interès aquesta última morfologia de colònia explicada, que serà a partir de la qual es farà l'estudi. Per a la confirmació de que es tracta de S.aureus, s'agafa una colònia negra amb els dos halos i es sembra en un medi de cultiu usual, com el TSA.[21][36] També a partir de les colònies obtingudes del medi Baird-Parker, es pot fer una altra prova de confirmació que es tracta de sembrar en un altre medi de cultiu com és l'LB.[21][23]
També s'utilitza el Mannitol-salt agar, amb un 7-9% de NaCl; actuant com a medi selectiu i diferencial.[21][36] És selectiu degut a que presenta sals i S.aureus presenta una elevada resistència a aquestes, per tant, presentarà un creixement ideal. I és un medi diferencial perquè conté sucres, com el mannitol, el qual es degradat per S.aureus, però la resta de microorganismes no són capaços.[21][36] Incubació a 37 °C. S'observen colònies típicament de color groguenc degut a la degradació de sucres; hi ha un indicador de pH que amb la degradació de metabòlits canvia de color. Per a la confirmació de S.aureus, s'agafa una colònia groga i es sembra en un altre medi, en aquest cas LB.[21]A partir d'aquestes es poden realitzar totes les altres tècniques per confirmar el diagnòstic.
Si el metge sospita una osteomielitis, es poden dur a terme les següents tècniques: Tomografia computada, ressonància magnètica nuclear i altres que serveixen per mostrar la localització del dany i determinar la seva gravetat.[23]
Proves bioquímiques i metabòliques[modifica]
S'empren en conjunt les proves bioquímiques (coagulasa, catalasa) i les altres per tal de determinar si S. aureus és causant de la infecció i què suposa aquesta infecció. Per determinar si es tracta de S. aureus es fan servir diverses proves diferencials per distingir-lo d'altres microorganismes tals com Micrococcus, Macrococcus, Streptococcus, i altres Staphylococcus.[23][36]
Pel que fa a les proves metabòliques i bioquímiques són una bona alternativa d'identificació de microorganismes. Pel que fa a S.aureus, aquestes proves, gràcies al metabolisme del microorganisme, ens permeten diferenciar-los i també determinar el gènere i l'espècie.[23]
Són oxidasa negativa i positius en els tests de la catalasa i la coagulasa.[23][36]
Proves moleculars[modifica]
Unes de les proves moleculars que es poden realitzar per a confirmar la presència i la identificació de Staphylococcus aureus són la Real Time PCR i la Quantitative PCR.[23][36]
Identificació de toxines[modifica]
Importants sobretot en intoxicacions alimentàries. S. aureus produeix diverses toxines així com enterotoxines A-D, les quals es poden identificar mitjançant tests d'aglutinació.[36] A més, se sap que a major concentració de S.aureus en una mostra, més probabilitat hi ha de trobar soques que siguin productores d'enterotoxines; per tant, si hi ha una concentració de S.aureus alta, el més probable és que hi hagi toxines, amb un 99% de probabilitat.[21][36]
Una altra opció per a veure si hi ha soques productores d'enterotoxines consisteix en agafar colònies positives en el medi mannitol-salt agar i sembrar-les en un altre medi de cultiu molt ric, com és el BHI, que s'utilitza per tal d'augmentar la concentració de S.aureus. Incubació a 37 °C durant 24 hores.[21][36]
Pel que fa a proves bioquímiques, per a trobar les enterotoxines es fa una ELISA, que es una tècnica basada en la reacció antigen-anticòs. Primer de tot, el que es fa és agafar una possible colònia de S.aureus de la placa de medi BHI (ja que és on creixen les soques productores d'enterotoxines) i es passa a un tub, el qual serà centrifugat per a separar les toxines dels bacteris.[21][23] En el sobrenedant és on es trobaran les enterotoxines ja que són preformades i termosensibles; i aquest es passarà per un filtre. I per a finalitzar, es realitza l'ELISA.[21]
Sensibilitats a antibiòtics[modifica]
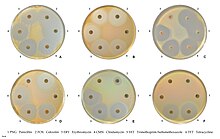
Detecció de MRSA (S. aureus resistent a la meticil·lina) vs. MSSA (S.aureus sensibles a meticil·lina).[47] S'utilitzen antibiogrames i altres tècniques.
Al llarg de la història clínica de S. aureus ha sigut capaç de desenvolupar resistència als antibiòtics, destacant la meticil·lina.[9] Per això s'usa el terme MRSA per referir-se a aquelles soques resistents a la meticil·lina i altres antibiòtics com clindamicina o daptomicina.[41] Aquesta infecció sol ser nosocomial encara que també es pot adquirir fora dels centres sanitaris.[1] Els més utilitzats són amb agar cromogènic, normalment els que estan suplementats amb oxacil·lina que actua com a agent selectiu impedint el creixement de les soques no MRSA.[48][49] Aquests medis requereixen un control de qualitat rigorós.[48][49]
Tractament[modifica]
Els primers tractaments contra les malalties infeccioses causades per S.aureus es basaven en l'ús de la penicil·lina, després de ser descoberta per Alexander Fleming i permetia un bon control d'aquestes infeccions fins que als anys 50, on degut a l'ús generalitzat d'aquest antibiòtic van aparèixer soques resistents.[50] La causa d'aquesta resistència era la capacitat de S.aureus de produir penicil·linasa que hidrolitza l'anell β-lactàmic de la penicil·lina.[50] Més tard, els científics van desenvolupar una nova penicil·lina semisintètica resistent a la penicil·linasa anomenada meticil·lina, que també va ser capaç de controlar eficaçment les infeccions de S.aureus.[50]
Al 1960 però, es va descobrir la primera soca de S.aureus amb resistència a la meticil·lina (MRSA) proporcionada pel gen mecA, i que actualment suposa una preocupació sanitària a nivell mundial, ja que és la causa de taxes de mortalitat elevades i d'un augment de la durada de l'estada a l'hospital i dels costos d'atenció sanitària.[51][52][53]
La creixent taxa d'aquesta resistència a la meticil·lina per part de S. aureus durant els anys 90 va provocar l'increment d'estudis d'altres antibiòtics i, gràcies a això, van sorgir multitud de nous antibiòtics eficaços contra els MRSA que s'han comercialitzat durant els últims anys.[54] Els més representatius són: betalactàmics, clindamicina, cotrimoxazole, daptomicina, vancomicina i fosfomicina.[54]
Betalactàmics[modifica]
Són antibiòtics d'acció lenta que constitueixen la família més nombrosa dins els antimicrobians i són la més utilitzada en casos clínics.[55][56] El seu mecanisme d'acció consisteix en la inhibició de l'última etapa de la síntesi de la paret cel·lular, provocant la mort del microorganisme.[55][56] L'activitat dels betalactàmics és menor front fenotips sèssils (biopel·lícules) i colònies reduïdes.[55][56] La majoria de soques de S. aureus produeixen betalactamases que inactiven la penicil·lina i s'han identificat 4 subtipus de betalactamases designades A, B, C i D. La progressiva aparició de resistències limita el seu ús i eficàcia.[55][56] La resistència a la meticil·lina ja s'ha creuat amb la majoria de betalactàmics que s'han usat per controlar les poblacions de S. aureus. A concentracions subinhibitòries (més baixes que la CMI) poden induir la síntesi de diverses toxines bacterianes.[55][56]
Clindamicina[modifica]
La clindamicina s'uneix a la subunitat 50 S del ribosoma bacterià interferint en la síntesi de proteïnes i té un efecte bacteriostàtic similar al cloramfenicol i l'eritromicina.[57] S'empra molt per tractar les infeccions òssies (osteomielitis) causades per S. aureus, és eficaç front l'acne i s'inclou com a possible alternativa terapèutica enfront de les infeccions a la pell i parts toves de gravetat lleu o moderada, produïdes sobretot SARM.[57] Com a efecte secundari pot produir desordres gastrointestinals.[57]
Cotrimoxazole[modifica]
Està format per una combinació de dos antibiòtics amb efecte sinèrgic bactericida: trimetoprim/sulfametoxazole. Bloqueja l'enzim responsable de la síntesi de tetrahidrofolat.[58] Els bacteris no són capaços d'extreure-la del medi, depenen completament de la seva síntesi, això acaba generant un dèficit metabòlic a la cèl·lula impedint la reproducció i facilitant la mort.[58]
No provoca efectes secundaris importants. Presenta un espectre antimicrobià molt ampli, incloent-hi MRSA.[58]
Vancomicina[modifica]
La vancomicina és un antibiòtic de la família dels glicopèptids, que actua inhibint la síntesi de paret cel·lular en bacteris grampositius i que s'administra per via intravenosa.[59] S'empra en infeccions d'S. aureus MRSA, i inclou una gran varietat d'efectes secundaris, en els que destaquen la nefrotoxicitat, hipotensió i reaccions d'hipensensibilitat.[59]
Daptomicina[modifica]
La daptomicina és un lipopèptid natural, efectiu únicament contra bacteris grampositius.[60] El seu mecanisme d'acció cursa amb la unió a la membrana bacteriana de les cèl·lules, tant en fase de creixement com estacionaria i causa una despolarització, una inhibició de la síntesi d'algunes proteïnes, ADN i ARN i, conseqüentment, la mort.[60] S'acostuma a utilitzar en infeccions complicades de la pell, en pacients normalment pediàtrics i en bacterièmies. La resistència a daptomicina s'ha observat després de diverses setmanes de tractament, sobretot en pacients que han patit alguna altra infecció recent.[60] Aquesta resistència es deu a l'existència de diferents mutacions d'un sol nucleòtid produïdes successivament en diferents gens. (mprF, yycG, rpoB i rpoC).[60]
Fosfomicina[modifica]
La fosfomicina inhibeix l'enzim fosfoenolpiruvat sintetasa,[61] que intervé en la fase inicial de síntesi del peptidoglicà, deixant la paret del bacteri incompleta. S'utilitza sobretot en infeccions urinàries. És un medicament tolerat i té baixa incidència de reaccions adverses.[61][62] La resistència a fosfomicina pot ser causada per mutacions cromosòmiques que afecten l'activitat dels sistemes de transport cap a l'interior del bacteri o a l'adquisició de certs plasmidis.[62]
Referències[modifica]
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 Foster, Timothy. «Chapter 12 Staphylococcus». A: Medical Microbiology (en anglès). 4th. Galveston (TX): University of Texas Medical Branch at Galveston, 1996. ISBN 0963117211.
- ↑ 2,0 2,1 2,2 Tong, Steven Y. C.; Davis, Joshua S.; Eichenberger, Emily; Holland, Thomas L.; Fowler, Vance G. «Staphylococcus aureus Infections: Epidemiology, Pathophysiology, Clinical Manifestations, and Management» (en anglès). Clinical Microbiology Reviews, 28, 3, 2015-7, pàg. 603–661. DOI: 10.1128/CMR.00134-14. ISSN: 0893-8512. PMC: PMC4451395. PMID: 26016486.
- ↑ «[https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/887570/UK_SMI_ID_07i4.pdf Identification of Staphylococcus species, Micrococcus species and Rothia species]» (en anglès). UK Standards for Microbiology Investigations, 26-05-2020. [Consulta: 17 novembre 2022].
- ↑ 4,0 4,1 4,2 Sakr, Adèle; Brégeon, Fabienne; Mège, Jean-Louis; Rolain, Jean-Marc; Blin, Olivier «Staphylococcus aureus Nasal Colonization: An Update on Mechanisms, Epidemiology, Risk Factors, and Subsequent Infections» (en anglès). Frontiers in Microbiology, 9, 2018. DOI: 10.3389/fmicb.2018.02419. ISSN: 1664-302X. PMC: PMC6186810. PMID: 30349525.
- ↑ 5,0 5,1 5,2 Taylor, Tracey A.; Unakal, Chandrashekhar G. Staphylococcus Aureus (en anglès). Treasure Island (FL): StatPearls Publishing, 2018.
- ↑ 6,0 6,1 «STAPHYLOCOCCUS AUREUS» (en anglès). University of Texas Arlington. [Consulta: 17 novembre 2022].
- ↑ Pasachova Garzón, Jennifer; Ramirez Martinez, Sara; Muñoz Molina, L «Staphylococcus aureus» (en castellà). Nova, 17, 32, 15-11-2019, pàg. 25–38. DOI: 10.22490/24629448.3631. ISSN: 2462-9448.
- ↑ 8,0 8,1 Chambers, Henry F.; DeLeo, Frank R. «Waves of resistance: Staphylococcus aureus in the antibiotic era» (en anglès). Nature Reviews Microbiology, 7, 9, 2009-09, pàg. 629–641. DOI: 10.1038/nrmicro2200. ISSN: 1740-1526. PMC: PMC2871281. PMID: 19680247.
- ↑ 9,0 9,1 9,2 9,3 9,4 Enright, Mark C.; Robinson, D. Ashley; Randle, Gaynor; Feil, Edward J.; Grundmann, Hajo «The evolutionary history of methicillin-resistant Staphylococcus aureus (MRSA)» (en anglès). Proceedings of the National Academy of Sciences, 99, 11, 28-05-2002, pàg. 7687–7692. DOI: 10.1073/pnas.122108599. ISSN: 0027-8424. PMC: PMC124322. PMID: 12032344.
- ↑ 10,0 10,1 «Nosocomial Infection Surveillance, 1984» (en anglès), 01-12-1986. [Consulta: 31 octubre 2022].
- ↑ 11,0 11,1 11,2 11,3 Chambers, H. F. «The Changing Epidemiology of Staphylococcus aureus? - Volume 7, Number 2—April 2001 - Emerging Infectious Diseases journal - CDC» (en anglès). Emerging Infectious Diseases journal. DOI: 10.3201/eid0702.700178.
- ↑ 12,0 12,1 12,2 Paul- Satyaseela, Maneesh; Hariharan, Periasamy; Gnanamani, Arumugam «Staphylococcus aureus: Overview of Bacteriology, Clinical Diseases, Epidemiology, Antibiotic Resistance and Therapeutic Approach» (en anglès). Frontiers in Staphylococcus aureus, 08-03-2017. DOI: 10.5772/67338.
- ↑ 13,0 13,1 Kwiecinski, Jakub M; Horswill, Alexander R «Staphylococcus aureus bloodstream infections: pathogenesis and regulatory mechanisms» (en anglès). Current opinion in microbiology, 53, 2020-2, pàg. 51–60. DOI: 10.1016/j.mib.2020.02.005. ISSN: 1369-5274. PMC: 7244392. PMID: 32172183.
- ↑ 14,0 14,1 Balasubramanian, Divya; Harper, Lamia; Shopsin, Bo; Torres, Victor J. «Staphylococcus aureus pathogenesis in diverse host environments» (en anglès). Pathogens and Disease, 75, 1, 01-01-2017. DOI: 10.1093/femspd/ftx005. ISSN: 2049-632X. PMC: 5353994. PMID: 28104617.
- ↑ 15,0 15,1 Kong, Cin; Neoh, Hui-min; Nathan, Sheila «Targeting Staphylococcus aureus Toxins: A Potential form of Anti-Virulence Therapy» (en anglès). Toxins, 8, 3, 15-03-2016, pàg. E72. DOI: 10.3390/toxins8030072. ISSN: 2072-6651. PMC: 4810217. PMID: 26999200.
- ↑ 16,0 16,1 16,2 16,3 Löffler, Bettina; Tuchscherr, Lorena «Staphylococcus aureus Toxins: Promoter or Handicap during Infection?» (en anglès). Toxins, 13, 4, 19-04-2021, pàg. 287. DOI: 10.3390/toxins13040287. ISSN: 2072-6651. PMC: 8072895. PMID: 33921743.
- ↑ 17,0 17,1 17,2 17,3 Tong, Steven Y. C.; Davis, Joshua S.; Eichenberger, Emily; Holland, Thomas L.; Fowler, Vance G. «Staphylococcus aureus Infections: Epidemiology, Pathophysiology, Clinical Manifestations, and Management» (en anglès). Clinical Microbiology Reviews, 28, 3, 2015-7, pàg. 603–661. DOI: 10.1128/CMR.00134-14. ISSN: 0893-8512. PMC: 4451395. PMID: 26016486.
- ↑ Otto, Michael «Staphylococcus aureus toxins» (en anglès). Current Opinion in Microbiology, 17, 2014-02, pàg. 32–37. DOI: 10.1016/j.mib.2013.11.004. PMC: PMC3942668. PMID: 24581690.
- ↑ 19,0 19,1 19,2 19,3 Tam, Kayan; Torres, Victor J. «Staphylococcus aureus Secreted Toxins and Extracellular Enzymes» (en anglès). Microbiology Spectrum, 7, 2, 12-04-2019. DOI: 10.1128/microbiolspec.GPP3-0039-2018. ISSN: 2165-0497. PMC: PMC6422052. PMID: 30873936.
- ↑ 20,0 20,1 20,2 20,3 20,4 20,5 Sutton, Joshua A. F.; Carnell, Oliver T.; Lafage, Lucia; Gray, Joe; Biboy, Jacob «Staphylococcus aureus cell wall structure and dynamics during host-pathogen interaction» (en anglès). PLOS Pathogens, 17, 3, 31-03-2021. DOI: 10.1371/journal.ppat.1009468. ISSN: 1553-7374. PMC: PMC8041196. PMID: 33788901.
- ↑ 21,00 21,01 21,02 21,03 21,04 21,05 21,06 21,07 21,08 21,09 21,10 21,11 21,12 21,13 21,14 21,15 21,16 21,17 21,18 21,19 21,20 21,21 Guia per a la prevenció i el control de les toxiinfeccions alimentàrie (en català). 2a. edició, juliol de 2006. ISBN 84-393-7091-1.
- ↑ Otto, Michael «Staphylococcus aureus toxins» (en anglès). Current Opinion in Microbiology, 17, 2 2014, pàg. 32–37. DOI: 10.1016/j.mib.2013.11.004. PMC: PMC3942668. PMID: 24581690.
- ↑ 23,00 23,01 23,02 23,03 23,04 23,05 23,06 23,07 23,08 23,09 23,10 23,11 23,12 23,13 Murray, Patrick R.; Rosenthal, Ken S.; Pfaller, Michael A. Medical microbiology (en anglès). 8th edition. Philadelphia, PA: Elsevier, 2016. ISBN 978-0-323-29956-5.
- ↑ Castañón-Sánchez, Carlos Alberto «Patogenia molecular de Staphylococcus aureus» (en castellà). Evidencia Médica e Investigación en Salud, 5, 3, 9 2012, pàg. 79-84.
- ↑ Pasachova Garzón, Jennifer; Ramirez Martinez, Sara; Muñoz Molina, L «Staphylococcus aureus: generalidades, mecanismos de patogenicidad y colonización celular» (en castellà). Nova, 17, 32, 15-11-2019, pàg. 25–38. DOI: 10.22490/24629448.3631. ISSN: 2462-9448.
- ↑ Tong, Steven Y. C.; Davis, Joshua S.; Eichenberger, Emily; Holland, Thomas L.; Fowler, Vance G. «Staphylococcus aureus Infections: Epidemiology, Pathophysiology, Clinical Manifestations, and Management» (en anglès). Clinical Microbiology Reviews, 28, 3, 2015-07, pàg. 603–661. DOI: 10.1128/CMR.00134-14. ISSN: 0893-8512. PMC: PMC4451395. PMID: 26016486.
- ↑ McCaig, Linda F.; McDonald, L. Clifford; Mandal, Sanjay; Jernigan, Daniel B. «Staphylococcus aureus–associated Skin and Soft Tissue Infections in Ambulatory Care». Emerging Infectious Diseases, 12, 11, 2006-11, pàg. 1715–1723. DOI: 10.3201/eid1211.060190. ISSN: 1080-6040. PMC: PMC3372331. PMID: 17283622.
- ↑ «Síntomas y causas - Mayo Clinic» (en castellà). [Consulta: 3 desembre 2018].
- ↑ 29,0 29,1 «Infecciones por estafilococos - Síntomas y causas - Mayo Clinic» (en castellà). Mayo Clinic, 19-07-2022. [Consulta: 7 desembre 2018].
- ↑ Esteban, Marcos Rodríguez; Febles, Jesús Ode; Montero, Sara Isabel Miranda; López, María Ramos; Villalba, Marcos Farrais «Evolución de la resistencia antimicrobiana y mortalidad en la endocarditis por Staphylococcus aureus durante 15 años en un hospital universitario». Revista Española de Quimioterapia, 34, 2, 2021, pàg. 100–106. DOI: 10.37201/req/103.2020. ISSN: 0214-3429. PMC: 8019456. PMID: 33491408.
- ↑ Koulenti, Despoina; Myrianthefs, Pavlos; Dimopoulos, George; Baltopoulos, George «Neumonía nosocomial causada por Staphylococcus aureus resistente a meticilina» (en castellà). Enfermedades Infecciosas y Microbiología Clínica, 23, 01-12-2005, pàg. 37–45. DOI: 10.1157/13091219. ISSN: 0213-005X.
- ↑ Ensinck, Gabriela; Lazarte, Gustavo; Ernst, Adriana; Romagnoli, Antonela; López Papucci, Santiago; Alicia Aletti, Ana Chiossone, Fernanda Pigozzi, Yanina Sguassero «Community-acquired methicillin-resistant Staphylococcus aureus pneumonia in a children’s hospital. Our ten-year experience» (en anglès). Archivos Argentinos de Pediatria, 119, 1, 01-02-2021. DOI: 10.5546/aap.2021.eng.11.
- ↑ Argudín, María Ángeles; Mendoza, María Carmen; Rodicio, María Rosario «Food Poisoning and Staphylococcus aureus Enterotoxins» (en anglès). Toxins, 2, 7, 05-07-2010, pàg. 1751–1773. DOI: 10.3390/toxins2071751. ISSN: 2072-6651. PMC: PMC3153270. PMID: 22069659.
- ↑ 34,0 34,1 CDC. «Staphylococcal Food Poisoning» (en anglès). Centers for Disease Control and Prevention, 09-08-2018. [Consulta: 9 desembre 2018].
- ↑ 35,0 35,1 «Staphylococcus aureus». Gencat, 25-10-2022. [Consulta: 27 octubre 2022].
- ↑ 36,00 36,01 36,02 36,03 36,04 36,05 36,06 36,07 36,08 36,09 36,10 36,11 36,12 36,13 36,14 36,15 Pascual Anderson, María del Rosario. Microbiología alimentaria : metodología analítica para alimentos y bebidas (en castellà). 2 da. ed. Madrid: Ediciones Díaz de Santos, 2000. ISBN 84-7978-424-5.
- ↑ «Staphylococcus aureus» (en castellà). Instituto Nacional de Seguridad y Salud en el Trabajo, 25-05-2021. [Consulta: 25 octubre 2022].
- ↑ 38,0 38,1 38,2 38,3 38,4 38,5 38,6 38,7 «UNE-EN ISO 6888-1:2022» (en castellà). Asociación Española de Normalización, 18-05-2022. [Consulta: 27 octubre 2022].
- ↑ 39,0 39,1 39,2 39,3 «UNE-EN ISO 6888-2:2022» (en castellà). Asociación Española de Normalización, 05-2022. [Consulta: 27 octubre 2022].
- ↑ 40,0 40,1 40,2 40,3 40,4 40,5 «Staphylococcus aureus» (en espanyol europeu). [Consulta: 15 novembre 2022].
- ↑ 41,0 41,1 41,2 L. Kolendi, Charles. Methicillin-resistant Staphylococcus aureus (MRSA) : etiology, at-risk populations and treatment (en anglès). Nova York: Nova Science Publishers, 2010. ISBN 9781614702436. OCLC 1162210830.
- ↑ 42,0 42,1 Baños Álvarez, Elena; Llanos Méndez, Aurora «[https://www.aetsa.org/download/publicaciones/antiguas/AETSA_2011_2_5_MRSA.pdf Identificación rápida de Staphylococcus aureus meticilina resistente]» (en castellà). Identificación rápida de Staphylococcus aureus meticilina resistente.. Agencia de Evaluación de Tecnologías Sanitarias de Andalucía [Sevilla], 2012.
- ↑ Red Nacional de Laboratorios Oficiales de Alimento (ReNaLOA) «Còpia arxivada». Análisis microbiológico de los alimentos, Metodología analítica oficial, Microorganismos patógenos [Argentina], 1, 12-2011. Arxivat de l'original el 2023-03-08 [Consulta: 17 novembre 2022].
- ↑ 44,0 44,1 «Elección del hisopo correcto para muestrear una superficie» (en castellà). Microplanet, 13-04-2018. [Consulta: 17 novembre 2022].
- ↑ 45,0 45,1 «Placas RODAC en higiene de superfícies» (en castellà). I.C.T S.L, 2012. [Consulta: 17 novembre 2022].
- ↑ «Food & Environment ¦¦ Applications ¦¦ Oxford Biosystems» (en anglès). [Consulta: 17 novembre 2022].
- ↑ Pierce, Marcia M. (en anglès) Methicillin-resistant Staphylococcus aureus (MRSA), maig 2020. DOI: 10.1036/1097-8542.421540.
- ↑ 48,0 48,1 Peterson, Jess F.; Riebe, Katherine M.; Hall, Gerri S.; Wilson, Deborah; Whittier, Susan «Spectra MRSA, a New Chromogenic Agar Medium To Screen for Methicillin-Resistant Staphylococcus aureus» (en anglès). Journal of Clinical Microbiology, 48, 1, 2010-01, pàg. 215–219. DOI: 10.1128/JCM.01555-09. ISSN: 0095-1137. PMC: PMC2812258. PMID: 19889898.
- ↑ 49,0 49,1 Perry, John D.; Davies, Amie; Butterworth, Lynne A.; Hopley, Andrew L. J.; Nicholson, Audrey «Development and Evaluation of a Chromogenic Agar Medium for Methicillin-Resistant Staphylococcus aureus» (en anglès). Journal of Clinical Microbiology, 42, 10, 2004-10, pàg. 4519–4523. DOI: 10.1128/JCM.42.10.4519-4523.2004. ISSN: 0095-1137. PMC: PMC522333. PMID: 15472303.
- ↑ 50,0 50,1 50,2 Guo, Yunlei; Song, Guanghui; Sun, Meiling; Wang, Juan; Wang, Yi «Prevalence and Therapies of Antibiotic-Resistance in Staphylococcus aureus» (en anglès). Frontiers in Cellular and Infection Microbiology, 10, 17-03-2020, pàg. 107. DOI: 10.3389/fcimb.2020.00107. ISSN: 2235-2988. PMC: PMC7089872. PMID: 32257966.
- ↑ Lakhundi, Sahreena; Zhang, Kunyan «Methicillin-Resistant Staphylococcus aureus: Molecular Characterization, Evolution, and Epidemiology» (en anglès). Clinical Microbiology Reviews, 31, 4, 12-09-2018, pàg. e00020–18. DOI: 10.1128/CMR.00020-18. ISSN: 0893-8512. PMC: 6148192. PMID: 30209034.
- ↑ Aguayo-Reyes, Alejandro; Quezada-Aguiluz, Mario; Mella, Sergio; Riedel, Gisela; Opazo-Capurro, Andrés «[Molecular basis of methicillin-resistance in Staphylococcus aureus]» (en anglès). Revista Chilena De Infectologia: Organo Oficial De La Sociedad Chilena De Infectologia, 35, 1, 2018, pàg. 7–14. DOI: 10.4067/s0716-10182018000100007. ISSN: 0717-6341. PMID: 29652966.
- ↑ «Methicillin resistant Staphylococcus aureus: A brief review of virulence and resistance» (en anglès). JPMA - Journal Of Pakistan Medical Association, març 2022. DOI: 10.47391/JPMA.0504. [Consulta: 17 novembre 2022].
- ↑ 54,0 54,1 Pahissa Berga, Alberto. Infecciones producidas por Staphylococcus aureus (en castellà). Barcelona: Marge Medica Books, 2009. ISBN 9788492442768. OCLC 992065403.
- ↑ 55,0 55,1 55,2 55,3 55,4 Pandey, Neelanjana; Cascella, Marco. Beta Lactam Antibiotics (en anglès). Treasure Island (FL): StatPearls Publishing, 2022.
- ↑ 56,0 56,1 56,2 56,3 56,4 Kong, Kok-Fai; Schneper, Lisa; Mathee, Kalai «Beta-lactam antibiotics: from antibiosis to resistance and bacteriology: BETA-LACTAM RESISTANCE» (en anglès). APMIS, 118, 1, 2010-01, pàg. 1–36. DOI: 10.1111/j.1600-0463.2009.02563.x. PMC: PMC2894812. PMID: 20041868.
- ↑ 57,0 57,1 57,2 «Clindamicina» (en castellà). The American Society of Health-System Pharmacists, 15-05-2018. [Consulta: 14 novembre 2022].
- ↑ 58,0 58,1 58,2 «Cotrimoxazol» (en castellà). Comité de Medicamentos de la Asociación Española de Pediatría, 2015. [Consulta: 14 novembre 2022].
- ↑ 59,0 59,1 Patel, Shivali; Preuss, Charles V.; Bernice, Fidelia. Vancomycin (en anglès). Treasure Island (FL): StatPearls Publishing, 2022.
- ↑ 60,0 60,1 60,2 60,3 «Daptomicina» (en castellà). Comité de Medicamentos de la Asociación Española de Pediatría., 2015. [Consulta: 14 novembre 2022].
- ↑ 61,0 61,1 Grif, K.; Dierich, M. P.; Pfaller, K.; Miglioli, P. A.; Allerberger, F. «In vitro activity of fosfomycin in combination with various antistaphylococcal substances» (en anglès). The Journal of Antimicrobial Chemotherapy, 48, 2, 2001-8, pàg. 209–217. ISSN: 0305-7453. PMID: 11481290.
- ↑ 62,0 62,1 «Fosfomicina» (en castellà). Comité de Medicamentos de la Asociación Española de Pediatría., 2015. [Consulta: 14 novembre 2022].


