Xilanasa
 | |||||||||
| Identificadors | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Número EC | 3.2.1.8 | ||||||||
| Número CAS | 9025-57-4
| ||||||||
| Bases de dades | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| Estructures PDB | RCSB PDB PDBj PDBe PDBsum | ||||||||
| |||||||||
La xilanasa és una classe d'enzims que degraden el polisacàrid beta-1,4-xilà a xilosa mitjançant la degradació de l'hemicel·lulosa, que és un dels principals components de la paret cel·lular de les plantes.
Per tant, es tracta d'una proteïna que té un paper principal en els microorganismes que es nodreixen de les plantes i són molt presents en els fongs que degraden la matèria vegetal en nutrients utilitzables.
Entre les aplicacions comercials en què s'utilitza la xilanasa, destaca el blanquejament de la polpa de la fusta en papereria sense fer servir clor i incrementar la digestibilitat en els ensitjats de les plantes farratgeres com també en el compostatge fermentat anaeròbic.[1]
A banda d'això, és important també la utilització de les xilanases en additius alimentaris per la producció avícola, en la farina per millorar la qualitat de la massa fornejada, l'extracció del cafè, els olis de les plantes, en el midó i el clarificat de sucs, entre altres aplicacions.[2][3][4][5][6][7][8][9][10][11]
En el futur, la xilanasa es podria utilitzar per la síntesi de biocombustibles a partir de materials no utilitzables de les plantes.[12]
Funcionament de l'enzim
[modifica]Les xilanases són glicosidases (o-glicosil hidrolases, EC 3.2.1.X) que s'encarreguen de catalitzar la endohidròlisi d'enllaços 1,4- β-d-xilosídics al xilà, produint nous xilo-oligosacàrids. Aquest polisacàrid es troba majoritàriament a la paret secundària dels vegetals i forma part de l'hemicel·lulosa.[13][14]

Les xilanases constitutives, a baixos nivells d'energia, son responsables de l'inici de la hidròlisi del xilà i de la posterior producció de polisacàrids petits com ara xilobiosa o xilotrosa. És amb l'ajuda de les β-xilosil premeases que els oligosacàrids es transporten a la cèl·lula (aquestes permeases poden reduir la seva activitat en contacte amb la glucosa). Dins la cèl·lula activen la transcripció dels gens xilanolítics produint així endoxilanasses i β-xilosidasse, el què és molt important doncs són les endoxilanasses les que tenen un paper crucial en la despolimerització d'aquest glícid. En primer lloc, trenquen l'enllaç glicosídic 1,4 i posteriorment es forma un enllaç hemiacetàlic que condueix a l'obtenció d'un sucre.[15]
Llocs de reconeixement del substrat i zones actives
[modifica]Existeixen diferents tipus de xilanases i la seva funció i estructura encara romanen en investigació. A continuació, però, s'explica les característiques d'una de les xilanases més utilitzades al sector industrial, les quals, lògicament, s‘han estudiat de manera més detallada donat l'interès que tenen en la societat.
1,4-β-Xilanasa sintetitzada per Trichoderma reesei
[modifica]Trichoderma Reesei és un tipus de fong caracteritzat dins els éssers vius per la capacitat de sintetitzar una gran quantitat d'enzims hidrolítics de polisacàrids. Un d'aquests enzims, doncs, és la 1,4-β-Xilanasa. La 1,4-β-Xilanasa és un tipus d'entre els molts que hi ha d'aquest enzim degradant del xilà. Tot i això, d'aquest tipus existeixen diferents subtipus, de tal manera que aquest organisme pot sintetitzar-ne dos, la endo-1,4-β-xylanase 1(Xyn-I) i la endo-1,4-β-xylanase 2 (Xyn-II).
En les dues endo-1,4-β-xylanases hi ha diferents llocs de reconeixement i unió del substrat en els quals tenen una important implicació diferents aminoàcids. A més a més, hi ha dues zones actives. En la taula següent podem observar tots aquests llocs de reconeixement, l'aminoàcid implicat i la seva posició, i també la funció que desenvolupen (reconeixement del substrat, donador de protons, nucleòfil).[16][17]

Els llocs de reconeixement o unió i les zones actives de l'endo-1,4-β-xilanasa 1 són els següents:
| Zona actiu / Lloc de reconeixement o unió | Posició de l'aminoàcid | Aminoàcid | Funció que desenvolupa |
|---|---|---|---|
| Lloc de reconeixement/unió | 117 | Tirosina | Reconeixement del substrat |
| Zona activa | 126 | Glutamat | Nucleòfila |
| Lloc de reconeixement/unió | 128 | Tirosina | Reconeixement del substrat |
| Lloc de reconeixement/unió | 160 | Arginina | Reconeixement del substrat |
| Lloc de reconeixement/unió | 164 | Prolina | Reconeixement del substrat (mitjançant oxigen carbonílic) |
| Lloc de reconeixement/unió | 174 | Glutamina | Reconeixement del substrat |
| Lloc de reconeixement/unió | 209 | Tirosina | Reconeixement del substrat |
| Zona activa | 215 | Glutamat | Donador de protons |
En l'endo-1,4-β-xilanasa 2 els llocs de reconeixement o unió i les zones actives són les següents:

| Lloc de reconeixement o unió i zones actives | Posició del aminoàcid | Aminoàcid | Funció que desenvolupa |
|---|---|---|---|
| Lloc de reconeixement/unió | 106 | Tirosina | Reconeixement del substrat |
| Lloc de reconeixement/unió | 110 | Tirosina | Reconeixement del substrat |
| Zona activa | 119 | Glutamat | Nucleòfila |
| Lloc de reconeixement/unió | 121 | Tirosina | Reconeixement del substrat |
| Lloc de reconeixement/unió | 155 | Arginina | Reconeixement del substrat |
| Lloc de reconeixement/unió | 159 | Prolina | Reconeixement del substrat |
| Lloc de reconeixement/unió | 169 | Tirosina | Reconeixement del substrat |
| Lloc de reconeixement/unió | 204 | Tirosina | Reconeixement del substrat |
| Zona activa | 210 | Glutamat | Donador de protons |
Complex xilanolític
[modifica]
La xilanasa, però, no és l'únic enzim que intervé en la degradació del xilà. El xilà es degrada per l'acció de diferents enzims que formen el complex xilanolític (els més estudiats del qual són les endoxilanases i les β-xilosidases). Els enzims més importants de aquest complex són: l'endoxilanasa (endo-1,4-β-xilanasa, E.C.3.2.1.8), la β-xilosidasa (xilà-1,4-β-xilosidasa, E.C.3.2.1.37), l'α-glucuronidasa (α-glucosiduronasa, E.C.3.2.1.139), l'α-arabinofuranosidasa (α-Larabinofuranosidasa, E.C.3.2.1.55), l'acetilxilà esterasa (E.C.3.1.1.72) i l'esterasa d'àcid ferúlic i àcid p-coumàric. És necessària l'actuació de diferents enzims a causa de la heterogeneïtat i complexitat del xilè, que té una estructura amb un esquelet de xilosa no ramificat, el qual pot tenir substitucions de grups acetil, L-arabinofuranosil, glucuronil i 4-o-metilglucuronil. Les característiques d'aquests enzims són:
- Endo-1,4-β-xilanases: S'encarrega del trencament dels enllaços glicosídics de l'esquelet del xilà reduint-ne el grau de polimerització.
- β-D-xilosidases: No hidrolitzen xilà. Ell substrat amb el qual millor actuen és la xilobiosa i la seva afinitat pels xilooligosacàrids és inversament proporcional al seu grau de polimerització.
- Acetilxilà esterasa: Elimina els grups O-acetil de les posicions 2 i/o 3 en els residus β-D-xilopiranosil d'acetil-xilà.
- Arabinasa: Elimina els residus de L-arabinosa substituïts a les posicions 2 i 3 del β-D-xilopiranosil.
- α-Glucuronidasa: Hidrolitza els enllaços α-1,2 entre els residus d'àcid glucurònic i les unitats de l'esquelet de β-D-xilopiranosil que es troben en glucuronoxilà.
- L'esterasa d'àcid ferúlic i l'esterasa d'àcid p-coumàric: Trenquen els enllaços éster del xilà.[3]
Activitat enzimàtica
[modifica]Existeixen molts tipus de xilanases i la seva estructura, el funcionament o les característiques òptimes per a la major activitat enzimàtica es diferencien bastant. Generalment, podríem dir que és un enzim termoestable amb temperatures òptimes elevades (sovint superiors a 40 °C). En diferents articles es troben taules de pH òptims per a diferents xilanases de diferènts espècies. En conjunt, podríem dir que el valor en què l'ezim és funcional oscil·la entre un interval ampli, des de 4 per a algunes espècies i tipus de xilanases fins a 8 per a altres, amb alguns valors més extrems i poc freqüents.[3]
Segons UniProt, una de les bases de dades més importants de proteïnes, el pH òptim de la endo-1,4-beta-xilanasa 1 és 3.5-4 i és estable en un pH des de 2.5 fins a 8.5 a temperatura ambient i a un pH de 2.5 fins a 4.5 a 40 °C. [18][19]
La cinètica, valorada amb la constant de Michaelis-Menten (KM), varia segons el tipus de substrat.[18]
- KM=0.22 mg/ml per a fusta de faig (xilà 1)
- KM=14.8 mg/ml per glucuronoxilà acetilat 1
- KM=22.3 mg/ml per glucuronozilà desacetilat 1
Per la endo-1,4-beta-xilanasa 2, el pH òptim és 4.5-5.5 segons UniProt i és estable en un pH des de 3.0 fins a 8.5 a temperatura ambient i a un pH de 4.0 fins a 7.5 a 40 °C. La cinètica també varia depenent del substrat al qual s'uneix:[19]
- KM=0.14 mg/ml per a fusta de faig (xilà 1)
- KM=3.0 mg/ml per glucuronoxilà acetilat 1
- KM=3.8 mg/ml per glucuronozilà desacetilat 1
L'activitat de la xilanasa pot ser inhibida per la unió de l'inhibidor al centre actiu de l'enzim de manera competitiva. Inhibir l'activitat de la xilanasa és de gran avantatge per als hostes de fongs patògens, ja que la inhibició de l'enzim afecta el creixement del fong.[20]
Estructura
[modifica]A continuació s'explicarà l'estructura dels dos tipus d'endo-1,4-β-xylanases sintetitzades per Trichoderma reesei. Per tal de fer-ho, cal que fem referència als diferents nivells que podem distingir:
Estructura primària
[modifica]Sabent que l'estructura primària, bàsicament, fa referència a la seqüència d'aminoàcids que conforma una cadena polipeptídica, cal destacar que la Xyn-I i la Xyn-II estan constituïdes per 178 i 190 aminoàcids,[21] respectivament (tot i que tenint en compte la seqüència senyal i la part propeptídica, estan constituïts per 229 i 223 aa).[22] Així doncs, deduïm que es tracta de dues proteïnes relativament petites amb un pes molecular que oscil·la entre 19 i 21 kDa.

Tots dos enzims són molt semblants (presenten aproximadament un 45% d'homologia) i destaca la presència en ells d'una gran quantitat d'aminoàcids polars sense càrrega, i també de polars amb càrrega positiva i amb càrrega negativa. Aquests tipus d'aa, entre altres funcions, intervenen en la conformació de l'estructura tridimensional gràcies a les interaccions per pont d'hidrogen que estableixen entre ells.
Un altre aminoàcid que intervé en la conformació de l'estructura tridimensional de les proteïnes és la cisteïna. En el cas d'aquests dos enzims, però, tan sols trobem una cisteïna situada en la posició nou de la Xyn-I, i per això no es poden formar enllaços per pont disulfur intramoleculars.
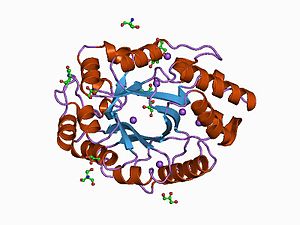
Conformació tridimensional. Estructura secundària
[modifica]
L'estructura secundària és la conformació en l'espai que adopta la seqüència d'aminoàcids segons tres models: α-hèlix, làmina-β (i hèlix de col·lagen). En el cas d'ambdues xilanases, observem la presència d'una gran quantitat de cadenes-β disposades de forma mixta que donen lloc, en cadascuna, a dues làmines-β diferents.

Com podem observar en el diagrama adjuntat, les dues xilanases consten també d'una α-hèlix, i també podem trobar un gir de tipus β en la endo-1,4-beta-xylanase 1 i dos en el cas de la endo-1,4-beta-xylanase 2.

Conformació tridimensional. Estructura terciària
[modifica]Totes aquestes conformacions s'ajunten en l'espai donant lloc a una proteïna tridimensional. Les Xyn-I i II, però, no segueixen un patró definit a diferència de, per exemple, l'hemoglobina (proteïna globular) o el col·lagen (proteïna filamentosa).
Tanmateix, per explicar la seva estructura terciària sovint es fa referència a que comparteix certa similitud amb la forma que adopten el polze i l'índex de la mà dreta, com podem observar a la figura.[21]
Dins d'aquesta conformació caldria puntualitzar que, com normalment succeeix, l'interior d'ambdues molècules està compost bàsicament d'aminoàcids no polars. Aquests residus estan empaquetats formant així una estructura estabilitzada gràcies a interaccions hidrofòbiques. Pel contrari, els residus polars estan localitzats a la zona externa de les seves estructures, la qual cosa permet establir interaccions amb el medi aquós que les envolta.

Canvis post-traduccionals
[modifica]Aquests enzims, no obstant això, no són funcionals fins que pateixen l'addició en la seva estructura d'una sèrie de substàncies.
En el cas de la Xyn-I tan sols es produeix l'addició d'un glicosaminoglicà (glicosilació amb GAGs) en l'asparagina situada en la posició 31. La Xyl-II, per contra, presenta tres addicions del mateix glícid en les asparagines situades en les posicions 71, 94 i 130 i, a més a més, també podem apreciar una modificació de la glutamina situada en la posició 34, que dona lloc a un àcid piroglutàmic.
Localització
[modifica]Aquests enzims són produïts principalment per microorganismes i la seva activitat se centra en la catàlisi de la paret cel·lular de les plantes, juntament amb altres enzims que catalitzen polisacàrids. A més, digereixen el xilà durant la germinació de llavors. L'enzim xilanasa també es troba en protists (tant algues com protozous), insectes, crustacis, cargols i llavors d'algunes plantes. La localització d'aquest enzim depèn de cada tipus de xilanasa. Per exemple, en el bacteri Thermotoga maritima es troba fixada a la paret cel·lular, més concretament en la fracció periplàsmica. Una proporció de la xilanasa també es troba lliure a l'espai intercel·lular, malgrat que la majoria es troba unit a la cèl·lula. En un estudi amb Aeromonas caviae ME-1, es va trobar la xilanasa en el citoplasma. Posteriorment, l'enzim va ser alliberat a la zona periplàsmica a causa de l'osmosi.[23] En general, les xilanases són proteïnes extracel·lulars o enzims superficials de membrana.[24] Acostumen a trobar-se al medi extracel·lular, ja que el substrat no pot entrar a la cel·lula causa de la seva mida.[25]
Les xilanases tenen diversos dominis catalítics i a més a més alguns de suplementaris com ara dominis d'unió de xilà i de cel·lulosa, dominis termoestabilitzadors i altres els quals encara no se’n coneix la funció. Normalment aquests dominis tenen un plegament i funció independent i queden separats per segments d'unió curts rics en aminoàcids hidroxils.
Acostumen a trobar-se al medi extracel·lular, ja que el substrat no pot entrar a la cel·lula causa de la seva mida.
Famílies
[modifica]La realització de diferents estudis sobre les cel·lulases i les xilanases ha permès la identificació dels seus corresponents dominis catalítics. Això s'ha realitzat a partir de la proteòlisi controlada en els enzims madurs tot mantenint l'activitat catalítica. De forma alternativa, mitjançant talls i l'eliminació dels gens que són els encarregats de codificar-los i el posterior anàlisi de la seva expressió, també s'ha identificat, en els mateixos gens, regions que es corresponen als dominis catalítics als enzims. S'ha estudiat l'anàlisi de les seqüències dels dominis de les xilanases en conjunt amb les cel·lulases, que juntament amb la seva revisió ha permès establir una classificació de 12 famílies.
En primer lloc, les famílies A,B,F,G i H engloben enzims bacterians i d'origen fúngic. Per altra banda, la família E es constitueix amb enzims bacterians i de plantes. Això indica una possible transferència de gens entre les plantes i els bacteris amb els quals es troben associades. Les diverses cel·lulases i xilanases tenen mides diferents en funció del nombre d'aminoàcids que les constitueixen. Això no obstant, els seus dominis catalítics acostumen a ser més uniformes respecte a la mida. Les xilanases, dins d'aquesta classificació es troben agrupades en les famílies 10 (o F) i 11(o G)[26]
| Familia | Origen | Enzim | Total | Domini catalític |
| 10 (F) | Bacillus sp C-125 | Xilanasa A | 396 | |
| Bacilluspolymyxa | Xilanasa D | |||
| Butyrivibrio fibrisolvens | Xilanasa A | 378 | ≈350 | |
| Caldocellum saccharolyticum | Xilanasa A | 312 | ||
| Clostridium thermocellum | Xilanasa Z | 809 | ≈350 | |
| Cryptococcus albidus | Xilanasa | 311 | ||
| Penicillium chrysogenum | Xilanasa | |||
| P. fluorecens subsp. cellulosa | Xilanasa A | 585 | 345 | |
| P. fluorecens subsp. cellulosa | Xilanasa B | 555 | 272 | |
| Streptomyces lividans | Xilanasa A | |||
| Thermoascus aurantiacus | Xilanasa | 269 | ||
| 11 (G) | Aspergillus niger | Xilanasa A | ||
| Aspergillus tubigensis | Xilanasa A | |||
| Bacillus circulans | Xilanasa | 185 | ||
| Bacillus pumilus | Xilanasa A | 201 | ||
| Bacillus subtilis | Xilanasa | 182 | ||
| Clostridium acetobutylicum | Xilanasa B | 234 | ||
| Neocallismatix patriciarum | Xilanasa A | |||
| Ruminococcus flavefaciens | Xilanasa A | |||
| Schyzofillum commune | Xilanasa A | |||
| Streptomyces lividans | Xilanasa B i C | |||
| Trichoderma harzianum | Xilanasa | |||
| Trichoderma reesei | Xilanasa 1 i 2 | |||
| Trichoderma viride | Xilanasa |
Síntesi
[modifica]Natural
[modifica]La presència de les cèl·lules vegetals en un medi amb xilà indueix la síntesi de xilanasa. Aquest fet ha estat qüestionat perquè el xilà és una macromolècula gran que no pot entrar a la cèl·lula i per tant no té contactes amb molècules intracel·lulars que puguin influenciar la regulació de l'expressió gènica. Ha d'haver contacte entre alguna molècula del mecanisme de regulació i la molècula inductora perquè la xilenasa se sintetitzi, la qual cosa suggereix l'existència d'algun tipus de lloc de reconeixement a la part externa de la cèl·lula.[3]
Artificial
[modifica]A part de la síntesi natural, la síntesi també s'indueix de manera artifical per obtenir xilanases sintètiques per a la indústria. Aquesta síntesi es duu a terme tant en cultius líquids com sòlids, tot i que predomina el primer cas. En cultius sòlids s'utilitza segó de blat i arròs com a inductors majoritàriament. En cultius líquids, la xilanasa es sintetitza també com a resposta a xilans de diferent procedència.[3]
Aplicacions en la indústria alimentària
[modifica]Les xilanases tenen bastantes aplicacions a causa de la seva alta estabilitat i l'activitat óptima a un pH àcid,[27] com per exemple:
Indústria de la panificació
[modifica]Els principals component dels polisacàrids que no són midó, són els pentosans, principalment els arabinoxilans. Els arabinoxilans (hemicel·lulosa) són polisacàrids constituïts per dues pentoses: xilosa i arabinosa.[28] N'hi ha poca quantitat en base seca a la farina, poden haver-hi tant solubles com insolubles en aigua. S'ha pogut observar que tenen un paper important, tant en la reologia de la massa com en la qualitat del pa final.
La xilanasa bàsicament torna l'hemicel·lulosa insoluble en l'aigua en productes solubles, fent que la massa uneixi més aigua. Això provoca una disminució de la fermesa, augmentant el volum i provocant una molla més fina i uniforme. La massa per tant no s'enganxa tant a les maquinàries i és més fàcil de treballar.[29]
S'ha observat també que millora l'elasticitat de la xarxa de gluten i que podrien substituir l'ús d'emulgents i altres additius, o la combinació amb aquests per una millora del pa. La hidròlisi dels arabinoxilans provoca la transferència d'aigua cap al gluten, fent que la massa sigui més suau i viscosa. La solubilització de l'arabinoxilà provoca un augment de la viscositat, mentre que la degradació de l'arabinoxilà soluble a compostos de més baix pes molecular provoca una disminució de la viscositat. La hidratació del gluten farà que tingui més extensibilitat i millorarà l'augment de volum en el forn.[30]
El volum del pa és especialment important quan es tracta de pa integral, ja que l'addició de segó en la farina refinada, fa que aquest no tingui tant volum final. Això és degut al fet que el segó absorbeix part de l'aigua, per tant la xarxa del gluten no es pot desenvolupar tan bé com amb farina refinada. La hidròlisi enzimàtica allibera aigua lliure i canvia les propietats viscoelàstiques.
La vida útil del pa millora amb l'ús de xilanases, a causa de les que solubilitzen l'hemicel·lulosa. Trenquen els arabinoxilans alliberant aigua i donant una massa menys ferma, això provoca un major volum i que el pa no s'endureixi tan ràpidament. La reducció de l'enduriment del pa s'atribueix a la reducció de la retrogradació del midó, a l'augment de la rigidesa de l'estructura dels polímers i a la degradació de l'hemicel·lulosa que redistribueixen aigua entre les matrius proteiques del midó.
En altres casos s'ha observat que la utilització d'amilases i/o xilanases pot reduir el temps de fermentació sense produir canvis en el pH o la "maquinabilitat" de la massa. Dosis molt altes de xilanases provoquen una massa enganxifosa i difícil de treballar, i una dosis molt baixa no provocaria millora, per tant s'ha de vigilar amb la dosi aplicada.[29]
Clarificació dels sucs
[modifica]El mercat dels enzims té un pes important en la indústria del suc i el vi. La producció de sucs de fruita i hortalisses requereix mètodes d'extracció, neteja i estabilització. Quan es van començar a fer sucs de forma industrial els principals problemes eren les filtracions, a causa de la terbolesa, i el baix rendiment d'extracció. El coneixement dels compostos dels sucs i la utilització d'enzims han ajudat a resoldre aquests problemes.[3]
Actualment els mètodes químics, físics i mecànics per pelar fruites i verdures, s'estan substituint per mètodes enzimàtics, ja que causen menor dany a la carn de les verdures i fruites. La barreja de cel·lulases, pectinases i hemicel·lulases (entre ells, xilanases), s'utilitzen per pelar albercocs, nectarines o fruites d'os, com els préssecs.
Els sucs de fruites i verdures solen estar concentrats de polisacàrids, com pectina, cel·lulosa, hemicel·lulosa, midó i lignina. Aquests components fan que els sucs siguin molt opacs i viscosos després de l'extracció, i el tractament enzimàtic és necessari per a la clarificació. Fruites i verdures com les pinyes, els tomàquets i les pomes contenen quantitats considerables de xilans, ja que la corresponent hemicel·lulosa és rica en xilans. Per tant, el tractament d'aquests amb xilanases millora la transparència i el rendiment del suc. També d'altres com el raïm i la taronja.
També s'han utilitzat enzims, incloent-hi les xilanases, per a la maceració de fruites i verdures, és a dir, per extreure el líquid que aquestes contenen. Durant el processament del suc, els enzims de maceració s'utilitzen en dos passos: després de triturar les fruites i verdures i després de l'extracció del suc. Els enzims de maceració poden hidrolitzar les parets cel·lulars i les pectines solubles de fruites i verdures, contribuint a reduir la viscositat del suc i alliberar més sabor, proteïnes, polisacàrids i enzims durant el processament mentre es mantenen les textures de sucs de fruites i verdures. Aquests passos augmenten el rendiment del suc i la transparència, milloren l'estabilitat, la textura, el sabor i l'aroma, i redueixen la viscositat dels nèctars i els purés de fruites tropicals com prunes, papaies, préssecs, mangos, albercocs, cítrics, kiwi, pomes, plàtans i pinyes.[31]
Avui en dia, les xilanases conjuntament amb les cel·lulases, amilases i pectinases, ajuden a obtenir un millor rendiment del suc mitjançant la liqüefacció de fruites i verdures, l'estabilització de la polpa de la fruita, l'augment de recuperació d'aromes, olis essencials, vitamines, sals minerals, pigments, ... reducció de la viscositat i la hidròlisi de les substàncies que dificulten la clarificació.[3]
Processament d'olis vegetals
[modifica]Els olis vegetals (olis de cuina) de coco, canola, gira-sol, palma i d'oliva s'extreuen comunament amb el dissolvent orgànic hexà, que és un potencial carcinogen. L'addició d'enzims pèctinolítics en l'extracció d'olis vegetals permet la degradació de les parets cel·lulars millorant la qualitat de l'oli i augmentant l'extracció de compostos fenòlics amb un alt poder antioxidant.
S'han obtingut rendiments més alts d'oli a partir d'olives completament madurades quan es processen per sobre de la temperatura ambient, però l'oli resultant mostrava una alta acidesa, ranciesa i poc aroma. Per superar aquest problema, els enzims degradants de la paret cel·lular vegetal han estat àmpliament utilitzats en el procés d'extracció d'oli d'oliva. Hi ha certs preparats enzimàtics comercials que contenen, pectinases, cel·lulases i hemicel·lulases (xilansases), que augmenten el contingut d'aromes, polifenols i vitamina E i redueixen la ranciesa de l'oli d'oliva verge extra.[31]
Begudes alcohòliques
[modifica]En la producció de vi, tres principals enzims exògens, pectinases, β-glucanases i hemicel·lulases, s'han utilitzat àmpliament per hidrolitzar els polisacàrids en la paret cel·lular per millorar el procés de maceració de la pell, per millorar l'extracció del color natural de la pell del raïm, per clarificar els mostos i facilitar els processos de filtració. Finalment, milloren la qualitat i l'estabilitat del vi.
S'ha observat que la Cytolase 219, un enzim de maceració disponible comercialment (una barreja de cel·lulasa, pectinasa i xilanasa), ha estat àmpliament utilitzat en la preparació del vi a partir de 3 varietats de raïm blanc: Soave, Chardonnay, i Sauvignon del nord d'Itàlia. L'ús d'aquest enzim de maceració va provocar un augment de les taxes d'extracció i filtració del 10% al 35% i del 70% al 80%, respectivament. La disminució observada del temps de premsa i de viscositat del most ha estat de 50 a 120 min i del 30% al 70%, respectivament. La millora global va correspondre a una reducció del 20% al 40% en l'ús d'energia del sistema de refrigeració del fermentador i va donar lloc a una major estabilitat del vi.[31]
Durant la fabricació de la cervesa, la paret cel·lular de l'ordi s'hidrolitza alliberant llargues cadenes d'arabinoxilans que augmenten la viscositat de la cervesa i la fan aparentment "fangosa". Per tant, les xilanases s'utilitzen per hidrolitzar els arabinoxilans a oligosacàrids inferiors, disminuint la viscositat de la cervesa eliminant el seu aspecte fangós.
Amb els avenços en les tècniques de biologia molecular, s'estan descobrint altres usos de les xilanases. Es va construir un llevat recombinant de vi amb el gen de la xilanasa d'Aspergillus nidulans, xlnA, resultant en un vi amb un aroma més pronunciat que el convencional.[3]
Millora nutricional d'aliments
[modifica]Quan el xilà és degradat per les xilanases es produeixen xilo-oligosacàrids. Aquests xilo-oligosacàrids tenen efectes prebiòtics, i poden ser utilitzats en aliments funcionals. Els xilo-oligosacàrids augmenten el creixement de microorganismes que promouen la salut, com ara els bifidobacteris a la microflora intestinal humana i també restringeixen la proliferació de microorganismes nocius. Per aquest motiu, s'han utilitzat en diversos productes de begudes com la llet de soja, el te, el cafè i els productes lactis.[32]
Alimentació animal
[modifica]Les xilanases s'utilitzen en l'alimentació animal juntament amb les glucanases, pectinases, cel·lulases, proteases, fitases, galactocinases i lipases. Aquests enzims desglossen els arabinoxilans en els ingredients de l'aliment, reduint així la viscositat de la matèria primera. L'arabinoxilà que es troba en les parets cel·lulars dels grans té un efecte negatiu en l'aviram. Quan aquests components es troben en forma soluble, augmenten la viscositat de l'aliment ingerit dificultant la mobilitat i l'absorció d'altres components de l'aliment.
Si s'afegeixen xilanases en pinsos amb blat de moro o sorgo, que tenen una baixa viscositat, pot millor la digestió dels nutrients en la part inicial de l'intestí, donant lloc a un millor aprofitament. Juntament amb els altres enzims llistats anteriorment, el pinso serà molt més digerible sobretot per aus i porcins joves que tenen menys capacitat de produir enzims que els adults. A més, s'ha trobat que aquest tipus de dieta redueix els residus no desitjables de les excrecions, cosa que podria tenir un efecte positiu pel medi ambient.[3]
Producció d'edulcornat
[modifica]La xilosa resultant de la despolimerització de xilans també es pot convertir en xilitol, un edulcorant valuós que té aplicacions tant en les indústries farmacèutiques com en les indústries alimentàries. Un cop s'obté la xilosa, mitjançant fermentacions dutes a terme per llevats, com per exemple Candida tropicalis, es pot obtenir xilitol. El xilitol és un polialcohol amb poder edulcorant comparable a la sacarosa, no és cariogen (no causa càries) i és apte per diabètics. Es pot trobar al mercat diversos productes que contenen xilitol, com els xiclets.[3][13]
Referències
[modifica]- ↑ Gulzar, Production and partial purification of Xylanase fromTrichoderma longibrachiatum. Published in international conference on biotechnology and neurosciences. CUSAT, 2004.P33
- ↑ Beg, Q. K.; Kapoor, M.; Mahajan, L.; Hoondal, G. S. «Microbial xylanases and their industrial applications: A review». Applied Microbiology and Biotechnology, 56, 3–4, 2001, pàg. 326–338. DOI: 10.1007/s002530100704. PMID: 11548999.
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 Polizeli, M. L. T. M.; Rizzatti, A. C. S.; Monti, R.; Terenzi, H. F.; Jorge, J. A.; Amorim, D. S. «Xylanases from fungi: Properties and industrial applications». Applied Microbiology and Biotechnology, 67, 5, 2005, pàg. 577–91. DOI: 10.1007/s00253-005-1904-7. PMID: 15944805.
- ↑ Subramaniyan, S.; Prema, P. «Biotechnology of Microbial Xylanases: Enzymology, Molecular Biology, and Application». Critical Reviews in Biotechnology, 22, 1, 2002, pàg. 33–64. DOI: 10.1080/07388550290789450. PMID: 11958335.
- ↑ Kulkarni, Neeta; Shendye, Abhay; Rao, Mala «Molecular and biotechnological aspects of xylanases». FEMS Microbiology Reviews, 23, 4, 1999, pàg. 411–56. DOI: 10.1111/j.1574-6976.1999.tb00407.x. PMID: 10422261.
- ↑ Ahmed, Sibtain; Riaz, Saba; Jamil, Amer «Molecular cloning of fungal xylanases: An overview». Applied Microbiology and Biotechnology, 84, 1, 2009, pàg. 19–35. DOI: 10.1007/s00253-009-2079-4. PMID: 19568746.
- ↑ Sá-Pereira, Paula; Paveia, Helena; Costa-Ferreira, Maria; Aires-Barros, Maria Raquel «A New Look at Xylanases: An Overview of Purification Strategies». Molecular Biotechnology, 24, 3, 2003, pàg. 257–81. DOI: 10.1385/MB:24:3:257. PMID: 12777693.
- ↑ Alves-Prado, Heloiza Ferreira; Pavezzi, Fabiana Carina; Leite, Rodrigo Simões Ribeiro; Oliveira, Valéria Maia; Sette, Lara Durães; Dasilva, Roberto «Screening and Production Study of Microbial Xylanase Producers from Brazilian Cerrado». Applied Biochemistry and Biotechnology, 161, 1–8, 2009, pàg. 333–46. DOI: 10.1007/s12010-009-8823-5. PMID: 19898784.
- ↑ Prade, R. A. «Xylanases: From biology to biotechnology». Biotechnology & Genetic Engineering Reviews, 13, 1996, pàg. 101–31. DOI: 10.1016/S0140-6701(97)80292-5. PMID: 8948110.
- ↑ Sunna, A.; Antranikian, G. «Xylanolytic Enzymes from Fungi and Bacteria». Critical Reviews in Biotechnology, 17, 1, 1997, pàg. 39–67. DOI: 10.3109/07388559709146606. PMID: 9118232.
- ↑ Chávez, Renato; Bull, Paulina; Eyzaguirre, Jaime «The xylanolytic enzyme system from the genus Penicillium». Journal of Biotechnology, 123, 4, 2006, pàg. 413–33. DOI: 10.1016/j.jbiotec.2005.12.036. PMID: 16569456.
- ↑ Lee, Charles C.; Wong, Dominic W. S.; Robertson, George H. «Cloning and Characterization of the Xyn11A Gene from Lentinula edodes». The Protein Journal, 24, 1, 2005, pàg. 21–6. DOI: 10.1007/s10930-004-0602-0. PMID: 15756814.
- ↑ 13,0 13,1 Motta A Review of Xylanase Production by the Fermentation of Xylan: Classification, Characterization and Applications, 2013, pàg. 27.
- ↑ Collins, Tony; Gerday, Charles; Feller, Georges «Xylanases, xylanase families and extremophilic xylanases» (en anglès). FEMS Microbiology Reviews, 29, 1, 01-01-2005, pàg. 3–23. DOI: 10.1016/j.femsre.2004.06.005. ISSN: 1574-6976.
- ↑ Polizeli «Inici sessió - Identificació UB - Universitat de Barcelona». Xylanases from fungi: properties and industrial applications. DOI: 10.1007/s00253-005-1904-7.pdf.
- ↑ «xyn1 - Endo-1,4-beta-xylanase 1 precursor - Hypocrea jecorina (strain ATCC 56765 / BCRC 32924 / NRRL 11460 / Rut C-30) - xyn1 gene & protein» (en anglès). [Consulta: 27 octubre 2017].
- ↑ «xyn2 - Endo-1,4-beta-xylanase 2 precursor - Hypocrea jecorina (strain ATCC 56765 / BCRC 32924 / NRRL 11460 / Rut C-30) - xyn2 gene & protein» (en anglès). [Consulta: 27 octubre 2017].
- ↑ 18,0 18,1 18,2 «xyn1 - Endo-1,4-beta-xylanase 1 precursor - Hypocrea jecorina (strain ATCC 56765 / BCRC 32924 / NRRL 11460 / Rut C-30) - xyn1 gene & protein» (en anglès). [Consulta: 19 octubre 2017].
- ↑ 19,0 19,1 19,2 «xyn2 - Endo-1,4-beta-xylanase 2 precursor - Hypocrea jecorina (strain ATCC 56765 / BCRC 32924 / NRRL 11460 / Rut C-30) - xyn2 gene & protein» (en anglès). [Consulta: 19 octubre 2017].
- ↑ Dash, Chandravanu; Ahmad, Absar; Nath, Devyani; Rao, Mala «Novel Bifunctional Inhibitor of Xylanase and Aspartic Protease: Implications for Inhibition of Fungal Growth». Antimicrobial Agents and Chemotherapy, 45, 7, 7-2001, pàg. 2008–2017. DOI: 10.1128/AAC.45.7.2008-2017.2001. ISSN: 0066-4804. PMID: 11408216.
- ↑ 21,0 21,1 TÖRRÖNEN A, ROUVINEN J (24 of August, 1994), "Structural Comparison of Two Major endo-1,4-Xylanases from Trichoderma reesei". Biochemistry 1995, 34, pages 847—856. PMID: 7827044. Consultat el 17-10-2017 (en anglès)
- ↑ 22,0 22,1 «Alineament entre la endo-1,4-β-xilanasa 1 i la endo-1,4-β-xilanasa 2». Uniprot. [Consulta: 17 octubre 2017].
- ↑ Usui, Kengo; Suzuki, Tohru; Akisaka, Toshitaka; Kawai, Keiichi «A cytoplasmic xylanase (XynX) of Aeromonas caviae ME-1 is released from the cytoplasm to the periplasm by osmotic downshock». Journal of Bioscience and Bioengineering, 95, 5, 2003, pàg. 488–495. ISSN: 1389-1723. PMID: 16233445.
- ↑ Liebl, Wolfgang; Winterhalter, Christoph; Baumeister, Wolfgang; Armbrecht, Martin; Valdez, Michael «Xylanase attachment to the cell wall of the hyperthermophilic bacterium Thermotoga maritima». Journal of Bacteriology, 190, 4, 2-2008, pàg. 1350–1358. DOI: 10.1128/JB.01149-07. ISSN: 1098-5530. PMC: PMC2238225. PMID: 18083821.
- ↑ Collins, Tony; Gerday, Charles; Feller, Georges «Xylanases, xylanase families and extremophilic xylanases» (en anglès). FEMS Microbiology Reviews, 29, 1, 01-01-2005, pàg. 3–23. DOI: 10.1016/j.femsre.2004.06.005. ISSN: 0168-6445.
- ↑ 26,0 26,1 Lorea Corral, Dr Octavio «LAS XILANASAS MICROBIANAS Y SUS APLICACIONES». LAS XILANASAS MICROBIANAS Y SUS APLICACIONES Biotecnología Vol. 7 No. 2, 2002, pàg. 30-31. Arxivat de l'original el 2017-12-15 [Consulta: 21 octubre 2017]. Arxivat 2017-12-15 a Wayback Machine.
- ↑ Polizeli, M. L. T. M.; Rizzatti, A. C. S.; Monti, R.; Terenzi, H. F.; Jorge, J. A. «Xylanases from fungi: properties and industrial applications» (en anglès). Applied Microbiology and Biotechnology, 67, 5, 6-2005, pàg. 577–591. DOI: 10.1007/s00253-005-1904-7. ISSN: 0175-7598.
- ↑ Dervilly-Pinel, G «Investigation of the distribution of arabinose residues on the xylan backbone of water-soluble arabinoxylans from wheat flour» (en anglès). Carbohydrate Polymers, 55, 2, 22-01-2004, pàg. 171–177. DOI: 10.1016/j.carbpol.2003.09.004.
- ↑ 29,0 29,1 Butt, M.S; Tahir-Nadeem, M; Ahmad, Z.; Sultan, M.T. «Food Technology and Biotechnology». Xylanases and their applications in baking industry, 46, 2008, pàg. 22-31.
- ↑ Harris, Annie Deborah; Ramalingam, C. «Journal of Experimental Sciences». Xylanases and its Application in Food Industry: A Review, 1, 2010, pàg. 01-11.
- ↑ 31,0 31,1 31,2 Toushik, Sazzad Hossen; Lee, Kyung-Tai; Lee, Jin-Sung; Kim, Keun-Sung «Functional Applications of Lignocellulolytic Enzymes in the Fruit and Vegetable Processing Industries: Applications of lignocellulolytic enzymes…» (en anglès). Journal of Food Science, 82, 3, 3-2017, pàg. 585–593. DOI: 10.1111/1750-3841.13636.
- ↑ Kumar, Vishal; Dangi, Arun Kumar; Shukla, Pratyoosh «Engineering Thermostable Microbial Xylanases Toward its Industrial Applications» (en anglès). Molecular Biotechnology, 60, 3, 3-2018, pàg. 226–235. DOI: 10.1007/s12033-018-0059-6. ISSN: 1073-6085.
Bibliografia
[modifica]- Dashek, William V. «Xylanase». A: Methods in Plant Biochemistry and Molecular Biology. CRC Press, 1997, p. 313–5. ISBN 0-8493-9480-5. «Xylans can by hydrolyzed by β-xylanase»
- Risk Assessment Summary, CEPA 1999. Trichoderma reesei 1391A Arxivat 2013-11-20 a Wayback Machine.
- Risk Assessment Summary, CEPA 1999. Trichoderma reesei P345A
- Risk Assessment Summary, CEPA 1999. Trichoderma reesei P210A
- Risk Assessment Summary, CEPA 1999. Trichoderma longibrachiatum RM4-100
- SWISS-MODEL, the fully automated protein structure homology-modelling server. https://www.proteinmodelportal.org/?pid=modelDetail&provider=SWISSMODEL&template=1xyn.&pmpuid=1001078468040&range_from=1&range_to=229&ref_ac=P36218&mapped_ac=P36218&zid=async
- SWISS-MODEL, the fully automated protein structure homology-modelling server. https://www.proteinmodelportal.org/?pid=modelDetail&provider=SWISSMODEL&template=5k7p.&pmpuid=1001078486684&range_from=1&range_to=223&ref_ac=P36217&mapped_ac=P36217&zid=async
- «Three-dimensional structure of endo-1,4-3-xylanase 11 from Trichoderma reesei: two conformational states in the active site». The EMBO Journal, 13, 11, 1994, pàg. 2493 - 2501. PMID: PMC395120.
- «Effect of Temperature on Xylanase II from Trichoderma reesei QM 9414: A Calorimetric, Catalytic, and Conformational Study». Enzyme research, 2014, 07-09-2014, pàg. 1-16. PMID: PMC4170777.
