Model atòmic de Bohr: diferència entre les revisions
Ampliació |
→Postulats de Bohr: Ampliació |
||
| Línia 21: | Línia 21: | ||
== Postulats de Bohr == |
== Postulats de Bohr == |
||
[[Fitxer:Niels Bohr.jpg|miniatura|Niels Bohr el 1922]] |
[[Fitxer:Niels Bohr.jpg|miniatura|Niels Bohr el 1922]] |
||
El model atòmic que Bohr exposà es publicà en dos articles el 1913.<ref>{{Ref-publicació|article=I. On the constitution of atoms and molecules|url=https://doi.org/10.1080/14786441308634955|publicació=The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science|data=1913-07-01|issn=1941-5982|pàgines=1–25|volum=26|exemplar=151|doi=10.1080/14786441308634955|nom=N.|cognom=Bohr}}</ref><ref>{{Ref-publicació|article=LXXIII. On the constitution of atoms and molecules|url=https://doi.org/10.1080/14786441308635031|publicació=The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science|data=1913-11-01|issn=1941-5982|pàgines=857–875|volum=26|exemplar=155|doi=10.1080/14786441308635031|nom=N.|cognom=Bohr}}</ref> Aquest model se sol resumir en tres postulats que es refereixen exclusivament a l'[[electró]].<ref>[http://www.eis.uva.es/~qgintro/atom/tutorial-08.html Modelo atómico de Bohr], www.eis.uva.es {{es}} [consulta:02-04-2014]</ref> |
El model atòmic que Bohr exposà es publicà en dos articles el 1913.<ref name=":2">{{Ref-publicació|article=I. On the constitution of atoms and molecules|url=https://doi.org/10.1080/14786441308634955|publicació=The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science|data=1913-07-01|issn=1941-5982|pàgines=1–25|volum=26|exemplar=151|doi=10.1080/14786441308634955|nom=N.|cognom=Bohr}}</ref><ref>{{Ref-publicació|article=LXXIII. On the constitution of atoms and molecules|url=https://doi.org/10.1080/14786441308635031|publicació=The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science|data=1913-11-01|issn=1941-5982|pàgines=857–875|volum=26|exemplar=155|doi=10.1080/14786441308635031|nom=N.|cognom=Bohr}}</ref> Aquest model se sol resumir en tres postulats que es refereixen exclusivament a l'[[electró]].<ref>[http://www.eis.uva.es/~qgintro/atom/tutorial-08.html Modelo atómico de Bohr], www.eis.uva.es {{es}} [consulta:02-04-2014]</ref> |
||
=== Primer postulat === |
=== Primer postulat === |
||
| Línia 27: | Línia 27: | ||
=== Segon postulat === |
=== Segon postulat === |
||
Els electrons no emeten energia, en contra de la [[Equació de continuïtat|teoria electromagnètica]] de Maxwell, si giren al voltant del nucli en aquelles òrbites per les quals el [[moment angular]] de l'electró, <math>L = r m v</math>, és un múltiple sencer (<math>n = 1, 2, 3...</math>) de la [[constant de Planck]] <math>h</math> dividida per <math>2 \pi</math>, que Bohr representà com <math>\hbar</math>. |
Els electrons no emeten energia, en contra de la [[Equació de continuïtat|teoria electromagnètica]] de Maxwell, si giren al voltant del nucli en aquelles òrbites per les quals el [[moment angular]] de l'electró, <math>L = r m v</math>, és un múltiple sencer (<math>n = 1, 2, 3...</math>) de la [[constant de Planck]] <math>h</math> dividida per <math>2 \pi</math>,<ref name=":2" /> que Bohr representà com <math>\hbar</math>. |
||
{{equació| |
{{equació| |
||
| Línia 34: | Línia 34: | ||
==== Radi de la 1a òrbita ==== |
==== Radi de la 1a òrbita ==== |
||
D'aquesta expressió es pot calcular el radi de qualsevol òrbita. Per a l'òrbita fonamental de l'àtom d'hidrogen és <math>n = 1</math>. El radi s'obté d'igualar la [[força centrípeta]] a la [[Llei de Coulomb|força electroestàtica]] (força de Coulomb): |
D'aquesta expressió es pot calcular el radi de qualsevol òrbita. Per a l'òrbita fonamental de l'àtom d'hidrogen és <math>n = 1</math>. El radi s'obté d'igualar la [[força centrípeta]] a la [[Llei de Coulomb|força electroestàtica]] (força de Coulomb):<ref name=":2" /> |
||
<math display="block">F_c = F_e \quad \Longrightarrow \quad m \frac {v^2}{r} = k \frac {e^2}{r^2} \quad \Longrightarrow \quad m r v^2 = k e^2</math>A aquesta expressió hom pot substituir la velocitat pel valor que apareix a la relació amb la constant de Planck d'aquest segon postulat, i s'obté el radi de la 1a òrbita: |
<math display="block">F_c = F_e \quad \Longrightarrow \quad m \frac {v^2}{r} = k \frac {e^2}{r^2} \quad \Longrightarrow \quad m r v^2 = k e^2</math>A aquesta expressió hom pot substituir la velocitat pel valor que apareix a la relació amb la constant de Planck d'aquest segon postulat, i s'obté el radi de la 1a òrbita:<ref name=":2" /> |
||
<math display="block">r_1 = \frac {h^2}{4 \pi^2 k e^2 m}</math> |
<math display="block">r_1 = \frac {h^2}{4 \pi^2 k e^2 m}</math> |
||
| ⚫ | |||
==== Velocitat de la 1a òrbita ==== |
|||
| ⚫ | |||
La velocitat de l'electró en la primera òrbita s'obté de l'expressió del segon postulat i substituint el radi per l'expressió obtinguda: |
==== Velocitat de la 1a òrbita ==== |
||
La velocitat de l'electró en la primera òrbita s'obté de l'expressió del segon postulat i substituint el radi per l'expressió obtinguda:<ref name=":2" /> |
|||
<math display="block">v = \frac {h}{2 \pi m r_1} = \frac {2 \pi k e^2}{h}</math> |
<math display="block">v = \frac {h}{2 \pi m r_1} = \frac {2 \pi k e^2}{h}</math> |
||
El valor és <math>v_1 = 2 \; 191 \, km/s</math>, un valor molt allunyat de la [[velocitat de la llum]] que requeriria contemplar efectes relativistes. |
El valor és <math>v_1 = 2 \; 191 \, km/s</math>, un valor molt allunyat de la [[velocitat de la llum]] que requeriria contemplar efectes relativistes. |
||
La relació entre aquesta velocitat i la velocitat de la llum s'anomena [[constant d'estructura fina]]. Normalment denotada per <math>\alpha</math>, és la constant física fonamental que caracteritza la intensitat de la [[interacció electromagnètica]]. Fou introduïda originàriament per [[Arnold Sommerfeld]] el [[1916]], com una mesura de les desviacions relativistes en les línies espectrals atòmiques respecte a les prediccions del model de Bohr. La seva expressió és: |
|||
<math display="block">\alpha = \frac {v_1}{c} = \frac {2 \pi k e^2}{h c}</math> |
|||
El seu valor actual és: <math>\alpha = 7,297 352 5693(11) \times 10^{-3} \approx \frac{1}{137} </math>.<ref>{{Ref-web|títol=CODATA Value: fine-structure constant|url=https://physics.nist.gov/cgi-bin/cuu/Value?alph|consulta=2021-05-05}}</ref> |
|||
==== Energia de la 1a òrbita ==== |
==== Energia de la 1a òrbita ==== |
||
| Línia 54: | Línia 60: | ||
<math display="block">E = \frac {1}{2}mv^2 - k \frac{e^2}{r} = \frac {1}{2}m \frac {k e^2}{mr} - k \frac{e^2}{r} = -k \frac{e^2}{2r}</math> |
<math display="block">E = \frac {1}{2}mv^2 - k \frac{e^2}{r} = \frac {1}{2}m \frac {k e^2}{mr} - k \frac{e^2}{r} = -k \frac{e^2}{2r}</math> |
||
Si se substitueix el valor del radi de la 1a òrbita, s'obté: |
Si se substitueix el valor del radi de la 1a òrbita, s'obté:<ref name=":2" /> |
||
<math display="block">E_1 = - 2 \pi^2 k^2 \frac {e^4 m}{h^2}</math> |
<math display="block">E_1 = - 2 \pi^2 k^2 \frac {e^4 m}{h^2}</math> |
||
| Línia 61: | Línia 67: | ||
=== Tercer postulat === |
=== Tercer postulat === |
||
[[Fitxer:Bohr atom animation.gif|miniatura|Animació del procés d'absorció i emissió d'energia a l'àtom de Bohr]] |
|||
El pas d'un electró d'una òrbita a una altra provoca una emissió o absorció d'energia d'acord amb la diferència d'energia entre els dos nivells energètics. |
El pas d'un electró d'una òrbita a una altra provoca una emissió o absorció d'energia d'acord amb la diferència d'energia entre els dos nivells energètics. Si un electró passa d'una òrbita de menys energia a una de més energia, aquest absorbeix energia; en canvi, si és a l'inrevés, emet energia. |
||
L'energia d'una òrbita <math>n</math> és: |
|||
<math display="block">E_n = - 2 \pi^2 k^2 \frac {e^4 m}{n^2h^2}</math> |
<math display="block">E_n = - 2 \pi^2 k^2 \frac {e^4 m}{n^2h^2}</math> |
||
| ⚫ | |||
{{equació| |
|||
<math> E = E_{n_i} - E_{n_f} </math> |
|||
<math display="block">h \nu = E_{n_i} - E_{n_f} = - 2 \pi^2 k^2 \frac {e^4 m}{n_i^2h^2} - [- 2 \pi^2 k^2 \frac {e^4 m}{n_f^2h^2}] = |
|||
||center}} |
|||
2 \pi^2 k^2 \frac {e^4 m}{h^2} \biggl(\frac{1}{n_f^2} - \frac{1}{n_i^2}\biggr)</math>D'aquí s'obté que la freqüència de la radiació emesa és: |
|||
<math display="block">\nu = \frac {2 \pi^2 k^2 e^4 m}{h^3} \biggl(\frac{1}{n_f^2} - \frac{1}{n_i^2}\biggr)</math> |
|||
[[Fitxer:Hydrogen spectrum sl.svg|miniatura|440x440px|Espectre de l'hidrogen]] |
|||
Si se substitueix <math>n_f = 2</math> i <math>n_i > 2</math> s'obté la fórmula de Balmer i totes les freqüències de l'espectre atòmic corresponents a la [[Sèries de Balmer|sèrie de Balmer]]. Si se substitueix <math>n_f = 3</math> i <math>n_i > 3</math> s'obtenen les freqüències de les línies de la [[sèrie de Paschen]]. Eren les dues sèries que es coneixien el 1913. Bohr predigué correctament l'existència d'una sèrie a l'ultraviolat <math>n_f = 1</math>, descoberta per [[Theodore Lyman]] entre 1906 i 1914 i de més sèries a l'infraroig <math>n_f = 4, 5, 6...</math> , descobertes per [[Frederick Sumner Brackett]] el 1922, [[August Herman Pfund]] el 1924 i [[Curtis J. Humphreys]] el 1953.<ref name=":2" /> |
|||
Aquesta equació l'havia obtinguda a partir de dades experimentals el físic suec [[Johannes Robert Rydberg]] (1854–1919) i la fracció de constants es coneix com a [[constant de Rydberg]] <math>R_H</math>: |
|||
| ⚫ | |||
<chem display="block">R_{H} = \frac {2 \pi^2 k^2 e^4 m}{h^3}</chem>El seu valor és <math display="inline">R_H = 10 \, 967\, 758,3 \; m^{-1}</math>.<ref name=":12">{{Ref-llibre|cognom=Boeyens|nom=J.C.A.|títol=Electronic Structure and Number Theory: Bohr's Boldest Dream|url=https://books.google.cat/books?id=ZBy6BQAAQBAJ&vq=rydberg+constant&hl=ca&source=gbs_navlinks_s|data=2013|editorial=Springer|lloc=|isbn=9783642319778|cognom2=Comba|nom2=P}}</ref> |
|||
No gaire temps després de publicar-se aquest model, van aparèixer espectrògrafs de poder resolutiu més gran i van posar de manifest que les línies espectrals estaven realment formades per diverses línies molt fines tal com havia predit Bohr. |
|||
== Referències == |
== Referències == |
||
Revisió del 00:25, 6 maig 2021
|
|
Aquest article o secció s'està elaborant i està inacabat. L'usuari Antoni Salvà hi està treballant i és possible que trobeu defectes de contingut o de forma. Comenteu abans els canvis majors per coordinar-los. Aquest avís és temporal: es pot treure o substituir per {{incomplet}} després d'uns dies d'inactivitat. Fou afegit el maig de 2021. |

El model atòmic de Bohr és un model que representa, de manera gràfica, la matèria en la seva dimensió atòmica,[1] proposat pel físic danès Niels Bohr l'any 1913.[2] El model de Bohr és una representació simple que recorda al model planetari de Copèrnic. Bohr va postular la idea que l'àtom és com un petit sistema solar amb un petit nucli al centre i un núvol d'electrons que hi donen voltes.[3]
El model de Rutherford
El físic britànic Ernest Rutherford, mitjançant estudis de dispersió de partícules α per làmines molt fines de metalls (experiment de Rutherford), arribà a la conclusió que tota la càrrega positiva de l'àtom i pràcticament tota la seva massa estaven concentrades en un volum molt petit al centre de l'àtom. És el que anomenà nucli atòmic. El model vigent aleshores era el model de Thomson, que no contemplava l'existència d'aquest nucli atòmic. Per aquesta raó el 1911, Rutherford proposà un nou model on els electrons giraven enrevoltant el nucli en òrbites circulars, atrets per la força de Coulomb, o força electroestàtica. L'àtom se semblava a un sistema solar en miniatura on el lloc del Sol l'ocupava el nucli atòmic, els dels planetes els electrons i la força gravitatòria era substituïda per la força electroestàtica.[4]
Aquest model patia d'uns quants problemes. Un d'ells era que no permetia explicar els espectres atòmics. Cada àtom absorbeix, o emet, unes determinades freqüències de radiació electromagnètica, essent diferents per a cada element químic, i s'havia aconseguit relacionar totes les d'un mateix element químic amb una fórmula. La fórmula de Balmer per a l'espectre de l'hidrogen en la zona visible i la fórmula de Rydberg, generalització de l'anterior per a tota mena de radiació electromagnètica. Tampoc podia justificar valors d'energia d'ionització, l'energia que es precisa per extreure un electró d'un àtom. Per altra banda els electrons movent-se en òrbites de forma aleatòria assolirien posicions on la repulsió entre ells superaria l'atracció del nucli, convertint l'àtom en inestable mecànicament. Un altre problema que presentava el model de Rutherford era que, segons la teoria electromagnètica de Maxwell, una càrrega accelerada ha d'emetre radiació electromagnètica. Els electrons en òrbita tenen almanco una acceleració, l'acceleració centrípeta, que possibilita una trajectòria circular. Per tant un electró seguint una òrbita hauria de perdre energia i caure cap al nucli atòmic, cosa que no passa.[4]
Idees sobre quantització
El 1910 el físic austríac Arthur Erich Haas (1884–1941) publicà un article[5] on observà que si es dividia la constant de Planck per l'energia d'un electró a la superfície de l'àtom, el resultat era del mateix ordre de magnitud que les freqüències de l'espectre atòmic de l'hidrogen. Suposant que l'energia d'un quàntum emès o absorbit era igual a l'energia d'un electró en una òrbita de radi , establí que (on és la freqüència de la radiació emesa, la càrrega de l'electró i del nucli atòmic). Per altra banda, igualant la força centrípeta amb l'atracció electroestàtica determinà que la freqüència orbital dels electrons, de massa , era ( és la constant elèctrica del buit, 8,9875517923(14)×109 kg⋅m3⋅s−2⋅C−2)[6]:
Després assumí que ambdues freqüències eren iguals, , i aconseguí una expressió per a la constant de Planck en termes d'altres quantitats mesurables:
El matemàtic anglès John William Nicholson (1881–1955) el 1912[8] descobrí una proporció d'energia i freqüència que, segons ell, també es podria expressar en termes del moment angular total dels electrons en la seva òrbita sobre el nucli.[7]
Postulats de Bohr

El model atòmic que Bohr exposà es publicà en dos articles el 1913.[9][10] Aquest model se sol resumir en tres postulats que es refereixen exclusivament a l'electró.[11]
Primer postulat
Bohr assumí el model atòmic de Rutherford en quant la massa de l'àtom i la seva càrrega positiva estan en el nucli atòmic que és molt més petit que l'àtom. L'electró té una massa negligible i, a conseqüència de la força electroestàtica produïda per la càrrega positiva del nucli, gira al seu voltant en òrbites el·líptiques o circulars, amb una velocitat molt menor que la velocitat de la llum. La càrrega positiva del nucli és igual a la suma de càrregues negatives dels electrons, de manera que l'àtom és neutre.
Segon postulat
Els electrons no emeten energia, en contra de la teoria electromagnètica de Maxwell, si giren al voltant del nucli en aquelles òrbites per les quals el moment angular de l'electró, , és un múltiple sencer () de la constant de Planck dividida per ,[9] que Bohr representà com .
Radi de la 1a òrbita
D'aquesta expressió es pot calcular el radi de qualsevol òrbita. Per a l'òrbita fonamental de l'àtom d'hidrogen és . El radi s'obté d'igualar la força centrípeta a la força electroestàtica (força de Coulomb):[9]
Substituint pels valors coneguts actualment s'obté , valor conegut com a radi de Bohr i simbolitzat com a .
Velocitat de la 1a òrbita
La velocitat de l'electró en la primera òrbita s'obté de l'expressió del segon postulat i substituint el radi per l'expressió obtinguda:[9]
El valor és , un valor molt allunyat de la velocitat de la llum que requeriria contemplar efectes relativistes.
La relació entre aquesta velocitat i la velocitat de la llum s'anomena constant d'estructura fina. Normalment denotada per , és la constant física fonamental que caracteritza la intensitat de la interacció electromagnètica. Fou introduïda originàriament per Arnold Sommerfeld el 1916, com una mesura de les desviacions relativistes en les línies espectrals atòmiques respecte a les prediccions del model de Bohr. La seva expressió és:
El seu valor actual és: .[12]
Energia de la 1a òrbita
L'energia de l'electró s'obté sumant l'energia cinètica i l'energia potencial electroestàtica, i substituint la velocitat per l'expressió trobada en igualar la força centrípeta a la força electroestàtica:
Si se substitueix el valor del radi de la 1a òrbita, s'obté:[9]
El valor de l'energia de l'electró en la primera òrbita és:
Tercer postulat
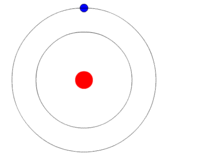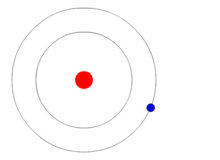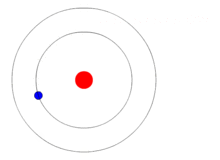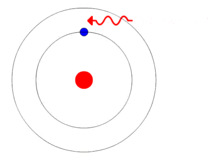
El pas d'un electró d'una òrbita a una altra provoca una emissió o absorció d'energia d'acord amb la diferència d'energia entre els dos nivells energètics. Si un electró passa d'una òrbita de menys energia a una de més energia, aquest absorbeix energia; en canvi, si és a l'inrevés, emet energia.
L'energia d'una òrbita és:
L'energia emesa quan l'electró passa d'una òrbita inicial, , més allunyada del nucli, a una final, val:

Si se substitueix i s'obté la fórmula de Balmer i totes les freqüències de l'espectre atòmic corresponents a la sèrie de Balmer. Si se substitueix i s'obtenen les freqüències de les línies de la sèrie de Paschen. Eren les dues sèries que es coneixien el 1913. Bohr predigué correctament l'existència d'una sèrie a l'ultraviolat , descoberta per Theodore Lyman entre 1906 i 1914 i de més sèries a l'infraroig , descobertes per Frederick Sumner Brackett el 1922, August Herman Pfund el 1924 i Curtis J. Humphreys el 1953.[9]
Aquesta equació l'havia obtinguda a partir de dades experimentals el físic suec Johannes Robert Rydberg (1854–1919) i la fracció de constants es coneix com a constant de Rydberg :
Referències
- ↑ Definición de modelo atómico, definicion.de (castellà) [consulta: 02-04-2014]
- ↑ Estructura de la materia – El modelo atómico de Bohr www.quimitube.com (castellà) [consulta:02-04-2014]
- ↑ Modelo atómico según Niels Bohr, astrojem.com (castellà) [consulta:02-04-2014]
- ↑ 4,0 4,1 Hettema, Hinne «Bohr's theory of the atom 1913–1923: A case study in the progress of scientific research programmes». Studies in History and Philosophy of Science Part B: Studies in History and Philosophy of Modern Physics, 26, 3, 1995-12-XX, pàg. 307–323. DOI: 10.1016/1355-2198(95)00018-6. ISSN: 1355-2198.
- ↑ Haas, A.E. «Der Zusammenhang des Planckschen elementaren Wirkungsquatums mit den Grundgrossen der Electronentheorie.». Jahrbuch der Radioaktivitaet und Elektronik, 7, 1910, pàg. 261-268.
- ↑ Calculada com k = 1/(4πε0) – «2018 CODATA Value: vacuum electric permittivity». The NIST Reference on Constants, Units, and Uncertainty. NIST, 20-05-2019. [Consulta: 20 maig 2019].
- ↑ 7,0 7,1 Baily, C. «Early atomic models – from mechanical to quantum (1904–1913)». The European Physical Journal H, 38, 1, 24-10-2012, pàg. 1–38. DOI: 10.1140/epjh/e2012-30009-7. ISSN: 2102-6459.
- ↑ Nicholson, J.W. «The Constitution of the Solar Corona II». Monthly Notices of the Royal Astronomical Society, 72, 1912, pàg. 677-692.
- ↑ 9,0 9,1 9,2 9,3 9,4 9,5 9,6 Bohr, N. «I. On the constitution of atoms and molecules». The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 26, 151, 01-07-1913, pàg. 1–25. DOI: 10.1080/14786441308634955. ISSN: 1941-5982.
- ↑ Bohr, N. «LXXIII. On the constitution of atoms and molecules». The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 26, 155, 01-11-1913, pàg. 857–875. DOI: 10.1080/14786441308635031. ISSN: 1941-5982.
- ↑ Modelo atómico de Bohr, www.eis.uva.es (castellà) [consulta:02-04-2014]
- ↑ «CODATA Value: fine-structure constant». [Consulta: 5 maig 2021].
- ↑ Boeyens, J.C.A.; Comba, P. Electronic Structure and Number Theory: Bohr's Boldest Dream. Springer, 2013. ISBN 9783642319778.
Vegeu també
- Model atòmic de Dalton
- Model atòmic de Thomson
- Model atòmic de Rutherford
- Model atòmic de Sommerfeld
- Model atòmic de Schrödinger
Enllaços externs
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Model atòmic de Bohr |
- Model atòmic de Bohr (UPV) (castellà)
- Model atòmico de Bohr i correccions al model (castellà)


































![{\displaystyle h\nu =E_{n_{i}}-E_{n_{f}}=-2\pi ^{2}k^{2}{\frac {e^{4}m}{n_{i}^{2}h^{2}}}-[-2\pi ^{2}k^{2}{\frac {e^{4}m}{n_{f}^{2}h^{2}}}]=2\pi ^{2}k^{2}{\frac {e^{4}m}{h^{2}}}{\biggl (}{\frac {1}{n_{f}^{2}}}-{\frac {1}{n_{i}^{2}}}{\biggr )}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/01b943a248efbdb7ea266cfc25abb4d7f6740037)









