Malaltia pulmonar obstructiva crònica
La malaltia pulmonar obstructiva crònica (MPOC) es caracteritza per la presència d'una obstrucció crònica i poc reversible al flux aeri. Sol iniciar-se amb una bronquitis crònica i pot coexistir amb l'emfisema pulmonar, un parell de malalties dels pulmons, en les quals també les vies respiratòries s'estrenyen.[1]
Això duu a una limitació del flux d'aire cap i des dels pulmons, causant dispnea. A la pràctica clínica la MPOC es defineix pel seu característic baix flux d'aire en les proves de funció pulmonar.[2] En contrast amb l'asma, aquesta limitació és poc reversible i en general s'agreuja progressivament amb el pas del temps.
La MPOC és causada per partícules nocives o gasos, en general de consum de tabac (tabaquisme), el que desencadena una resposta inflamatòria anòmala del pulmó.[3] Només un 20-25% dels fumadors desenvolupen la malaltia, però es desconeixen les causes que en predisposen el desenvolupament, tot i que pot ser que sigui un component multifactorial que incloguin elements ambientals com susceptibilitat individual.
El diagnòstic de MPOC requereix proves de funció pulmonar. Les mesures de tractament més importants inclouen la deixar de fumar, la teràpia farmacològica (principalment amb l'ús d'inhaladors), la vacunació (antigripal i antipneumocòccica) i la rehabilitació. Alguns pacients poden requerir tractament a llarg termini d'oxigen (oxigenoteràpia) o un trasplantament de pulmó.[3]
Arreu del món la MPOC fou tipificada la sisena causa de mort el 1990. Es preveu que sigui la quarta causa de mort al món el 2030 a causa d'un augment en les taxes de tabaquisme i els canvis demogràfics en molts països.[4]
Causes
[modifica]L'escala feta servir difereix entre les dues gràfiques.[5]
La causa primària de MPOC és el fum de tabac, juntament amb la contaminació i exposició ocupacional a focs interiors, són les causes més significatives.[6] Típicament, aquestes exposicions han d'ocórrer al llarg de diverses dècades abans no es desenvolupin els símptomes.[6] La inhalació del fum produeix inflamació dels bronquis i destrucció dels envans alveolars. Això explica que els efectes siguin només parcialment reversibles (atès que hi ha un component de destrucció i d'inflamació crònica). Per això, la funció pulmonar perduda no es recupera. El fum de l'ambient i algunes condicions laborals també poden causar la malaltia.[7] La composició genètica d'una persona també afecta el risc.[6]
Fumador
[modifica]El factor de risc primari per al MPOC globalment és el fum del tabac.[6] Dels qui fumen aproximadament 20% tindrà MPOC,[8] i dels qui són fumadors de llarga durada, ho patiran la meitat.[9] Als Estats Units i Regne Unit, entre un 80–95% de les persones amb MPOC, són o han estat fumadors o ex-fumadors.[8][10][11] La probabilitat de desenvolupar MPOC augmenta amb l'exposició total al fum.[12] A més, les dones són més susceptibles als efectes nocius del fum que els homes.[11] Entre els no-fumadors, ser fumador passiu és la causa d'aproximadament el 20% dels casos.[10] Altres tipus de fum, com el de la marihuana, els cigars, o les pipes de l'aigua, també suposen un risc. Les dones que fumen durant l'embaràs poden augmentar el risc de MPOC en el seu nen.[6]
Contaminació de l'aire
[modifica]Els focs de cuina mal ventilats, sovint basats en carbó o combustibles de biomassa com fusta i excrements animals, incrementen la contaminació d'espais tancats i és una de les causes més comunes de MPOC en països en desenvolupament.[13] Aquests combustibles són un mètode de cuinar i escalfar per gairebé 3.000 milions de persones amb uns efectes en la seva salut cada cop pitjor, especialment entre dones a causa d'una alta exposició.[6][13] Són utilitzats com la font principal d'energia en el 80% de les llars a l'Índia, Xina i l'Àfrica subsahariana.[14]
Les persones que viuen en grans ciutats tenen un índex més alt de MPOC comparat a persones que viuen en àrees rurals.[15] Mentre la contaminació atmosfèrica urbana és un factor que contribueix en les exacerbacions de la malaltia, la seva contribució com a causa del MPOC no està confirmada.[6] Les àrees amb qualitat atmosfèrica pobra, incloent els derivats del gasos de combustió, generalment arriben a índexs més alts de MPOC.[14] L'efecte global comparat amb el derivat de fumar és bastant petit.[6]
Exposicions ocupacionals
[modifica]Una exposició intensa i prolongada a la pols, substàncies químiques i fumes per raons professionals augmenten el risc de MPOC tant en fumadors com en no fumadors.[16] Les exposicions d'índole laboral es consideren la causa d'un 10–20% dels casos.[17] Als Estats Units es consideren relacionats amb més de 30% de casos entre la població qui mai ha fumat, i probablement representa un risc més gran als països sense controls suficients.[6]
Un important nombre d'indústries i altres fonts estan implicades, incloent-hi els alts nivells de pols de la mineria del carbó, de l'or, i la indústria tèxtil del cotó, les activitats en contacte amb el cadmi i els isocianats, i el fum de les soldadures.[14][16] Treballar en l'agricultura és també un factor de risc.[14] En algunes professions els efectes es consideren equivalents a fumar entre mig o dos paquets de cigarrets al dia.[18] L'exposició a la pols de sílice també accelera el MPOC, un fet que se suma al risc de patir silicosi.[19] Els efectes negatius de l'exposició a la pols i al fum del cigarret tenen, un efecte additiu.[18]
Genètica
[modifica]La genètica juga una funció en el desenvolupament de MPOC.[6] És més comú entre parents fumadors que hagin patit MPOC, que amb no-fumadors.[6] Actualment, l'únic factor de risc heretat clarament és la deficiència d'alfa-1-antitripsina (AAT).[20] Aquest risc és particularment alt si algú amb aquesta deficiència també és fumador.[20] És responsable d'aproximadament 1–5% dels casos i la condició és presents en aproximadament 3–4 de cada 10.000 persones.[20][21][22] S'estima que pot haver altres factors genètics implicats que estan sent investigats.[20][14]
Altre
[modifica]Altres factors estan menys relacionats amb el MPOC, si bé s'ha identificat alguna correlació. El risc és més gran entre persones pobres, tot i que no està clar si la causa és directa o es deu a altres factors de risc que van associats amb la pobresa, com la contaminació de l'aire i la desnutrició.[6] Hi ha proves provisionals que aquells amb asma i hiperreactivitat de vies aèries augmenta el risc de MPOC.[6] Factors de naixement com un baix pes en néixer també pot jugar una rol així com un nombre de malalties contagioses incloent-hi el VIH i tuberculosi.[6] Les infeccions respiratòries com la pneumònia no semblen augmentar el risc de MPOC, com a mínim en adults.[22]
Signes i símptomes
[modifica]Els símptomes més comuns de MPOC són la producció d'esputs, dificultat per a respirar i una tos productiva.[23] Aquests símptomes es mostren presents per un prolongat període i típicament empitjorar amb el temps.[22][24] No s'han determinat tipus diferents de MPOC.[25] Si bé anteriorment estava dividit en emfisema i bronquitis crònica, l'emfisema és només una descripció de canvis en el pulmó més que una malaltia en si, i la bronquitis crònica és senzillament un descriptor de símptomes que poden o no pot ocórrer amb MPOC.[6]
Tos
[modifica]Una tos crònica és sovint el primer símptoma identificable. Quan existeix per més de tres mesos a l'any per més de dos anys, combinat amb la producció d'esputs i sense una altra explicació, hi ha per definició una bronquitis crònica. Aquesta condició pot ocórrer abans que es desenvolupi plenament el MPOC. La quantitat d'esputs produïts pot canviar en hores o dies. En alguns casos la tos pot no ser present o només ocórrer ocasionalment i pot no ser productiva. Algunes persones amb MPOC atribueixen els símptomes a la tos del fumador. Una tos intensa pot comportar fractures de costella o una pèrdua breu de consciència. Els afectats de MPOC sovint tenen una història de "refredats comuns" que dura un temps llarg.[23]
Dispnea o dificultat per a respirar
[modifica]La dificultat per a respirar és sovint el símptoma que afecta una majoria de persones.[26] És generalment descrit com: "la respiració em requereix esforç," "em sento sense alè," o "em falta l'aire".[27] Típicament la dificultat de respiració és pitjor en un esforç d'una duració prolongada i empitjora amb el temps.[23] En estadis avançats ocorre durant el repòs, si bé pot ser sempre present.[28][29] És una font d'ansietat i d'una pobre qualitat de vida per als que pateixen MPOC.[23] Moltes persones amb la malaltia més avançada, respira a través del nas, però expulsant l'aire per la boca, una acció que pot millorar la seva dificultat de respiració.[30][31]
Aquesta malaltia és la causa de la tendència al sedentarisme de les persones que la pateixen i, a la llarga, es produeix l'anomenada espiral de l'ofec: en tenir ofec no fan activitat, en no fer activitat es perd forma física i, per tant, l'ofec es presenta amb activitats cada cop més simples. Aquesta espiral de l'ofec s'arriba a manifestar en casos avançats quan es fan les activitats bàsiques de la vida diària: higiene personal, menjar, vestir-se.[7]
Altres característiques
[modifica]Amb MPOC, costa més expirar que inspirar.[32] L'opressió del pit pot ocórrer, però no és comú i pot ser causat per un altre problema.[23][26] Les persones amb el flux d'aire obstruït poden tenir sibilància o disminució dels sons amb l'entrada d'aire, quan s'examina el tòrax amb un estetoscopi.[32] Un tòrax de bóta és un signe característic de MPOC, però és poc comú.[32] La posició del trípode és habitual quan la malaltia empitjora.[22]
Una MPOC avançat comporta hipertensió pulmonar i una insuficiència cardíaca del ventricle dret del cor.[24][33] Aquesta situació és coneguda com a cor pulmonale, i provoca símptomes d'inflament de cames i hipertensió jugular.[23][24] MPOC és l'afecció de pulmó més comú en produir cor pulmonale,[34][33] una afecció que disminueix amb l'ús d'oxigen suplementari.[22]
La MPOC sovint va associada a un seguit d'altres afeccions amb les quals comparteix els mateixos factors de risc.[25] Entre elles destaquen la isquèmia cardíaca, pressió de sang alta, diabetis mellitus, desgast muscular, osteoporosi, càncer de pulmó, trastorn d'ansietat i depressió.[25] Les persones amb malaltia severa tenen sensació de cansament regularment.[23]
Agudització
[modifica]Una agudització de la malaltia pulmonar obstructiva crònica és un augment de la dificultat respiratòria, augmentar de la producció d'esput associat a un canvi en el seu color de clar a verd o groc, o un augment de la tos.[32][35] Pot presentar signes d'un esforç extra en respirar, com una respiració ràpida, una freqüència cardíaca ràpida, sudoració, ús actiu dels músculs respiratoris, un coloració blavosa de la pell, confusió o comportament agressiu.[32][35] També es poden sentir crepitants als pulmons en una auscultació amb un estetoscopi.[36]
Fisiopatologia
[modifica]
La MPOC és un tipus de malaltia pulmonar obstructiva crònica en què es combina un pobre flux d'aire (limitació del flux aeri) incompletament reversible i la incapacitat per expirar l'aire completament (atrapament aeri).[25] El flux d'aire pobre és el resultat del trencament de teixit pulmonar (conegut com a emfisema) i de petites malaltia que redueixen el flux (conegudes com a bronquitis obstructiva). Les contribucions relatives d'aquests dos factors varien entre persones.[6] La destrucció severa de les vies respiratòries petites pot conduir a la formació de grans bosses d'aire —conegudes com a bullofes— que reemplacen el teixit pulmonar. Aquesta forma de la malaltia es diu emfisema bulloso.[37]
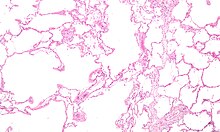
La MPOC es desenvolupa com una resposta inflamatòria significativa i crònica a irritants inhalats.[6] Infeccions bacterianes cròniques també poden afegir a aquest estat inflamatori.[38] Les cèl·lules inflamatòries implicades inclouen neutròfil granulòcits i macròfags, dos tipus de cèl·lula blanca. Els qui fumen, a més tenen la participació del limfòcit Tc1 implicació de limfòcit i algunes persones amb MPOC tenen implicació d'eosinòfils similar a la de l'asma.Part d'aquesta resposta de les cèl·lules és provocada per mediadors inflamatoris com ara el factors quimiotaxis. Altres processos implicats amb dany pulmonar inclouen l'estrès oxidatiu produït per altes concentracions de radicals lliures en el fum del tabac i alliberat per les cèl·lules inflamatòries, i la descomposició del teixit connectiu dels pulmons per proteases que no són prou inhibida per inhibidors de la proteasa de dins fum de tabac i alliberat per inflammatory cèl·lules, i desglossament del teixit connectiu dels pulmons per proteases que són insuficientment inhibides per inhibides. La destrucció del teixit connectiu dels pulmons és el que condueix a l'emfisema, que llavors contribueix a una pobra circulació d'aire i, finalment, la mala absorció i alliberament dels gasos respiratoris. El desgast muscular general que sovint passa amb la MPOC pot ser en part a causa de los mediadors inflamatoris alliberats pels pulmons a la sang.[6]
Diagnòstic
[modifica]Espirometria
[modifica]Mitjançant una espirometria, es pot classificar en:[39]
| Grau | Denominació | Definició |
|---|---|---|
| I | Lleu | FEV1/FVC < 70%; FEV1 ≥ 80% predit |
| II | Moderada | FEV1/FVC < 70%; 50% ≤ FEV1 < 80% predit |
| III | Severa | FEV1/FVC < 70%; 30% ≤ FEV1 < 50% predit |
| IV | Molt severa | FEV1/FVC < 70%; FEV1 < 30% predit o FEV1 < 50% predit més insuficiència respiratòria crònica (PaO₂ < 60 mmHg) |
Fenotips
[modifica]El 2012 apareix la Guia de tractament espanyola de la MPOC, que ve a completar l'anterior guia de diagnòstic i tractament,[40] classificant els pacients segons quatre "fenotips" clínics. Això comporta la realització d'anamnesi, espirometria i, sovint, de radiografia de tòrax i anàlisi.
Es parlarà d'aguditzadors quan presentin 2 o més crisis greus, en els últims 12 mesos, que han precisat antibiòtics i/o glucocorticoides sistèmics.
A. No aguditzador
[modifica]Amb emfisema o bronquitis crònica.
B. Mixt MPOC-asma
[modifica]Calen, almenys, 2 criteris majors o 1 de major amb 2 de menors, dels següents:
Criteris majors
- Prova broncodilatadora molt positiva (increment del FEV1 > 15% i de > 400 ml, respecte al valor basal)
- Eosinofília en esput
- Antecedents personals d'asma
Criteris menors
- Xifres elevades d'IgE total
- Antecedents personals d'atòpia
- Prova broncodilatadora positiva en almenys dues ocasions (increment del FEV1 > 12% i de > 200 ml, respecte al valor basal)
C. Aguditzador amb emfisema
[modifica]Quan presenta clínica i radiologia compatible amb emfisema.
D. Aguditzador amb bronquitis crònica
[modifica]Quan presenta tos i expectoració cròniques.
Valoració de la gravetat
[modifica]Es realitza a atenció primària de salut segons la següent taula:[40]
| 0 | 1 | 2 | 3 | ||
|---|---|---|---|---|---|
| B | IMC | > 21 | ≤21 | ||
| O | FEV1 (%) | ≥ 65 | 50-64 | 36-49 | ≤35 |
| D | Dispnea (mMRC) | 0-1 | 2 | 3 | 4 |
| Ex | Exacerbacions greus | 0 | 1-2 | ≥3 |
El resultat de la gravetat és:
- Lleu: 0-2 punts.
- Moderat: 3-4 punts.
- Greu o molt greu (necessita valoració BODE, en atenció especialitzada): més de 4 punts.
Tractament
[modifica]Mesures generals
[modifica]S'aconsella:,[41] en tots els graus:
- Consell antitabàquic, si és fumador
- Educació sanitària
- Vacunació antigripal i antipneumocòccica
Fàrmacs utilitzats
[modifica]Els noms comercials dels fàrmacs que segueixen a continuació corresponen al mercat espanyol:[42]
- Agonistes β-2
-
- de curta durada, coneguts com a SABA (short-acting β adrenoceptor agonists)
- Salbutamol (EFG, Ventolin)
- Terbutalina (Terbasmin)
- de llarga durada, coneguts com a LABA (long-acting β adrenoceptor agonists)
- Salmeterol (Beglan, Betamican, Inaspir, Serevent)
- Formoterol (EFG, Foradil, Oxis)
- Indacaterol (Hirobriz, Onbrez, Oslif)
- Anticolinèrgics
-
- de curta durada, conegut com a SAMA (short-acting muscarinic antagonist)
- Bromur d'ipratropi (EFG, Atrovent)
- de llarga durada, coneguts com a LAMA (long-acting muscarinic antagonist)
- Glucocorticoides inhalats
- Beclometasona (Becloasma, Becloforte, Becotide)
- Budesonida (EFG, Pulmicort turbuhaler)
- Fluticasona (Avamys, Flixotide accuhaler, Flusonal accuhaler, Inalacor accuhaler, Trialona accuhaler).
- Glucocorticoides associats amb broncodilatadors de llarga durada
- Beclometasona + formoterol (Formodual, Foster).
- Budesonida + formoterol (Rilast turbuhaler, Symbicort turbuhaler).
- Fluticasona + salmeterol (Anasma, Brisair accuhaler, Inhaladuo accuhaler, Plusvent accuhaler, Seretide accuhaler).
- Glucocorticoides sistèmics
- Inhibidors de la fosfodiesterasa 4, coneguts, a vegades com a IPE4
- Roflumilast (Daxas, Libertek)
- Oxigenoteràpia domiciliària a llarg termini
- Si existeix insuficiència respiratòria.
Tractament esgraonat
[modifica]El tractament dependrà del fenotip i de l'estadi de gravetat:[40]
| Lleu | Moderat | Greu | Molt greu | |
|---|---|---|---|---|
| A. No aguditzador | LAMA o LABA SABA o SAMA* |
LAMA o LABA LAMA + LABA |
LAMA + LABA | LAMA + LABA + teofil·lina |
| B. Mixt MPOC-asma | LABA + CI | LABA + CI | LAMA + LABA + CI | LAMA + LABA + CI (valorar afegir teofilina o IPE4 si expectoració i aguditzacions) |
| C. Aguditzador amb emfisema | LAMA o LABA | (LABA o LAMA) + CI LAMA + LABA LAMA o LABA |
LAMA + LABA + CI | LAMA + LABA + CI (valorar afegir teofil·lina) |
| D. Aguditzador amb bronquitis crònica | LAMA o LABA | (LAMA o LABA) + (CI o IPE4) LAMA + LABA LAMA o LABA |
LAMA + LABA + (CI o IPE4) (LAMA o LABA) + CI + IPE4 (valorar afegir carbocisteïna) |
LAMA + LABA + (CI o IPE4) LAMA + LABA + CI + IPE4 (valorar afegir carbocisteïna) (valorar afegir teofil·lina) (valorar afegir antibiótics) |
Abreviatures: SABA: beta-2 agonista de curta durada; SAMA: anticolinèrgic de curta durada; CI: corticoesteroide inhalat; LAMA: anticolinèrgic de llarga durada; LABA: beta-2 agonista de llarga durada; IPE4: inhibidor de la fosfodiesterasa 4.
Exacerbacions agudes
[modifica]En aquests casos se solen utilitzar els criteris i classificació d'Anthonisen per determinar la conveniència d'administrar antibiòtics.
Referències
[modifica]- ↑ U.S. National Heart Lung and Blood Institute - What is COPD
- ↑ Nathell, L.; Nathell, M.; Malmberg, P.; Larsson, K. «COPD diagnosis related to different guidelines and spirometry techniques». Respiratory research, 8, 1, 2007, pàg. 89. DOI: 10.1186/1465-9921-8-89. PMC: 2217523. PMID: 18053200.
- ↑ 3,0 3,1 Rabe KF, Hurd S, Anzueto A, et al. «Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease: GOLD Executive Summary». Am. J. Respir. Crit. Care Med., 176, 6, 2007, pàg. 532–55.
- ↑ Mathers CD, Loncar D «Projections of Global Mortality and Burden of Disease from 2002 to 2030». PLoS Med., 3, 11, novembre 2006, pàg. e442. DOI: 10.1371/journal.pmed.0030442. PMC: 1664601. PMID: 17132052.
- ↑ World Health Organization. WHO Report on the Global Tobacco Epidemic 2008: The MPOWER Package. Geneva: World Health Organization, 2008, p. 268–309. ISBN 92-4-159628-7.
- ↑ 6,00 6,01 6,02 6,03 6,04 6,05 6,06 6,07 6,08 6,09 6,10 6,11 6,12 6,13 6,14 6,15 6,16 6,17 Vestbo, Jørgen. «Definition and Overview». A: Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease, 2013, p. 1–7.
- ↑ 7,0 7,1 «La Salut de la A a la Z.». Web. Generalitat de Catalunya, 2013. [Consulta: maig 2013].
- ↑ 8,0 8,1 Ward, Helen. Oxford Handbook of Epidemiology for Clinicians. Oxford University Press, 2012, p. 289–290. ISBN 978-0-19-165478-7.
- ↑ Laniado-Laborín, R «Smoking and chronic obstructive pulmonary disease (COPD). Parallel epidemics of the 21st century». International journal of environmental research and public health, 6, 1, 1-2009, pàg. 209–24. DOI: 10.3390/ijerph6010209. PMC: 2672326. PMID: 19440278.
- ↑ 10,0 10,1 Rennard, Stephen. Clinical management of chronic obstructive pulmonary disease. 2ª edició. Nova York: Informa Healthcare, 2013, p. 23. ISBN 978-0-8493-7588-0.
- ↑ 11,0 11,1 Anita Sharma ; with a contribution by David Pitchforth ; forewords by Gail Richards; Barclay, Joyce. COPD in primary care. Oxford: Radcliffe Pub., 2010, p. 9. ISBN 978-1-84619-316-3.
- ↑ Goldman, Lee. Goldman's Cecil medicine. 24th. Philadelphia: Elsevier/Saunders, 2012, p. 537. ISBN 978-1-4377-1604-7.
- ↑ 13,0 13,1 Kennedy SM, Chambers R, Du W, Dimich-Ward H «Environmental and occupational exposures: do they affect chronic obstructive pulmonary disease differently in women and men?». Proceedings of the American Thoracic Society, 4, 8, 12-2007, pàg. 692–4. DOI: 10.1513/pats.200707-094SD. PMID: 18073405.
- ↑ 14,0 14,1 14,2 14,3 14,4 Pirozzi C, Scholand MB «Smoking cessation and environmental hygiene». Med. Clin. North Am., 96, 4, 7-2012, pàg. 849–67. DOI: 10.1016/j.mcna.2012.04.014. PMID: 22793948.
- ↑ Halbert RJ, Natoli JL, Gano A, Badamgarav E, Buist AS, Mannino DM «Global burden of COPD: systematic review and meta-analysis». Eur. Respir. J., 28, 3, 9-2006, pàg. 523–32. DOI: 10.1183/09031936.06.00124605. PMID: 16611654.
- ↑ 16,0 16,1 Devereux, Graham «Definition, epidemiology and risk factors». BMJ, 332, 7550, 2006, pàg. 1142–4. DOI: 10.1136/bmj.332.7550.1142. PMC: 1459603. PMID: 16690673.
- ↑ Laine, Christine. In the Clinic: Practical Information about Common Health Problems. ACP Press, 2009, p. 226. ISBN 978-1-934465-64-6.
- ↑ 18,0 18,1 «Relationship between cigarette smoking and occupational exposures». A: Asthma and COPD: Basic Mechanisms and Clinical Management. Amsterdam: Academic, 2009, p. 464. ISBN 978-0-12-374001-4.
- ↑ Rushton, Lesley «Chronic Obstructive Pulmonary Disease and Occupational Exposure to Silica». Reviews on Environmental Health, 22, 4, 2007, pàg. 255–72. DOI: 10.1515/REVEH.2007.22.4.255. PMID: 18351226.
- ↑ 20,0 20,1 20,2 20,3 Foreman MG, Campos M, Celedón JC «Genes and chronic obstructive pulmonary disease». Med. Clin. North Am., 96, 4, 7-2012, pàg. 699–711. DOI: 10.1016/j.mcna.2012.02.006. PMC: 3399759. PMID: 22793939.
- ↑ Brode SK, Ling SC, Chapman KR «Alpha-1 antitrypsin deficiency: a commonly overlooked cause of lung disease». CMAJ, 184, 12, 9-2012, pàg. 1365–71. DOI: 10.1503/cmaj.111749. PMC: 3447047. PMID: 22761482.
- ↑ 22,0 22,1 22,2 22,3 22,4 Reilly, John J.; Silverman, Edwin K.; Shapiro, Steven D. «Chronic Obstructive Pulmonary Disease». A: Harrison's Principles of Internal Medicine. 18th. McGraw Hill, 2011, p. 2151–9. ISBN 978-0-07-174889-6.
- ↑ 23,0 23,1 23,2 23,3 23,4 23,5 23,6 Vestbo, Jørgen. «Diagnosis and Assessment». A: Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease, 2013, p. 9–17.
- ↑ 24,0 24,1 24,2 Rabe KF, Hurd S, Anzueto A, Barnes PJ, Buist SA, Calverley P, Fukuchi Y, Jenkins C, Rodriguez-Roisin R, van Weel C, Zielinski J «Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary». Am. J. Respir. Crit. Care Med., 176, 6, 9-2007, pàg. 532–55. DOI: 10.1164/rccm.200703-456SO. PMID: 17507545.
- ↑ 25,0 25,1 25,2 25,3 Decramer M, Janssens W, Miravitlles M «Chronic obstructive pulmonary disease». Lancet, 379, 9823, 4-2012, pàg. 1341–51. DOI: 10.1016/S0140-6736(11)60968-9. PMID: 22314182.
- ↑ 26,0 26,1 National Institute for Health and Clinical Excellence.
- ↑ Mahler DA «Mechanisms and measurement of dyspnea in chronic obstructive pulmonary disease». Proceedings of the American Thoracic Society, 3, 3, 2006, pàg. 234–8. DOI: 10.1513/pats.200509-103SF. PMID: 16636091.
- ↑ "What Are the Signs and Symptoms of COPD?"
- ↑ MedlinePlus Encyclopedia Chronic obstructive pulmonary disease
- ↑ Morrison, [edited by] Nathan E. Goldstein, R. Sean. Evidence-based practice of palliative medicine. Philadelphia: Elsevier/Saunders, 2013, p. 124. ISBN 978-1-4377-3796-7.
- ↑ Holland AE, Hill CJ, Jones AY, McDonald CF «Breathing exercises for chronic obstructive pulmonary disease». Cochrane Database Syst Rev, 10, 2012, pàg. CD008250. DOI: 10.1002/14651858.CD008250.pub2. PMID: 23076942.
- ↑ 32,0 32,1 32,2 32,3 32,4 Gruber, Phillip «The Acute Presentation of Chronic Obstructive Pulmonary Disease In the Emergency Department: A Challenging Oxymoron». Emergency Medicine Practice, 10, 11, 11-2008.
- ↑ 33,0 33,1 «Cor pulmonale». A: Professional guide to diseases. 9th. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins, 2009, p. 120–2. ISBN 978-0-7817-7899-2.
- ↑ Weitzenblum E, Chaouat A «Cor pulmonale». Chron Respir Dis, 6, 3, 2009, pàg. 177–85. DOI: 10.1177/1479972309104664. PMID: 19643833.
- ↑ 35,0 35,1 Brulotte CA, Lang ES «Acute exacerbations of chronic obstructive pulmonary disease in the emergency department». Emerg. Med. Clin. North Am., 30, 2, 5-2012, pàg. 223–47, vii. DOI: 10.1016/j.emc.2011.10.005. PMID: 22487106.
- ↑ Spiro, Stephen. Clinical respiratory medicine expert consult. 4th. Philadelphia, PA: Saunders, 2012. ISBN 978-1-4557-2329-4.
- ↑ Murphy DMF, Fishman AP. «Chapter 53». A: Fishman's Pulmonary Diseases and Disorders. 4th. McGraw-Hill, 2008, p. 913. ISBN 0-07-145739-9.
- ↑ Beasley, V; Joshi, PV; Singanayagam, A; Molyneaux, PL; Johnston, SL «Lung microbiology and exacerbations in COPD». International journal of chronic obstructive pulmonary disease, 7, 2012, pàg. 555–69. DOI: 10.2147/COPD.S28286. PMC: 3437812. PMID: 22969296.
- ↑ «Global strategy for the diagnois, management, and prevention of chronic obstructive pulmonary disease». Global Initiative for Chronic Obstructive Lung Disease, Inc, 2010. Arxivat de l'original el 2015-09-24. [Consulta: 6 desembre 2011].
- ↑ 40,0 40,1 40,2 «Guía de Práctica Clínica para el Diagnóstico y Tratamiento de Pacientes con Enfermedad Pulmonar Obstructiva Crónica (EPOC) - Guía Española de la EPOC (GesEPOC)». Arch Bronconeumol, 48(Supl 1), 2012, pàg. 2-58.
- ↑ Carme Anguera i cols. «Malaltia pulmonar obstructiva crònica». Guies de pràctica clínica. Institut Català de la Salut, 2010.
- ↑ AEMPS. 2011. «sinaem4.agemed.es». Arxivat de l'original el 2007-07-21. [Consulta: 12 desembre 2011].
Enllaços externs
[modifica]- «Malaltia pulmonar obstructiva crònica (MPOC)». Canal Salut. Generalitat de Catalunya.



