Diòxid de silici
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 59,967 Da, 60,0843 g/mol i 60,038 g/mol |
| Trobat en el tàxon | |
| Estructura química | |
| Fórmula química | SiO₂ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Solubilitat | 0,12 g/L (aigua, valor desconegut) 0,9 g/L (aigua destil·lada, 200 °C) |
| Punt de fusió | 1.710 °C |
| Punt d'ebullició | 2.230 °C (a 760 Torr) |
| Pressió de vapor | 0 mmHg (a 20 °C) |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
| Altres | |
| Higroscopicitat | |
El compost químic conegut com a diòxid de silici o sílice és l'òxid de silici, amb fórmula química SiO₂, que es troba més freqüentment a la natura com el quars i en diversos organismes vius.[1][2] En moltes parts del món, la sílice és el principal constituent de la sorra. La sílice és una de les famílies de materials més complexes i abundants, existent com a compost de diversos minerals i com a producte sintètic. Alguns exemples notables inclouen el quars fos, la sílice fumada, el gel de sílice, l'òpal i els aerogels. S'utilitza en materials estructurals, microelectrònica (com a aïllant elèctric) i com a components a les indústries alimentàries i farmacèutiques.
Es pot trobar a la natura en múltiples formes: quars, arena, cristobalita, òpal, sílex…
És el principal constituent de la sorra, principalment en forma de quars, ja que la gran duresa d'aquest el protegeix de l'erosió. Tot i això la composició de la sorra, varia en funció de la geologia i les condicions locals.
La inhalació de diòxid de silici cristal·li en la pols, pot provocar la silicosi, malaltia que afecta especialment els miners.
El diòxid de silici cristal·litzat és un material molt dur. S'empra per produir ones radioelèctriques d'una freqüència molt precisa, la qual cosa és molt útil per fabricar rellotges, aparells de ràdio, ordinadors, i qualsevol equip electrònic on cal una freqüència radioelèctrica molt precisa.
Estructura[modifica]
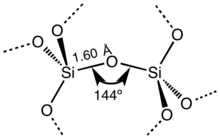
A la majoria dels silicats, l'àtom de silici mostra una coordinació tetraèdrica, amb quatre àtoms d'oxigen que envolten un àtom central de Si (vegeu Cèl·lula unitat 3-D). Així, SiO ₂ forma sòlids de xarxa tridimensionals en els quals cada àtom de silici està enllaçat covalentment de manera tetraèdrica a 4 àtoms d'oxigen. En canvi, el CO ₂ és una molècula lineal. Les estructures molt diferents dels diòxids de carboni i silici són una manifestació de la regla del doble enllaç.
SiO ₂ té diverses formes cristal·lines diferents, però gairebé sempre tenen la mateixa estructura local al voltant de Si i O. En el quars α, la longitud de l'enllaç Si–O és de 161 pm, mentre que en l'α-tridimita es troba entre 154 i 171 pm.. L' angle Si–O–Si també varia entre un valor baix de 140° en α-tridimita, fins a 180° en β-tridimita. En el quars α, l'angle Si–O–Si és de 144°.[3]
Polimorfisme[modifica]

El quars alfa és la forma més estable de SiO ₂ sòlid a temperatura ambient. Els minerals d'alta temperatura, cristobalita i tridimita, tenen densitats i índexs de refracció més baixos que el quars. La transformació de quars α a quars beta té lloc bruscament a 573 °C. Com que la transformació va acompanyada d'un canvi important de volum, pot induir fàcilment la fractura de ceràmiques o roques que passen per aquest límit de temperatura.[4] Els minerals d'alta pressió, la seifertita, l'estishovita i la coesita, però, tenen densitats i índexs de refracció més alts que el quars.[5] La estixovita té una estructura semblant al rutil on el silici té 6 coordenades. La densitat de l'estistovita és de 4,287 g/cm 3, que es compara amb l'α-quars, la més densa de les formes de baixa pressió, que té una densitat de 2,648 g/cm 3 .[6] La diferència de densitat es pot atribuir a l'augment de la coordinació, ja que les sis longituds d'enllaç Si–O més curtes de la stishovita (quatre longituds d'enllaç Si–O de 176 pm i altres dues de 181 pm) són més grans que la longitud de l'enllaç Si–O (161 pm) en quars α.[7] El canvi en la coordinació augmenta la ionitat de l'enllaç Si-O.[8] Més important encara, qualsevol desviació d'aquests paràmetres estàndard constitueix diferències o variacions microestructurals, que representen una aproximació a un sòlid amorf, vitri o vidre.
La sílice de faujasita, un altre polimorf, s'obté per desaluminació d'una zeolita Y ultraestable i baixa en sodi amb tractament àcid i tèrmic combinat. El producte resultant conté més del 99% de sílice, i té una gran cristal·linitat i una superfície específica (més de 800 m 2 /g). Faujasite-sílice té una estabilitat tèrmica i àcida molt alta. Per exemple, manté un alt grau d'ordre molecular a llarg abast o de cristalinitat fins i tot després d'ebullició en àcid clorhídric concentrat.[9]
Sílice fosa[modifica]

Relació entre l'índex de refracció i la densitat d'algunes formes de SiO ₂
La sílice fosa presenta diverses característiques físiques peculiars que són similars a les observades a l'aigua líquida: expansió de temperatura negativa, densitat màxima a temperatures ~ 5000 °C, i una capacitat calorífica mínima.[11] La seva densitat disminueix a partir de 2,08 g/cm 3 a 1950 °C a 2,03 g/cm 3 a 2200 °C.[12]
Sílice molecular[modifica]
El SiO ₂ molecular té una estructura lineal com el CO2 . S'ha produït combinant monòxid de silici (SiO) amb oxigen en una matriu d'argó. El diòxid de silici dimèric, (SiO ₂) ₂ s'ha obtingut fent reaccionar O ₂ amb monòxid de silici dimèric aïllat en matriu, (Si ₂ O ₂). En el diòxid de silici dimèric hi ha dos àtoms d'oxigen que s'uneixen entre els àtoms de silici amb un angle Si–O–Si de 94 ° i una longitud d'enllaç de 164,6 pm i la longitud terminal de l'enllaç Si–O és de 150,2 pm. La longitud de l'enllaç Si–O és de 148,3 pm, que es compara amb la durada de 161 pm en quars α. L'energia d'enllaç s'estima en 621,7 kJ/mol.[13]
Química[modifica]
El diòxid de silici es pot formar en escalfar silici a temperatures extremadament altes en presència d'oxigen (o aire). Ocasionalment, pot ocórrer de manera natural en incendis, o al caure un llamp sobre sorra.
El diòxid de silici es pot atacar amb àcids forts, particularment el fluorur d'hidrogen (HF). Precisament s'utilitza aquest àcid per eliminar o marcar el diòxid de silici en la indústria dels semiconductors.
-
Feix de fibres òptiques fetes de sílice d'alta puresa.
-
Bateria AGM 100 ampere-hora feta amb malla de sílice
-
Malla de fibra de sílice per a aïllament tèrmic.
-
Sorra de Quars (Sílice) com a material base per la producció de vidre.
Formes cristal·lines[modifica]
SiO ₂, més que gairebé qualsevol material, existeix en moltes formes cristal·lines. Aquestes formes s'anomenen polimorfs
| Simetria cristal·lina
Símbol de Pearson, grup núm. |
ρ
g/cm 3 |
Notes |
|---|---|---|
| romboèdric (trigonal)
</br> hP9, P3 1 21 núm.152 [14] |
2.648 | Cadenes helicoïdals que fan òpticament actius els cristalls individuals; El quars α es converteix en quars β a 846 K |
| hexagonal</br> hP18, P6 ₂ 22, núm. 180 [15] | 2.533 | Estretament relacionat amb l'α-quars (amb un angle Si-O-Si de 155°) i òpticament actiu; El β-quars es converteix en β-tridimita a 1140 K |
| ortorròmbic</br> oS24, C222 1, núm.20 [16] | 2.265 | Forma metaestable sota pressió normal |
| hexagonal
</br> hP12, P6 ₃ /mmc, núm. 194 [16] |
Estretament relacionat amb l'α-tridimita; La β-tridimita es converteix en β-cristobalita a 2010 K | |
| tetragonal</br> tP12, P4 1 2 1 2, núm. 92 [17] | 2.334 | Forma metaestable sota pressió normal |
| cúbic</br> cF104, Fd 3 m, núm.227 [18] | Estretament relacionat amb l'α-cristobalita; es fon a 1978 K | |
| tetragonal
</br> tP36, P4 1 2 1 2, núm. 92 [19] |
3.011 | anells Si 5 O 10, Si 4 O 8, Si 8 O 16 ; sintetitzat a partir de sílice vidre i àlcali a 600–900 K i 40–400 MPa |
| monoclínica</br> mS46, C2/c, núm.15 [20] | Anells Si 4 O 8 i Si 6 O ₁₂ | |
| monoclínica
</br> mS48, C2/c, núm.15 [21] |
2.911 | anells Si 4 O 8 i Si 8 O 16 ; 900 K i 3–3,5 GPa |
| tetragonal
</br> tP6, P4 ₂ /mnm, núm.136 [22] |
4.287 | Un dels polimorfs de sílice més densos (juntament amb la seifertita); semblant al rutil amb Si coordinat de 6 vegades; 7,5–8,5 GPa |
| ortorròmbic
</br> oP, Pbcn [23] |
4.294 | Un dels polimorfs de sílice més densos (juntament amb l'estishovita); es produeix a pressions superiors a 40 GPa.[24] |
| cúbic (cP*, P4 ₂ 32, núm.208) [25] o tetragonal (P4 ₂ /nbc) [26] | 2.04 | anells Si 5 O 10, Si 6 O ₁₂ ; mineral que sempre es troba amb hidrocarburs en espais intersticials: un clatrasil (clatrat de sílice) [27] |
| ortorròmbic
</br> oI12, Ibam, No.72 [28] |
1,97 | Igual que SiS ₂ que consisteix en cadenes de compartir vores, es fon a ~ 1700 K |
| hexagonal | Estructura de bicapa en forma de làmina |
Referències[modifica]
- ↑ The Chemistry of Silica. Nova York: Wiley, 1979. ISBN 9780471024040.
- ↑ European Journal of Protistology, 51, 5, 2015, pàg. 409–24. DOI: 10.1016/j.ejop.2015.07.001. PMID: 26340665.
- ↑ Plantilla:Holleman&Wiberg
- ↑ Ceramic Technology for Potters and Sculptors. Philadelphia: University of Pennsylvania, 1996, p. 93–95. ISBN 9780812213775.
- ↑ «Mystical Crystals of Silica». A: Silica Stories. Cham: Springer, 2017, p. 50–55. DOI 10.1007/978-3-319-54054-2_4. ISBN 9783319540542.
- ↑ Plantilla:Greenwood&Earnshaw1st
- ↑ Structural Inorganic Chemistry. Oxford Science Publications, 1984. ISBN 9780198553700.
- ↑ Acta Crystallogr. A, 57, 6, 2001, pàg. 663–77. DOI: 10.1107/S0108767301010698. PMID: 11679696 [Consulta: free].
- ↑ J. Catal., 54, 2, 1978, pàg. 285. DOI: 10.1016/0021-9517(78)90051-9.
- ↑ Am. Mineral., 48, 1963, pàg. 854–867.
- ↑ «Còpia arxivada». Phys. Rev. E, 66, 1, 2002, pàg. 011202. Arxivat de l'original el 2016-06-04. arXiv: cond-mat/0203383. Bibcode: 2002PhRvE..66a1202S. DOI: 10.1103/PhysRevE.66.011202. PMID: 12241346 [Consulta: 7 juliol 2009].
- ↑ J. Am. Ceram. Soc., 62, 7–8, 1979, pàg. 332–336. DOI: 10.1111/j.1151-2916.1979.tb19071.x.
- ↑ Silicon chemistry: from the atom to extended systems. Wiley-VCH, 2003. ISBN 9783527306473.
- ↑ Lager G. A.; Jorgensen J. D.; Rotella F.J. Journal of Applied Physics, 53, 10, 1982, pàg. 6751–6756. Bibcode: 1982JAP....53.6751L. DOI: 10.1063/1.330062.
- ↑ Wright, A. F.; Lehmann, M. S. Journal of Solid State Chemistry, 36, 3, 1981, pàg. 371–80. Bibcode: 1981JSSCh..36..371W. DOI: 10.1016/0022-4596(81)90449-7.
- ↑ 16,0 16,1 Kihara, Kuniaki; Matsumoto, Takeo; Imamura, Moritaka Zeitschrift für Kristallographie, 177, 1–2, 1986, pàg. 27–38. Bibcode: 1986ZK....177...27K. DOI: 10.1524/zkri.1986.177.1-2.27.
- ↑ Downs R. T.; Palmer D. C. American Mineralogist, 79, 1994, pàg. 9–14.
- ↑ Wright, A. F.; Leadbetter, A. J. Philosophical Magazine, 31, 6, 1975, pàg. 1391–401. Bibcode: 1975PMag...31.1391W. DOI: 10.1080/00318087508228690.
- ↑ Shropshire, Joseph; Keat, Paul P.; Vaughan, Philip A. Zeitschrift für Kristallographie, 112, 1–6, 1959, pàg. 409–13. Bibcode: 1959ZK....112..409S. DOI: 10.1524/zkri.1959.112.1-6.409.
- ↑ Miehe, Gerhard; Graetsch, Heribert European Journal of Mineralogy, 4, 4, 1992, pàg. 693–706. Bibcode: 1992EJMin...4..693M. DOI: 10.1127/ejm/4/4/0693.
- ↑ Levien L.; Prewitt C. T. American Mineralogist, 66, 1981, pàg. 324–333.
- ↑ Smyth J. R.; Swope R. J.; Pawley A. R. American Mineralogist, 80, 5–6, 1995, pàg. 454–456. Bibcode: 1995AmMin..80..454S. DOI: 10.2138/am-1995-5-605.
- ↑ Dera P.; Prewitt C. T.; Boctor N. Z.; Hemley R. J. American Mineralogist, 87, 7, 2002, pàg. 1018. Bibcode: 2002AmMin..87.1018D. DOI: 10.2138/am-2002-0728.
- ↑ Seifertite.
- ↑ Am. Mineral., 48, 1963, pàg. 854–867.
- ↑ Nakagawa T.; Kihara K.; Harada K. American Mineralogist, 86, 11–12, 2001, pàg. 1506. Bibcode: 2001AmMin..86.1506N. DOI: 10.2138/am-2001-11-1219.
- ↑ Rosemarie Szostak. Molecular sieves: Principles of Synthesis and Identification. Springer, 1998. ISBN 978-0-7514-0480-7.
- ↑ Weiss, Alarich; Weiss, Armin Zeitschrift für Anorganische und Allgemeine Chemie, 276, 1–2, 1954, pàg. 95–112. DOI: 10.1002/zaac.19542760110.
Bibliografia[modifica]
- Tridymite, International Chemical Safety Card 0807
- Quartz, International Chemical Safety Card 0808
- Cristobalite, International Chemical Safety Card 0809
- amorphous, NIOSH Pocket Guide to Chemical Hazards
- crystalline, as respirable dust, NIOSH Pocket Guide to Chemical Hazards
- Formation of silicon oxide layers in the semiconductor industry. LPCVD and PECVD method in comparison. Stress prevention.
- Epidemiological evidence on the carcinogenicity of silica: factors in scientific judgement by C. Soutar and others. Institute of Occupational Medicine Research Report TM/97/09
- Scientific opinion on the health effects of airborne silica by A Pilkington and others. Institute of Occupational Medicine Research Report TM/95/08
- The toxic effects of silica Arxivat 2016-04-15 a Wayback Machine. by A Seaton and others. Institute of Occupational Medicine Research Report TM/87/13
- Structure of precipitated silica Arxivat 2015-07-15 a Wayback Machine.
Enllaços externs[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Diòxid de silici |




