Òxid de magnesi
 | |
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 39,979956 Da |
| Epònim | Ancient Magnesia (en) |
| Rol | antiàcid |
| Estructura química | |
| Fórmula química | MgO |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Densitat | 3,58 g/cm³ (a 20 °C) |
| Solubilitat | 0,009 g/100 g (aigua, 30 °C) |
| Punt de fusió | 2.800 °C 2.826 °C |
| Punt d'ebullició | 3.600 °C (a 760 Torr) |
| Entropia molar estàndard | 26,9 J/(mol K) |
| Entalpia estàndard de formació | −601,8 kJ/mol |
| Pressió de vapor | 0 mmHg (a 20 °C) |
| Perill | |
| Límit d'exposició mitjana ponderada en el temps | 15 mg/m³ (8 h, Estats Units d'Amèrica) |
| IDLH | 750 mg/m³ |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
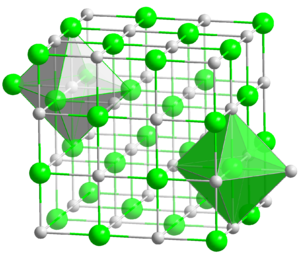
L'òxid de magnesi, MgO, també anomenat magnèsia, és un compost inorgànic iònic format per cations magnesi, Mg2+, i anions òxid, O2–. Es presenta en forma de cristalls blancs. La seva estructura cristal·lina és cúbica, tipus clorur de sodi. És un compost higroscòpic que, en absorbir aigua, es transforma suaument en el seu hidròxid. També absorbeix diòxid de carboni, CO₂, transformant-se en carbonat de magnesi, MgCO₃. A la naturalesa es troba en el mineral periclassa.
L'obtenció es pot fer:
- Per reacció de calcinació del magnesi metall, Mg, amb oxigen, O₂:
- Mg(s) + O2(g) → MgO(s)
- També per calcinació de l'hidròxid de magnesi o de les oxisals del magnesi:
- Mg(OH)2(s) → MgO(s) + H₂O(g)
- MgCO3(s) → MgO(s) + CO2(g)
Reaccions químiques[modifica]
Amb l'aigua reacciona produint l'hidròxid de magnesi. És una reacció reversible que s'inverteix aplicant calor:
- MgO + H₂O → Mg(OH)₂
Amb àcids reacciona fàcilment donant les corresponents sals i aigua:
- MgO + 2 HCl → MgCl₂ + H₂O
Aplicacions[modifica]
- S'utilitza com a aïllant en la fabricació de cables industrials.
- S'empra com a material refractari en la fabricació de maons.
- En la construcció s'empra com a principal ingredient dels materials emprats en la protecció contra els incendis.
- És utilitzat com a referència del color blanc en colorimetria.
- S'empra en la transformació de l'energia elèctrica en calor per efecte Joule.
- L'òxid de magnesi també s'empra com a material òptic, ja que és transparent des de 300 nm fins a 7 µm. El seu índex de refracció és 1,72 a 1 µm.
Bibliografia[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Òxid de magnesi |
- LIDE D.R. (Ed.) Handbook of Chemistry and Physics. CRC Press. 77th Ed. (1996-1997) New York
