Telofase: diferència entre les revisions
mCap resum de modificació |
m #QQ19 |
||
| Línia 1: | Línia 1: | ||
{{AP|Meiosi|Mitosi}} |
|||
{{inacabat|jaumellecha}} |
|||
[[Fitxer:Mitotic_Telophase.svg|thumb|miniatura|Anafase de la mitosi cel·lular]] |
|||
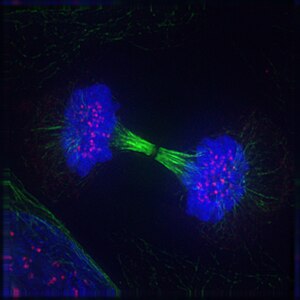
La '''telofase''' (també coneguda com a '''telefase'''), del [[grec antic]] τελος (extrem) i φασις (fase), és una etapa tant de la [[meiosi]] com de la [[mitosi]] a les [[cèl·lules]] [[eucariotes]]. Durant la telofase s'inverteixen els efectes dels esdeveniments de la [[profase]] i la [[prometafase]]. Es formen dos [[nucli cel·lular|nuclis]] fills dins la cèl·lula. Els embolcalls nuclears de les cèl·lules filles es formen a partir dels fragments de l'embolcall nuclear de la cèl·lula mare. A mesura que es forma l'embolcall nuclear al voltant de cada parell de [[cromàtide]]s, reapareixen els [[nuclèol]]s. La telofase representa aproximadament un 2% de la durada del [[cicle cel·lular]]. |
|||
'''Telofase''' (del [[Grec antic|grec]]; τέλος ''(télos)'', «final» + φάσις ''(fàsis)'', «etapa») és l'estadi final tant en la [[meiosi]] com en la [[mitosi]], després del procès de l'[[anafase]], d'una [[cèl·lula eucariota]]. |
|||
| ⚫ | |||
La [[citocinesi]] se sol produir al mateix temps que es reforma l'[[embolcall nuclear]], però són processos diferents. En [[cèl·lula animal|cèl·lules animals]] es desenvolupa un [[solc de segmentació]] on abans hi havia la placa [[metafase|metafàsica]], separant els dos nuclis. |
|||
Durant la telofase, es reverteixen els efectes de la [[profase]] i de la [[prometafase]] (quan es desintegren el [[Nucli cel·lular|nucli]] i la [[membrana nuclear]]). A mesura que els [[Cromosoma|cromosomes]] arriben als pols de les [[Cèl·lula|cèl·lules]], es crea una [[membrana nuclear]] al voltant de cada conjunt de [[Cromàtide|cromàtides]], els [[Nuclèol|nuclèols]] tornen a aparèixer, i els cromosomes comencen a decondensar de nou la [[cromatina]] que es troba present durant la [[interfase]]. Es desfà el [[fus acromàtic]] i es [[Polimerització|despolimeritzen]] els eixos dels [[Microtúbul|microtúbuls]]. |
|||
En les cèl·lules [[vegetals]], unes vesícules derivades de l'[[aparell de Golgi]] es mouen vers el centre de la cèl·lula al llarg d'una bastida de [[microtúbul]]s anomenat [[fragmoplast]]. Aquesta estructura dirigeix paquets de materials de la [[paret cel·lular]] que es fusionen en una estructura en forma de disc anomenada [[placa cel·lular]]. La placa cel·lular creix centrífugament i acaba desenvolupant-se en una paret cel·lular autèntica, separant ambdós nuclis. |
|||
La [[citoquinesi]] comença abans de la telofase tardana i, quan es completa, segrega els dos [[Nucli cel·lular|nuclis]] fills entre un parell de [[Cèl·lula|cèl·lules]] filles separades.{{sfn|Reece|Urry|Cain|Wasserman|2011}} |
|||
Cada cèl·lula filla té una còpia completa del [[genoma]] de la cèl·lula mare, i la mitosi és completa. |
|||
La telofase es basa principalment en la [[Desfosforilació|defosforilació]] de substrats de [[cinasa dependent de ciclina]] (Cdk).{{sfn|Morgan|2007|p=154-155}} |
|||
La telofase representa aproximadament el 2% de la durada del [[cicle cel·lular]]. Un cop finalitzada la telofase, la [[mitosi]] és completa i la cèl·lula passa a l'estadi d'[[interfase]] |
|||
== La desfosforilació de substrats de Cdk == |
|||
La [[fosforilació]] de les dianes de [[Proteïna|proteïnes]] de la M-Cdk ([[cinasa dependent de ciclina]] de la [[mitosi]]) produeix la creació del [[fus acromàtic]], la condensació dels [[Cromosoma|cromosomes]] i la descomposició de la [[membrana nuclear]] al principi de la [[mitosi]]. La [[desfosforilació]] d'aquests mateixos substrats produeix el desmuntatge dels fusos, la descondensació de cromosomes i la reconstrucció dels nuclis fills durant la telofase. L'establiment d'un grau de desfosforilació permissible als esdeveniments de la telofase requereix tant la inactivació dels substrats de Cdk com l'activació de [[Fosfatasa|fosfatases]]. |
|||
La inactivació de la Cdk és principalment el resultat de la destrucció de la seva [[ciclina]] associada. Les ciclines estan orientades a la [[Proteòlisi|degradació proteolítica]] pel [[complex promotor de l'anafase]] (APC, ''anaphase promoting complex''), també conegut com ''ciclosoma'', <ref>{{ref-publicació | cognom = Juang |nom=YL |cognom2=Huang |nom2=J |cognom3=Peters |nom3=JM |cognom4=McLaughlin |nom4=ME |autor5=et al. | article = APC-mediated proteolysis of Ase1 and the morphogenesis of the mitotic spindle | publicació = Science | volum = 275(5304) | pàgina = 1311–1314 | data = febrer de 1997 | pmid = 9036857 |llengua=anglès}}</ref> una [[ubiquitina]]-[[ligasa]]. El complex proteic [[Complex promotor de l'anafase|APC]]-[[CDC20]] (APC/C<sup>CDC20</sup>) s'adreça a les [[Ciclina|ciclines]] mitòtiques per a la degradació que s'inicia durant l'[[anafase]].{{sfn|Alberts|Johnson|Lewis|Morgan|2015|p=995-996}} L'addició experimental de M-ciclina no degradable a les cèl·lules indueix l'aturada del [[cicle cel·lular]] en un estat post-anafase / pre-telofase, amb cromosomes condensats capturats als pols cel·lulars, un [[fus acromàtic]] intacte i cap modificació de la [[membrana nuclear]]. Això s'ha demostrat en els [[Òvul|òvuls]] de granota ''([[Xenopus]])'' i de les mosques del vinagre ''([[Drosophila melanogaster|Drosophilla melanogaster]])'', en el [[rent]] de la cervesa ''([[Saccharomyces cerevisiae]])'', en el rent de fissió ''([[Schizosaccharomyces pombe]]),'' i en diverses línies de cèl·lules [[Ésser humà|humanes]].{{sfn|Inzé|2007|p=99-103}} |
|||
El requeriment per a l'activació de la fosfatasa es pot observar en el rent que es reprodueix per [[gemmació]], que no té fosfatases redundants per finalitzar la mitosi i que confien en la fosfatasa [[cdc14]]. El bloqueig per l'activació de cdc14 en aquestes cèl·lules es tradueix de la mateixa manera que la detenció fenotípica que bloqueja la degradació de la M-ciclina.{{sfn|Morgan|2007|p=154-155}}{{sfn|Alberts|Johnson|Lewis|Morgan|2015|p=995-996}} |
|||
Històricament, s'ha pensat que l'anafase i la telofase són esdeveniments que es produeixen passivament després de la satisfacció del [[punt de control de l'assemblatge del fus]] (SAC, ''spindle-assembly checkpoint'') que defineix la transició metafase-anafase.<ref name=":3">{{ref-publicació | cognom = Afonso |nom=O |cognom2=Matos |nom2=I |cognom3= Maiato |nom3=H | article = Spatial control of the anaphase-telophase transition | publicació = Cell Cycle | volum = 13(19) | pàgina = 2985-2986 | any = 2014 | pmid = 25486554 | pmc = 4614036 | doi = 10.4161/15384101.2014.959853 |llengua=anglès}}</ref> Tanmateix, l'existència de fases diferencials a l'activitat de cdc14 entre anafase i telofase suggereixen que existeixen [[punts de control]] mitòtics addicionals desconeguts. El cdc14 s'activa pel seu alliberament del [[Nucli cel·lular|nucli]] (de la seva captura dins del [[nuclèol]]) i posterior exportació al [[citoplasma]]. La ruta d'alliberament del cdc14 durant l'anafase primerenca (que estabilitza el [[fus acromàtic]]) també allibera cdc14 del nucli, però el restringeix al nucli. L'alliberament complet i el manteniment de l'activació del cdc14 s'assoleix mitjançant la separació de la ruta de la xarxa de sortida mitòtica (MEN, ''Mitotic Exit Network'') fins a un grau suficient per desencadenar el desmuntatge del [[fus acromàtic]] i tornar a crear la [[membrana nuclear]], després d'una anafase tardana.{{sfn|Monje-Casas|Queralt|2017|p=3-8}}<ref>{{ref-publicació | cognom = Yellman |nom=CM |cognom2=Roeder |nom2=GS | article = Cdc14 Early Anaphase Release, FEAR, Is Limited to the Nucleus and Dispensable for Efficient Mitotic Exit | publicació = PLOS One | volum = 10(6) | pàgina = e0128604 | any = 2015 | pmid = 26090959 | pmc = 4474866 | doi = 10.1371/journal.pone.0128604 |llengua=anglès}}</ref> |
|||
La [[desfosforilació]] mediada per cdc14 activa processos de regulació posteriors exclusius per a telofase. Per exemple, la desfosforilació del [[CDH1]] permet a l'APC/C unir-se amb CDH1. L'APC/C<sup>CDH1</sup> marca el CDC20 per a la [[proteòlisi]], donant com a resultat un canvi cel·lular de l'activitat APC/CC<sup>DC20</sup> a l'activitat APC/C<sup>CDH1</sup>.{{sfn|Inzé|2007|p=99-103}} La [[Ubiquitina|ubiqüitinació]] de les [[Ciclina|ciclines]] mitòtiques continua juntament amb la dels objectius específics d'APC/C<sup>CDH1</sup> com el component del [[fus acromàtic]] del [[rent]] (Ase1){{sfn|Morgan|2007|p=154-155}} i del cdc5, la degradació dels quals és necessària per al retorn de les cèl·lules a la [[Fase G1|fase G<sub>1</sub>]].{{sfn|Monje-Casas|Queralt|2017|p=3-8}} |
|||
=== Mecanismes addicionals de la conducció de la telofase === |
|||
Un canvi en el perfil de [[Fosfoproteïna|fosfoproteïnes]] a tota la cèl·lula és només el més ampli de molts mecanismes reguladors que contribueixen a l'aparició d'esdeveniments individuals de durant la telofase. |
|||
* El distanciament mediat dels cromosomes per l'anafase de la placa de la metafase pot desencadenar indicis espacials per a l'aparició de la telofase.<ref name=":3" /> |
|||
* Un important efectuador i regulador de la telofase és el [[Proteïna que conté valosina|cdc48]] (l'homòleg del cdc48 del [[rent]] és el [[p97]] humà, tant estructuralment com funcionalment), una [[proteïna]] que utilitza mecànicament la seva activitat [[ATPasa]] per alterar la conformació de proteïnes diana. El cdc48 és necessari per al desmuntatge del fus acromàtic, del muntatge de la membrana nuclear i la descondensació de cromosomes. El cdc48 modifica les proteïnes estructuralment implicades en aquests processos i també algunes proteïnes [[Ubiquitina|ubiqüitinades]] que, per tant, estan dirigides a la [[proteasoma]].{{sfn|Morgan|2007|p=154-155}}<ref name=":5">{{ref-publicació | cognom = Cao |nom= K |cognom2= Nakajima |nom2= R |cognom3=Meyer |nom3=HH |cognom4=Zheng |nom4=Y | article = The AAA-ATPase Cdc48/p97 regulates spindle disassembly at the end of mitosis | publicació = Cell | volum = 115(3) | pàgina = 355–367 | data = octubre de 2003 | pmid = 14636562 | doi = 10.1016/S0092-8674(03)00815-8 |llengua=anglès}}</ref><ref>{{ref-publicació | cognom = Hetzer |nom=M |cognom2=Meyer |nom2=HH |cognom3=Walther |nom3=TC |cognom4=Bilbao-Cortes |nom4=D |autor5= et al. | article = Distinct AAA-ATPase p97 complexes function in discrete steps of nuclear assembly | publicació = Nature Cell Biology | volum = 3(12) | pàgina = 1086–1091 | date = desembre de 2001 | pmid = 11781570 | doi = 10.1038/ncb1201-1086 |llengua0anglès}}</ref> |
|||
== El desmuntatge del fus acromàtic == |
|||
[[Fitxer:Telophase_in_Animal_Cell.jpg|thumb|Telofase d'una cèl·lula animal, on es pot veure el [[fus acromàtic]]]] |
|||
El trencament del [[fus acromàtic]], comú a l'acabament de la mitosi en tots els [[eucariotes]], és l'esdeveniment que s'utilitza més sovint per definir la transició de l'anafase B a la telofase,{{sfn|Morgan|2007|p=154-155}}<ref name=":3" /> tot i que l'inici del muntatge de la [[membrana nuclear]] tendeix a precedir el del desmuntatge del fus.<ref name=":6">{{ref-publicació | cognom = Aist |nom=JR | article = Mitosis and motor proteins in the filamentous ascomycete, Nectria haematococca, and some related fungi | publicació = International Review of Cytology | volum = 212 | pàgina = 239–263 | data = 1 de gener de 2002 | pmid = 11804038 | doi = 10.1016/S0074-7696(01)12007-3 |llengua=anglès}}</ref> |
|||
El desmuntatge del fus és un procés irreversible que no ha d'afectar la degradació definitiva, sinó la reorganització dels [[Microtúbul|microtúbuls]] constituents; els microtúbuls se separen dels [[Cinetocor|cinetocors]] i dels [[Centrosoma|centrosomes]], i tornen als seus estats d'[[interfase]]. |
|||
La [[Polimerització|despolimerització]] del fus acromàtic durant la telofase es produeix des de l'extrem més llunyà i és, d'aquesta manera, l'operació inversa del muntatge del fus.<ref>{{ref-publicació |cognom=Woodruff |nom=Jeffrey Blake | article=Mechanisms of Mitotic Spindle Disassembly and Positioning in Saccharomyces cerevisiae |any=2011 |publicació=UC Berkeley|url=https://escholarship.org/uc/item/923199gx|llengua=anglès}}</ref> El conjunt posterior de la matriu de microtúbuls és, a diferència del fus polaritzat, interpolar. Això és especialment aparent en les [[Cèl·lula animal|cèl·lules animals]] que de forma immediata, després del desmuntatge del fus acromàtic, han d'establir el feix antiparal·lel de microtúbuls conegut com a [[fus central]] per tal de regular la [[citoquinesi]].{{sfn|Morgan|2007|p=154-155}} Es requireix de l'[[ATP sintetasa|ATPasa]] p97 per l'establiment de [[Centre organitzador de microtúbuls|matrius de microtúbuls]] d'interfase relativament estables i llargues després del desmuntatge del fus acromàtic altament dinàmic i relativament curt.<ref name=":5" /> |
|||
Si bé el conjunt del fus acromàtic ha estat estudiat i caracteritzat com un procés en què les estructures provisionals són edificades pel SAC, la base molecular del desmuntatge del fus encara no s'entén amb detalls comparables. La [[cascada de desfosforilació]] mitòtica tardana dels substrats de M-Cdk per la xarxa de sortida de la mitosi (MEN, ''mitosis exit network'') és considerada com a responsable del desmuntatge dels fusos. Els estats de fosforilació dels factors estabilitzadors i desestabilitzadors dels microtúbuls, així com els nucleadors de microtúbuls, són els reguladors clau de les seves activitats.<ref name=":5" /> Per exemple, NuMA és una proteïna reticulant de l'extrem inferior i el substrat Cdk, la dissociació del qual es fa des del microtúbul, es afectat per la seva desfosforilació durant la telofase.{{sfn|Morgan|2007|p=154-155}} |
|||
Un model general per al desmuntatge de fus en el [[rent]] és que els tres subprocessos funcionals superposats de ''desconnexió'', ''desestabilització'' i ''despolimerització'' del fus són afectats principalment per l'APC/C<sup>CDH1</sup>, per les [[Cinasa|cinases]] específiques per a estabilitzar microtúbuls, i per les depolimerases de microtúbuls de l'extrem més llunyà, respectivament. Es coneix que aquests efectors estan molt ben conservats entre el [[rent]] i els [[eucariotes]] superiors. L'APC/C<sup>CDH1</sup> té com a objectiu proteïnes associades a microtúbuls entre reticulacions (NuMA, Ase1, Cin1 i més). [[Cinasa Aurora B|Aurora B]] (rent IpI1) [[Fosforilació|fosforilasa]] el fus associat la proteïna estabilitzant [[MAPRE1|EB1]] (lrent Bim1), que després es dissocia des dels microtúbuls, i el desestabilitzador She1, que després s'associa amb els microtúbuls. La [[kinesina 8]] (rent Kip3), una depolimerasa que depèn dels ATP, accelera la despolimerització de microtúbuls a l'extrem més llunyà. Es va demostrar que la interrupció simultània d'aquests mecanismes, però no d'alguns, resulta en una hiperestabilitat dramàtica del fus durant la telofase, cosa que suggereix un solapament funcional malgrat la diversitat dels mecanismes.<ref>{{ref-publicació | cognom = Woodruff |nom=JB |cognom2=Drubin |nom2=DG |cognom3=Barnes |nom3=G | article = Mitotic spindle disassembly occurs via distinct subprocesses driven by the anaphase-promoting complex, Aurora B kinase, and kinesin-8 | publicació = The Journal of Cell Biology | volum = 191(4) | pàgina = 795–808 | data = novembre de 2010 | pmid = 21079246 | doi = 10.1083/jcb.201006028 | pmc = 2983061 |llengua=anglès}}</ref> |
|||
== La reconstrucció de la membrana nuclear == |
|||
Els components principals de la [[membrana nuclear]] són una membrana doble, formada per [[Porus nuclear|complexos de porus nuclears]] i una [[làmina nuclear]] interna a la membrana nuclear interior. Aquests components es desfan durant la [[profase]] i la [[prometafase]], i es reconstrueixen durant la telofase, quan la membrana nuclear es torna a formar a la superfície de les [[Cromàtide|cromàtides]] germanes separades.{{sfn|Yael|Choi|DeSaix|Jurukovski|2013|p=281-283}}<ref name="Molecular Cell Biology">{{ref-web|url=https://www.ncbi.nlm.nih.gov/books/NBK21704/|títol=Molecular Cell Biology |editorial=W H Freeman|any=2000|pàgina=Secció 13.4 |llengua=anglès}}</ref> La membrana nuclear és fragmentada i parcialment absorbida pel [[reticle endoplasmàtic]] durant la prometafase, i l'agregació de la membrana nuclear interna (amb [[Vesícula|vesícules]] del reticle endoplasmàtic que contenen proteïnes) a la cromatina es produeix durant la telofase en una inversió d'aquest procés. Les vesícules formadores de la membrana s'agreguen directament a la superfície de la cromatina, on es [[Fusió de vesícules|fonen]] lateralment en una membrana contínua.{{sfn|Morgan|2007|p=154-155}} |
|||
Es requereix del [[Ran (proteïna)|Ran-GTP]] per a un muntatge precoç de la membrana nuclear a la superfície dels cromosomes; allibera els components de la membrana capturats per la [[Importina|importina-β]] durant la mitosi primerenca. El Ran-GTP es localitza a prop dels cromosomes a través de la mitosi, però no desencadena la dissociació de proteïnes de la membrana nuclear des de la importina-β fins que els objectius del M-Cdk es [[desfosforilació|desfosforilitzen]] en la telofase.{{sfn|Morgan|2007|p=154-155}} Aquests components de la membrana inclouen diversos components de [[Porus nuclear|porus nuclears]], el més estudiat dels quals és la proteïna de bastida de porus nuclear [[AHCTF1|ELYS]], que pot reconèixer les regions d'[[Àcid desoxiribonucleic|ADN]] riques en [[Parell de bases|parells de bases]] [[Adenosina|A]]:[[Timina|T]] (''[[in vitro]]'') i, per tant, poden unir-se directament a l'ADN.{{sfn|Pollard|Earnshaw|Lippincott-Schwartz|Johnson|2017|p=770-771}} No obstant això, els experiments amb extractes d'òvul de ''[[Xenopus]]'' han conclòs que l'ELYS no s'associa amb l'ADN nu i només s'uneix directament els [[Dímer|dímers]] d'[[histona]] i [[Nucleosoma|nucleosomes]].<ref>{{ref-publicació | cognom = Zierhut |nom=C |cognom2=Jenness |nom2=C |cognom3=Kimura |nom3=H |cognom4=Funabiki |nom4=H | article = Nucleosomal regulation of chromatin composition and nuclear assembly revealed by histone depletion | publicació = Nature Structural & Molecular Biology | volum = 21(7) | pàgina = 617–625 | data = juliol de 2014 | pmid = 24952593 | pmc = 4082469 | doi = 10.1038/nsmb.2845 |llengua=anglès}}</ref> Després d'enllaçar-se a la cromatina, l'ELYS recluta altres components de la bastida de porus nuclear i de les proteïnes dels porus transmembrals. El complex de porus nuclears s'assambla i s'integra a la membrana nuclear de forma organitzada, afegint consecutivament Nup107-160, [[POM121]] i FG Nups.<ref name=":8">{{ref-publicació | cognom = Gay |nom=S |cognom2=Foiani |nom2= M | article = Nuclear envelope and chromatin, lock and key of genome integrity | publicació = International Review of Cell and Molecular Biology | volum = 317 | pàgina = 267–330 | data = 1 de gener de 2015 | pmid = 26008788 | doi = 10.1016/bs.ircmb.2015.03.001 |llengua=anglès}}</ref> |
|||
Es debat si el mecanisme de reconstrucció de membrana nuclear implica el muntatge inicial de [[Porus nuclear|porus nuclears]] i el reclutament posterior de les [[Vesícula|vesícules]] de la membrana al voltant dels porus, o si la membrana nuclear es forma principalment a partir de [[Cisterna (membrana)|''cisternae'']] del [[reticle endoplasmàtic]] esteses, precedents del muntatge dels porus nuclears: |
|||
* A les cèl·lules on la membrana nuclear es fragmenta en [[Vesícula|vesícules]] no-[[Reticle endoplasmàtic|ER]] durant la mitosi, una ruta dependent de Ran-GTP pot dirigir aquestes poblacions discretes de vesícules cap a la [[cromatina]], on es [[Fusió de vesícules|fonen]] per reconstruir la membrana nuclear.{{sfn|Pollard|Earnshaw|Lippincott-Schwartz|Johnson|2017|p=770-771}}<ref>{{ref-publicació |cognom = Clarke |nom=PR |cognom2=Zhang |nom2=C | article = Spatial and temporal control of nuclear envelope assembly by Ran GTPase | publicació = Symposia of the Society for Experimental Biology | volum = 56 | pàgina = 193–204 | any = 2004 | pmid = 15565882 |llengua=anglès}}</ref> |
|||
* A les cèl·lules on la membrana nuclear s'absorbeix dins del [[reticle endoplasmàtic]] durant la mitosi, la reconstrucció implica l'expansió lateral al voltant de la cromatina amb l'estabilització de la membrana en expansió sobre la superfície de la cromatina.<ref name="TheNuclearEnvelope-NCBI">{{ref-publicació | cognom = Hetzer |nom=MW | article = The nuclear envelope | publicació = Cold Spring Harbor Perspectives in Biology | volum = 2(3) | pàgina = a000539 | data = març 2010 | pmid = 20300205 | pmc = 2829960 | doi = 10.1101/cshperspect.a000539 |llengua=anglès}}</ref> Estudis que afirmen que aquest mecanisme és un requisit previ per a la formació de porus nuclears han trobat que els complexos Nup107-160 associats a la cromatina nua estan presents en unitats simples en lloc d'estar assamblats des de abans de la formació dels porus.{{sfn|Pollard|Earnshaw|Lippincott-Schwartz|Johnson|2017|p=770-771}}<ref>{{ref-publicació | cognom = Lu |nom=L |cognom2=Ladinsky |nom2=MS |cognom3=Kirchhausen |nom3=T | article = Formation of the postmitotic nuclear envelope from extended ER cisternae precedes nuclear pore assembly | publicació = The Journal of Cell Biology | volum = 194(3) | pàgina = 425–440 | data = agost de 2011 | pmid = 21825076 | doi = 10.1083/jcb.201012063 | pmc = 3153650 |llengua=anglès}}</ref> |
|||
La membrana s'allisa i s'expandeix tancant dins d'ella tot el conjunt de cromàtides. Probablement això es produeix a causa de la importació de [[Làmina nuclear|làmines]] dels porus nuclears, que es pot conservar dins d'una membrana contínua. Les membranes nuclears dels extractes d'òvul de ''[[Xenopus]]'' no es van suavitzar quan es va inhibir la importació de la [[làmina nuclear]], quedant arrugades i estretament lligades als cromosomes condensats.<ref>{{ref-publicació | cognom = Wiese |nom=C |cognom2=Goldberg |nom2=MW |cognom3=Allen |nom3=TD |cognom4=Wilson |nom4=KL | article = Nuclear envelope assembly in Xenopus extracts visualized by scanning EM reveals a transport-dependent 'envelope smoothing' event | publicació = Journal of Cell Science | volum = 110(13) | pàgina = 1489–1502 | data = juliol 1997 | pmid = 9224766 |llengua=anglès}}</ref> Tanmateix, en el cas de l'expansió lateral des del [[reticle endoplasmàtic]], la importació nuclear s'inicia abans de finalitzar el reassemblament de la membrana nuclear, donant lloc a un gradient de proteïna intra-nuclear temporal entre els aspectes distals i medials del nucli que es forma.<ref name=":8" /> |
|||
Les subunitats de [[Làmina nuclear|làmines]] desmuntades en la [[profase]] s'activen i són capturades durant la mitosi. El muntatge de làmines es desencadena per la [[desfosforilació]] de la làmina (i, a més, per l'[[esterificació]] metílica dels residus de [[Àcid carboxílic|COOH]] de la [[Làmina-B1|làmina-B]]). La lamina B pot orientar-se a la cromatina fins a mitja [[anafase]]. Durant la telofase, quan es restableix la importació nuclear, la [[Lamina A/C|làmina-A]] entra al nucli reconstruït, però continua muntant lentament a la làmina perifèrica durant diverses hores durant tota la [[Fase G1|fase G<sub>1</sub>]].{{sfn|Pollard|Earnshaw|Lippincott-Schwartz|Johnson|2017|p=770-771}} |
|||
Els extractes d'òvul de ''[[Xenopus]]'' i les línies cel·lulars de [[càncer]] humà han estat els models principals utilitzats per a l'estudi de la reconstrucció de la membrana nuclear.<ref name=":8" /> |
|||
Els [[Rent|rents]] no tenen [[Làmina nuclear|làmines]]; la seva membrana nuclear roman intacta durant tota la mitosi i la divisió nuclear es produeix durant la [[citoquinesi]].<ref name=":6" /><ref>{{ref-publicació | cognom = Taddei |nom=A |cognom2=Schober |nom2=H |cognom3=Gasser |nom3=SM | article = The budding yeast nucleus | publicació = Cold Spring Harbor Perspectives in Biology | volum = 2(8) | pàgina = a000612 | data = agost de 2010 | pmid = 20554704 | pmc = 2908769 | doi = 10.1101/cshperspect.a000612 |llengua=anglès}}</ref> |
|||
== La decondensació dels cromosomes == |
|||
La descondensació del [[cromosoma]] (també coneguda com ''relaxació'' o ''descompactació'') a la cromatina expandida és necessària per a que la cèl·lula reprengui els processos de la [[interfase]], i es produeix paral·lelament al muntatge de la membrana nuclear durant la telofase en moltes [[eucariotes]]. La [[desfosforilació]] Cdk mediada per la xarxa de sortida de la mitosi (MEN, ''mitosis exit network'') és necessària per a la descondensació cromosòmica.{{sfn|Morgan|2007|p=154-155}}{{sfn|Inzé|2007|p=99-103}} |
|||
En els [[vertebrats]], la descondensació cromosòmica només s’inicia després de restablir la importació nuclear. Si s'evita el transport de [[Làmina nuclear|làmines]] a través dels [[Porus nuclear|porus nuclears]], els cromosomes es mantenen condensats després de la [[citoquinesi]] i les cèl·lules no assoleixen tornar a introduir la següent [[fase S]] (fase de síntesi).{{sfn|Pollard|Earnshaw|Lippincott-Schwartz|Johnson|2017|p=770-771}} En els [[mamífers]], el permís de l'[[Àcid desoxiribonucleic|ADN]] per a la fase S (l'associació de la cromatina als múltiples factors proteics necessaris per a la seva [[Replicació de l'ADN|replicació]]) també es produeix coincidint amb la maduració de la [[membrana nuclear]] durant la telofase tardana.<ref>{{ref-publicació | cognom = Dimitrova |nom=DS |cognom2=Prokhorova |nom2=TA |cognom3=Blow |nom3=JJ |cognom4=Todorov |nom4=IT |cognom5=Gilbert |nom5=DM | article = Mammalian nuclei become licensed for DNA replication during late telophase | publicació = Journal of Cell Science | volum = 115(1) | pàgina = 51–59 | data = juny de 2002 | pmid = 11801723 |llengua=anglès}}</ref><ref name="pmid28135906">{{ref-publicació | cognom = Fukushima |nom=K |cognom2=Wang |nom2=M |cognom3=Naito |nom3=Y |cognom4=Uchihashi |nom4=T |autor5=et al. | article = GAK is phosphorylated by c-Src and translocated from the centrosome to chromatin at the end of telophase | publicació = Cell Cycle | volum = 16(5) | pàgina = 415–427 | data = març de 2017 | pmid = 28135906 | pmc = 5351929 | doi = 10.1080/15384101.2016.1241916 |llengua=anglès}}</ref> Això pot atribuir i proporcionar proves per a la restitució de la maquinària d'importació nuclear de localitzacions de proteïnes nuclears i citoplasmàtiques interfàsiques durant la telofase. |
|||
<gallery mode="packed" heights="250"> |
|||
Fitxer:Cell Cycle-es.jpg|[[Cicle cel·lular]] complet. La telofase és una part de la [[mitosi]] (M) |
|||
Fitxer:Gray2.png|Canvis que es produeixen en una cèl·lula durant la mitosi (I,II,III: [[Profase]]; IV: [[Prometafase]]; V: [[Metafase]]; VI: [[Anafase]]; VII,VIII: [[Telofase]]) |
|||
Fitxer:Allium-Mitose10-DM100x BL28.jpg|Cèl·lules de la zona del [[meristema]] de la punta de l'arrel de la [[ceba]] ''(Allium cepa)'' durant la telofase |
|||
</gallery> |
|||
== Referències == |
|||
{{referències}} |
|||
== Bibliografia == |
|||
{{commonscat}} |
{{commonscat}} |
||
* {{ref-llibre|títol=Molecular Biology of the Cell | cognom = Alberts |nom=B |cognom2=Johnson |nom2=A |cognom3=Lewis |nom3=J |cognom4=Morgan |nom4=D |autor5=et al. |editorial=Garland Science, Taylor and Francis Group|any=2015|isbn=978-0-8153-4432-2|lloc=New York, NY| llengua=anglès}} |
|||
| ⚫ | |||
* {{ref-llibre |títol=Cell Cycle Control and Plant Development|cognom=Inzé|nom=Dirk|editorial=Blackwell Publishing Ltd.|any=2007|isbn=978-1-4051-5043-9|lloc=Oxford, UK|url=https://archive.org/details/cellcyclecontrol0000unse/page/99 |llengua=anglès}} |
|||
* {{ref-llibre|títol=The Mitotic Exit Network|cognom=Monje-Casas|nom=Fernando|cognom2=Queralt|nom2=Ethel|editorial=Humana Press|any=2017|isbn=9781493965007|lloc=New York, NY| llengua=anglès}} |
|||
* {{ref-llibre|títol=The Cell Cycle|cognom=Morgan|nom=David | editorial=New Science Press Ltd.|any=2007|isbn=0-9539181-2-2|lloc=London, UK|pages=154–155}} |
|||
* {{ref-llibre |títol=Cell Biology |cognom = Pollard |nom=TD |cognom2=Earnshaw |nom2=WC |cognom3=Lippincott-Schwartz |nom3=J |cognom4=Johnson |nom4=GT |editorial = Elsevier |any=2017 |isbn=978-0-323-34126-4 |lloc=Philadelphia, PA| llengua=anglès}} |
|||
* {{ref-llibre| cognom=Reece |nom=Jane |cognom2=Urry |nom2=Lisa |cognom3=Cain |nom3=Michael |cognom4=Wasserman |nom4=Steven |autor5=et al. |any=2011 |títol=Campbell Biology |editorial=Pearson |llengua=anglès |isbn=978-0-321-77565-8}} |
|||
* {{ref-llibre | cognom = Yael | nom = Avisar | cognom2 = Choi | nom2 = Jung | cognom3 = DeSaix | nom3 = Jean | cognom4 = Jurukovski | nom4 = Vladimir | autor5=et al. | any = 2013 | títol = Biology | lloc = Texas, USA | editorial = OpenStax College | isbn = 978-1-938168-09-3 |llengua=anglès}} |
|||
== Vegeu també == |
|||
| ⚫ | |||
<gallery mode="packed" heights="200"> |
|||
Fitxer:ProphaseIF.jpg|[[Profase]] |
|||
Fitxer:MetaphaseIF.jpg|[[Metafase]] |
|||
Fitxer:Anaphase_IF.jpg|[[Anafase]] |
|||
| ⚫ | |||
</gallery> |
|||
| ⚫ | |||
[[Categoria:Meiosi]] |
[[Categoria:Meiosi]] |
||
| ⚫ | |||
Revisió del 23:49, 20 des 2019

Telofase (del grec; τέλος (télos), «final» + φάσις (fàsis), «etapa») és l'estadi final tant en la meiosi com en la mitosi, després del procès de l'anafase, d'una cèl·lula eucariota.
Durant la telofase, es reverteixen els efectes de la profase i de la prometafase (quan es desintegren el nucli i la membrana nuclear). A mesura que els cromosomes arriben als pols de les cèl·lules, es crea una membrana nuclear al voltant de cada conjunt de cromàtides, els nuclèols tornen a aparèixer, i els cromosomes comencen a decondensar de nou la cromatina que es troba present durant la interfase. Es desfà el fus acromàtic i es despolimeritzen els eixos dels microtúbuls.
La citoquinesi comença abans de la telofase tardana i, quan es completa, segrega els dos nuclis fills entre un parell de cèl·lules filles separades.[1]
La telofase es basa principalment en la defosforilació de substrats de cinasa dependent de ciclina (Cdk).[2]
La telofase representa aproximadament el 2% de la durada del cicle cel·lular. Un cop finalitzada la telofase, la mitosi és completa i la cèl·lula passa a l'estadi d'interfase
La desfosforilació de substrats de Cdk
La fosforilació de les dianes de proteïnes de la M-Cdk (cinasa dependent de ciclina de la mitosi) produeix la creació del fus acromàtic, la condensació dels cromosomes i la descomposició de la membrana nuclear al principi de la mitosi. La desfosforilació d'aquests mateixos substrats produeix el desmuntatge dels fusos, la descondensació de cromosomes i la reconstrucció dels nuclis fills durant la telofase. L'establiment d'un grau de desfosforilació permissible als esdeveniments de la telofase requereix tant la inactivació dels substrats de Cdk com l'activació de fosfatases.
La inactivació de la Cdk és principalment el resultat de la destrucció de la seva ciclina associada. Les ciclines estan orientades a la degradació proteolítica pel complex promotor de l'anafase (APC, anaphase promoting complex), també conegut com ciclosoma, [3] una ubiquitina-ligasa. El complex proteic APC-CDC20 (APC/CCDC20) s'adreça a les ciclines mitòtiques per a la degradació que s'inicia durant l'anafase.[4] L'addició experimental de M-ciclina no degradable a les cèl·lules indueix l'aturada del cicle cel·lular en un estat post-anafase / pre-telofase, amb cromosomes condensats capturats als pols cel·lulars, un fus acromàtic intacte i cap modificació de la membrana nuclear. Això s'ha demostrat en els òvuls de granota (Xenopus) i de les mosques del vinagre (Drosophilla melanogaster), en el rent de la cervesa (Saccharomyces cerevisiae), en el rent de fissió (Schizosaccharomyces pombe), i en diverses línies de cèl·lules humanes.[5]
El requeriment per a l'activació de la fosfatasa es pot observar en el rent que es reprodueix per gemmació, que no té fosfatases redundants per finalitzar la mitosi i que confien en la fosfatasa cdc14. El bloqueig per l'activació de cdc14 en aquestes cèl·lules es tradueix de la mateixa manera que la detenció fenotípica que bloqueja la degradació de la M-ciclina.[2][4]
Històricament, s'ha pensat que l'anafase i la telofase són esdeveniments que es produeixen passivament després de la satisfacció del punt de control de l'assemblatge del fus (SAC, spindle-assembly checkpoint) que defineix la transició metafase-anafase.[6] Tanmateix, l'existència de fases diferencials a l'activitat de cdc14 entre anafase i telofase suggereixen que existeixen punts de control mitòtics addicionals desconeguts. El cdc14 s'activa pel seu alliberament del nucli (de la seva captura dins del nuclèol) i posterior exportació al citoplasma. La ruta d'alliberament del cdc14 durant l'anafase primerenca (que estabilitza el fus acromàtic) també allibera cdc14 del nucli, però el restringeix al nucli. L'alliberament complet i el manteniment de l'activació del cdc14 s'assoleix mitjançant la separació de la ruta de la xarxa de sortida mitòtica (MEN, Mitotic Exit Network) fins a un grau suficient per desencadenar el desmuntatge del fus acromàtic i tornar a crear la membrana nuclear, després d'una anafase tardana.[7][8]
La desfosforilació mediada per cdc14 activa processos de regulació posteriors exclusius per a telofase. Per exemple, la desfosforilació del CDH1 permet a l'APC/C unir-se amb CDH1. L'APC/CCDH1 marca el CDC20 per a la proteòlisi, donant com a resultat un canvi cel·lular de l'activitat APC/CCDC20 a l'activitat APC/CCDH1.[5] La ubiqüitinació de les ciclines mitòtiques continua juntament amb la dels objectius específics d'APC/CCDH1 com el component del fus acromàtic del rent (Ase1)[2] i del cdc5, la degradació dels quals és necessària per al retorn de les cèl·lules a la fase G1.[7]
Mecanismes addicionals de la conducció de la telofase
Un canvi en el perfil de fosfoproteïnes a tota la cèl·lula és només el més ampli de molts mecanismes reguladors que contribueixen a l'aparició d'esdeveniments individuals de durant la telofase.
- El distanciament mediat dels cromosomes per l'anafase de la placa de la metafase pot desencadenar indicis espacials per a l'aparició de la telofase.[6]
- Un important efectuador i regulador de la telofase és el cdc48 (l'homòleg del cdc48 del rent és el p97 humà, tant estructuralment com funcionalment), una proteïna que utilitza mecànicament la seva activitat ATPasa per alterar la conformació de proteïnes diana. El cdc48 és necessari per al desmuntatge del fus acromàtic, del muntatge de la membrana nuclear i la descondensació de cromosomes. El cdc48 modifica les proteïnes estructuralment implicades en aquests processos i també algunes proteïnes ubiqüitinades que, per tant, estan dirigides a la proteasoma.[2][9][10]
El desmuntatge del fus acromàtic

El trencament del fus acromàtic, comú a l'acabament de la mitosi en tots els eucariotes, és l'esdeveniment que s'utilitza més sovint per definir la transició de l'anafase B a la telofase,[2][6] tot i que l'inici del muntatge de la membrana nuclear tendeix a precedir el del desmuntatge del fus.[11]
El desmuntatge del fus és un procés irreversible que no ha d'afectar la degradació definitiva, sinó la reorganització dels microtúbuls constituents; els microtúbuls se separen dels cinetocors i dels centrosomes, i tornen als seus estats d'interfase.
La despolimerització del fus acromàtic durant la telofase es produeix des de l'extrem més llunyà i és, d'aquesta manera, l'operació inversa del muntatge del fus.[12] El conjunt posterior de la matriu de microtúbuls és, a diferència del fus polaritzat, interpolar. Això és especialment aparent en les cèl·lules animals que de forma immediata, després del desmuntatge del fus acromàtic, han d'establir el feix antiparal·lel de microtúbuls conegut com a fus central per tal de regular la citoquinesi.[2] Es requireix de l'ATPasa p97 per l'establiment de matrius de microtúbuls d'interfase relativament estables i llargues després del desmuntatge del fus acromàtic altament dinàmic i relativament curt.[9]
Si bé el conjunt del fus acromàtic ha estat estudiat i caracteritzat com un procés en què les estructures provisionals són edificades pel SAC, la base molecular del desmuntatge del fus encara no s'entén amb detalls comparables. La cascada de desfosforilació mitòtica tardana dels substrats de M-Cdk per la xarxa de sortida de la mitosi (MEN, mitosis exit network) és considerada com a responsable del desmuntatge dels fusos. Els estats de fosforilació dels factors estabilitzadors i desestabilitzadors dels microtúbuls, així com els nucleadors de microtúbuls, són els reguladors clau de les seves activitats.[9] Per exemple, NuMA és una proteïna reticulant de l'extrem inferior i el substrat Cdk, la dissociació del qual es fa des del microtúbul, es afectat per la seva desfosforilació durant la telofase.[2]
Un model general per al desmuntatge de fus en el rent és que els tres subprocessos funcionals superposats de desconnexió, desestabilització i despolimerització del fus són afectats principalment per l'APC/CCDH1, per les cinases específiques per a estabilitzar microtúbuls, i per les depolimerases de microtúbuls de l'extrem més llunyà, respectivament. Es coneix que aquests efectors estan molt ben conservats entre el rent i els eucariotes superiors. L'APC/CCDH1 té com a objectiu proteïnes associades a microtúbuls entre reticulacions (NuMA, Ase1, Cin1 i més). Aurora B (rent IpI1) fosforilasa el fus associat la proteïna estabilitzant EB1 (lrent Bim1), que després es dissocia des dels microtúbuls, i el desestabilitzador She1, que després s'associa amb els microtúbuls. La kinesina 8 (rent Kip3), una depolimerasa que depèn dels ATP, accelera la despolimerització de microtúbuls a l'extrem més llunyà. Es va demostrar que la interrupció simultània d'aquests mecanismes, però no d'alguns, resulta en una hiperestabilitat dramàtica del fus durant la telofase, cosa que suggereix un solapament funcional malgrat la diversitat dels mecanismes.[13]
La reconstrucció de la membrana nuclear
Els components principals de la membrana nuclear són una membrana doble, formada per complexos de porus nuclears i una làmina nuclear interna a la membrana nuclear interior. Aquests components es desfan durant la profase i la prometafase, i es reconstrueixen durant la telofase, quan la membrana nuclear es torna a formar a la superfície de les cromàtides germanes separades.[14][15] La membrana nuclear és fragmentada i parcialment absorbida pel reticle endoplasmàtic durant la prometafase, i l'agregació de la membrana nuclear interna (amb vesícules del reticle endoplasmàtic que contenen proteïnes) a la cromatina es produeix durant la telofase en una inversió d'aquest procés. Les vesícules formadores de la membrana s'agreguen directament a la superfície de la cromatina, on es fonen lateralment en una membrana contínua.[2]
Es requereix del Ran-GTP per a un muntatge precoç de la membrana nuclear a la superfície dels cromosomes; allibera els components de la membrana capturats per la importina-β durant la mitosi primerenca. El Ran-GTP es localitza a prop dels cromosomes a través de la mitosi, però no desencadena la dissociació de proteïnes de la membrana nuclear des de la importina-β fins que els objectius del M-Cdk es desfosforilitzen en la telofase.[2] Aquests components de la membrana inclouen diversos components de porus nuclears, el més estudiat dels quals és la proteïna de bastida de porus nuclear ELYS, que pot reconèixer les regions d'ADN riques en parells de bases A:T (in vitro) i, per tant, poden unir-se directament a l'ADN.[16] No obstant això, els experiments amb extractes d'òvul de Xenopus han conclòs que l'ELYS no s'associa amb l'ADN nu i només s'uneix directament els dímers d'histona i nucleosomes.[17] Després d'enllaçar-se a la cromatina, l'ELYS recluta altres components de la bastida de porus nuclear i de les proteïnes dels porus transmembrals. El complex de porus nuclears s'assambla i s'integra a la membrana nuclear de forma organitzada, afegint consecutivament Nup107-160, POM121 i FG Nups.[18]
Es debat si el mecanisme de reconstrucció de membrana nuclear implica el muntatge inicial de porus nuclears i el reclutament posterior de les vesícules de la membrana al voltant dels porus, o si la membrana nuclear es forma principalment a partir de cisternae del reticle endoplasmàtic esteses, precedents del muntatge dels porus nuclears:
- A les cèl·lules on la membrana nuclear es fragmenta en vesícules no-ER durant la mitosi, una ruta dependent de Ran-GTP pot dirigir aquestes poblacions discretes de vesícules cap a la cromatina, on es fonen per reconstruir la membrana nuclear.[16][19]
- A les cèl·lules on la membrana nuclear s'absorbeix dins del reticle endoplasmàtic durant la mitosi, la reconstrucció implica l'expansió lateral al voltant de la cromatina amb l'estabilització de la membrana en expansió sobre la superfície de la cromatina.[20] Estudis que afirmen que aquest mecanisme és un requisit previ per a la formació de porus nuclears han trobat que els complexos Nup107-160 associats a la cromatina nua estan presents en unitats simples en lloc d'estar assamblats des de abans de la formació dels porus.[16][21]
La membrana s'allisa i s'expandeix tancant dins d'ella tot el conjunt de cromàtides. Probablement això es produeix a causa de la importació de làmines dels porus nuclears, que es pot conservar dins d'una membrana contínua. Les membranes nuclears dels extractes d'òvul de Xenopus no es van suavitzar quan es va inhibir la importació de la làmina nuclear, quedant arrugades i estretament lligades als cromosomes condensats.[22] Tanmateix, en el cas de l'expansió lateral des del reticle endoplasmàtic, la importació nuclear s'inicia abans de finalitzar el reassemblament de la membrana nuclear, donant lloc a un gradient de proteïna intra-nuclear temporal entre els aspectes distals i medials del nucli que es forma.[18]
Les subunitats de làmines desmuntades en la profase s'activen i són capturades durant la mitosi. El muntatge de làmines es desencadena per la desfosforilació de la làmina (i, a més, per l'esterificació metílica dels residus de COOH de la làmina-B). La lamina B pot orientar-se a la cromatina fins a mitja anafase. Durant la telofase, quan es restableix la importació nuclear, la làmina-A entra al nucli reconstruït, però continua muntant lentament a la làmina perifèrica durant diverses hores durant tota la fase G1.[16]
Els extractes d'òvul de Xenopus i les línies cel·lulars de càncer humà han estat els models principals utilitzats per a l'estudi de la reconstrucció de la membrana nuclear.[18]
Els rents no tenen làmines; la seva membrana nuclear roman intacta durant tota la mitosi i la divisió nuclear es produeix durant la citoquinesi.[11][23]
La decondensació dels cromosomes
La descondensació del cromosoma (també coneguda com relaxació o descompactació) a la cromatina expandida és necessària per a que la cèl·lula reprengui els processos de la interfase, i es produeix paral·lelament al muntatge de la membrana nuclear durant la telofase en moltes eucariotes. La desfosforilació Cdk mediada per la xarxa de sortida de la mitosi (MEN, mitosis exit network) és necessària per a la descondensació cromosòmica.[2][5]
En els vertebrats, la descondensació cromosòmica només s’inicia després de restablir la importació nuclear. Si s'evita el transport de làmines a través dels porus nuclears, els cromosomes es mantenen condensats després de la citoquinesi i les cèl·lules no assoleixen tornar a introduir la següent fase S (fase de síntesi).[16] En els mamífers, el permís de l'ADN per a la fase S (l'associació de la cromatina als múltiples factors proteics necessaris per a la seva replicació) també es produeix coincidint amb la maduració de la membrana nuclear durant la telofase tardana.[24][25] Això pot atribuir i proporcionar proves per a la restitució de la maquinària d'importació nuclear de localitzacions de proteïnes nuclears i citoplasmàtiques interfàsiques durant la telofase.
-
Cicle cel·lular complet. La telofase és una part de la mitosi (M)
-
Canvis que es produeixen en una cèl·lula durant la mitosi (I,II,III: Profase; IV: Prometafase; V: Metafase; VI: Anafase; VII,VIII: Telofase)
Referències
- ↑ Reece et al., 2011.
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 Morgan, 2007, p. 154-155.
- ↑ Juang, YL; Huang, J; Peters, JM; McLaughlin, ME; et al. «APC-mediated proteolysis of Ase1 and the morphogenesis of the mitotic spindle» (en anglès). Science, 275(5304), febrer 1997, pàg. 1311–1314. PMID: 9036857.
- ↑ 4,0 4,1 Alberts et al., 2015, p. 995-996.
- ↑ 5,0 5,1 5,2 Inzé, 2007, p. 99-103.
- ↑ 6,0 6,1 6,2 Afonso, O; Matos, I; Maiato, H «Spatial control of the anaphase-telophase transition» (en anglès). Cell Cycle, 13(19), 2014, pàg. 2985-2986. DOI: 10.4161/15384101.2014.959853. PMC: 4614036. PMID: 25486554.
- ↑ 7,0 7,1 Monje-Casas i Queralt, 2017, p. 3-8.
- ↑ Yellman, CM; Roeder, GS «Cdc14 Early Anaphase Release, FEAR, Is Limited to the Nucleus and Dispensable for Efficient Mitotic Exit» (en anglès). PLOS One, 10(6), 2015, pàg. e0128604. DOI: 10.1371/journal.pone.0128604. PMC: 4474866. PMID: 26090959.
- ↑ 9,0 9,1 9,2 Cao, K; Nakajima, R; Meyer, HH; Zheng, Y «The AAA-ATPase Cdc48/p97 regulates spindle disassembly at the end of mitosis» (en anglès). Cell, 115(3), octubre 2003, pàg. 355–367. DOI: 10.1016/S0092-8674(03)00815-8. PMID: 14636562.
- ↑ Hetzer, M; Meyer, HH; Walther, TC; Bilbao-Cortes, D; et al. «Distinct AAA-ATPase p97 complexes function in discrete steps of nuclear assembly». Nature Cell Biology, 3(12), pàg. 1086–1091. DOI: 10.1038/ncb1201-1086. PMID: 11781570.
- ↑ 11,0 11,1 Aist, JR «Mitosis and motor proteins in the filamentous ascomycete, Nectria haematococca, and some related fungi» (en anglès). International Review of Cytology, 212, 01-01-2002, pàg. 239–263. DOI: 10.1016/S0074-7696(01)12007-3. PMID: 11804038.
- ↑ Woodruff, Jeffrey Blake «Mechanisms of Mitotic Spindle Disassembly and Positioning in Saccharomyces cerevisiae» (en anglès). UC Berkeley, 2011.
- ↑ Woodruff, JB; Drubin, DG; Barnes, G «Mitotic spindle disassembly occurs via distinct subprocesses driven by the anaphase-promoting complex, Aurora B kinase, and kinesin-8» (en anglès). The Journal of Cell Biology, 191(4), novembre 2010, pàg. 795–808. DOI: 10.1083/jcb.201006028. PMC: 2983061. PMID: 21079246.
- ↑ Yael et al., 2013, p. 281-283.
- ↑ «Molecular Cell Biology» (en anglès) p. Secció 13.4, 2000.
- ↑ 16,0 16,1 16,2 16,3 16,4 Pollard et al., 2017, p. 770-771.
- ↑ Zierhut, C; Jenness, C; Kimura, H; Funabiki, H «Nucleosomal regulation of chromatin composition and nuclear assembly revealed by histone depletion» (en anglès). Nature Structural & Molecular Biology, 21(7), juliol 2014, pàg. 617–625. DOI: 10.1038/nsmb.2845. PMC: 4082469. PMID: 24952593.
- ↑ 18,0 18,1 18,2 Gay, S; Foiani, M «Nuclear envelope and chromatin, lock and key of genome integrity» (en anglès). International Review of Cell and Molecular Biology, 317, 01-01-2015, pàg. 267–330. DOI: 10.1016/bs.ircmb.2015.03.001. PMID: 26008788.
- ↑ Clarke, PR; Zhang, C «Spatial and temporal control of nuclear envelope assembly by Ran GTPase» (en anglès). Symposia of the Society for Experimental Biology, 56, 2004, pàg. 193–204. PMID: 15565882.
- ↑ Hetzer, MW «The nuclear envelope» (en anglès). Cold Spring Harbor Perspectives in Biology, 2(3), març 2010, pàg. a000539. DOI: 10.1101/cshperspect.a000539. PMC: 2829960. PMID: 20300205.
- ↑ Lu, L; Ladinsky, MS; Kirchhausen, T «Formation of the postmitotic nuclear envelope from extended ER cisternae precedes nuclear pore assembly» (en anglès). The Journal of Cell Biology, 194(3), agost 2011, pàg. 425–440. DOI: 10.1083/jcb.201012063. PMC: 3153650. PMID: 21825076.
- ↑ Wiese, C; Goldberg, MW; Allen, TD; Wilson, KL «Nuclear envelope assembly in Xenopus extracts visualized by scanning EM reveals a transport-dependent 'envelope smoothing' event» (en anglès). Journal of Cell Science, 110(13), juliol 1997, pàg. 1489–1502. PMID: 9224766.
- ↑ Taddei, A; Schober, H; Gasser, SM «The budding yeast nucleus» (en anglès). Cold Spring Harbor Perspectives in Biology, 2(8), agost 2010, pàg. a000612. DOI: 10.1101/cshperspect.a000612. PMC: 2908769. PMID: 20554704.
- ↑ Dimitrova, DS; Prokhorova, TA; Blow, JJ; Todorov, IT; Gilbert, DM «Mammalian nuclei become licensed for DNA replication during late telophase» (en anglès). Journal of Cell Science, 115(1), juny 2002, pàg. 51–59. PMID: 11801723.
- ↑ Fukushima, K; Wang, M; Naito, Y; Uchihashi, T; et al. «GAK is phosphorylated by c-Src and translocated from the centrosome to chromatin at the end of telophase» (en anglès). Cell Cycle, 16(5), març 2017, pàg. 415–427. DOI: 10.1080/15384101.2016.1241916. PMC: 5351929. PMID: 28135906.
Bibliografia
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Telofase |
- Alberts, B; Johnson, A; Lewis, J; Morgan, D; et al.. Molecular Biology of the Cell (en anglès). New York, NY: Garland Science, Taylor and Francis Group, 2015. ISBN 978-0-8153-4432-2.
- Inzé, Dirk. Cell Cycle Control and Plant Development (en anglès). Oxford, UK: Blackwell Publishing Ltd., 2007. ISBN 978-1-4051-5043-9.
- Monje-Casas, Fernando; Queralt, Ethel. The Mitotic Exit Network (en anglès). New York, NY: Humana Press, 2017. ISBN 9781493965007.
- Morgan, David. The Cell Cycle. London, UK: New Science Press Ltd., 2007. ISBN 0-9539181-2-2.
- Pollard, TD; Earnshaw, WC; Lippincott-Schwartz, J; Johnson, GT. Cell Biology (en anglès). Philadelphia, PA: Elsevier, 2017. ISBN 978-0-323-34126-4.
- Reece, Jane; Urry, Lisa; Cain, Michael; Wasserman, Steven; et al.. Campbell Biology (en anglès). Pearson, 2011. ISBN 978-0-321-77565-8.
- Yael, Avisar; Choi, Jung; DeSaix, Jean; Jurukovski, Vladimir; et al.. Biology (en anglès). Texas, USA: OpenStax College, 2013. ISBN 978-1-938168-09-3.