Fosfofructocinasa-1
 | |||||||||
| Identificadors | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Número EC | 2.7.1.11 | ||||||||
| Número CAS | 9001-80-3
| ||||||||
| Bases de dades | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| Estructures PDB | RCSB PDB PDBj PDBe PDBsum | ||||||||
| |||||||||
La fosfofructocinasa-1 o 6-fosfofructocinasa (PFK-1) és un enzim que catalitza la tercera reacció de la glucòlisi, on és un enzim essencial, ja que constitueix el principal punt de control d'aquesta via de degradació de glucosa en piruvat. La seva activitat està regulada per la concentració dels substrats però també per nombrosos efectors al·lostèrics relacionats amb la producció d'energia per la fosforilació oxidativa.
Activitat catalítica[modifica]
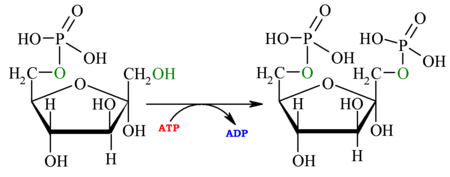
La fosfofructocinasa transforma una molècula de fructosa-6-fosfat i una d'ATP en una de fructosa-1,6-bisfosfat, una d'ADP i un H+. Es tracta de la fosforilació de la fructosa-6-fosfat en el carboni 1. Com per totes les catàlisis que fan intervenir nucleòtids com a substrats, la presència de Mg2+ és indispensable perquè la reacció pugui tenir lloc.
Per aquesta reacció,
ΔG= -25,9 kJ·mol-1 i ΔGº= -17,2 kJ·mol-1
Aquesta etapa de la glucòlisi està regulada no únicament perquè és irreversible, sinó perquè a més el substrat és embarcat necessàriament a la glucòlisi una vegada es realitza.
Abans d'aquesta reacció, la glucosa-6-fosfat, que dona el fructosa-6-fosfat a la glucòlisi, pot anar a la via de les pentoses fosfat o ésser transformada en glucosa-1-fosfat en el que s'anomena neoglucogènesi.
Estructura[modifica]
La fosfofructocinasa-1 és formada per quatres unitats i el seu pes molecular varia en funció de l'espècie: és de 85 kDa en humans i 50kDa en el Trypanosoma brucei,[1] per exemple.
Cadascuna d'aquestes unitats conté dos centres de fixació per l'ATP; un pel substrat i l'altre pel regulador. El centre de fixació pel substrat fixa l'ATP per qualsevol conformació de la PFK-1, mentre que el centre de fixació del regulador només el fixa per la conformació T (tense). La forma R (relax) és la forma activa de l'enzim. El centre actiu o catalític de cada unitat fixa també una molècula de fructosa-6-fosfat.
S'han trobat diferents isoformes d'aquest enzim depenent del teixit i del tipus cel·lular. En els mamífers se n'han trobat tres tipus: PFKL (fetge), PFKM (múscul) i PFKP (plaquetes).[2] Aquestes isoformes es poden combinar i formar així homotetràmers o heterotetràmers, que són l'estructura funcional de la fosfofructocinasa. Les diferents isoformes mostren un comportament cinètic i una afinitat distinta pel substrat. Mentre la isoforma PFKP mostra una cinètica altament cooperativa per a la Fructosa-6-fosfat com a substrat, la isoforma PFKM presenta una cinètica hiperbòlica i per tant més afinitat. La isoforma PFKL té un comportament intermedi entre les formes PFKP i PFK-M.[3] Aquestes diferències són importants perquè l'expressió de les isoformes en un tipus cel·lular dependrà de les necessitats energètiques de la cél·lula.
Al múscul únicament se sintetitza la PFKM, pel que es formen homotetràmers amb quatre subunitats idèntiques M. Al cervell se sintetitzen les tres formes,[4] formant homo i heterotetràmers. A les cèl·lules β dels illots de Langerhans també se sintetitzen aquestes tres formes.[5]
La deficiència en PFKM, glucogènosi de tipus VII, coneguda com a síndrome de Tarui, és un trastorn recessiu autosòmic caracteritzat per una miopatia i un trastorn hemolític greus.[6][7][8]
Codificació genètica[modifica]
Existeixen tres gens de la fosfofructocinasa en els humans:
- PFKL - fetge Localitzat en el cromosoma 21q22.3
- PFKM - múscul Localitzat en el cromosoma 12q13
- PFKP - plaquetes Localitzat en el cromosoma 10p15.2-p15.3
El gen de la PFKL s'expressa al fetge, als eritròcits, al ronyó, a la placenta, a la glàndula tiroide, als adipòcits, al cervell, al cor, als testicles, als pulmons, a la melsa, a les cèl·lules β del illots de Langerhans, al múscul uterí.
El gen que codifica per la PFKM s'expressa al múscul esquelètic, al diafragma, al cor, al cervell, als eritròcits, als testicles, al pulmó, al ronyó, a l'estómac, a les cèl·lules β dels illots de Langerhans.
El gen que codifica per la PFKP s'expressa al cervell, a les plaquetes, als fibroblasts, als limfòcits, a la glàndula tiroide, al pulmó, a la melsa, als testicles, a les cèl·lules β del illots de Langerhans i al múscul uterí.[9]
El gen humà de la PFKL té 28 Kb de longitud i conté 22 exons.[10] La seva expressió s'activa per la insulina (hormona hipoglucemiant) i s'inhibeix pel glucagó (hormona hiperglucemiant)[9] El gen de la PFKM té 30Kb de longitud i es divideix en 24 exons.[11]
S'han descrit canvis en el patró d'expressió d'aquestes formes durant l'envelliment i la maduració del cervell, el cor i el múscul esquelètic.[12][13]
Regulació[modifica]
Inhibició[modifica]

La primera part de la corba és hiperbòlica: per tant, la fixació de l'ATP als quatre centres catalítics (per cada unitat de l'enzim) segueix un mecanisme michaelià. No hi ha, així, efecte cooperatiu en la fixació de les molècules d'ATP. A partir d'una certa concentració, les molècules d'ATP es fixen en un centre que no és el catalític, però que està relacionat amb l'activitat catalítica: la fixació de molècules d'ATP en aquest lloc indueix un canvi de conformació d'algunes molècules d'enzim. Els centres catalítics en aquesta conformació (tense, T) no fixen o fixen difícilment l'ATP, l'enzim no està actiu, o molt poc.[14]
Quan les necessitats energètiques de la cèl·lula són baixes, les concentracions d'ATP, de fosfoenolpiruvat, de NADH i d'àcid cítric, un dels primers compostos del cicle de Krebs, són elevades (aquests metabòlits s'acumulen): l'activitat de la PFK-1 disminueix, regulant la glucòlisi i l'obtenció d'energia per la cèl·lula. Aquests metabòlits són inhibidors al·lostèrics, es fixen en un centre de regulació, diferent del centre catalític.[14] Kole et al. afirmaren que el NADP també pot inhibir la fosfofructocinasa-1.[15]
Quan el pH cau bruscament, H+ inhibeix la PFK-1. S'evita així una formació excessiva de lactat i una disminució del pH sanguini (el lactat és alliberat a la sang).[16]
Activació[modifica]
Els activadors de la PFK-1 són: l'Adenosina difosfat (ADP), l'Adenosina monofosfat (AMP), el fosfat inorgànic (Pi), la Nicotinamida adenina dinucleòtid oxidat (NAD) i la fructosa-2,6-bisfosfat.[14]
Quan la cèl·lula necessita energia, la hidròlisi de l'ATP provoca un augment d'ADP, AMP i Pi, el NADH reduït és utilitzat i en conseqüència es forma el NAD : la PFK-1 s'activa i la glucòlisi té lloc.


La β-D-fructosa-2,6-bisfosfat (F-2,6-P2) és un dels activadors més potents de la PFK-1, el més important en el fetge. És interessant entendre com el control del nivell de F-2,6-P2 explica l'activitat de la PFK-1.
El nivell de F-2,6-P2 és regulat per un enzim bifuncional, també present en el citosol cel·lular, que presenta un domini fosfatasa i un domini cinasa i que catalitza les reaccions:
fructosa-2,6-bisfosfat + H2O → fructosa-6-fosfat + Pi quan està fosforilat. Aquesta forma de l'enzim rep el nom de Fructosa-2,6-bisfosfatasa (FBPasa 2)
i fructosa-6-fosfat + ATP → fructosa-2,6-bisfosfat + ADP quan no ho està. Aquesta forma rep el nom de fosfofructocinasa-2 (PFK-2).
La fosforilació és regulada per l'activitat d'una fosfocinasa dependent d'AMPc, que s'activa després d'una cadena de reaccions provocada per l'arribada de glucagó (hormona hiperglucemiant) al fetge. Així, la concentració de fructosa-2,6-bisfosfat disminueix i la PKF-1 està menys activa, augmentant la concentració de glucosa. En el múscul, però, la forma cinasa (PFK-2) es veu estimulada per la fosforilació que té lloc sota l'efecte de l'AMPc, i no inhibida.[16]
La glucòlisi i la neoglucogènesi no tenen lloc simultàniament a la cèl·lula gràcies a la regulació de la fosfofructocinasa.
Referències[modifica]
- ↑ Structural features of T. brucei, E. coli, and human PFK (web) Arxivat 2010-07-20 a Wayback Machine.
- ↑ Dunaway GA, Kasten TP.Nature of the rat brain 6-phosphofructo-1-kinase isozymes.,J Biol Chem. 1985 Apr 10;260(7):4180-5.
- ↑ Vora S, Oskam R, Staal GE.Isoenzymes of phosphofructokinase in the rat. Demonstration of the three non-identical subunits by biochemical, immunochemical and kinetic studies.Biochem J. 1985 Jul 15;229(2):333-41.
- ↑ Nakajima H, Kono N, Yamasaki T, Hamaguchi T, Hotta K, Kuwajima M, Noguchi T, Tanaka T, Tarui S, Tissue specificity in expression and alternative RNA splicing of human phosphofructokinase-M and -L genes, Biochem Biophys Res Commun. 1990 Dec 31;173(3):1317-21
- ↑ Ma Z, Ramanadham S, Kempe K, Hu Z, Ladenson J, Turk J, Characterization of expression of phosphofructokinase isoforms in isolated rat pancreatic islets and purified beta cells and cloning and expression of the rat phosphofructokinase-A isoform, Biochim Biophys Acta. 1996 Aug 14;1308(2):151-63.
- ↑ Tarui S, Okuno G, Ikura Y, et al. Phosphofructokinase deficiency in skeletal muscle: a new type of glycogenosis. Biochem Biophys Res Commun. May 3 1965;19:517-23.
- ↑ Raben N, Exelbert R, Spiegel R, Sherman JB, Nakajima H, Plotz P, Heinisch J, Functional expression of human mutant phosphofructokinase in yeast: genetic defects in French Canadian and Swiss patients with phosphofructokinase deficiency, Am J Hum Genet. 1995 Jan;56(1):131-41.
- ↑ Nakajima H, Raben N, Hamaguchi T, Yamasaki T (2002). Phosphofructokinase deficiency; past, present and future. Curr. Mol. Med. 2 (2): 197–212. doi:10.2174/1566524024605734. PMID: 11949936. http://www.bentham-direct.org/pages/content.php?CMM/2002/00000002/00000002/0009M.SGM Arxivat 2013-04-14 at Archive.is.
- ↑ 9,0 9,1 GARCIA MARTINEZ, Miguel, Generación de un ratón deficiente en 6-fosfofructo-1-cinasa muscular: modelo de glucogénesis de tipo VII [en línia]. Barcelona: Universitat Autònoma de Barcelona. Departamento de Bioquímica i Biología Molecular, Facultad de Veterinaria y Centro de Biotecnología Animal y Bioterapia génica, 2006
- ↑ Levanon D, Danciger E, Dafni N, Bernstein Y, Elson A, Moens W, Brandeis M, Groner Y, The primary structure of human liver type phosphofructokinase and its comparison with other types of PFK, DNA. 1989 Dec;8(10):733-43.
- ↑ Yamasaki T, Nakajima H, Kono N, Hotta K, Yamada K, Imai E, Kuwajima M, Noguchi T, Tanaka T, Tarui S, Structure of the entire human muscle phosphofructokinase-encoding gene: a two-promoter system, Gene. 1991 Aug 15;104(2):277-82.
- ↑ Dunaway GA, Kasten TP, Nickols GA, Chesky JA, Regulation of skeletal muscle 6-phosphofructo-1-kinase during aging and development, Mech Ageing Dev. 1986 Sep;36(1):13-23.
- ↑ Dunaway GA, Kasten TP, Kolm P, Alteration of 6-phosphofructo-1-kinase isozyme pools during heart development and aging, J Biol Chem. 1986 Dec 25;261(36):17170-3.
- ↑ 14,0 14,1 14,2 «Régulation de la glycolyse». Arxivat de l'original el 2010-01-14. [Consulta: 16 desembre 2009].
- ↑ Kole HK, Resnick RJ, Van Doren M, Racker E, Regulation of 6-phosphofructo-1-kinase activity in ras-transformed rat-1 fibroblasts, Arch Biochem Biophys. 1991 May 1;286(2):586-90.
- ↑ 16,0 16,1 STRYER, L, Bioquímica, Tomo II, Cuarta Edición, Ed. Reverté, 1995. (ISBN 84-291-7452-4)
Enllaços externs[modifica]
- «Fosfofructocinasa-1» (en anglès). Medical Subject Headings.
- http://www.pdb.org/pdb/static.do?p=education_discussion/molecule_of_the_month/pdb50_4.html Arxivat 2011-06-08 a Wayback Machine.
- Proteopedia.org Phosphofructokinase (anglès)

