Glucosa
| Substància química | família de compostos |
|---|---|
| Rol | edulcorant, medicament essencial i metabòlit primari |
| Estructura química | |
| Fórmula química | C₆H₁₂O₆ |
La glucosa o glicosa[a] (DGLC), també anomenada sucre de raïm, és un monosacàrid que les cèl·lules utilitzen com a font d'energia i com a intermediari metabòlic.[1] És un dels principals productes de la fotosíntesi i el principal punt de partida de la respiració cel·lular, tant als organismes procariotes com als eucariotes.
Químicament, la glucosa és una aldohexosa, però dels dos isòmers possibles d'aquesta aldohexosa, només la D-glucosa és biològicament activa, ja que la L-glucosa no pot ésser utilitzada per les cèl·lules.
La D-glucosa rep el nom de dextrosa (terme que és una síncope de «glucosa dextrorotatòria»[2]) especialment a la indústria alimentària, que la utilitza en l'elaboració de molts productes. Combinada amb la fructosa constitueix un disacàrid: la sacarosa, que és la molècula que forma el sucre ordinari o sucre de canya. També és la molècula que, en polimeritzar-se de diverses maneres, forma la cel·lulosa, el midó o el glicogen.
Investigadors del Departament de Psiquiatria i Psicobiologia Clínica de la Universitat de Barcelona han conclòs que combinar cafeïna i glucosa afavoreix l'atenció, l'aprenentatge i la consolidació de la memòria verbal, efecte que no s'observa si hom ingereix aquestes dues substàncies per separat.[b]
Estructura[modifica]

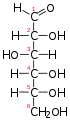
La glucosa (C₆H₁₂O₆) és una hexosa (monosacàrid amb sis àtoms de carboni), que conté un grup -CHO, és a dir, un grup aldehid. Per tant, es classifica com una aldohexosa.
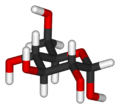
La molècula de glucosa en dissolució aquosa presenta un equilibri entre dues formes que coexisteixen: la forma de cadena oberta i la forma cíclica, predominant a pH 7. Les formes cícliques es formen per la reacció intramolecular del grup hidroxil (-OH) del C-5 amb el grup aldehid (-CHO) del C-1, que origina un hemiacetal. L'anell resultant està format per cinc àtoms de carboni i un àtom d'oxigen i recorda l'estructura del piran, per la qual cosa la forma cíclica de la glucosa s'anomena glucopiranosa. Els carbonis 1 al 4 estan units a un grup hidroxil, mentre que el C-5 resta unit a un grup -CH₂OH, que es manté fora de l'anell.
Isòmers[modifica]
Les aldohexoses tenen 4 carbonis asimètrics i, per tant, 16 (24) estereoisòmers o isòmers òptics que es divideixen en dues sèries, D i L, cadascuna amb 8 compostos. De la glucosa, doncs, existeixen dos estereoisòmers, la D-glucosa, el monosacàrid més abundant, i la L-glucosa que, com ja hem dit, no pot ésser utilitzada per les cèl·lules. Entre les aldohexoses trobem altres compostos importants per als éssers vius, com la D-galactosa (Gal) o la D-mannosa (Man).
Com a resultat de la ciclació de la D-glucosa apareix un nou carboni asimètric, el C-1, que origina dos diastereoisòmers diferents. Aquests diastereoisòmers, que en la química dels glúcids s'anomenen anòmers, difereixen tan sols en la configuració del C-1, o carboni anomèric, i es designen amb els prefixos α (alfa) i β (beta). En la projecció de Haworth la forma α de la D-glucosa té el grup hidroxil del C-1 sobre el pla de l'anell, mentre que en la forma β aquest grup queda situat sota l'anell de glucopiranosa.
-
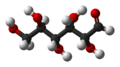
La forma oberta de la D-glucosa -
La projecció de Fischer de la forma oberta de la D-glucosa -
α-D-glucopiranosa -
β-D-glucopiranosa
-
Model de boles i barres de la cadena de la D-glucosa -
Model de boles de la cadena de la D-glucosa -
α-D-glucopiranosa -
β-D-glucopiranosa

Les formes α i β tenen propietats químiques i físiques diferents. Per exemple, els valors de la rotació òptica específica, [α]20, de la α-D-glucosa i la β-D-glucosa són, respectivament, +112,2º i +18,7º.[3] No obstant aquests valors, quan qualsevol d'aquestes dues substàncies es dissol en aigua, la rotació específica de la dissolució va variant fins que assoleix un valor d'equilibri de +52,7º. El motiu és que ambdues formes, α i β, es transformen de l'una a l'altra passant per la forma oberta fins a arribar a una ràtio d'equilibri d'α:β equivalent a 36:64, en un fenomen conegut amb el nom de mutarotació.
Reaccions químiques[modifica]

Enllaç glicosídic[modifica]
L'enllaç glicosídic és el tipus d'enllaç que manté unides les unitats de glucosa de polisacàrids com la cel·lulosa, el midó i el glicogen. Es forma quan el grup hidroxil del carboni anomèric d'una molècula de glucosa es condensa amb un grup hidroxil d'una altra molècula de glucosa. Segons la conformació del carboni anomèric (α o β) i el carboni al qual pertany el segon grup hidroxil, hi ha diferents tipus d'enllaç glicosídic. Per exemple, la cel·lulosa és un polímer lineal de la glucosa formada per enllaços del tipus β(1→4).
Reaccions d'oxidació-reducció[modifica]
En la forma oberta de la glucosa el grup aldehid queda lliure, de tal manera que pot experimentar reaccions típiques del grup, com les d'oxidació-reducció. L'oxidació suau de la glucosa transforma el grup aldehid en un grup carboxil i origina l'àcid D-glucònic. D'altra banda, l'oxidació del grup hidroxil del C₆ origina l'àcid D-glucurònic, un component important de molts polisacàrids.
Funcions[modifica]

Es pot especular sobre les raons per les quals la glucosa, i no un altre monosacàrid, com per exemple la fructosa, està tan àmpliament representada -al llarg de l'evolució- en el metabolisme de totes les formes de vida. La glucosa es pot originar en condicions abiòtiques a partir del formaldehid, de manera que hauria pogut ser present i disponible en els sistemes bioquímics primitius. És probable que en aquest fet hi sigui més determinant la baixa tendència de la glucosa, si la comparem amb altres sucres, a reaccionar de manera no específica amb els grups amino de les proteïnes. Aquesta reacció de glicosilació no enzimàtica redueix o impossibilita el funcionament de molts enzims i el fet que tingui una taxa baixa d'ocurrència es deu a la preferència de la glucosa per la forma cíclica, menys reactiva. De totes maneres, moltes de les complicacions a llarg termini de la diabetis (per exemple, la ceguesa, la fallada renal i la neuropatia perifèrica) estan probablement relacionades amb la glicosilació de proteïnes o lípids. En contrast, l'addició enzimàtica de glucosa a les proteïnes mitjançant glucosilació és sovint essencial per a la seva funció.
Font d'energia[modifica]
La glucosa és el combustible universal dels organismes aeròbics.[4] La utilitzen com a font d'energia des dels bacteris fins a les plantes i els animals, inclosos els éssers humans. La glucosa es pot utilitzar mitjançant la respiració aeròbica (aleshores proporcionen aproximadament 4 quilocalories (17 quilojoules) d'energia per gram) o bé a través de la fermentació.[4][5] En el cas dels éssers humans les vies metabòliques que segueix aquest compost presenten diferències, com es pot observar a la imatge. La hidròlisi de glúcids complexos, per exemple el midó, origina disacàrids i monosacàrids, principalment glucosa. La glucosa s'oxida fins a CO₂ i aigua mitjançant la respiració cel·lular, amb la glicòlisi i les posteriors reaccions del cicle de l'àcid cítric (cicle de Krebs), en un procés que allibera energia, principalment en forma d'ATP.[4]
La glucosa a la glucòlisi[modifica]
Les cèl·lules poden utilitzar la glucosa mitjançant la respiració cel·lular aeròbica o la fermentació. Ambdues vies comencen amb la via metabòlica de la glucòlisi. El primer pas és la fosforilació de la glucosa per acció de l'enzim hexocinasa, un pas necessari que la prepara per ser trencada i obtenir així energia. La principal raó per la qual es fa aquesta fosforilació és evitar que la glucosa pugui sortir de la cèl·lula, ja que la fosforilació transforma la glucosa en glucosa-6-fosfat, que conté un grup fosfat carregat negativament, la qual cosa li impedeix de travessar la membrana plasmàtica. El grup fosfat li confereix una alta reactivitat i permet que la glucosa pugui ésser integrada en polisacàrids (funció estructural o de reserva) o bé pugui ésser destinada a la glicòlisi (funció energètica).[4]
| ||||||||||||||||||||
Precursor químic[modifica]
La glucosa, especialment la forma fosforilada, és un compost crític per a la producció de proteïnes i de lípids. A més, en les plantes i en molts animals, és també el precursor per a la producció de la vitamina C (àcid ascòrbic). Algunes substàncies importants per als éssers vius -polisacàrids com el midó, la cel·lulosa o el glicogen- són polímers de glucosa. La lactosa, el sucre més abundant a la llet, és un disacàrid de glucosa i galactosa, mentre que la sacarosa, el sucre comú o sucre de canya, un altre disacàrid important, és format per glucosa i fructosa.
Origen natural[modifica]

La glucosa arriba als organismes mitjançant tres mecanismes bàsics:
- La fotosíntesi de les plantes verdes i alguns procariotes com els cianobacteris.[6]
- La degradació de polisacàrids complexos, com el midó o el glicogen (glicogenolisi).
- La síntesi, anomenada gluconeogènesi, a partir de compostos diversos (lactat, piruvat, glicerol…) que s'esdevé al fetge i als ronyons dels animals.[7]
Patologies[modifica]
Diabetis[modifica]
La diabetis és una síndrome de metabolisme alterat, en la qual el cos no és capaç de regular els nivells de glucosa en sang, ja sigui per una falta d'insulina al cos (diabetis tipus 1)[8][9] o a causa de que les cèl·lules del cos no reconeixen correctament a la insulina (diabetis tipus 2);[8][10] en els dos casos es resultat és hiperglucèmia, és a dir, nivells de glucosa en sang anormalment alts.[11] La insulina és una hormona, fabricada pel pàncrees, que regula els nivells de glucosa en sang, permetent que el cos absorbeixi i utilitzi la glucosa, segons les necessitats, i els manté dins els valors normals.[12] Sense aquesta hormona, la glucosa no pot entrar a a la cèl·lula i, per tant, el cos no la pot utilitzar com a font d'energia i s'acumula a la sang.[13]
Per les persones amb diabetis, és important mantenir els nivells de glucosa en sang dins els valors normals.[14] Aquesta fita, en general, es pot aconseguir amb canvis a la dieta, un augment en la quantitat d'exercici, amb pèrdua de pes i amb l'ús de medicació apropiada, com pot ser la insulina.[14]
Notes[modifica]
- ↑ «Monografies mèdiques» publica una nota demanant si no fora millor de dir glicosa en lloc de glucosa. El mot glicosa vindria llavors a fer costat a glicocol·la, glicosúria, etc., el primer element dels quals és el mot grec glukus, dolç. Si el primer element d'aquell mot vol ésser el mateix que el d'aquests, glicosa seria evidentment el sol mot acceptable; i ja en anglès i en francès s'ha intentat de reemplaçar glucose per glycose. El que sembla, però, que el qui proposà el mot glucosa, no formà aquest mot traient-lo de glukus, sinó de gleukos, vi dolç. Si és així, això explicaria la divergència entre la primera síl·laba de glucosa i la dels mots que realment contenen com a primer element l'adjectiu glukus. Però la lletra "u" hi és de totes maneres irregular, puix que el mot originari conté el grup eu (Cp. leucocit, de leukos, blanc). Glucosa és, així, evidentment, un mot mal fet: llavors, tenint en compte que la glucosa és una substància dolça, podríem, sembla, abandonant el mot glucosa, adoptar glicosa, tret de glukus, dolç (com glicocol·la, glicosúria, etc.). Nosaltres, però, potser ens inclinaríem a respectar glucosa –que és ja d'un ús general–, almenys mentre no es convingui arreu a substituir-lo per un mot derivat de glukus. Pompeu Fabra, Converses filològiques, pàg. 762-763
- ↑ La combinació de cafeïna i glucosa afavoreix l'atenció i la memòria verbal, BUC - Revista de la Xarxa Vives d'Universitats, Tardor 2010. Codi ISSN 1888-7414
Referències[modifica]
- ↑ «Glucose». Encyclopædia Britannica, 05-04-2023. Arxivat de l'original el 18 març 2023. [Consulta: 19 abril 2023].
- ↑ «Merriam-Webster Online Dictionary». [Consulta: 15 setembre 2009]. «dextrose»
- ↑ «Carbohydrates». ScienceDirect. Arxivat de l'original el 21 octubre 2021. [Consulta: 19 abril 2023].
- ↑ 4,0 4,1 4,2 4,3 Naifeh, Jeffrey; Manjari, Dimri; Matthew, Varacallo. «Biochemistry, Aerobic Glycolysis». National Institutes of Health, 09-01-2023. [Consulta: 19 abril 2023].
- ↑ «Chapter 3: Calculation of the Energy Content of Foods – Energy Conversion Factors». Food energy – methods of analysis and conversion factors. Arxivat de l'original el 21 març 2023. [Consulta: 19 abril 2023].
- ↑ «Photosynthesis». National Geographic, 15-07-2022. Arxivat de l'original el 7 abril 2023. [Consulta: 19 abril 2023].
- ↑ Moisés, Pérez-Mendoza; De Ita-Pérez, Dalia; De Ita-Pérez, Mauricio «GLUCONEOGÉNESIS: UNA VISIÓN CONTEMPORÁNEA DE UNA VÍA METABÓLICA ANTIGUA». Instituto de Neurobiología, Campus UNAM-Juriquilla, 31, 1, 2012, pàg. 10-20 [Consulta: 19 abril 2023].
- ↑ 8,0 8,1 «Symptoms & Causes of Diabetes». National Institute of Diabetes and Digestive and Kidney Diseases, 2016. Arxivat de l'original el 7 octubre 2022. [Consulta: 19 abril 2023].
- ↑ «Diabetes». Organització Mundial de la Salut. Arxivat de l'original el 26 agost 2013. [Consulta: 19 abril 2023].
- ↑ «Definition, Diagnosis and Classification of Diabetis Mellitus and its Complications». Organització Mundial de la Salut, 1999. Arxivat de l'original el 8 març 2003. [Consulta: 19 abril 2023].
- ↑ «Hiperglucèmia». gencat.cat. Arxivat de l'original el 25 febrer 2021. [Consulta: 19 abril 2023].
- ↑ Dibner, Charna; Schibler, Ueli «A pancreatic clock times insulin release» (en anglès). Science, 350, 6261, Novembre 2015, pàg. 628-629 [Consulta: 19 abril 2023].
- ↑ «What is Diabetis?». National Institute of Diabetes and Digestive and Kidney Diseases, Desembre 2016. Arxivat de l'original el 14 d’abril 2023. [Consulta: 19 abril 2023].
- ↑ 14,0 14,1 «Managing Diabetes». National Institute of Diabetes and Digestive and Kidney Diseases, desembre 2016. Arxivat de l'original el 6 de març 2023. [Consulta: 19 abril 2023].
Vegeu també[modifica]
Bibliografia complementària[modifica]
- Solomons, T. W. Graham. Química orgánica (en castellà). 1. ed. Mexico: Limusa, 1979. ISBN 968-18-0982-3.
- Voet, Donald. Bioquímica (en castellà). Barcelona: Omega, 1990. ISBN 84-282-0906-5.