Inhibidor de l'enzim conversiu de l'angiotensina
| Dades clíniques | |
|---|---|
| Grup farmacològic | Inhibidor de la proteasa |
| Codi ATC | C09A |
| ChEBI | 35457 |
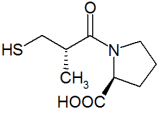
Els inhibidors de l'enzim conversiu de l'angiotensina (IECA)[1] són una classe de medicaments que s'empren principalment en el tractament de la hipertensió arterial i la insuficiència cardíaca crònica. Formen part de la inhibició d'una sèrie de reaccions que regulen la pressió sanguínia, el sistema renina-angiotensina-aldosterona. Les substàncies inhibidores ECA van ser descobertes per primera vegada en verins de serps i actuen inhibint l'enzim que actua en la conversió de l'angiotensina I a angiotensina II. Els inhibidors ECA més importants utilitzats en tractaments són: el captopril, l'enalapril, el lisinopril i el ramipril. Són uns dels fàrmacs més venuts per la seva gran importància terapèutica.
Història
[modifica]
El 1956 aparegueren les bases pel desenvolupament dels inhibidors ECA quan Leonard T. Skeggs aïllà i aconseguí explicar el funcionament de l'enzim de conversió de l'angiotensina (ECA) sense subestimar la importància d'aquest enzim per a la regulació de la pressió sanguínia.[2][3]
Catorze anys després del descobriment de l'enzim de conversió de l'angiotensina (1970), el farmacòleg Sergio H. Ferreira descobrí que el verí del jararacà (Bothrops jararaca) és capaç d'inhibir aquest enzim in vitro. Així mateix, amb el pentapèptid BPP5a d'aquest verí de serp s'aïllà un dels components efectors d'aquesta acció inhibitòria.[4]
Com que el BPP5a és molt inestable a l'organisme, gairebé immediatament s'inicià la cerca d'inhibidors de l'enzim més potents i estables. El 1971 es descobrí l'efecte inhibidor de l'ECA del nonapèptid tepròtid, que té efectes hipotensors molt similars al del verí del jararacà.[5]
Igualment, a principis de la dècada de 1970 es descobrí l'estructura parcial efectiva del pèptid BPP5a i del tepròtid, ambdós inhibidors de l'ECA. A partir d'aquests descobriments es desenvoluparen nous inhibidors ECA no pèptids. El 1974 es descrigué per primera vegada l'inhibidor ACA captopril, que era el producte de la cerca a gran escala d'un fàrmac (tamisat) per l'empresa farmacèutica Squibb.[6] El 1981 aquesta fou la primera substància emprada com a inhibidor ECA en un tractament. Dos anys més tard es comercialitzà un segon inhibidor ACA, l'enalapril.
Per tal de minimitzar els efectes adversos i aprofitar l'èxit terapèutic i econòmic del captopril i l'enalapril, es desenvolupà una segona generació d'inhibidors ACE disponibles al mercat des de principis dels anys 1990, com ara el lisinopril i el ramipril.
Composició química
[modifica]
Els inhibidors ECA com el captopril, l'enalapril i les seves substàncies derivades tenen una estructura similar a la del pèptid BPP5a o pèptid potenciador de la bradiquinina, (BPP, sigles de l'anglès bradykinin-potentiating peptide); aïllat del verí de la serp jararacà (Bothrops jararaca). S'ha descobert que la seqüència tripeptídica de triptòfan-alanina-prolina que apareix al BPP5a és un dels components actius d'aquesta molècula.[7]
Com que el cos elimina molt ràpidament el BPP5a i el tripèptid, s'han dut a terme moltes modificacions de la molècula per perllongar-ne l'efecte, incloent-hi el canvi de la seqüència de triptòfan-alanina-prolina per una seqüència semblant però més estable de fenilalanina-alanina-prolina. L'aportació d'una estructura anàloga a l'àcid succínic o l'àcid glutàmic li proporcionà més estabilitat i en reforçà les propietats inhibidores de l'enzim de conversió de l'angiotensina.
Tots els inhibidors ECA d'ús terapèutic excepte el captopril i el lisinopril són profàrmacs que s'activen en entrar al cos. En el cas de l'enalapril i el ramipril, aquest procés es produeix mitjançant la separació del grup etil per part d'esterases, produint la forma activa (enalaprilat i ramiprilat) amb un grup carboxil lliure, que és capaç de formar complexos amb el zinc de l'ECA.
Indicacions
[modifica]Els inhibidors ECA s'empren principalment per al tractament de la hipertensió, per la qual cosa es consideren en molts casos, tan sols (tractament únic o monoteràpia) com en combinació amb altres hipotensors (tractament combinat, especialment amb diürètics o blocadors dels canals de calci), el remei preferent.[8] Per això es troba al mercat com una formulació de productes que combinen un IECA amb un diürètic tiazida, com és el cas de la hidroclorotiazida en tauleta per administració directa a pacients que ho requereixin. En canvi, en certes formes d'hipertensió acompanyades d'un nivell reduït de renina al plasma sanguini (com la malaltia de Crohn), els inhibidors ECA mostren una efectivitat insuficient.
A més, nombrosos assajos clínics han demostrat que els inhibidors de l'enzim convertidor d'angiotensina han permès reduir la morbiditat i allargar la vida de pacients amb insuficiència cardíaca crònica[9] Això és degut probablement a la disminució de la postcàrrega i la reducció de la tensió de la paret del miocardi mitjançant la reducció de l'angiotensina II.
S'empren inhibidors ECA fins i tot després d'infarts de miocardi, reduint la morbiditat i la mortalitat en els pacients que segueixen aquest tractament. S'ha demostrat que l'enalapril millora considerablement la qualitat de vida de pacients amb disfunció ventricular esquerra, disminuint la velocitat d'aparició de l'engrandiment ventricular.[10]
Una altra indicació dels inhibidors ECA és la nefropatia diabètica, tant en la prevenció de la malaltia com als estadis inicials. Els IECA mantenen la funció renal independent del control de la tensió arterial i disminueixen la proteïnúria en pacients diabètics tant normotensos com hipertensos.[11] Tot i que no sempre s'aconsegueix impedir el progrés d'una nefropatia diabètica, els IECA tendeixen a revertir la fase de microalbuminúria de la malaltia.[12]
Mecanisme d'acció
[modifica]
El mecanisme d'acció dels inhibidors ECA consisteix a inhibir l'enzim que actua en la conversió de l'angiotensina I en angiotensina II. Aquest enzim té dues funcions principals a l'organisme. D'una banda, s'encarrega de sintetitzar l'angiotensina II, un octapèptid (pèptid format per vuit aminoàcids) vasoconstrictor efectiu, a partir del seu preestadi inactiu, el decapèptid (deu aminoàcids) angiotensina I, separant dos aminoàcids de l'extrem C terminal de la molècula. De l'altra banda, catalitza l'eliminació del mediador bradiquinina en productes inactius.[13]
La vasoconstricció a través de l'angiotensina II és ràpida i intensa a nivell de les arterioles, però no tant a nivell de les venes. La constricció arteriolar augmenta la resistència vascular perifèrica respecte al cor, augmentant així la pressió arterial.[14] La constricció venosa augmenta el retorn venós. L'angiotensina II també augmenta la pressió arterial pel seu efecte renal, disminuint l'excreció del catió sodi i aigua i fent que el volum extracel·lular augmenti.
La inhibició de l'enzim que converteix l'angiotensina en un vasoconstrictor actiu fa que la concentració d'angiotensina II disminueixi a nivell dels receptors d'angiotensina (AT1 i AT₂). Això redueix el to vascular, cosa que mitiga la resistència vascular sistèmica i la pressió sanguínia, tant sistòlica com diastòlica, disminueix.[14][15] A continuació, la reducció del nivell d'angiotensina II provoca una reducció de la secreció de l'hormona aldosterona de la glàndula suprarenal, determinant el contingut d'aigua. Es creu que l'angiotensina pot ser produïda en altres teixits, incloent-hi el cor.[13] A nivell cel·lular, es pot observar un retrocés dels efectes dels mitògens induïts per l'angiotensina II als fibroblasts i miòcits del cor, que causen alteracions adverses especialment després d'un infart de miocardi (remodelació).[16]
La bradiquinina és un potent vasodilatador que actua mitjançant l'alliberament de l'òxid nítric i prostaciclina. Alguns dels IECA són capaços de mantenir l'acció de la bradiquinina produint una disminució de la resistència vascular perifèrica i, per tant, la pressió arterial.[13]
En cas de malalties renals com la nefropatia diabètica, els inhibidors ECA provoquen una menor eliminació de proteïnes (proteïnúria) i prevenen l'avanç de la malaltia (nefroprotecció).
La inhibició de l'eliminació de la bradiquinina en promou l'acumulació i els efectes secundaris.
Mecanisme d'efecte molecular
[modifica]També s'ha pogut explicar el mecanisme d'efecte molecular dels inhibidors ECA. Es basa en la semblança dels inhibidors ECA amb un dels extrems de la cadena de pèptids de l'angiotensina I. Així, l'enzim de conversió de l'angiotensina pren els inhibidors ECA pel substrat fisiològic de l'angiotensina I. No obstant això, i a diferència del que passa amb el substrat (bioquímica) fisiològic, l'enzim no es transforma, sinó que queda bloquejada per ells.
| Mecanisme d'efecte molecular dels inhibidors ECA: Els inhibidors ECA (per exemple, l'enalaprilat) s'enllacen al domini d'unió al lligand de l'enzim de conversió de l'angiotensina (ECA, en lloc del substrat d'angiotensina I), bloquejant aquest enzim. |
Farmacologia
[modifica]La farmacocinètica dels inhibidors CECA varia segons les seves diferències químiques. La majoria d'inhibidors ECA disponibles actualment són profàrmacs, cosa que implica que després d'una absorció d'un 20% (ramipril) a gairebé un 100% (resorció) han de ser activats per l'acció d'enzims presents al cos. Els únics que no necessiten aquest pas són el captopril i el lisinopril. Al cap d'entre una i vuit hores s'assoleix el nivell màxim de forma efectiva en plasma. La vida mitjana d'eliminació oscil·la entre dues (captopril) i quaranta hores (espirapril). La durada de l'efecte varia de la manera corresponent (vuit a quaranta-vuis hores). Els inhibidors ECA són eliminats principalment pels ronyons. A més, el fosinopril, el moexipril i l'espirapril mostren una excreció biliar significativa.[13]
Efectes secundaris
[modifica]La majoria dels efectes secundaris dels inhibidors ECA es relacionen amb una lenta eliminació i acumulació de la bradicinina. Inclouen reaccions cutànies com exantemes (0,1 - 1%) i urticària en fins a un 10% dels pacients. En canvi, són rares les reaccions al·lèrgiques cutànies greus (<0,01%). L'efecte secundari considerat característic dels inhibidors ECA, l'aparició d'edemes angioneuròtics, s'ha pogut observar en casos molt aïllats (0,01 - 0,1%).[17]
La majoria d'efectes secundaris que afecten les vies respiratòries també es poden relacionar amb l'acumulació de bradicinina. Entre ells es troben la tos seca,[13][18] la disfonia i el mal de coll (0,1 - 1%). També, poden aparèixer atacs d'asma i insuficiència respiratòria, tot i que són inusuals (0,01 - 0,1%).
Durant el tractament amb inhibidors de l'ECA, el pacient pot patir una forta hipotensió independentment de l'acció de la bradicinina. Per tant, es poden observar marejos, mal de cap i sopor (0,1 - 1%). Només en casos aïllats s'han registrat episodis cardiovasculars greus, com angina de pit, infart de miocardi i síncope. A causa del seu efecte sobre el contingut d'aigua i electròlits al cos, l'ús de IECA pot produir trastorns renals funcionals (0,1 – 1%) en determinats pacients. En canvi, molt rarament s'ha observat proteïnúria (eliminació de les proteïnes en l'orina) (0,01 - 0,1%).
Els efectes del sistema-renina-angiotensina-aldosterona amb reducció de la secreció de l'aldosterona són els responsables d'un altre efecte indesitjat dels IECA: d'una banda, l'aldosterona potència la reabsorció de sodi i aigua als ronyons, i de l'altra, facilita l'eliminació de potassi. Una concentració reduïda d'aldosterona provoca l'efecte contrari: una major eliminació de sodi i aigua pels ronyons i una major retenció de potassi al cos. D'aquesta manera, pot arribar a produir-se una hiperpotassèmia, especialment perillosa pel cor i freqüent en pacients diabètics i amb insuficiència renal.[13][12] Rarament es produeix una hiponatrèmia. Això té importància en intervencions quirúrgiques de pacients que utilitzen IECA crònicament, augmentant el risc de trastorns en el balanç hídric durant l'operació per l'administració d'anestèsia, cosa que al seu torn disminueix el volum hídric que arriba al ventricle cardíac, causant una hipotensió superior a la desitjada.[14]
Com que els inhibidors de l'ECA poden ocasionar, entre d'altres, hipotensió fetal, insuficiència renal i trastorns del creixement i formació òssia del nadó durant l'embaràs, a més d'estar relacionats amb una taxa de mortalitat elevada, no han de ser administrats durant aquest període, sinó que han de ser substituïts per altres mesures terapèutiques indicades.[12]
Interaccions amb altres medicaments
[modifica]Els inhibidors de l'enzim convertidor d'angiotensina reforcen els efectes secundaris transformadors d'hemograma dels fàrmacs d'efecte immunosupressor (immunosupressors, citostàtics i glucocorticoides). Igualment, els inhibidors ECA potencien l'efecte de reducció de sucre en la sang dels antidiabètics orals i la insulina.
Els IECA poden reduir la velocitat d'eliminació del liti que té, entre altres indicacions, la profilaxi del trastorn afectiu bipolar i el tractament de la mania i la hipomania. De la mateixa manera, es pot observar una potenciació de l'increment del nivell de potassi (hiperpotassèmia) amb l'ús combinat amb diürètics conservadors de potassi o amb suplements de potassi.
Els antiinflamatoris no esteroidals tendeixen a minimitzar els efectes hipotensors dels IECA a través de la bradiquinina.
En combinació amb altres fàrmacs hipotensors, cal controlar si es produeix una caiguda de la pressió sanguínia. Els efectes sinèrgics, que també es poden aprofitar en el marc de tractaments, apareixen especialment amb diürètics i bloquejadors del canal de calci. S'ha pogut observar una reducció en l'efecte de disminució de la pressió sanguínia dels inhibidors ECA després de la ingestió d'aliments salats.
Prendre aspirina conjuntament amb un IECA pot millorar la supervivència de pacients amb insuficiència cardíaca o una cardiopatia isquèmica.[19]
Fàrmacs
[modifica]Fàrmacs comercialitzats al mercat espanyol:[20]
- Captopril (EFG, Capoten), el primer.
- Enalapril (EFG, Acetensil, Baripril, Crinoren, Dabonal, Herten, Hipoartel, Naprilene, Renitec), el més emprat.
- Fosinopril (EFG, Fositens)
- Lisinopril (EFG, Doneka, Prinivil, Zestril)
- Perindopril (EFG, Coversoral, Coversyl)
- Quinapril (EFG, Acuprel, Ectren, Lidaltrin)
- Trandolapril (Gopten)
- Ramipril (EFG, Acovil)
Alguns compostos naturals com les casoquinines i lactoquinines (productes bioactius de la descomposició de la caseïna i el sèrum de llet), especialment presents en productes fermentats de la llet, poden tenir un paper en el control de la tensió arterial[21] similar al dels IECA.[22] Els compostos tripeptídics Val-Pro-Pro i Ile-Pro-Pro produïts pel Lactobacillus helveticus probiòtic també han estat associats a funcions antihipertensives per inhibició de l'ECA.[23]
Alternatives
[modifica]Les noves substàncies del grup dels antagonistes del receptor de l'angiotensina II ja no inhibeixen l'enzim de conversió de l'angiotensina, sinó que tenen un efecte antagonista sobre el subtipus del receptor 1 de l'angiotensina II, reduint possiblement l'aparició d'efectes secundaris.[13] No obstant això, els antagonistes AT1 continuen sent molt més cars que els inhibidors ECA, motiu pel qual no han arribat a substituir-los. La millor tolerància és deguda al fet que no afecten el sistema de la bradiquinina.
Els inhibidors de la vasopeptidasa com l'omapatrilat deriven dels inhibidors ECA clàssics i estan a punt de ser homologats per les autoritats sanitàries.[24] A més d'inhibir l'enzim conversiu de l'angiotensina, els inhibidors de la vasopeptidasa bloquegen l'endopeptidasa neutra, un enzim encarregat des desactivar les atriopeptines (ANP), que relaxen els vasos sanguinis.
Un altre nou punt d'intervenció rau en l'inhibidor de l'enzim renina secretat pels ronyons i que s'encarrega de sintetitzar l'angiotensina I. Amb l'A-72.517 s'està sotmetent a un assaig clínic un inhibidor selectiu d'aquest enzim.
Medicina intensiva
[modifica]A la medicina intensiva s'ha observat que els pacients que han rebut un tractament amb inhibidors ECA abans de la seva estada a la unitat de cures intensives requereixen sovint un major consum de catecolamines per tal d'estabilitzar la pressió arterial. El motiu podria ser una manca d'hormona antidiürètica, atribuïble a una teràpia anterior amb inhibidors ECA. La substitució de l'hormona antidiürètica, especialment en pacients que es troben en un dilema de catecolamina, pot reduir ràpidament la necessitat de catecolamines (sempre que no hi hagi altres causes de la hipotensió) i en un període comprès entre 12 i 24 hores pot compensar l'hormona antidiürètica.
En pacients amb insuficiència cardíaca s'ha observat que alguns deixen de prendre els IECA prescrits en rebre l'alta mèdica o en menys d'un mes després de sortir de l'hospital. Un estudi demostrà que prop d'un 33% d'aquests pacients deixen de prendre els IECA prescrits al cap d'un any, indicant la necessitat de fer seguiment a les quals es prescrigui medicaments IECA.[25]
Referències
[modifica]- ↑ Consulta Termcat 2020: Ni conversor ni convertiu són adequats; tampoc convertidor en aquest cas.
- ↑ Leonard T. Skeggs, Jr., Joseph R. Kahn i Norman P. Shumway. The preparation and function of the hypertensin-converting enzyme (article complet disponible en anglès). J Exp Med. 1956 February 29; 103(3): 295-299. Consultat el 16 de juny del 2008.
- ↑ Leonard T. Skeggs, Jr., Walton H. Marsh, Joseph R. Kahn i Norman P. Shumway. The existence of two forms of hypertensin (article complet disponible en anglès). J Exp Med. 1954 February 28; 99(3): 275-282. Consultat el 16 de juny del 2008.
- ↑ Lewis I. Greene; Sergio H. Ferreira i John Ad. Stewart.Bradykinin Potentiating Factor[Enllaç no actiu](anglès). Chest, vol 59, No. 59, maig del 1971. Consultat el 16 de juny del 2008.
- ↑ VandenBurg MJ, Sharman VL, Morton JJ, Williams GH, Marsh FP. Hormonal and blood pressure changes during converting enzyme inhibition by teprotide (anglès). Postgrad Med J. 1981 May;57(667):283-8. Consultat el 16 de juny del 2008.
- ↑ Charles G. Smith i John R. Vane. The Discovery of Captopril (article complet disponible en anglès). The FASEB Journal. 2003;17:788-789. Consultat el 16 de juny del 2008.
- ↑ Gainer JV, Morrow JD, Loveland A, King DJ, Brown NJ «Effect of bradykinin-receptor blockade on the response to angiotensin-converting-enzyme inhibitor in normotensive and hypertensive subjects». N. Engl. J. Med., 339, 18, 1998, pàg. 1285-92. PMID: 9791144.
- ↑ James Mason et al. Safety and costs of initiating angiotensin converting enzyme inhibitors for heart failure in primary care: analysis of individual patient data from studies of left ventricular dysfunction (article complet disponible en anglès). BMJ 2000;321:1113-1116,1095-1096. Consultat el 17 de juny del 2008.
- ↑ Lalljie, GR i Lalljie, SE. "Characteristics, treatment and short-term survival of patients with heart failure in a cardiology private practice in Jamaica." West Indian Med. J. [en línia]. 2007, vol. 56, no. 2 [citat el 16-06-2008], pàg. 139-143. Disponible a: scielo.org Arxivat 2009-02-17 a Wayback Machine.. ISSN 0043-3144
- ↑ Greenberg B, Quinones MA, Koilpillai C, Limacher M, Shindler D, Benedict C, Shelton. Effects of long-term enalapril therapy on cardiac structure and function in patients with left ventricular dysfunction. Results of the SOLVD echocardiography substudy Arxivat 2008-10-06 a Wayback Machine. (article complet disponible en anglès). Circulation 1995 May 15;91(10):2573-2581. Últim accés 17 de juny de 2008.
- ↑ Gutiérrez, Carlos; Suárez, Juan C. "Nefropatía diabética: prevención o retraso por el médico general integral versus lamentos del nefrólogo." Rev Cubana Med Gen Integr [en línia]. 1997, vol. 13, no. 1 [citat el 17-06-2008], pàg. 19-27. Disponible a: «scielo.org».
- ↑ 12,0 12,1 12,2 Jara Albarrán, A. "Nefropatía diabética". An. Med. Interna (Madrid). [en línia]. 2001, vol. 18, no. 4 [citat el 18-06-2008], pàg. 5-6. Disponible a: «isciii.es». ISSN 0212-7199
- ↑ 13,0 13,1 13,2 13,3 13,4 13,5 13,6 Katzung, Bertram G. «11». A: Basic & Clinical Pharmacology. 9a ed.. McGraw-Hill, 2007, p. 250-253. ISBN 0071451536.
- ↑ 14,0 14,1 14,2 Jordao, Míriam Gomes; Santos, Ari Tadeu Lírio dos. "Arterial hypotension in myocardial revascularization surgery: influence of angiotensin-converting enzyme inhibitors." Rev. Bras. Anestesiol. [en línia]. 2002, vol. 52, no. 2 [citat el 16 de juny del 2008], pàg. 209-216. Disponible a «scielo.org». ISSN 0034-7094 doi:10.1590/S0034-70942002000200008
- ↑ Heran BS, Wong MM, Heran IK, Wright JM «Blood pressure lowering efficacy of angiotensin converting enzyme (ACE) inhibitors for primary hypertension». Cochrane database of systematic reviews, 2008 [Consulta: 8 juny 2022].
- ↑ Garg, R; Yusuf, S «Overview of randomized trials of angiotensin-converting enzyme inhibitors on mortality and morbidity in patients with heart failure». JAMA, 273, 18, 1995, pàg. 1450-6. PMID: 7654275.
- ↑ Scheirey CD, Scholz FJ, Shortsleeve MJ, Katz DS «Angiotensin-converting enzyme inhibitor-induced small-bowel angioedema: clinical and imaging findings in 20 patients.». AJR Am J Roentgenol, 197, 2, 2011, pàg. 393-8. DOI: 10.2214/AJR.10.4451. PMID: 21785085 [Consulta: 8 juny 2022].
- ↑ Morimoto T, Gandhi TK, Fiskio JM «Development and validation of a clinical prediction rule for angiotensin-converting enzyme inhibitor-induced cough». J Gen Intern Med, 19, 6, 2004, pàg. 684-91. DOI: 10.1111/j.1525-1497.2004.30016.x. PMC: 1492376. PMID: 15209608.
- ↑ Leor J, Reicher-Reiss H, Goldbourt U, et al. Aspirin and mortality in patients treated with angiotensin-converting enzyme inhibitors: a cohort study of 11,575 patients with coronary artery disease (article complet disponible en anglès). J Am Coll Cardiol. 1999;33:1920-1925. Consultat el 17 de juny del 2008.
- ↑ «Centro de Información online de Medicamentos de la AEMPS - CIMA». Madrid: AEMPS. Ministerio de Sanidad, Servicios Sociales e Igualdad, 2017.
- ↑ FitzGerald RJ, Murray BA, Walsh DJ. Hypotensive peptides from milk proteins. J Nutr 2004;134:980S-8S. PMID: 15051858
- ↑ María de Jesús Torres-Llanez, Belinda Vallejo-Cordoba y Aarón Fernando González-Córdova. Péptidos bioactivos derivados de las proteínas de la leche Arxivat 2008-06-10 a Wayback Machine. (text complet disponible en castellà). Archivos Latinoamericanos de Nutrición Año 2005, volum 55 - número 2. Consultat el 16 de juny del 2008.
- ↑ Aihara K, Kajimoto O, Hirata H, Takahashi R, Nakamura Y. Effect of powdered fermented milk with Lactobacillus helveticus on subjects with high-normal blood pressure or mild hypertension. Arxivat 2008-04-13 a Wayback Machine. J Am Coll Nutr. Agost del 2005;24(4):257-65 PMID: 16093403
- ↑ Juan Tamargo i José López-Sendón. Bases y evidencias clínicas de los efectos de los nuevos tratamientos farmacológicos en la insuficiencia cardíaca (article complet disponible en castellà). Avances en el tratamiento de la insuficiencia cardíaca (IV). Maig del 2004. Número 05- volum 57 pàg. 447 - 464. Consultat el 16 de juny del 2008.
- ↑ Javed Butler, Patrick Arbogast, James Daugherty, Manoj Jain, Wayne Ray, Marie Griffin. Outpatient utilization of angiotensin-converting enzyme inhibitors among heart failure patients after hospital discharge(anglès). J Am Coll Cardiol. 2 de juny del 2004, volum 43, número 11, pàgines 2036-2043. Consultat el 17 de juny del 2008.
Biografia
[modifica]- D. W. Cusham, M. A. Ondetti: History of the design of captopril and related inhibitors of angiotensin converting enzyme. A: Hypertension. 17.1991, 589-592
- S. H. Ferreira, L. H. Greene, V. A. Alabaster, Y. S. Bakhle, J. R. Vane: History of the design of captopril and related inhibitors of angiotensin converting enzyme. a: Nature. Macmillan Journals, London 225.1970, 379-380. ISSN 0028-0836
Vegeu també
[modifica]Enllaços externs
[modifica]- Inhibidors de l'enzim conversiu de l'angiotensina (ECA) Centre d'Informació Cardiovascular (Institut del Cor de Texas)(castellà)
- Efectes fisiològics i fisiopatològics de l'angiotensina II Arxivat 2008-06-16 a Wayback Machine. Diagrama de flux en castellà. Programa d'actualització contínua per cardiologia.(castellà)
