Procés termodinàmic
Un procés termodinàmic és el desenvolupament energètic d'un sistema termodinàmic que avança des d'un estat inicial fins a un estat final. Els camins a través de l'espai de variables termodinàmiques se solen especificar mantenint certes variables termodinàmiques constants. Una funció d'estat és una variable termodinàmica que depèn només de l'estat actual del sistema i no pas del camí pres per arribar a tal estat. En canvi, una funció de procés sí que depèn del camí.
Descripció[modifica]
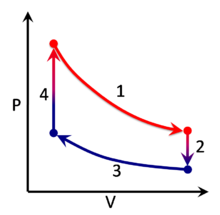
Un procés termodinàmic es pot visualitzar dibuixant gràficament els canvis en les variables d'estat del sistema. En l'exemple de la dreta, es mostren quatre processos. Cada procés té uns punts d'inici i finalització ben definits. En aquest exemple particular, els processos 1 i 3 són isotèrmics (o isoterms), mentre que els processos 2 i 4 són isocors. El diagrama PV és particularment útil per visualitzar un procés, ja que l'àrea sota la corba del procés és la quantitat de treball fet pel sistema durant aquest procés. El treball es considera, doncs, una variable de procés, ja que el seu valor exacte depèn del camí que s'hagi triat per anar des del punt inicial del camí al punt final. D'una manera similar, la calor pot ser transferida durant el procés, per la qual cosa també és una variable de procés. En canvi, la pressió i el volum (així com moltes altres propietats) es consideren variables d'estat perquè els seus valors depenen només de la posició dels punts d'inici i finalització, i no del camí entre aquests.
Processos de variables conjugades[modifica]
És interessant agrupar els processos termodinàmics en parells en els quals cada variable que es manté constant és un membre d'un parell conjugat de variables termodinàmiques.
Pressió-volum[modifica]
El parell conjugat pressió-volum té a veure amb la transferència d'energia mecànica o dinàmic com a resultat del treball.
- Un procés isobàric té lloc a pressió constant. Un exemple seria un pistó movible en un cilindre, de tal manera que la pressió dins del cilindre és sempre la pressió atmosfèrica encara que estigui aïllat de l'atmosfera. En altres paraules, el sistema està dinàmicament connectat, amb una frontera movible, a una dipòsit a pressió constant.
- Un procés isocor té lloc a volum constant, de tal manera que el treball fet pel sistema serà zero. D'això se'n desprèn que, per un sistema simple bidimensional, qualsevol energia calorífica transferida al sistema externament s'absorbeix en forma d'energia interna. Un exemple seria col·locar una llauna tancada d'estany que contingués només aire dins de foc; en una primera aproximació, la llauna no s'expandirà, i l'únic canvi serà que el gas guanyarà energia interna, tal com s'evidenciarà per l'increment de temperatura i pressió. Matemàticament, . Es pot dir que el sistema es troba dinàmicament isolat de l'entorn per una frontera rígida.
Temperatura-entropia[modifica]
El parell conjugat temperatura-entropia té a veure amb la transferència d'energia tèrmica com a resultat de l'escalfament.
- Un procés isotèrmic (o procés isoterm) té lloc a temperatura constant. Un exemple seria tenir un sistema immers en un gran bany de temperatura constant. Qualsevol energia en forma de treball duta a terme pel sistema es perdrà cap al bany, però la seva temperatura romandrà constant. En altres paraules, el sistema està connectat tèrmicament, per una frontera tèrmicament conductora, a un dipòsit de temperatura constant.
- Un procés adiabàtic és un procés en el qual no hi ha energia afegida o sostreta del sistema mitjançant escalfament o refredament. Per a un procés reversible, això és idèntic a un procés isentròpic. Es pot dir que el sistema és tèrmicament isolat del seu entorn i que la seva frontera és un isolador tèrmic. Si el sistema té una entropia que encara no ha arribat al seu màxim valor d'equilibri, l'entropia augmentarà encara que el sistema estigui tèrmicament isolat. Sota certes condicions, dos estats del sistema es poden considerar diabàticament accessibles.
- Un procés isentròpic té lloc a entropia constant. Per un procés reversible, això és idèntic a un procés adiabàtic. Si el sistema té una entropia que encara no ha arribat al màxim valor d'equilibri, pot ser que es necessiti un procés de refredament per mantenir aquest valor d'entropia.
Potencial químic - nombre de partícules[modifica]
Els processos de les seccions tenen assumit implícitament que les fronteres també són impermeables a les partícules. Es pot assumir que les fronteres són rígides i tèrmicament isoladores, però són permeables a un o més tipus de partícules. Pel parell potencial químic-nombre de partícules es mantenen aquestes consideracions; aquest parell conjugat té a veure amb la transferència d'energia mitjançant la transferència de partícules.
- En un procés de potencial químic constant el sistema és connectat per transferència de partícules amb una frontera permeable a les partícules, a un dipòsit de µ constant.
- En un procés de nombre de partícules constant no hi ha energia afegida o sostreta del sistema per transferència de partícules. Es pot dir que el sistema és isolat per transferència de partícules del seu entorn per una frontera permeable a les partícules.
Potencials termodinàmics[modifica]
Qualsevol dels potencials termodinàmics es pot mantenir constant durant un procés. Per exemple:
- Un procés isentàlpic no produeix cap canvi en l'entalpia del sistema.
Processos politròpics[modifica]
Un procés politròpic és un procés que obeeix la següent relació:
On P és la pressió, V és el volum, n és qualsevol nombre real (índex politròpic) i C és una constant. Aquesta equació es pot fer servir per caracteritzar de manera acurada els processos de certs sistemes, especialment els processos de compressió i expansió d'un gas (i, de vegades, líquids i sòlids).
Procés quasiestàtic[modifica]
Un procés quasiestàtic és un model idealitzat d'un procés termodinàmic que té lloc infinitament a poc a poc. És important adonar-se que cap real procés és quasiestàtic. A la pràctica, aquest tipus de processos tan sols es poden aproximar duent-los a terme infinitesimalment a poc a poc. Un procés quasiestàtic normalment assegura que el sistema passarà per una seqüència d'estats que són infinitesimalment propers a l'equilibri (de tal manera que el sistema roman en equilibri quasiestàtic); en aquest cas, el procés normalment és reversible.
Vegeu també[modifica]
Bibliografia[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Procés termodinàmic |
- Physics for Scientists and Engineers - with Modern Physics (6a ed.), P. A. Tipler, G. Mosca, Freeman, 2008, ISBN 0-7167-8964-7 (anglès)
- Encyclopaedia of Physics (2a ed.), R.G. Lerner, G.L. Trigg, VHC publishers, 1991, ISBN 3-527-26954-1 (Verlagsgesellschaft), ISBN 0-89573-752-3 (VHC Inc.) (anglès)
- McGraw Hill Encyclopaedia of Physics (2a ed.), C.B. Parker, 1994, ISBN 0-07-051400-3 (anglès)
- Physics with Modern Applications, L.H. Greenberg, Holt-Saunders International W.B. Saunders and Co, 1978, ISBN 0-7216-4247-0 (anglès)
- Essential Principles of Physics, P.M. Whelan, M.J. Hodgeson, 2a ed., 1978, John Murray, ISBN 0-7195-3382-1 (anglès)
- Thermodynamics, From Concepts to Applications (2a ed), A. Shavit, C. Gutfinger, CRC Press (Taylor and Francis Group, USA), 2009 (anglès)
- Chemical Thermodynamics, D.J.G. Ives, University Chemistry, Macdonald Technical and Scientific, 1971, ISBN 0-356-03736-3 (anglès)
- Elements of Statistical Thermodynamics (2a ed.), L.K. Nash, Principles of Chemistry, Addison-Wesley, 1974, ISBN 0-201-05229-6 (anglès)
- Statistical Physics (2a ed,), F. Mandl, Manchester Physics, John Wiley & Sons, 2008 (anglès)


















