Entalpia
L'entalpia (simbolitzada H, també anomenada contingut calorífic; del grec thalpein, 'escalfar') és una mesura de l'energia d'un sistema termodinàmic.[1] Inclou l'energia interna, que és l'energia necessària per crear un sistema, i la quantitat d'energia requerida per fer-li lloc desplaçant el seu entorn i per establir el seu volum i pressió.[2]
L'entalpia es defineix per la següent equació:
on (totes les unitats en SI)
- és l'entalpia (en joules)
- és l'energia interna del sistema (en joules)
- és la pressió del sistema (en pascals)
- és el volum del sistema (en metres cúbics)
L'entalpia es defineix com una funció d'estat que depèn solament de l'estat d'equilibri actual identificat per les variables energia interna, pressió i volum. És una propietat extensiva. La unitat de mesura de l'entalpia en el Sistema Internacional d'Unitats és el joule (J), però encara s'utilitzen altres unitats històriques com la unitat tèrmica britànica (BTU) i la caloria (cal).
Història[modifica]

L'entalpia fou introduïda en la termodinàmica el 1875 per part del físic nord-americà Josiah Williard Gibbs[3] que la definí com la «funció calor a pressió constant» i escriví l'equació: , simbolitzant-la, per tant, amb la lletra grega chi . El 1909 el físic neerlandès Heike Kamerlingh Onnes (1853–1926) donà el nom «entalpia» a aquesta funció definida per Gibbs, del grec εν (en), en, i θαλπος (thalpos), calor, o a partir del mot grec ενθαλπος (enthalpos) escalfar. El 1922 el físic anglès Alfred William Porter (1863–1939), president de la Societat Faraday, proposà simbolitzar-la amb una , a partir de la inicial de calor en anglès («heat»), o la lletra majúscula grega eta , pronunciada en grec antic com una «e» llarga [e:], d'«entalpia», a elecció del lector.[4][5]
Calor a pressió constant[modifica]
L'entalpia és una funció d'estat que permet calcular la calor que absorbeix o produeix una transformació en un sistema determinat a pressió constant. La calor no és una funció d'estat, per la qual cosa el seu valor en una transformació depèn del camí seguit per arribar a l'estat final des de l'estat inicial. Per contra, l'entalpia és una funció d'estat, el seu valor no depèn del camí seguit, només de l'estat inicial i del final. Per això resulta útil, ja que per determinar-la es poden seguir camins alternatius per arribar a l'estat final que siguin més senzills de dur a la pràctica.
La variació de l'entalpia entre un estat inicial i un final és
Ara hom pot substituir la variació d'energia interna pel treball més la calor , segons el primer principi de la termodinàmica:
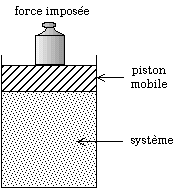
El treball d'expansió s'obté pel producte de la força que fa el sistema i el desplaçament que aconsegueix en expandir-se. Si el sistema és un gas i s'expandeix hom pot multiplicar i dividir per la superfície de l'èmbol que es desplaça i posar el treball en funció de la pressió del gas i l'increment de volum :
El treball és negatiu perquè el sistema perd energia en expandir-se. Si aquesta expressió del treball se substitueix a l'expressió obtinguda de la variació d'entalpia, hom obté:
Si la transformació és a pressió constant . Per tant:
Quedant:
Per tant, la calor intercanviada amb l'entorn en un procés a pressió constant és igual a la variació d'entalpia del sistema . Malgrat que la deducció es fa per un procés reversible, el resultat també es pot aplicar a processos irreversibles, ja que l'entalpia és una funció d'estat i no depèn del camí seguit, sigui reversible o irreversible.[6]
Entalpia de reacció[modifica]

L'entalpia de reacció és la variació d'entalpia que es produeix quan té lloc una reacció química, i es correspon amb la calor que s'absorbeix o desprèn durant la transformació si es duu a terme a pressió constant, que és la situació més habitual.
Les entalpies de reacció depenen de la temperatura, de la pressió i de l'estat dels reactius i productes. Per a comparar entalpies de reacció cal especificar les condicions experimentals. Per tal de tabular les dades s’escullen unes condicions determinades que s’anomenen condicions estàndard o tipus, simbolitzada amb un cercle, , com a superíndex a la dreta del símbol . En aquestes condicions l'entalpia de reacció estàndard a P = cnt. correspon a:[7]

On és l'entalpia parcial molar estàndard (J/mol) de l'espècie -èsima que intervé a la reacció (reactiu o producte) i el coeficient estequiomètric () de cada espècie a l'equació química (positiu per a productes i negatiu per a reactius). L'equació química hom pot representar-la com:
S’entén com a estat estàndard dels sòlids o líquids purs com la seva forma estable a 100 kPa (abans del 1982 el valor era 101 325 Pa 0 1 atm)[8] i a una determinada temperatura . Per exemple, l'estat estàndard de l’aigua a 25º C és l’aigua en fase líquida a la P = 100 kPa. Per a un gas es pren el gas a P = 100 kPa comportant-se idealment a la temperatura de treball. No s’empra habitualment la determinació directa de les entalpies de reacció, ja que no sempre són fàcils de determinar i a més a més caldrien moltes reaccions a tabular. L'estratègia implica definir entalpies de formació estàndard.[6]
Entalpia de formació estàndard[modifica]
Entalpies de formació estàndard a 25 °C
(Estat: g = gasós; l = líquid; s = sòlid; aq = aquós)
| Compost químic | Estat físic |
Fórmula química |
(kJ/mol) |
|---|---|---|---|
| Amoníac | g | NH₃ | –46,1 |
| Carbonat de sodi | s | Na₂CO₃ | –1 131 |
| Clorur de sodi | s | NaCl | –411,12 |
| Hidròxid de sodi | s | NaOH | –426,7 |
| Nitrat de sodi | s | NaNO₃ | –424,8 |
| Diòxid de sofre | g | SO₂ | –297 |
| Àcid sulfúric | l | H₂SO₄ | –814 |
| Diòxid de silici | s | SiO₂ | –911 |
| Diòxid de nitrogen | g | NO₂ | +33 |
| Monòxid de nitrogen | g | NO | +90 |
| Aigua | l | H₂O | –285,8 |
| Aigua | g | H₂O | –241,8 |
| Diòxid de carboni | g | CO₂ | –393,5 |
L’entalpia de formació estàndard d’un compost químic, , és igual a la variació d’entalpia associada a la formació d’un mol del compost químic a partir dels seus elements químics en el seu estat estable a la P = 100 kPa i a la temperatura de l'experiment. Les entalpies de formació estàndard dels elements químics, en el seu estat més estable a 100 kPa i la temperatura emprada s'ha acordat donar-les el valor 0. En el cas de l'aigua líquida la reacció de formació és (ajustada de manera que el coeficient estequiomètric del producte sigui 1):
Aquest criteri no afecta els càlculs, ja que mai es calculen entalpies d'un sistema, sinó variacions d'entalpies de transformacions, de reaccions químiques. És per això que:[7]
Entalpia de combustió[modifica]
Els composts orgànics en combinar-se amb l'oxigen s'oxiden completament i donen diòxid de carboni i aigua. Són reaccions molt exotèrmiques i la calor implicada s'anomena entalpia de combustió, que correspon a la diferència d'entalpies de productes i reactius. És una entalpia de reacció. Se simbolitza per . Són valors que hom pot trobar-los tabulats.[7]
Variació de l'entalpia de reacció amb la temperatura. Llei de Kirchhoff[modifica]
Per a qualsevol reacció química
l'entalpia de reacció es defineix com:

La variació de l'entalpia amb la temperatura és la capacitat calorífica a pressió constant:
Variació de la constant d'equilibri amb la temperatura[modifica]
L'entalpia de reacció està relacionada amb la variació de la constant d'equilibri amb la temperatura. Hom pot escriure la relació entre la constant d'equilibri i l'energia de Gibbs de la reacció de la següent manera i derivar-la respecte de la temperatura:

que, aplicant l'equació de Gibbs-Helmholtz, queda en funció de l'entalpia de reacció:
Si s'assumeix que l'entalpia de reacció no varia amb la temperatura, la resolució d'aquesta equació diferencial condueix la següent relació:
En aquesta equació és la constant d'equilibri a la temperatura absoluta i és la constant d'equilibri a la temperatura absoluta i és la constant dels gasos.[6]
Referències[modifica]
- ↑ «Entalpia». Gran Enciclopèdia Catalana. [Consulta: 12 agost 2022].
- ↑ Mark W. Zemansky (1968), Heat and Thermodynamics, Chapter 11 (5a edició) page 275, McGraw Hill, New York.
- ↑ «Josiah Willard Gibbs». Gran Enciclopèdia Catalana. [Consulta: 13 agost 2022].
- ↑ Porter, Alfred W. «The Generation and Utilisation of Cold. A general discussion». Transactions Faraday Society, 18, 1922, pàg. 139-143.
- ↑ Howard, Irmgard K. «H Is for Enthalpy, Thanks to Heike Kamerlingh Onnes and Alfred W. Porter» (en anglès). Journal of Chemical Education, 79, 6, 2002-06, pàg. 697. DOI: 10.1021/ed079p697. ISSN: 0021-9584.
- ↑ 6,0 6,1 6,2 6,3 Rodríguez Renuncio, Juan Antonio. Termodinámica química (en castellà). 2a. ed. Madrid: Síntesis, 2000. ISBN 84-7738-581-5.
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 Glasstone, Samuel. Termodinámica para químicos (en castellà). 5a. ed., 4a. reimp. Madrid: Aguilar, 1977. ISBN 84-03-20059-5.
- ↑ IUPAC. Quantities, Units and Symbols in Physical Chemistry (en anglès). ISBN 1-84755-788-0.









































































