Telòmer: diferència entre les revisions
Cap resum de modificació |
Cap resum de modificació |
||
| Línia 25: | Línia 25: | ||
En la síndrome de Werner (un trastorn [[autosòmic]] [[recessiu]] rar, anomenat també [[progèria]] de l'adult i que comporta un alt risc de sofrir alguns càncers), causat per mutacions en el gen WRN<ref>{{ref-publicació|cognom= Genetics Home Reference |títol= WRN gene |publicació= NIH. US National Library of Medicine |pàgines=pàgs: 7|volum= 2018; Maig 22 (rev) |url= https://ghr.nlm.nih.gov/gene/WRN#resources | llengua= anglès|consulta= 25 maig 2018|}}</ref> [[Codi genètic|codificador de la proteïna]] WRN (''WRNprot'', un membre de la família de les [[Helicasa|helicases]] RecQ); la inestabilitat del genoma cel·lular depèn directament de la disfunció dels telòmers. Diverses línies d'evidència indiquen que els telòmers són substrats fisiològics de la WRNprot i que el seu manteniment aberrant en cas d'absència de dita proteïna és un important mecanisme [[Patogènia|patogènic]] causal dels [[fenotip]]s progeroides de les persones amb la síndrome.<ref>{{ref-publicació|cognom= Crabbe L, Jauch A, Naeger CM, Holtgreve-Grez H, Karlseder J |títol= Telomere dysfunction as a cause of genomic instability in Werner syndrome |publicació= Proc Natl Acad Sci USA |pàgines=pp: 2205-2210|volum= 2007 Feb 13; 104 (7) |pmid= 17284601 |doi= 10.1073/pnas.0609410104 |pmc= 1794219 |url= https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1794219/ | llengua= anglès| consulta= 25 maig 2018|}}</ref><ref>{{ref-publicació|cognom= Oshima J, Sidorova JM, Monnat RJ Jr |títol= Werner syndrome: Clinical features, pathogenesis and potential therapeutic interventions |publicació= Ageing Res Rev |pàgines=pp: 105-114|volum=2017 Gen; 33|pmid= 26993153 |doi= 10.1016/j.arr.2016.03.002 |pmc= 5025328 |url= https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5025328/ | llengua= anglès| consulta= 25 maig 2018|}}</ref> |
En la síndrome de Werner (un trastorn [[autosòmic]] [[recessiu]] rar, anomenat també [[progèria]] de l'adult i que comporta un alt risc de sofrir alguns càncers), causat per mutacions en el gen WRN<ref>{{ref-publicació|cognom= Genetics Home Reference |títol= WRN gene |publicació= NIH. US National Library of Medicine |pàgines=pàgs: 7|volum= 2018; Maig 22 (rev) |url= https://ghr.nlm.nih.gov/gene/WRN#resources | llengua= anglès|consulta= 25 maig 2018|}}</ref> [[Codi genètic|codificador de la proteïna]] WRN (''WRNprot'', un membre de la família de les [[Helicasa|helicases]] RecQ); la inestabilitat del genoma cel·lular depèn directament de la disfunció dels telòmers. Diverses línies d'evidència indiquen que els telòmers són substrats fisiològics de la WRNprot i que el seu manteniment aberrant en cas d'absència de dita proteïna és un important mecanisme [[Patogènia|patogènic]] causal dels [[fenotip]]s progeroides de les persones amb la síndrome.<ref>{{ref-publicació|cognom= Crabbe L, Jauch A, Naeger CM, Holtgreve-Grez H, Karlseder J |títol= Telomere dysfunction as a cause of genomic instability in Werner syndrome |publicació= Proc Natl Acad Sci USA |pàgines=pp: 2205-2210|volum= 2007 Feb 13; 104 (7) |pmid= 17284601 |doi= 10.1073/pnas.0609410104 |pmc= 1794219 |url= https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1794219/ | llengua= anglès| consulta= 25 maig 2018|}}</ref><ref>{{ref-publicació|cognom= Oshima J, Sidorova JM, Monnat RJ Jr |títol= Werner syndrome: Clinical features, pathogenesis and potential therapeutic interventions |publicació= Ageing Res Rev |pàgines=pp: 105-114|volum=2017 Gen; 33|pmid= 26993153 |doi= 10.1016/j.arr.2016.03.002 |pmc= 5025328 |url= https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5025328/ | llengua= anglès| consulta= 25 maig 2018|}}</ref> |
||
La disqueratosi congènita (DC), o síndrome de Zinsser-Engman-Cole, és una genodermatosi descrita per primera vegada l'any 1906 i caracteritzada clàssicament per una triada clínica: leucoplàquia oral, distròfia unguial i hiperpigmentació reticular cutània. Té un patró hereditari [[recessiu]] i [[Herència lligada al sexe|lligat al sexe]] ([[cromosoma X]]). Molts malalts amb DC desenvolupen alguna forma de neoplàsia relacionada amb un augment de la divisió cel·lular. La seva causa fonamental és un defecte en el gen DKC1, codificador de la proteïna disquerina,<ref>{{ref-publicació|cognom= UniProt |títol= Dyskerin |publicació= Protein knowledgebase. UniProt Consortium |pàgines=pàgs: 2|volum= 2016 Jul 6; O95940 -O95940_HUMAN- (rev) |url= https://www.uniprot.org/uniprot/O95940 | llengua= anglès| consulta= 20 setembre 2018|}}</ref> la qual està fortament implicada en el manteniment de la longitud telomèrica. En la DC també s'han descrit mutacions en els gens TINF2, TERC, TERT, C16orf57, NOLA2, NOLA3, WRAP53/TCAB1 i RTEL1.<ref>{{ref-publicació|cognom= Garofola C, Gross GP |títol= Dyskeratosis Congenita |publicació= StatPearls [Internet]. StatPearls Publishing LLC |pàgines=pàgs: 5|volum= 2018 Jun 19; NBK507710 (rev) |pmid= 29939532 |url= https://www.ncbi.nlm.nih.gov/books/NBK507710/ | llengua= anglès| consulta= 20 setembre 2018|}}</ref> Una variant molt greu de la DC, la síndrome de Hoyeraal-Hreidarsson, cursa, a més a més, amb pancitopènia progressiva (disminució simultània dels valors de les tres sèries hematològiques: [[glòbuls blancs]], [[glòbuls vermells]] i [[plaquetes]]), hipoplàsia del [[cerebel]], [[microcefàlia]] i retard del creixement. Aquesta síndrome presenta, a banda de les moltes que comparteix amb la DC, determinades mutacions en els gens RTEL1 and DKC1 -els quals tenen funcions addicionals no relacionades amb els telòmers- que podrien ser l'origen de les seves manifestacions específiques.<ref>{{ref-publicació|cognom= Glousker G, Touzot F, Revy P, Tzfati Y, Savage SA |títol= Unraveling the Pathogenesis of Hoyeraal-Hreidarsson Syndrome, a Complex Telomere Biology Disorder |publicació= Br J Haematol |pàgines=pp: 457–471|volum= 2015 Ag; 170 (4) |pmid= 25940403 |doi= 10.1111/bjh.13442 |pmc= 4526362 |url= https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4526362/ | llengua=anglès| consulta= 30 setembre 2018|}}</ref> |
La disqueratosi congènita (DC), o síndrome de Zinsser-Engman-Cole, és una genodermatosi descrita per primera vegada l'any 1906 i caracteritzada clàssicament per una triada clínica: leucoplàquia oral, distròfia unguial i hiperpigmentació reticular cutània. Té un patró hereditari [[recessiu]] i [[Herència lligada al sexe|lligat al sexe]] ([[cromosoma X]]). Molts malalts amb DC desenvolupen alguna forma de neoplàsia relacionada amb un augment de la divisió cel·lular. La seva causa fonamental és un defecte en el gen DKC1, codificador de la proteïna disquerina,<ref>{{ref-publicació|cognom= UniProt |títol= Dyskerin |publicació= Protein knowledgebase. UniProt Consortium |pàgines=pàgs: 2|volum= 2016 Jul 6; O95940 -O95940_HUMAN- (rev) |url= https://www.uniprot.org/uniprot/O95940 | llengua= anglès| consulta= 20 setembre 2018|}}</ref> la qual està fortament implicada en el manteniment de la longitud telomèrica. En la DC també s'han descrit mutacions en els gens TINF2, TERC, TERT, C16orf57, NOLA2, NOLA3, WRAP53/TCAB1 i RTEL1.<ref>{{ref-publicació|cognom= Garofola C, Gross GP |títol= Dyskeratosis Congenita |publicació= StatPearls [Internet]. StatPearls Publishing LLC |pàgines=pàgs: 5|volum= 2018 Jun 19; NBK507710 (rev) |pmid= 29939532 |url= https://www.ncbi.nlm.nih.gov/books/NBK507710/ | llengua= anglès| consulta= 20 setembre 2018|}}</ref> Una variant molt greu de la DC, la síndrome de Hoyeraal-Hreidarsson, cursa, a més a més, amb pancitopènia progressiva (disminució simultània dels valors de les tres sèries hematològiques: [[glòbuls blancs]], [[glòbuls vermells]] i [[plaquetes]]), hipoplàsia del [[cerebel]], [[microcefàlia]] i retard del creixement. Aquesta síndrome presenta, a banda de les moltes que comparteix amb la DC, determinades mutacions en els gens RTEL1 and DKC1 -els quals tenen funcions addicionals no relacionades amb els telòmers- que podrien ser l'origen de les seves manifestacions específiques.<ref>{{ref-publicació|cognom= Glousker G, Touzot F, Revy P, Tzfati Y, Savage SA |títol= Unraveling the Pathogenesis of Hoyeraal-Hreidarsson Syndrome, a Complex Telomere Biology Disorder |publicació= Br J Haematol |pàgines=pp: 457–471|volum= 2015 Ag; 170 (4) |pmid= 25940403 |doi= 10.1111/bjh.13442 |pmc= 4526362 |url= https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4526362/ | llengua= anglès| consulta= 30 setembre 2018|}}</ref> |
||
En la síndrome de Coats ''plus'',<ref>{{ref-publicació|cognom= Genetics Home Reference |títol= Coats plus syndrome |publicació= NIH. US National Library of Medicine |pàgines=pàgs: 5|volum= 2019; Jul 9 (rev) |url= https://ghr.nlm.nih.gov/condition/coats-plus-syndrome | llengua= anglès| consulta= 12 juliol 2018|}}</ref> mutacions en el gen STN1 (membre del complex gènic CTC1–STN1–TEN1 humà) provoquen una greu telomeropatia estructural i funcional.<ref>{{ref-publicació|cognom= Simon AJ, Lev A, Zhang Y, Weiss B, ''et al'' |títol= Mutations in STN1 cause Coats plus syndrome and are associated with genomic and telomere defects |publicació= Int J Mol Sci |pàgines=pii: E2996|volum= 2019 Jun 19; 20 (12) |pmid= 31248154 |doi= 10.3390/ijms20122996 |issn= 1422-0067 |url= https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4986528/ | llengua= anglès| consulta= 30 setembre 2018|}}</ref> |
|||
S'ha observat un escurçament telomèric significatiu en malalts afectes d'[[anèmia aplàstica]] de gravetat diversa i temps d'evolució diferent. Existeixen evidències que relacionen l'augment de l'erosió dels telòmers amb la progressió de la malaltia. Una part important de dita erosió té lloc a nivell de les [[cèl·lules mare hematopoètiques]] comprometent tant la fracció granulocítica com la mononuclear, encara que és més accentuada en els [[granulòcit]]s. Es creu que la senescència de les esmentades cèl·lules hematopoètiques és el fenomen patofisiològic que condiciona l'aparició dels fenòmens de [[Moll d'os|mielo]][[displàsia]] i d'[[hemoglobinúria paroxística nocturna]] propis dels casos avançats d'anèmia aplàstica.<ref>{{ref-publicació|cognom= Ball SE, Gibson FM, Rizzo S, Tooze JA, ''et al'' |títol= Progressive Telomere Shortening in Aplastic Anemia |publicació= Blood |pàgines=pp: 3582-3592|volum= 1998 Maig 15; 91 (10) |pmid= 9572992 |doi=|issn= 0006-4971 |url= http://www.bloodjournal.org/content/bloodjournal/91/10/3582.full.pdf | llengua= anglès| consulta= 11 setembre 2018|}}</ref> Estudis en [[murins]] indiquen que la [[teràpia gènica]] restaura la longitud del telòmers, millora l'aplàsia [[Medul·la òssia|medul·lar]] i augmenta la supervivència dels individus. Això suggereix que dita teràpia s'ha de considerar una nova opció pel tractament d'aquesta gravíssima forma d'anèmia.<ref>{{ref-publicació|cognom= Bär C, Povedano JM, Serrano R, Benitez-Buelga C, ''et al'' |títol= Telomerase gene therapy rescues telomere length, bone marrow aplasia, and survival in mice with aplastic anemia |publicació= Blood |pàgines=pp: 1770-1779|volum= 2016 Abr 7; 127 (14) |pmid= 26903545 |doi= 10.1182/blood-2015-08-667485 |issn= 0006-4971 |url= http://www.bloodjournal.org/content/bloodjournal/early/2016/02/22/blood-2015-08-667485.full.pdf | llengua= anglès| consulta= 11 setembre 2018|}}</ref> En els individus que pateixen [[anèmia de Fanconi]] també s'han apreciat diverses anomalies telomèriques (escurçament, increment de les fusions terminals, pèrdues o ruptures estructurals en els telòmers dels leucòcits perifèrics).<ref>{{ref-publicació|cognom= Sarkar J, Liu Y |títol= Fanconi anemia proteins in telomere maintenance |publicació= DNA Repair (Amst) |pàgines=pp: 107-112|volum= 2016 Jul; 43 |pmid= 27118469 |doi= 10.1016/j.dnarep.2016.02.007 |issn= 4917397 |url= https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4917397/ | llengua= anglès| consulta= 28 setembre 2018|}}</ref> |
S'ha observat un escurçament telomèric significatiu en malalts afectes d'[[anèmia aplàstica]] de gravetat diversa i temps d'evolució diferent. Existeixen evidències que relacionen l'augment de l'erosió dels telòmers amb la progressió de la malaltia. Una part important de dita erosió té lloc a nivell de les [[cèl·lules mare hematopoètiques]] comprometent tant la fracció granulocítica com la mononuclear, encara que és més accentuada en els [[granulòcit]]s. Es creu que la senescència de les esmentades cèl·lules hematopoètiques és el fenomen patofisiològic que condiciona l'aparició dels fenòmens de [[Moll d'os|mielo]][[displàsia]] i d'[[hemoglobinúria paroxística nocturna]] propis dels casos avançats d'anèmia aplàstica.<ref>{{ref-publicació|cognom= Ball SE, Gibson FM, Rizzo S, Tooze JA, ''et al'' |títol= Progressive Telomere Shortening in Aplastic Anemia |publicació= Blood |pàgines=pp: 3582-3592|volum= 1998 Maig 15; 91 (10) |pmid= 9572992 |doi=|issn= 0006-4971 |url= http://www.bloodjournal.org/content/bloodjournal/91/10/3582.full.pdf | llengua= anglès| consulta= 11 setembre 2018|}}</ref> Estudis en [[murins]] indiquen que la [[teràpia gènica]] restaura la longitud del telòmers, millora l'aplàsia [[Medul·la òssia|medul·lar]] i augmenta la supervivència dels individus. Això suggereix que dita teràpia s'ha de considerar una nova opció pel tractament d'aquesta gravíssima forma d'anèmia.<ref>{{ref-publicació|cognom= Bär C, Povedano JM, Serrano R, Benitez-Buelga C, ''et al'' |títol= Telomerase gene therapy rescues telomere length, bone marrow aplasia, and survival in mice with aplastic anemia |publicació= Blood |pàgines=pp: 1770-1779|volum= 2016 Abr 7; 127 (14) |pmid= 26903545 |doi= 10.1182/blood-2015-08-667485 |issn= 0006-4971 |url= http://www.bloodjournal.org/content/bloodjournal/early/2016/02/22/blood-2015-08-667485.full.pdf | llengua= anglès| consulta= 11 setembre 2018|}}</ref> En els individus que pateixen [[anèmia de Fanconi]] també s'han apreciat diverses anomalies telomèriques (escurçament, increment de les fusions terminals, pèrdues o ruptures estructurals en els telòmers dels leucòcits perifèrics).<ref>{{ref-publicació|cognom= Sarkar J, Liu Y |títol= Fanconi anemia proteins in telomere maintenance |publicació= DNA Repair (Amst) |pàgines=pp: 107-112|volum= 2016 Jul; 43 |pmid= 27118469 |doi= 10.1016/j.dnarep.2016.02.007 |issn= 4917397 |url= https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4917397/ | llengua= anglès| consulta= 28 setembre 2018|}}</ref> |
||
Revisió del 12:14, 12 jul 2019
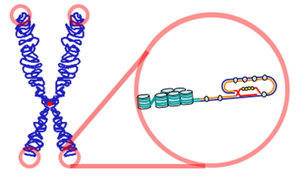
Un telòmer és una seqüència repetitiva de nucleòtids situada als extrems dels cromosomes lineals de la major part dels organismes eucariòtics, que serveix per a protegir aquests extrems de ser destruïts. El seu nom deriva dels mots grecs τἐλος telos ("final") i μέρος meros ("part").
Durant la divisió cel·lular, els enzims que dupliquen el cromosoma i el seu ADN no poden efectuar aquesta duplicació fins a la punta del cromosoma. Si les cèl·lules es dividissin sense telòmers, perdrien l'extrem dels cromosomes, juntament amb la informació necessària que conté (el 1972, James Watson donà a aquest fenomen el nom de "problema de replicació dels extrems"). El telòmer és un topall disposable, que és consumit durant la divisió cel·lular i que és recreat per un enzim, la telomerasa transcriptasa inversa, codificat pel gen hTERT.[1]
Entre el 1975 i el 1977, Elizabeth Blackburn, que treballava després del seu doctorat a la Universitat Yale amb Joseph Gall,[2] descobrí estudiant l'estructura genètica del protozou Tetrahymena thermophila la naturalesa inusual dels cromosomes, i el fet que les seves senzilles seqüències repetides d'ADN componien els extrems dels cromosomes. El seu treball fou publicat el 1978.[3]
Aquest mecanisme sol limitar les cèl·lules a un nombre determinat de divisions. Estudis en animals i experiments emprant material de cultiu suggereixen que això és la causa de l'envelliment a nivell cel·lular i que afecta la longevitat.[4][5] La velocitat a la qual s'escurcen els seus telòmers és la que determina l'esperança de vida de cada espècie.[6]
Telòmers i salut
Els telòmers eviten que els cromosomes d'una cèl·lula es fusionin o es recombinin. Aquestes anormalitats cromosòmiques podrien causar càncer, de manera que les cèl·lules són normalment destruïdes quan els telòmers són consumits. El mesurament in situ de la longitud dels telòmers és un mètode de biomarcatge amb valor pronòstic en determinats tipus de càncer, com ara el de pròstata.[7] En la majoria de casos, el càncer és el resultat del fet que hi ha cèl·lules que s'escapen d'aquesta destrucció.[8] Els biòlegs especulen que aquest mecanisme és un intercanvi entre envelliment i càncer.[9] La importància dels telòmers en la salut és gran i existeix un ampli ventall d'anomalies mendelianes (síndromes d'escurçament telomèric o trastorns biològics dels telòmers, TBTs) que inclou des de malalties multisistèmiques infantils a patologies locals aïllades en adults. Fins ara, es coneixen mutacions causants de TBTs de en almenys onze gens, cadascuna d'elles relacionada amb algun aspecte dels complexos processos de manteniment d'aquestes estructures cromosòmiques.[10]
Moltes cèl·lules tumorals desenvolupen canvis per evitar l'escurçament dels telòmers. La majoria empra processos de reactivació de la telomerasa que mantenen la seva longitud. Algunes aconsegueixen aturar la senescència allargant-los a través de vies alternatives no relacionades amb dit enzim, com la inactivació de certes proteïnes.[11] El càncer tiroïdal és un exemple paradigmàtic de la importància de la desregulació telomèrica en la gènesi i progressió de les neoplàsies malignes. Les mutacions en el gen TERT són unes de les anomalies genètiques més comunes observades en els tumors agressius de la tiroide, en particular les que modifiquen la codificació del component catalític central de la telomerasa. Per regla general, s'associen amb una major expressivitat del gen i de l'activitat de la telomerasa i, si bé no sempre van acompanyades d'un increment de la longitud dels telòmers, estan estretament relacionades amb el mal pronòstic, la disseminació metastàtica i la baixa supervivència global dels pacients.[12]
En les cirrosis criptogèniques i les derivades d'hepatitis B/C s'observa una reducció de la mida dels telòmers dels limfòcits perifèrics, un fenomen indicatiu de la continua destrucció i regeneració dels nòduls parenquimatosos propis d'aquestes afeccions hepàtiques.[13]
La longitud dels telòmers s'associa amb diverses malalties dels pulmons, com ara la pneumonitis crònica per hipersensibilitat o la bronquiolitis obliterant.[14] En el cas de la fibrosi pulmonar idiopàtica (FPI) es troben telòmers molt curts en els pneumòcits tipus II -cèl·lules fonamentals per la correcta regeneració de l'epiteli alveolar[15]- de les zones fibròtiques. La curtedat telomèrica està directament relacionada amb el temps de supervivència dels malalts que sofreixen aquesta patologia pulmonar.[16] En el 8–15% de FPIs de tipus familiar i en més del 11% de FPIs esporàdiques necessitades de trasplantament pulmonar s'han identificat mutacions en gens relacionats amb la telomerasa, com ara el TERT, el RTEL1[17] o el PARN.[18] Inclús en individus afectes de FPI sense mutacions identificables presenten telòmers més curts que els dels grups de control, un fet motiu d'estudi i atribuït presumptivament a l'existència de variants encara no caracteritzades.[19]
També ha estat demostrada una correlació entre la longitud telomèrica i la gravetat de la cardiomiopatia hipertròfica, especialment en la forma obstructiva de la malaltia.[20] A més, s'ha comprovat l'existència d'un escurçament significatiu en els telòmers dels miocardiòcits de les persones afectes de cardiomiopaties de naturalesa genètica, provocat per defectes hereditaris en proteïnes cardíaques essencials per una correcta funcionalitat contràctil de l'òrgan.[21] A banda d'això, se sap que durant el procés d'envelliment els cardiomiòcits humans i murins adquireixen un fenotip post-mitosi caracteritzat per un dany permanent de l'ADN telomèric a causa de disfuncions mitocondrials i que té lloc amb independència del nombre de divisions cel·lulars i de la longitud dels telòmers. El fenotip miocardiocitari associat amb la senescència resultant d'aquest dany és de tipus no canònic, pro-fibròtic i pro-hipertròfic.[22]
Determinades variacions en la telomerasa transcriptasa inversa materna s'associen amb la ruptura prematura de membranes i el part preterme.[23] Per una altra banda, l'exposició de la mare a diversos contaminants atmosfèrics durant el tercer trimestre de l'embaràs pot ocasionar un escurçament dels telòmers en el nounat.[24] També se sap que elevades concentracions ambientals de diversos metalls tòxics alteren la longitud relativa dels telòmers materns i fetals.[25]
Alguns especialistes afirmen que existeix una relació entre el desgast prematur dels telòmers i la síndrome de fatiga crònica i proposen que aquesta condició s'inclogui dins de la llista de malalties originades per un envelliment accelerat.[26]
En la síndrome de Werner (un trastorn autosòmic recessiu rar, anomenat també progèria de l'adult i que comporta un alt risc de sofrir alguns càncers), causat per mutacions en el gen WRN[27] codificador de la proteïna WRN (WRNprot, un membre de la família de les helicases RecQ); la inestabilitat del genoma cel·lular depèn directament de la disfunció dels telòmers. Diverses línies d'evidència indiquen que els telòmers són substrats fisiològics de la WRNprot i que el seu manteniment aberrant en cas d'absència de dita proteïna és un important mecanisme patogènic causal dels fenotips progeroides de les persones amb la síndrome.[28][29]
La disqueratosi congènita (DC), o síndrome de Zinsser-Engman-Cole, és una genodermatosi descrita per primera vegada l'any 1906 i caracteritzada clàssicament per una triada clínica: leucoplàquia oral, distròfia unguial i hiperpigmentació reticular cutània. Té un patró hereditari recessiu i lligat al sexe (cromosoma X). Molts malalts amb DC desenvolupen alguna forma de neoplàsia relacionada amb un augment de la divisió cel·lular. La seva causa fonamental és un defecte en el gen DKC1, codificador de la proteïna disquerina,[30] la qual està fortament implicada en el manteniment de la longitud telomèrica. En la DC també s'han descrit mutacions en els gens TINF2, TERC, TERT, C16orf57, NOLA2, NOLA3, WRAP53/TCAB1 i RTEL1.[31] Una variant molt greu de la DC, la síndrome de Hoyeraal-Hreidarsson, cursa, a més a més, amb pancitopènia progressiva (disminució simultània dels valors de les tres sèries hematològiques: glòbuls blancs, glòbuls vermells i plaquetes), hipoplàsia del cerebel, microcefàlia i retard del creixement. Aquesta síndrome presenta, a banda de les moltes que comparteix amb la DC, determinades mutacions en els gens RTEL1 and DKC1 -els quals tenen funcions addicionals no relacionades amb els telòmers- que podrien ser l'origen de les seves manifestacions específiques.[32]
En la síndrome de Coats plus,[33] mutacions en el gen STN1 (membre del complex gènic CTC1–STN1–TEN1 humà) provoquen una greu telomeropatia estructural i funcional.[34]
S'ha observat un escurçament telomèric significatiu en malalts afectes d'anèmia aplàstica de gravetat diversa i temps d'evolució diferent. Existeixen evidències que relacionen l'augment de l'erosió dels telòmers amb la progressió de la malaltia. Una part important de dita erosió té lloc a nivell de les cèl·lules mare hematopoètiques comprometent tant la fracció granulocítica com la mononuclear, encara que és més accentuada en els granulòcits. Es creu que la senescència de les esmentades cèl·lules hematopoètiques és el fenomen patofisiològic que condiciona l'aparició dels fenòmens de mielodisplàsia i d'hemoglobinúria paroxística nocturna propis dels casos avançats d'anèmia aplàstica.[35] Estudis en murins indiquen que la teràpia gènica restaura la longitud del telòmers, millora l'aplàsia medul·lar i augmenta la supervivència dels individus. Això suggereix que dita teràpia s'ha de considerar una nova opció pel tractament d'aquesta gravíssima forma d'anèmia.[36] En els individus que pateixen anèmia de Fanconi també s'han apreciat diverses anomalies telomèriques (escurçament, increment de les fusions terminals, pèrdues o ruptures estructurals en els telòmers dels leucòcits perifèrics).[37]
No totes les malalties derivades d'imperfeccions en els telòmers es deuen a l'escurçament d'aquests. Diversos càncers de naturalesa familiar tenen el seu origen en mutacions que augmenten la longitud telomèrica.[38]
En casos de síndrome de l'ovari poliquístic, l'endocrinopatia més comuna entre les dones en edat reproductiva, s'ha detectat una longitud excessiva en els telòmers de les cèl·lules fol·liculars.[39]
Hi ha autors que posen l'accent en la importància de la dieta per mantenir una correcta funcionalitat dels telòmers. En particular, s'associa la dieta mediterrània amb una major longitud telomèrica leucocitària.[40]
Darreres investigacions
Un estudi realitzat per especialistes de la Universitat Johns Hopkins indica que l'anàlisi de la longitud telomèrica en un àmbit hospitalari, emprant de forma combinada la citometria de flux i la hibridació in situ per fluorescència (flowFISH) com a element diagnòstic, pot ser útil per millorar les decisions terapèutiques en diversos supòsits clínics.[41]
Investigadors xinesos consideren que la longitud dels telòmers és un potencial biomarcador per predir el risc i el pronòstic de l'ictus.[42]
Per compilar i oferir als investigadors una base de dades dels gens implicats en el manteniment telomèric d'humans i llevats, ha estat creada la pàgina web TelNet,[43] amb el suport del consorci interdisciplinari de recerca alemany CancerTelSys.
S'han creat procediments bioinformàtics per identificar les característiques detallades dels telòmers en l'estudi de genomes nous, els quals fan possible aconseguir resultats d'una forma més senzilla i ràpida que la aconseguida amb les tècniques emprades habitualment.[44] Un equip del Centre Alemany de Recerca Oncològica de Heidelberg ha desenvolupat un nou software de disposició lliure sota la llicència GPL, anomenat TelomereHunter, que permet una caracterització in silico molt precisa dels mecanismes de manteniment dels telòmers en el genoma i amb la capacitat d'analitzar grans cohorts de genomes cancerosos, proporcionant així una àmplia varietat de dades amb valor diagnòstic.[45]
Referències
- ↑ Bryce LA, Morrison N, Hoare SF, Muir S, Keith WN «Mapping of the gene for the human telomerase reverse transcriptase, hTERT, to chromosome 5p15.33 by fluorescence in situ hybridization» (en anglès). Neoplàsia, 2000 Mai-Jun; 2 (3), pp: 197-201. ISSN: 1476-5586. PMC: 1507564. PMID: 10935505 [Consulta: 16 maig 2018].
- ↑ Carnegie Institution for Science «Joseph Gall» (en anglès). Faculty, Department of Embryology, 2019, pàgs: 6 [Consulta: 10 juliol 2019].
- ↑ Blackburn EH, Gall JG «A tandemly repeated sequence at the termini of the extrachromosomal ribosomal RNA genes in Tetrahymena» (en anglès). J Mol Biol, 1978 Mar 25; 120 (1), pp: 33-53. ISSN: 0022-2836. PMID: 642006 [Consulta: 11 setembre 2018].
- ↑ López-Otín C, Blasco MA, Partridge L, Serrano M, Kroemer G «The hallmarks of aging» (en anglès). Cell, 2013 Jun 6; 153 (6), pp: 1194-1217. DOI: 10.1016/j.cell.2013.05.039. PMC: 3836174. PMID: 23746838 [Consulta: 11 setembre 2018].
- ↑ Blasco, MA «Telomere length, stem cells and aging» (en anglès). Nat Chem Biol, 2007 Oct; 3 (10), pp: 640-649. DOI: 10.1038/nchembio.2007.38. ISSN: 0092-8674. PMID: 17876321 [Consulta: 11 setembre 2018].
- ↑ Whittemore, K; Vera, E; Martínez-Nevado, E; Sanpera, C; Blasco, MA «Telomere shortening rate predicts species life span» (en anglès). PNAS, 2019; Jul 8, pàgs: 6. DOI: 10.1073/pnas.1902452116. ISSN: 1091-6490 [Consulta: 9 juliol 2019].
- ↑ Meeker, AK «Cancer telomeres and white crows» (en anglès). Am J Clin Exp Urol, 2018 Abr 1; 6 (2), pp: 93-100. ISSN: 2330-1910. PMC: 5902727. PMID: 29666837 [Consulta: 16 maig 2018].
- ↑ Boukamp P, Mirancea N «Telomeres rather than telomerase a key target for anti-cancer therapy?» (en anglès). Exp Dermatol, 2007 Gen; 16 (1), pp: 71-79. DOI: 10.1111/j.1600-0625.2006.00517.x. ISSN: 1600-0625. PMID: 17181645 [Consulta: 16 maig 2018].
- ↑ Harrison's Principles of Internal Medicine, 16th Edition. Chap. 69: Cancer cell biology and angiogenesis, Robert G. Fenton i Dan L. Longo; 2005, pàg. 454. ISBN 9780071402354
- ↑ Savage, SA «Beginning at the ends: telomeres and human disease» (en anglès). F1000Res, 2018 Maig 1; 7, pii: F1000 Faculty Rev-524. DOI: 10.12688/f1000research.14068.1. PMC: 5931273. PMID: 29770205 [Consulta: 25 maig 2018].
- ↑ Gaspar TB, Sá A, Lopes JM8, Sobrinho-Simões M, et al «Telomere Maintenance Mechanisms in Cancer» (en anglès). Genes (Basel), 2018 Maig 3; 9 (5), pii: E241. DOI: 10.3390/genes9050241. ISSN: 2073-4425. PMID: 29751586 [Consulta: 19 maig 2018].
- ↑ Donati B, Ciarrocchi A «Telomerase and Telomeres Biology in Thyroid Cancer» (en anglès). Int J Mol Sci, 2019 Jun 13; 20 (12), pii: E2887. DOI: 10.3390/ijms20122887. ISSN: 1422-0067. PMID: 31200515 [Consulta: 11 juliol 2019].
- ↑ Laish I, Mari A, Mannasse B, Hadary R, et al «Telomere Length, Aggregates, and Capture in Cirrhosis» (en anglès). Isr Med Assoc J, 2018 Maig; 5 (20), pp: 295-299. ISSN: 1565-1088. PMID: 29761675 [Consulta: 21 maig 2018].
- ↑ Everaerts S, Lammertyn EJ, Martens DS, De Sadeleer L, et al «/ The aging lung: tissue telomere shortening in health and disease» (en anglès). Respir Res, 2018 Maig 11; 19 (1), pp: 95. DOI: 10.1186/s12931-018-0794-z. PMC: 5948770. PMID: 29751799 [Consulta: 23 maig 2018].
- ↑ NTP/NIH «Lung-Regeneration» (en anglès). Nonneoplastic Lesion Atlas, 2015; Des 7 (rev), pàgs: 3 [Consulta: 23 maig 2018].
- ↑ Snetselaar R, van Batenburg AA, van Oosterhout MFM2 Kazemier KM, et al «Short telomere length in IPF lung associates with fibrotic lesions and predicts survival» (en anglès). PLoS One, 2017 Des 27; 12 (12), pp: e0189467. DOI: 10.1371/journal.pone.0189467. PMC: 5744955. PMID: 29281671 [Consulta: 23 maig 2018].
- ↑ Genètics Home Reference «RTEL1 gene» (en anglès). NIH/US National Library of Medicine, 2018; Set 11, pàgs: 4 [Consulta: 16 setembre 2018].
- ↑ Genètics Home Reference «PARN gene» (en anglès). NIH/US National Library of Medicine, 2018; Set 11, pàgs: 4 [Consulta: 16 setembre 2018].
- ↑ McDonough JE, Martens DS, Tanabe N, Ahangari F, et al «A role for telomere length and chromosomal damage in idiopathic pulmonary fibrosis» (en anglès). Respir Res, 2018 Jul 9; 19 (1), pp: 132. DOI: 10.1186/s12931-018-0838-4. PMC: 6038197. PMID: 29986708 [Consulta: 16 setembre 2018].
- ↑ Chatterjee S, de Gonzalo-Calvo D, Derda AA, Schimmel K, et al «Leukocyte telomere length correlates with hypertrophic cardiomyopathy severity» (en anglès). Sci Rep, 2018 Jul 25; 8 (1), pp: 11227. DOI: 10.1038/s41598-018-29072-8. PMC: 6060137. PMID: 30046139 [Consulta: 14 setembre 2018].
- ↑ Chang ACY, Chang ACH, Kirillova A, Sasagawa K, et al «Telomere shortening is a hallmark of genetic cardiomyopathies» (en anglès). Proc Natl Acad Sci USA, 2018 Set 11; 115 (37), pp: 9276-9281. DOI: 10.1073/pnas.1714538115. ISSN: 1091-6490. PMID: 30150400 [Consulta: 19 setembre 2018].
- ↑ Anderson R, Lagnado A1,2, Maggiorani D3, Walaszczyk A, et al «Length-independent telomere damage drives post-mitotic cardiomyocyte senescence» (en anglès). EMBO J, 2019 Mar 1; 38 (5), pii: e100492. DOI: 10.15252/embj.2018100492. PMC: 6140486. PMID: 30150400 [Consulta: 12 juny 2019].
- ↑ Marrs C, Chesmore K, Menon R, Williams S «Maternal human telomerase reverse transcriptase variants are associated with preterm labor and preterm premature rupture of membranes» (en anglès). PLoS One, 2018 Maig 17; 13 (5), pp: e0195963. DOI: 10.1371/journal.pone.0195963. ISSN: 1932-6203. PMID: 29771920 [Consulta: 21 maig 2018].
- ↑ Song L, Zhang B, Liu B, Wu M, et al «Effects of maternal exposure to ambient air pollution on newborn telomere length» (en anglès). Environ Int, 2019 Jul; 128, pp: 254-260. DOI: 10.1016/j.envint.2019.04.064. ISSN: 1873-6750. PMID: 31059920 [Consulta: 10 juliol 2019].
- ↑ Herlin M, Broberg K, Igra AM, Li H, et al «Exploring telomere length in mother-newborn pairs in relation to exposure to multiple toxic metals and potential modifying effects by nutritional factors» (en anglès). BMC Med, 2019 Abr 11; 17 (1), pp: 77. DOI: 10.1186/s12916-019-1309-6. PMC: 6458832. PMID: 30971237 [Consulta: 11 juliol 2019].
- ↑ Rajeevan MS, Murray J, Oakley L, Lin JS, Unger ER «Association of chronic fatigue syndrome with premature telomere attrition» (en anglès). J Transl Med, 2018 Feb 27; 16 (1), pp: 44. DOI: 10.1186/s12967-018-1414-x. PMC: 5830066. PMID: 29486769 [Consulta: 25 maig 2018].
- ↑ Genetics Home Reference «WRN gene» (en anglès). NIH. US National Library of Medicine, 2018; Maig 22 (rev), pàgs: 7 [Consulta: 25 maig 2018].
- ↑ Crabbe L, Jauch A, Naeger CM, Holtgreve-Grez H, Karlseder J «Telomere dysfunction as a cause of genomic instability in Werner syndrome» (en anglès). Proc Natl Acad Sci USA, 2007 Feb 13; 104 (7), pp: 2205-2210. DOI: 10.1073/pnas.0609410104. PMC: 1794219. PMID: 17284601 [Consulta: 25 maig 2018].
- ↑ Oshima J, Sidorova JM, Monnat RJ Jr «Werner syndrome: Clinical features, pathogenesis and potential therapeutic interventions» (en anglès). Ageing Res Rev, 2017 Gen; 33, pp: 105-114. DOI: 10.1016/j.arr.2016.03.002. PMC: 5025328. PMID: 26993153 [Consulta: 25 maig 2018].
- ↑ UniProt «Dyskerin» (en anglès). Protein knowledgebase. UniProt Consortium, 2016 Jul 6; O95940 -O95940_HUMAN- (rev), pàgs: 2 [Consulta: 20 setembre 2018].
- ↑ Garofola C, Gross GP «Dyskeratosis Congenita» (en anglès). StatPearls [Internet]. StatPearls Publishing LLC, 2018 Jun 19; NBK507710 (rev), pàgs: 5. PMID: 29939532 [Consulta: 20 setembre 2018].
- ↑ Glousker G, Touzot F, Revy P, Tzfati Y, Savage SA «Unraveling the Pathogenesis of Hoyeraal-Hreidarsson Syndrome, a Complex Telomere Biology Disorder» (en anglès). Br J Haematol, 2015 Ag; 170 (4), pp: 457–471. DOI: 10.1111/bjh.13442. PMC: 4526362. PMID: 25940403 [Consulta: 30 setembre 2018].
- ↑ Genetics Home Reference «Coats plus syndrome» (en anglès). NIH. US National Library of Medicine, 2019; Jul 9 (rev), pàgs: 5 [Consulta: 12 juliol 2018].
- ↑ Simon AJ, Lev A, Zhang Y, Weiss B, et al «Mutations in STN1 cause Coats plus syndrome and are associated with genomic and telomere defects» (en anglès). Int J Mol Sci, 2019 Jun 19; 20 (12), pii: E2996. DOI: 10.3390/ijms20122996. ISSN: 1422-0067. PMID: 31248154 [Consulta: 30 setembre 2018].
- ↑ Ball SE, Gibson FM, Rizzo S, Tooze JA, et al «Progressive Telomere Shortening in Aplastic Anemia» (en anglès). Blood, 1998 Maig 15; 91 (10), pp: 3582-3592. ISSN: 0006-4971. PMID: 9572992 [Consulta: 11 setembre 2018].
- ↑ Bär C, Povedano JM, Serrano R, Benitez-Buelga C, et al «Telomerase gene therapy rescues telomere length, bone marrow aplasia, and survival in mice with aplastic anemia» (en anglès). Blood, 2016 Abr 7; 127 (14), pp: 1770-1779. DOI: 10.1182/blood-2015-08-667485. ISSN: 0006-4971. PMID: 26903545 [Consulta: 11 setembre 2018].
- ↑ Sarkar J, Liu Y «Fanconi anemia proteins in telomere maintenance» (en anglès). DNA Repair (Amst), 2016 Jul; 43, pp: 107-112. DOI: 10.1016/j.dnarep.2016.02.007. ISSN: 4917397. PMID: 27118469 [Consulta: 28 setembre 2018].
- ↑ Stanley SE, Armanios M «The short and long telomere syndromes: paired paradigms for molecular medicine» (en anglès). Curr Opin Genet Dev, 2015 Ag 1; 33, pp: 1-9. DOI: 10.1016/j.gde.2015.06.004. PMC: 4741306. PMID: 26232116 [Consulta: 5 octubre 2018].
- ↑ Wei D, Xie J, Yin B, Hao H, et al «Significantly lengthened telomere in granulosa cells from women with polycystic ovarian syndrome (PCOS)» (en anglès). J Assist Reprod Genet, 2017 Jul; 34 (7), pp: 861-866. DOI: 10.1007/s10815-017-0945-z. PMC: 5476553. PMID: 28502062 [Consulta: 5 octubre 2018].
- ↑ Crous-Bou M, Fung TT, Prescott J, Julin B, et al «Mediterranean diet and telomere length in Nurses' Health Study: population based cohort study» (en anglès). BMJ, 2014 Des 2; 349, pp: g6674. DOI: 10.1136/bmj.g6674. PMC: 4252824. PMID: 25467028 [Consulta: 5 juny 2018].
- ↑ Alder JK, Hanumanthu VS, Strong MA, DeZern AE, et al «Diagnostic utility of telomere length testing in a hospital-based setting» (en anglès). Proc Natl Acad Sci USA, 2018 Mar 6; 115 (10), pp: E2358-E2365. DOI: 10.1073/pnas.1720427115. PMC: 5877993. PMID: 29463756 [Consulta: 28 setembre 2018].
- ↑ Tian Y, Wang S, Jiao F, Kong Q, et al «Telomere Length: A Potential Biomarker for the Risk and Prognosis of Stroke» (en anglès). Front Neurol, 2019 Jun 13; 10, pp: 624. DOI: 10.3389/fneur.2019.00624. PMC: 6585102. PMID: 31263449 [Consulta: 9 juliol 2019].
- ↑ Braun DM, Chung I, Kepper N, Deeg KI, Rippe K «TelNet - a database for human and yeast genes involved in telomere maintenance» (en anglès). BMC Genet, 2018 Maig 18; 19 (1), pp: 32. DOI: 10.1186/s12863-018-0617-8. ISSN: 1471-2156. PMID: 29776332 [Consulta: 21 maig 2018].
- ↑ Somanathan I, Baysdorfer C «A bioinformatics approach to identify telomere sequences» (en anglès). Biotechniques, 2018 Jul; 65 (1), pp: 20-25. DOI: 10.2144/btn-2018-0057. ISSN: 0736-6205. PMID: 30014738 [Consulta: 11 setembre 2018].
- ↑ Feuerbach L, Sieverling L, Deeg KI, Ginsbach P, et al «TelomereHunter - in silico estimation of telomere content and composition from cancer genomes» (en anglès). BMC Bioinformàtics, 2019 Maig 28; 20 (1), pp: 272. DOI: 10.1186/s12859-019-2851-0. PMC: 6540518. PMID: 31138115 [Consulta: 10 juliol 2019].
Bibliografia
- Calado, Rodrigo T.; Young, Neal S. Telomere Diseases (en anglès). N Engl J Med, 2009 Des 10; 361 (24), pp: 2353–2365. DOI 10.1056/NEJMra0903373 [Consulta: 9 setembre 2018].
- Savage, Sharon A. Beginning at the ends: telomeres and human disease (en anglès). F1000Res, 2018 Maig 1; 7, pii: F1000 Faculty Rev-524. DOI 10.12688/f1000research.14068.1 [Consulta: 28 setembre 2018].
Enllaços externs
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Telòmer |
- CancerTelSys e:Med Systems Medicine Program. 2018 Feb. (en anglès)
- Replicación de ADN y telómeros Barjau Vallet, J, 2015 Abr. (en castellà)
