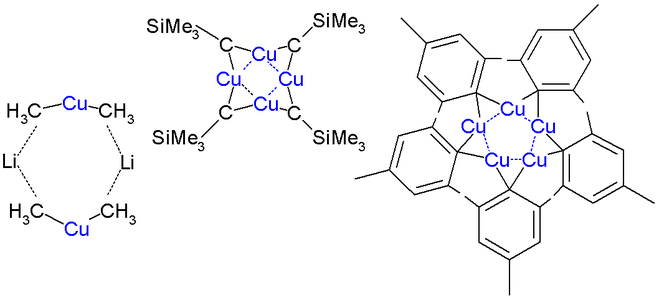
Enllaç C-Cu
|
|
S'ha proposat fusionar aquesta pàgina amb «Compost d'organocoure». (vegeu la discussió, pendent de concretar). Data: 2023 |
Els compostos d'organocoure (o compostos orgànics del coure) són compostos químics que contenen un enllaç químic entre carboni (C) i coure (Cu) (enllaç C-Cu).
-
Dímer d'eterat de difenilcuprat de liti d'estructura cristal·lina
-
Fórmula esqueletal del dímer d'eterat de difenilcuprat de liti
La química de l'organocoure és la ciència corresponent que explora les propietats, l'estructura i la reactivitat d'aquests compostos.[1][2][3]
Història[modifica]
El primer compost d'organocoure, l'explosiu acetilur de coure (I) Cu₂C₂ (Cu-C≡C-Cu), va ser sintetitzat per Rudolf Christian Böttger el 1859 fent passar gas acetilè a través d'una solució de clorur de coure (I),[4][5]
- C₂H2(g) + 2CuCl(aq) → Cu₂C2(s) + 2HCl(aq)
obtenint un precipitat vermell-marró, explosiu quan es seca. Aquesta reacció és emprada per detecció d'acetilè.
Henry Gilman i James Straley el 1936 van estudiar les reaccions d'organocuprats amb halurs orgànics,[6] i Kharash el 1941 va observar que els ions Cu- catalitzaven la 1,4-addició de reactius de Grignard a cetones conjugades selectivament enfront de la 1,2-addició. L'intermedi d'aquesta reacció no es va poder determinar passat el 1966 per House degut a l'obtenció, fins llavors, d'espècies d'organocoure impures.
Estructura i enllaç[modifica]
Els compostos d'organocoure són diversos en estructura i reactivitat, però els compostos d'organocoure es limiten en gran manera en estats d'oxidació al coure(I), de vegades denominat Cu+. Com a centre metàl·lic d10, està relacionat amb Ni(0), però a causa del seu estat d'oxidació més alt, participa en menys enllaços π. Els derivats orgànics de Cu(II) i Cu(III) s'invoquen com a intermedis, però rarament s'aïllen o fins i tot s'observen.
Pel que fa a la geometria molecular, el coure(I) adopta estructures simètriques, d'acord amb la seva capa d'electrons esfèrica. Normalment s'adopta una de les tres geometries de coordinació: lineal de 2 lligands, plana trigonal de 3 lligands i tetraèdrica de 4 lligands.
Els compostos organocoure formen complexos amb una varietat de lligands tous com ara alquilfosfines (R₃P), tioèters (R₂S) i cianur (CN−).
Complexos simples amb lligands CO, alquè i Cp[modifica]
Fa temps que se sap que les sals de coure(I) s'uneixen al CO, encara que feblement. Un complex representatiu és CuCl(CO), que és polimèric. En contrast amb els carbonils metàl·lics clàssics, l'enllaç π no és fort en aquests compostos.[7]
-
Part del marc de CuCl(CO). En aquest polímer de coordinació, els centres de Cu són tetraèdrics enllaçats mitjançant lligands de clorur de triple pont.
Els alquens s'uneixen al coure(I), encara que de nou generalment feblement. La unió de l'etilè al Cu a les proteïnes té una gran importància en biologia vegetal, tant que l'etilè es classifica com una hormona vegetal. La seva presència, detectada per la proteïna-Cu, afecta la maduració i molts altres desenvolupaments.[8]
Tot i que el coure no forma un metal·locè, es poden produir complexos de mig-sandvitx. Un d'aquests derivats és el coure (η-ciclopentadienil trietilfosfina).[9]
Compostos alquil i aril de coure[modifica]
Compostos alquil i aril de coure (I)[modifica]
Els halurs de coure reaccionen amb reactius d'organoliti per donar compostos d'organocoure. L'àrea va ser pionera per Henry Gilman, qui va informar de metilcoure el 1936. Així, el fenilcoure es prepara per reacció de fenil-liti amb bromur de coure(I) en èter dietílic. Els reactius de Grignard es poden utilitzar en lloc dels compostos d'organoliti. Gilman també va investigar els dialquilcuprats. S'obtenen combinant dos equivalents de RLi amb sals de Cu(I). Alternativament, aquests cuprats es preparen a partir de compostos d'organocoure neutres oligomèrics mitjançant tractament amb un equivalent de reactiu d'organoliti.
Els compostos del tipus [CuRn](n-1)- són reactius amb l'oxigen i l'aigua, formant òxid de coure(I). També solen ser tèrmicament inestables, cosa que pot ser útil en determinades reaccions d'acoblament. Malgrat o a causa d'aquestes dificultats, els reactius d'organocoure es generen i consumeixen amb freqüència in situ sense cap intent d'aïllar-los. S'utilitzen en la síntesi orgànica com a reactius alquilants perquè presenten una major tolerància al grup funcional que els reactius de Grignard i organoliti corresponents. L'electronegativitat del coure és molt superior a la del seu veí al costat del grup 12 de la taula periòdica, el zinc, cosa que suggereix una nucleofilia disminuïda per als seus lligands de carboni.
Les sals de coure reaccionen amb els alquins terminals per formar els acetilurs.
Els halurs d'alquil reaccionen amb compostos d'organocoure amb inversió de configuració. D'altra banda, les reaccions de compostos d'organocoure amb halura d'alquenil procedeixen amb la retenció de la configuració del subtrat.
Els compostos organocoure s'acoblen amb els halurs d'aril:
- :
Estructures[modifica]
Els complexos d'alquil i aril de coure s'agreguen tant en forma cristal·lina com en solució. L'agregació és especialment evident per als compostos d'organocoure neutres en càrrega, és a dir, espècies amb fórmula empírica (RCu), que adopten estructures cícliques. Com que cada centre de coure requereix almenys dos lligands, el grup orgànic és un lligand de pont. Aquest efecte s'il·lustra amb l'estructura del mesitilcoure, que és un pentàmer. També s'observa una estructura cíclica en CuCH₂SiMe₃, el primer compost d'organocoure 1:1 que es va analitzar per cristal·lografia de raigs X (el 1972 per Lappert). Aquest compost és relativament estable perquè els grups trimetilsilil voluminosos proporcionen protecció estèrica. És un tetràmer, formant un anell de 8 membres amb enllaços Cu-C alterns. A més, els quatre àtoms de coure formen un anell pla de Cu4 basat en enllaços de tres centres i dos electrons. La longitud de l'enllaç de coure a coure és de 242 pm en comparació amb les 256 pm del coure a granel. En el pentamesitilpentacoure es forma un anell de coure de 5 membres, semblant al (2,4,6-trimetilfenil)or i el pentafluorofenilcoure que són tetràmers.[10]
-
Agregats d'organocoure
El dimetilcuprat de liti és un dímer en èter dietílic, que forma un anell de 8 membres amb dos àtoms de liti que uneixen dos grups metil. De la mateixa manera, el difenilcuprat de liti forma un etherat dimèric, [{Li(OEt2)}(CuPh2)]2, en estat sòlid.[11]
Compostos alquil i aril de coure (III)[modifica]
-
Un intermedi de Cu(III) caracteritzat per RMN.[12]
S'ha demostrat la implicació de l'estat d'oxidació rar del Cu(III) en l'addició conjugada del reactiu de Gilman a una enona;[12] en un experiment de RMN d'injecció ràpida a -100 °C, el reactiu de Gilman Me₂CuLi (estabilitzat per iodur de liti) es va introduir a la ciclohexanona (1) permetent la detecció del complex π coure-alqué (2). En l'addició posterior de cianur de trimetilsilil es forma l'espècie Cu(III) (3) (indefinidament estable a aquesta temperatura) i en augmentar la temperatura a -80 °C es forma el producte d'addició del conjugat (4). Segons un experiment in silico adjunt,[13] l'intermedi Cu(III) té una geometria molecular plana quadrada amb el grup ciano en orientació cis respecte al grup ciclohexenil metina i antiparal·lel al protó metina. Amb altres lligands que el grup ciano, aquest estudi prediu compostos de Cu(III) estables a temperatura ambient.
Reaccions dels organocuprats[modifica]
Reaccions d'acoblament creuat[modifica]
Abans del desenvolupament de reaccions d'acoblament creuat catalitzats per pal·ladi, el coure va ser el catalitzador preferit durant gairebé un segle. El pal·ladi ofereix una reacció més ràpida i selectiva. Tanmateix, en els darrers anys el coure ha tornat a sorgir com un metall sintèticament útil, pel seu menor cost i perquè és un metall ecològic.[14]
Les reaccions de R₂CuLi amb halurs d'alquil R'-X donen el producte d'acoblament:
- R₂CuLi + R'X → R-R' + CuR + LiX
El mecanisme de reacció implica l'addició oxidativa (OA) de l'halur d'alquil a Cu(I), formant un intermedi pla de Cu (III), seguida d'una eliminació reductora (RE). L'atac nucleòfil és el pas que determina la velocitat. En la substitució del iodur, es proposa un mecanisme de transferència d'un sol electró (vegeu la figura).
Molts electròfils participen en aquesta reacció. L'ordre aproximat de reactivitat, començant pel més reactiu, és el següent: clorur d'acil[15] > aldehids > tosilats ~ epòxids > iodurs > bromurs > clorurs > cetones > èsters > nitrils > alquens.
-
Mecanisme proposat d'acoblament creuat de coure
En general, el mecanisme OA-RE és anàleg al de les reaccions d'acoblament creuat catalitzades per pal·ladi. Una diferència entre el coure i el pal·ladi és que el coure pot experimentar processos de transferència d'un sol electró.[16]
Reaccions d'acoblament[modifica]
L'acoblament oxidatiu és l'acoblament d'acetilurs de coure a alquins conjugats a l'acoblament de Glaser (per exemple, en la síntesi de ciclooctadecanonaè) o als halurs d'aril a l'acoblament de Castro-Stephens.
L'acoblament reductor és una reacció d'acoblament d'halurs d'aril amb un equivalent estequiomètric de coure metàl·lic que es produeix en la reacció d'Ullmann. En un exemple d'una reacció d'acoblament creuat actual anomenada acoblament descarboxilatiu, una quantitat catalítica de Cu(I) desplaça un grup carboxil formant l'intermedi arilcoure (ArCu). Simultàniament, un catalitzador de pal·ladi converteix un bromur d'aril en l'intermedi d'organopal·ladi (Ar'PdBr) i en la transmetal·lació el biaril es forma a partir d'ArPdAr'.[Nota 1][17]
-
Acoblament aril-aril descarboxilatiu
L'acoblament neutre redox és l'acoblament d'alquins terminals amb halurs-alquins amb una sal de coure(I) a l'acoblament Cadiot-Chodkiewicz. També és possible l'acoblament tèrmic de dos compostos organocoure.
Carbocupració[modifica]
La carbocupració és una addició nucleòfila de reactius d'organocure (R-Cu) a acetilè o alquins terminals que resulta en un compost d'alquenilcoure (RC=C-Cu). És un cas especial de carbometal·lació i també anomenada reacció de Normant.[18]
Carbocupration is a nucleophilic addition of organocopper reagents (R-Cu) to acetylene or terminal alkynes resulting in an alkenylcopper compound (RC=C-Cu).[19] It is a special case of carbometalation and also called the Normant reaction.
-
Mecanisme de carbocupració. Cicle catalític per a carbocupració per a la síntesi d'aldols, productes tipus Baylis-Hillman.[20]
Aplicacions sintètiques[modifica]
- L'acoblament de Chan-Lam permet la formació d'enllaços aril carboni-hetoroàtom. Implica l'acoblament d'àcids borònics, estanans o siloxans amb substrats que contenen NH o OH.
- La reacció d'Ullmann implica reaccions d'halurs d'aril mediades pel coure. Es reconeixen dos tipus de reaccions d'Ullmann:
- Síntesi clàssica promoguda pel coure de compostos biaril simètrics
- Substitució aromàtica nucleòfila promoguda pel coure.
- La reacció d'acoblament de Sonogashira, que utilitza coure i pal·ladi, comporta l'acoblament d'halurs d'aril i/o vinil amb alquins terminals.
- La dimerització tèrmica es produeix mitjançant un mecanisme d'hidrur de coure amb una retenció completa de la configuració organocoure.[16]
-
Mecanisme proposat d'hidrur de coure
La dimerització oxidativa es produeix mitjançant l'oxidació del dialquilcuprat(i) a diaquil coure(II) neutre transitori que es descompon per donar el dímer aquil-alquil desitjat. Aquesta reacció és una cinètica de primer ordre tant per a l'organocoure com per al substrat amb la inversió com a conseqüència estereoquímica, un mecanisme semblant a SN2 per a la dimerització oxidativa i el desplaçament directe.
-
Dimeròxid
Agents reductors[modifica]
Els hidrurs de coure són reactius especialitzats utilitzats ocasionalment com a agent reductor. L'hidrur de coure més conegut s'anomena reactiu de Stryker, un compost de clúster amb la fórmula [(PPh₃)CuH]6. Redueix els compostos carbonílics alquen α,β-insaturats.[21]
-
Reducció Buchwald catalitzada per coure
La reacció de Buchwald és una reducció asimètrica d'alquens activats catalitzada per coure. El reactiu es genera in situ a partir del complex NHC de coure (I). Els equivalents d'hidrur els proporciona un silà.[22][23]
-
Z-Flouroalquè
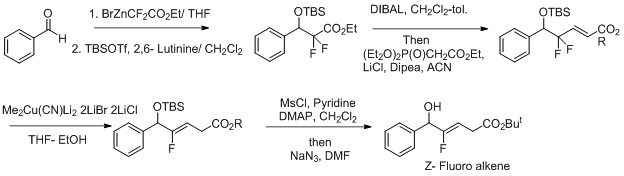
La síntesi d'isòsters de dipèptid d'alquè Z-Fluoro,[24][25] un altre esforç per fer que aquestes reaccions siguin més selectives inclou l'ús de condicions de reducció d'oxidació per a la reacció.[26] El fluorur actua com a grup sortint i millora la regioselectivitat en la transformació del Z-fluoroalquè.
Reacció d'alquilació de Cu[modifica]
En general, la reacció d'alquilació dels reactius d'organocoure es produeix mitjançant gamma-alquilació. L'atac cis-gamma es produeix millor en el carbamat de ciclohexil a causa dels estèrics. S'informa que la reacció és favorable en dissolvents d'èter. Es va demostrar que aquest mètode era molt eficaç per a l'acoblament oxidatiu d'amines i alquils, inclosos el tertbutil i els halurs d'aril.[27]
Reaccions de funcionalització veïnal[modifica]
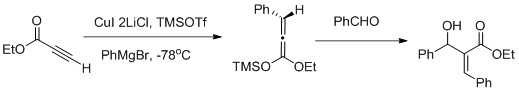
La funcionalització veïnal utilitza una seqüència de reacció aldòlica de carbocupracion-Mukaiyama:[28]
-
Funció veïnal
Muller i els seus col·laboradors van informar d'una funcionalització veïnal dels èsters α,β-acetilènics mitjançant una seqüència de reacció aldòlica de carbocupració-Mukaiyama (com es mostra a la figura anterior) la carbocupration afavoreix la formació del Z-aldol.
Notes[modifica]
- ↑ Reactius: carbonat de potassi (base); NMP (dissolvent); acetilacetonat de pal·ladi, iodur de coure(I) (catalitzadors); aturador MS (tamís molecular); fenantrolina (lligand).
Referències[modifica]
- ↑ Posner, 1980.
- ↑ Herrmann, 1999.
- ↑ Elschenbroich, 2006.
- ↑ Böttger, 1859, p. 351-362.
- ↑ Sladkov i Okhin, 1968, p. 748.
- ↑ Gilman i Straley, 1936, p. 821-834.
- ↑ Strauss, 2000, p. 1-6.
- ↑ Light et al., 2016, p. 715-728.
- ↑ Delbaere, McBride i Ferguson, 1970, p. 515-521.
- ↑ Cairncross et al., House, p. 122.
- ↑ Lorenzen i Weiss, 1990, p. 300-302.
- ↑ 12,0 12,1 Bertz et al., 2007, p. 7208-7209.
- ↑ Hu i Snyder, 2007, p. 7210-7211.
- ↑ Beletkaya i Cheprakov, 2004, p. 2337-2364.
- ↑ Posner, Gary H.; Whitten, Charles E. «Secondary and Tertiary Alkyl Ketones from Carboxylic Acid Chlorides and Lithium Phenylthio(Alkyl)Cuprate Reagents:tert-Butyl Phenyl Ketone» (en anglès). Organic Syntheses, 2003, pàg. 122. DOI: 10.1002/0471264180.os055.28.
- ↑ 16,0 16,1 Posner, 2011, p. 253-400.
- ↑ Goossen, Deng i Levy, 2006, p. 662-664.
- ↑ Norman i Bourgain, 1971, p. 2583.
- ↑ Per a un exemple: «Addition of an Ethylcopper Complex to 1-Octyne: (E)-5-Ethyl-1,4-Undecadiene» (en anglès). Organic Syntheses, 64, 1986, pàg. 1. DOI: 10.15227/orgsyn.064.0001.
- ↑ Hendryx, Amanda Joy Mueller. Novel methodologies via the catalytic carbocupration of alkynoates and the total synthesis of (+)-aspergillide B (
 PDF) (en anglès).
PDF) (en anglès).
- ↑ Daeuble i Stryker, 2001.
- ↑ Cox et al., 2014, p. 4219-4231.
- ↑ Jurkauskas, Sadighi i Buchwald, 2003, p. 2417-2420.
- ↑ Otaka et al., Tamamura, p. 285-287.
- ↑ Okada et al., Taguchi, p. 5845-5847.
- ↑ Otaka et al., Tamamura, p. 5443-5446.
- ↑ Yamamoto i Morouka, 1980, p. 2739-2740.
- ↑ Muller i Jennings, 2008, p. 1649-1652.
Bibliografia[modifica]
- Beletkaya, I. P.; Cheprakov, A. V. «Copper in Cross Coupling Reactions: The Post Ullman Chemistry» (en anglès). Coord. Chem. Rev., 248, 2004. DOI: 10.1016/j.ccr.2004.09.014.
- Bertz, Steven H.; Stephen; Craig, A.; Brad, J. «Rapid Injection NMR in Mechanistic Organocopper Chemistry. Preparation of the Elusive Copper(III) Intermediate» (en anglès). Journal of the American Chemical Society, 129(23), 2007, pàg. 7208-7209. DOI: 10.1021/ja067533d. PMID: 17506552.
- Böttger, R. C «Ueber die Einwirkung des Leuchtgases auf verschiedene Salzsolutionen, insbesondere auf eine ammoniakalische Kupferchlorürlösung» (en alemany). Annalen der Chemie und Pharmacie, 109(3), 1859. DOI: 10.1002/jlac.18591090318.
- Cairncross, Allan; Sheppard, William A.; Wonchoba, Edward; Guilford, William J.; House, Cynthia B.; Coates, Robert M. «Pentafluorophenylcopper tetramer, a reagent for synthesis of fluorinated aromatic compounds» (en anglès). Organic Syntheses, 59, 1979. DOI: 10.15227/orgsyn.059.0122.
- Cox, N.; Dang, H.; Whittaker, A. M.; Lalic, G. «NHC- copper hydrides as chemoselective reducing agents: catalytic reduction of alkynes, alkyl triflates and alkyl halides» (en anglès). Tetrahedron, 70(27)-70(28), 2014. DOI: 10.1016/j.tet.2014.04.004.
- Daeuble, John F.; Stryker, Jeffrey M. «Hexa-μ-hydrohexakis(triphenylphosphine)hexacopper» (en anglès). Encyclopedia of Reagents for Organic Synthesis, 2001. DOI: 10.1002/047084289X.rh011m.
- Delbaere, L. T. J.; McBride, D. W.; Ferguson, R. B. «Crystal structure of π-cyclopentadienyl(triethylphosphine)copper(I), π-C5H5CuP(C₂H5)₃» (en anglès). Acta Crystallographica B, 26(5), 1970. DOI: 10.1107/S056774087000273X.
- Elschenbroich, Christoph. Organometallics (en anglès). Weinheim: Wiley-VCH, 2006. ISBN 3-527-29390-6.
- Gilman, James M.; Straley, Henry «Relative reactivities of organometallic compounds XIII. Copper and silver.» (en anglès). Recueil des Travaux Chimiques des Pays-Bas et de la Belgique, 55, 1936. ISSN: 0370-7539.* Goossen, L. J.; Deng, G.; Levy, L. M. «Synthesis of Biaryls via Catalytic Decarboxylative Coupling» (en anglès). Science, 313(5787), 2006. Bibcode: 2006Sci...313..662G. DOI: 10.1126/science.1128684. PMID: 16888137.
- Herrmann, W. A. Synthetic Methods of Organometallic and Inorganic Chemistry (en anglès). vol. 5. Copper, Silver, Gold, Zinc, Cadmium, and Mercury. Stuttgart: Thieme, 1999. ISBN 3-13-103061-5.
- Hu, Haipeng; Snyder, James P. «Organocuprate Conjugate Addition: The Square-Planar "CuIII" Intermediate» (en anglès). Journal of the American Chemical Society, 129(23), 2007. DOI: 10.1021/ja0675346. PMID: 17506553.
- Jurkauskas, V.; Sadighi, J. P.; Buchwald, S. L. «Conjugate addition of a,b- unsaturated compounds catalyzad by a copper carbene complex» (en anglès). Org. Lett., 5(14), 2003. DOI: 10.1021/ol034560p. PMID: 12841744.
- Light, K. M.; Wisniewski, J. A.; Vinyard, W. A.; Kieber-Emmons, M. T. «Perception of the plant hormone ethylene: known-knowns and known-unknowns» (en anglès). J. Biol. Inorg. Chem., 21(5)-21(6), 2016. DOI: 10.1007/s00775-016-1378-3. PMID: 27456611.
- Lorenzen, N. P.; Weiss, E «Synthesis and Structure of a Dimeric Lithium Diphenylcuprate:[{Li(OEt₂)}(CuPh₂)]₂» (en anglès). Angew. Chem. Int. Ed., 29(3), 1990. DOI: 10.1002/anie.199003001.
- Muller, A. J.; Jennings, M. P. «Vicinal Functionalization of propionilate Esters via Tandem Catalytic Carbocupration-Mukaiyama Aldol Reaction sequence» (en anglès). Org. Lett., 10, 2008.
- Normant, J.; Bourgain, M. «Synthese stereospecifique and reactivite d' organocuivreux vinyliques» (en anglpes). Tetrahedron Letters, 12(27), 1971. DOI: 10.1016/S0040-4039(01)96925-4.
- Okada, M.; Nakamura, Y.; Sago, A.; Hirokawa, H.; Taguchi, T. «Stereoselective cosnstruction of functionalized (Z)- fluoroalkenes directed to o- depsipeptide isosteres» (en anglès). Tetrahedron Lett., 43, 2003.
- Otaka, A.; Watanabe, H.; Mitsoyama, E.; Yukimasa, A.; Tamamura, H.; Fujii, N. «Synthesis of (Z)-fluoroalkene isosteres utilizing organocopper- mediated reduction of gama, gamma- α,β - enoates» (en anglès). Tetrahedron Lett., 42, 2001.
- Otaka, A.; Watanabe, H.; Yukimasa, A.; Oishi, S.; Tamamura, H.; Fuji, N. «New access to α- substituted (Z)-fluoroalkene dipeptide isosteres utilizing organocopper reagents under redoctive-oxidative alkylation (R-OA) conditions» (en anglès). Tetrahedron Lett., 42, 2001.
- Posner, Gary H. An introduction to synthesis using organocopper reagents (en anglès). New Nova York: Wiley, 1980. ISBN 0-471-69538-6.
- Posner, G. H. «Substitution Reactions Using Organocopper Reagents» (en anglès). Organic Reactions, 22(2), 2011.
- Sladkov, A. M.; Okhin, L. Yu «Copper and Silver Acetylides in Organic Synthesis» (
 PDF) (en anglès). Russian Chemical Reviews, 37, 1968.
PDF) (en anglès). Russian Chemical Reviews, 37, 1968. - Strauss, S. H. «Copper(I) and Silver(I) Carbonyls. To be or not to be Nonclassical» (en anglès). Journal of the Chemical Society, Dalton Transactions, 2000, 2000. DOI: 10.1039/A908459B.
- Yamamoto, Y; Yamamoto, S; Yatagai, H; Maruyama, K «Lewis acid mediated reactions of organocopper reagent. A remarkably enhanced regioselective gamma- attack of allylic halides and direct alkylation of allylic alcohols via RCu.BF₃» (en anglès). JACS, 102(7), 1980, pàg. 2318-2325. DOI: 10.1021/ja00527a032.
- Yamamoto, H.; Marouka, K. «Novel N-alkylation of amines with organocopper reagents» (en anglès). J. Org. Chem., 45(13), 1980. DOI: 10.1021/jo01301a048.
- Yao, B; Liu, Y; Zhao, L; Wang, D; Wang, M «Designing a Cu(II)−ArCu(II)−ArCu(III)−Cu(I) Catalytic Cycle: Cu(II)-Catalyzed Oxidative Arene C−H Bond Azidation with Air as an Oxidant under Ambient Conditions» (en anglès). J. Org. Chem., 79(22), 2014, pàg. 11139-11145. DOI: 10.1021/jo502115a. PMID: 25350606.






![{\displaystyle [{\ce {R}}{-}{\color {Blue}{\ce {Cu}}}{\ce {-R}}]^{-}{\ce {Li+}}\ {\xrightarrow {\color {Red}{\ce {R'-X}}}}\ \left[{\ce {R}}{-}{\overset {{\displaystyle \color {Red}{\ce {R}}'} \atop |}{\underset {| \atop {\displaystyle \color {Red}{\ce {X}}}}{\color {Blue}{\ce {Cu}}}}}{\ce {-R}}\right]^{-}{\ce {Li+}}{\ce {->R}}{-}{\color {Blue}{\ce {Cu}}}+{\ce {R}}{-}{\color {Red}{\ce {R'}}}+{\ce {Li}}{-}{\color {Red}{\ce {X}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d7db6776d965a97de00837677a94c6fd3d1df2a)