Sulfat d'amoni
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 132,020477736 Da |
| Estructura química | |
| Fórmula química | H₈N₂O₄S |
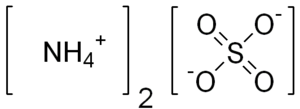 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Densitat | 1,769 g/cm³ (a 20 °C) |
| Punt de descomposició | 218 °C |
| Entalpia estàndard de formació | −1.180 kJ/mol |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
El sulfat d'amoni (antigament sulfat amònic) és un compost químic de fórmula (NH₄)₂SO₄, amb molts usos comercials. El seu ús principal és com a fertilitzant en agricultura. Fou el primer fertilitzant sintètic que es produí de forma industrial al Regne Unit a finals del segle xix a partir de l'amoníac obtingut en la destil·lació seca de l'hulla i el primer produït a partir de l'amoníac produït amb el procés de Haber-Bosch a Alemanya el 1914. Té un 21 % de nitrogen i un 24 % de sofre. Es fa servir per reduir el pH del sòl en els sòls de tendència alcalina.
Estat natural
[modifica]
A la natura hom troba rarament sulfat d'amoni en minerals. S'ha descrit un mineral en fumaroles volcàniques, la mascagnita, descoberta el 1779 al volcà Vesuvi i que duu el nom del seu descobridor, Paolo Mascagni (1755-1815), anatomista italià.[1][2]
Història
[modifica]
El sulfat d'amoni era una sal coneguda pels alquimistes i anomenada sel ammoniacum secretum Glauberi ‘sal secreta d'amoníac de Glauber’ perquè l'alquimista alemany Johann R. Glauber (1604-1670?) en descriví en el segle xvii la preparació a partir d'amoníac NH3 i àcid sulfúric H2SO4. La reacció és:[3]
El sulfat d'amoni fou el primer fertilitzant que es produí industrialment amb la mateixa reacció de Glauber. La producció s'inicià en la dècada del 1870 al Regne Unit[4] a partir de l'amoníac provinent de la destil·lació seca de l'hulla als forns de coc (l'any 1900 se'n produïen 85 000 tones anuals de nitrogen i el 1913 280 000 t). Amb la posada en funcionament a Alemanya del procés de Haber-Bosch de síntesi de l'amoníac el 1913, la producció augmentà (36 000 t per any equivalents a 8 000 t de nitrogen i el 1917/18 ja eren 105 000 t per any de nitrogen).[5] Fou molt emprat en la dècada del 1940. Malgrat que encara es fa servir, el seu baix contingut en nitrogen i la poca quantitat de sofre han fet que s'hagi substituït per d'altres.[6]
Propietats
[modifica]Propietats físiques
[modifica]
El sulfat d'amoni a temperatura ambient és un sòlid blanc o marró, inodor, amb una densitat d'1,77 g/cm³. Cristal·litza en el sistema ortoròmbic. Si se l'escalfa es descompon a 280 °C en òxids de sofre, de nitrogen i amoníac. És molt soluble en aigua (76,4 g es dissolen en 100 g d'aigua), i insoluble en etanol i acetona.[7][8]
Propietats químiques
[modifica]Quan es dissol en aigua, el sulfat d'amoni es dissocia en els seus ions i, després, el catió amoni NH4+ experimenta una reacció àcid-base amb les molècules de l'aigua donant amoníac i cations oxoni H3O+, establint-se un equilibri. L'existència d'aquests cations oxoni suposa que les dissolucions de sulfat d'amoni són lleugerament àcides (una dissolució de concentració 0,1 mol/l dona un pH = 5,5):[7]
Producció
[modifica]
El sulfat d'amoni es produeix mitjançant quatre processos diferents: (1) fabricació sintètica a partir d'amoníac pur i àcid sulfúric concentrat, (2) com a subproducte de l'eliminació d'amoníac dels gasos dels forns de coc, (3) a partir de la neteja amb amoníac del diòxid de sofre SO2 sobrant en plantes d'àcid sulfúric, i (4) com a subproducte de la producció de caprolactama (CH2)5COHN. Normalment, el sulfat d'amoni es produeix combinant amoníac anhidre i àcid sulfúric:[9]
En el procés, una barreja de gas d'amoníac i vapor d'aigua s'introdueix en un reactor que conté una solució saturada de sulfat d'amoni i al voltant del 2 % - 4 % v/v d'àcid sulfúric lliure a 60 °C. La calor de la reacció manté la temperatura desitjada. S'afegeix àcid sulfúric concentrat per mantenir la solució àcida i per retenir el seu nivell d'àcid lliure. El sulfat d'amoni sec i en pols es pot formar ruixant àcid sulfúric en una cambra de reacció plena de gas amoníac. La calor de reacció evapora tota l'aigua present al sistema amb la formació resultant de sal en pols seca. Els cristalls de sulfat d'amoni es formen fent circular la solució per un evaporador on s'espesseix. Una centrifugadora separa els cristalls del licor mare. Els cristalls contenen entre l'1 % i el 2,5 % d'humitat i s'assequen en un llit fluïditzat o assecador de tambor rotatiu. Els gasos d'escapament de l'assecador s'envien a un sistema de recollida de partícules (per exemple, un fregador humit) per controlar les emissions i recuperar el producte residual. Els grànuls gruixuts i fins se separen per cribratge abans d'emmagatzemar-los o enviar-los. El sulfat d'amoni també es fabrica a partir de guix, sulfat de calci dihidrat CaSO4·2H2O. En aquest procés, s'afegeix guix finament dividit a una solució de carbonat d'amoni (NH4)2CO3, provocant la precipitació de carbonat de calci CaCO3 com a sòlid, deixant sulfat d'amoni a la solució:[9]
Després de la formació de la solució de sulfat d'amoni, les operacions de fabricació de cada procés són similars. Els cristalls de sulfat d'amoni es formen fent circular el licor de sulfat d'amoni a través d'un evaporador. L'evaporació de l'aigua espessa la solució i els cristalls de sulfat d'amoni se separen del licor en una centrifugadora.[9]
La neteja amb amoníac del diòxid de sofre SO2 que s'elimina per una xemeneia d'un procés industrial segueix aquestes reaccions:[10]
Usos
[modifica]El sulfat d'amoni s'utilitza gairebé exclusivament com a material fertilitzant; s'utilitzen quantitats menors en aplicacions no fertilitzants, inclòs l'ús com a suplement per a l'alimentació del bestiar, per a diverses aplicacions farmacèutiques i per a la ignifugació, l'adob, la mineria de metalls de terres rares, el processament d'aliments, la fermentació, la tintura tèxtil i el tractament de l'aigua. El 2022, el sulfat d'amoni s'emprà principalment (95 % del consum mundial) com a material fertilitzant nitrogenat i representa al voltant del 5,9 % del mercat mundial de fertilitzants nitrogenats. L'ús industrial del sulfat d'amoni només representa al voltant del 5 % del consum mundial. El consum mundial de sulfat d'amoni es concentra al sud-est asiàtic i Oceania, Amèrica Central i del Sud, la Xina, Europa occidental i els Estats Units.[11]
Fertilitzant
[modifica]
En general, les regions industrialitzades representen la major part de la capacitat mundial de sulfat d'amoni, però la Xina és el principal productor des del 2012, seguida dels Estats Units i l'Europa occidental. Com que gran part del sulfat d'amoni es produeix involuntàriament com a subproducte, el volum de producció està més influenciat pels nivells generals de producció industrial que per la demanda de fertilitzants. Com a resultat, el gran creixement de la capacitat durant el període 2012-2022 es produí a la Xina, i es preveu que la Xina representi l'augment important durant el període de previsió, però a un ritme més lent.[11]

El sulfat d'amoni té un alt contingut de sofre en forma de sulfat, el que el fa fàcilment absorbible per les plantes. Té un pH baix, el que la fa apte per a sòls alcalins. Com a fertilitzant nitrogenat, competeix amb la urea, els fosfats d'amoni i el nitrat d'amoni. El sofre s'ha reconegut cada cop més com un nutrient essencial per al creixement de les plantes, ja que és necessari per a la síntesi d'aminoàcids, proteïnes, enzims, vitamines i clorofil·la. S'ha trobat que és beneficiós per a una varietat de cultius, com ara canola, alfals, blat de moro, patates, arròs, verdures i blat.[11]
No hi ha problemes mediambientals greus relacionats amb l'ús de sulfat d'amoni com a material fertilitzant. Tanmateix, la preocupació ambiental té un paper important en la indústria del sulfat d'amoni; una part important de la producció mundial de sulfat d'amoni és el resultat directe de la necessitat d'eliminar el diòxid de sofre SO2 dels gasos expulsats per les xemeneies en diverses operacions de fosa i refinació de metalls per tal d'ajustar-se a les regulacions governamentals sobre emissions de SO2. Una gran font potencial de producció addicional de sulfat d'amoni és la recuperació de SO2 de les centrals tèrmiques que empren carbó per a la generació elèctrica.[11]
Altres usos
[modifica]A més de com a fertilitzant, és un coadjuvant en insecticides, herbicides i fungicides amb la funció d'enllaçar el ferro i calci de l'aigua i les cèl·lules de les plantes, en això és particularment útil en l'herbicida glifosat. També es fa servir en la preparació d'altres sals d'amoni, especialment del persulfat d'amoni (NH4)2S2O8, un agent oxidant fort que s'utilitza com a catalitzador en la química dels polímers, com a gravador i com a agent de neteja i blanqueig. S'empra en la mineria de terres rares en resines de bescanvi iònic. Per cada tona de mineral brut de terres rares, es necessiten aproximadament 5 tones de sulfat d'amoni.[12]
En bioquímica, la precipitació del sulfat d'amoni és un mètode comú per purificar proteïnes. Ja que el sulfat d'amoni és una substància inerta, no és fàcil que reaccioni amb altres substàncies bioactives, i pot protegir al màxim l'activitat de les proteïnes en el procés de purificació. A més, el sulfat d'amoni té una solubilitat excel·lent i pot formar un entorn ric en sal, el que facilita les preparacions per a la precipitació de proteïnes i la purificació posterior amb alts nivells de sal.[12] Per això és un ingredient de vacunes.[13] També és un additiu alimentari (codi E517i) que té les funcions d'estabilitzant i regulador de l'acidesa.[14][15] En solució saturada en aigua pesant (D₂O) és una solució estàndard en espectroscòpia. També s'ha fet servir com retardant de flama.[16]
Amb sulfat d'amoni es poden fabricar explosius i en alguns casos està prohibit tenir-ne (per exemple a l'Afganistan l'any 2010), perquè pot explotar si es mescla amb oxidants (nitrat de potassi KNO3, nitrit de potassi KNO2 i clorat de potassi KClO3).[7]
Referències
[modifica]- ↑ Barthelmy, David. «Mascagnite Mineral Data». Mineralogy Database, 1997-2014. Arxivat de l'original el 2024-04-15. [Consulta: 14 gener 2024].
- ↑ «Mascagnite». Mindat.org. Mindat.org and the Hudson Institute of Mineralogy, 1993-2024. Arxivat de l'original el 19 de gener 2013. [Consulta: 12 gener 2024].
- ↑ IChemE. «Johann Glauber – Alchemy to Modern Chemistry». Arxivat de l'original el 2023-10-03. [Consulta: 14 gener 2024].
- ↑ Khosla, Anil «TRADE AND INDUSTRIAL ORGANISATION: JAPANESE AMMONIUM SULPHATE INDUSTRY IN THE INTERWAR PERIOD». Australian Economic History Review, 46, 1, 3-2006, pàg. 1–22. Arxivat de l'original el 2024-05-16. DOI: 10.1111/j.1467-8446.2006.00149.x. ISSN: 0004-8992 [Consulta: 16 maig 2024].
- ↑ Johnson, Benjamin. The State of Ammonia Synthesis at the Turn of the Twentieth Century: The Arena for Discovery (en anglès). Cham: Springer International Publishing, 2022, p. 77–89. DOI 10.1007/978-3-030-85532-1_9. ISBN 978-3-030-85532-1. Arxivat 2024-05-16 a Wayback Machine.
- ↑ Morel, P. Tecnología de los fertilizantes (en castellà). Xile: Andrés Bello, 1971. Arxivat 2024-02-15 a Wayback Machine.
- ↑ 7,0 7,1 7,2 PubChem. «Ammonium Sulfate» (en anglès). Arxivat de l'original el 2024-04-20. [Consulta: 14 gener 2024].
- ↑ Haynes, W.M. (ed.). CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data.. 95a edició. Boca Raton, Florida: CRC Press, 2014. ISBN 978-1-4822-0867-2. Arxivat 2024-05-14 a Wayback Machine.
- ↑ 9,0 9,1 9,2 Speight, James G. Chapter Three - Industrial Inorganic Chemistry. Butterworth-Heinemann, 2017, p. 111–169. DOI 10.1016/b978-0-12-849891-0.00003-5. ISBN 978-0-12-849891-0. Arxivat 2021-10-28 a Wayback Machine.
- ↑ Kohl, Arthur L.; Nielsen, Richard B. Gas purification (en anglès). 5a ed. Houston, Tex: Gulf Pub, 1997. ISBN 978-0-88415-220-0. Arxivat 2024-05-16 a Wayback Machine.
- ↑ 11,0 11,1 11,2 11,3 «Ammonium Sulfate». S&P Global Commodity Insights. Arxivat de l'original el 14 de gener 2024. [Consulta: 14 gener 2024].
- ↑ 12,0 12,1 «Difference and use of coke grade ammonium sulfate and caprolactam grade ammonium sulfate» (en anglès). Arxivat de l'original el 2024-01-15. [Consulta: 15 gener 2024].
- ↑ «Pink Book | Appendix B: Vaccine Excipient & Media Summary, Part 2». Arxivat de l'original el 2011-01-23. [Consulta: 17 gener 2011].
- ↑ «Panera Bread › Menu & Nutrition › Nutrition Information Profile». Arxivat de l'original el 2009-08-19. [Consulta: 17 gener 2011].
- ↑ «Official Subway Restaurants U.S. Products Ingredients Guide». Arxivat de l'original el 2011-08-14. [Consulta: 17 gener 2011].
- ↑ George, C.W.; Susott, R.A. «Effects of Ammonium Phosphate and Sulfate on the Pyrolysis and Combustion of Cellulose». Research Paper INT-90. USDA Forest Service, 4-1971.
Bibliografia
[modifica]- Properties: UNIDO and International Fertilizer Development Center (1998), Fertilizer Manual, Kluwer Academic Publishers, ISBN 0-7923-5032-4.






