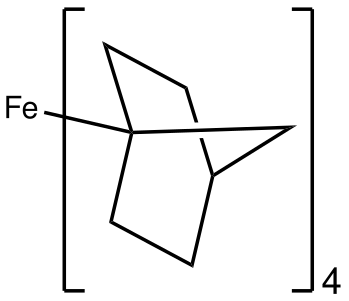
Enllaç C-Fe
| Substància química | classe estructural d'entitats químiques |
|---|
Els compostos d'organoferro (o compostos orgànics del ferro) són compostos químics que contenen un enllaç químic entre carboni (C) i ferro (Fe) (enllaç C-Fe).
La química de l'organoferro és la ciència corresponent que explora les propietats, l'estructura i la reactivitat d'aquests compostos.[1][2] Els compostos d'organoferro són rellevants en la síntesi orgànica com a reactius com el pentacarbonil de ferro, el nonacarbonil de diferro i el tetracarbonilferrat disòdic. Mentre que el ferro adopta estats d'oxidació des de Fe(−II) fins a Fe(VII), Fe(IV) és l'estat d'oxidació més alt establert per a espècies d'organoferro. Encara que el ferro és generalment menys actiu en moltes aplicacions catalítiques, és menys car i «més verd» que altres metalls.[3] Els compostos d'organoferro presenten una àmplia gamma de lligands que suporten l'enllaç Fe-C; com amb altres organometalls, aquests lligands de suport inclouen de manera destacada fosfines, monòxid de carboni i ciclopentadienil, però també s'utilitzen lligands durs com les amines.
F(0) i estats més reduïts[modifica]
Complexos carbonil[modifica]
Els carbonils de ferro importants són els tres carbonils binaris neutres, el pentacarbonil de ferro, el nonacarbonil de ferro i el dodecacarbonil de triferro. Un o més lligands carbonílics en aquests compostos es poden substituir per una varietat d'altres lligands, inclosos alquens i fosfines. Un complex de ferro(-II), tetracarbonilferrat disòdic (Na₂[Fe(CO)4]), també conegut com «reactiu de Collman», es prepara reduint el pentacarbonil de ferro amb sodi metàl·lic. El reactiu aniònic altament nucleòfil es pot alquilar i carbonilar per donar els derivats d'acil que pateixen protonòlisi per produir aldehids:[4]|
- LiFe(CO)4(C(O)R) + H+ → RCHO (+ productes que contenen ferro)
Es pot accedir a acils de ferro similars tractant el pentacarbonil de ferro amb compostos d'organoliti:
- ArLi + Fe(CO)5 → LiFe(CO)4C(O)R
En aquest cas, el carbanió ataca un lligand CO. En una reacció complementària, el reactiu de Collman es pot utilitzar per convertir clorurs d'acil en aldehids. Es poden aconseguir reaccions similars amb sals de [HFe(CO)4]−[5]
Derivats de l'alquè-Fe(0)-CO[modifica]
Monoalquens[modifica]
El pentacarbonil de ferro reacciona fotoquímicament amb alquens per donar Fe(CO)4(alquè).[6]
Derivats del diè-Fe(0)-CO[modifica]
Els complexos de ferrodiè solen preparar-se a partir de Fe(CO)5 o Fe₂(CO)9. Els derivats són coneguts pels diens comuns com el ciclohexadiè,[7] el norbornadiè i el ciclooctadiè, però fins i tot el ciclobutadiè es pot estabilitzar. En el complex amb butadiè, el diè adopta una conformació cis. Els carbonils de ferro són grups protectors potencials per als diens, protegint-los de les hidrogenacions i les reaccions de Diels-Alder. El tricarbonil de ciclobutadieferro es prepara a partir de 3,4-diclorociclobutè i Fe₂(CO)9.
Els ciclohexadiens, molts derivats de la reducció de Birch de compostos aromàtics, formen derivats (diè)Fe(CO)₃. L'afinitat de la unitat Fe(CO)₃ pels diens conjugats es manifesta en la capacitat dels carbonils de ferro de catalitzar les isomeritzacions de l'1,5-ciclooctadiè a l'1,3-ciclooctadiè. Els complexos de ciclohexadiè se sotmeten a l'abstracció d'hidrurs per donar cations de ciclohexadienil, que afegeixen nucleòfils. L'abstracció d'hidrurs dels complexos del ciclohexadiè de ferro(0) dóna derivats ferrosos.[8][9]
El complex enona tricarbonil de (bencilidenacetona)ferro serveix com a font de la subunitat de Fe(CO)₃ i s'utilitza per preparar altres derivats. S'utilitza de manera similar al Fe₂(CO)9.
Derivats de l'alquí-Fe(0)-CO[modifica]
Els alquins reaccionen amb carbonils de ferro per donar una gran varietat de derivats. Els derivats inclouen ferrols (Fe₂(C4R4)(CO)6), (p-quinona)Fe(CO)₃, (ciclobutadiè)Fe(CO)₃ i molts altres.[10]
Complexos triens i poliens de Fe(0)[modifica]
Els complexos estables que contenen ferro amb i sense lligands de CO són coneguts per una gran varietat d'hidrocarburs poliinsaturats, per exemple, cicloheptatriè, azulè i bullvalè. En el cas del ciclooctatetraè (COT), els derivats inclouen Fe(COT)₂,[11] Fe₃(COT)₃,[12] i diversos COT-carbonils mixts (per exemple, Fe(COT)(CO)₃ i Fe₂(COT)(CO)6).
-
El bis(ciclooctatetraè)ferro és un complex Fe(0) que no té lligands de CO
Fe(I) i Fe(II)[modifica]
Com que el Fe(II) és un estat d'oxidació comú per al Fe, es coneixen molts compostos d'organoferro (II). Els compostos Fe(I) sovint presenten enllaços Fe-Fe, però es produeixen excepcions, com ara [Fe(antracè)₂]−[13]
-
Dímer dicarbonil de ciclopentadieniliferro
El ferrocè i els seus derivats[modifica]
El ràpid creixement de la química organometàl·lica al segle xx es pot remuntar al descobriment del ferrocè, un compost molt estable que va prefigurar la síntesi de molts compostos sandvitx relacionats. El ferrocè es forma per reacció del ciclopentadienur de sodi amb el clorur de ferro(II):
- 2 NaC5H5 + FeCl₂ → Fe(C5H5)₂ + 2 NaCl
El ferrocè mostra una reactivitat diversa localitzada en els lligands del ciclopentadienil, incloses les reaccions de Friedel-Crafts i la litació. Algunes reaccions de funcionalització electròfila, però, procedeixen mitjançant un atac inicial al centre de Fe per donar l'espècie [Cp₂Fe–Z] + doblegada (que formalment són Fe(IV)). Per exemple, HF:PF5 i Hg(OTFA)₂, donen complexos aïllables o observables espectroscòpicament [Cp2Fe–H]+PF6– i Cp₂Fe+–Hg-(OTFA)₂, respectivament.[14][15][16]
El ferrocè també és una bastida estructuralment inusual, tal com ho mostra la popularitat de lligands com l'1,1'-bis(difenilfosfí)ferrocè, que són útils en catàlisi.[17] El tractament del ferrocè amb triclorur d'alumini i benzè dóna el catió [CpFe(C6H6)]+. L'oxidació del ferrocè dóna l'espècie blava 17e ferroceni. Els derivats del ful·lerè també poden actuar com un lligand de ciclopentadienil altament substituït.
Fp₂, Fp−, i Fp+ i derivats[modifica]
Fe(CO)5 reacciona amb el ciclopentadiè per donar l'espècie dinuclear Fe(I) dímer de ciclopentadienilferro dicarbonil ([FeCp(CO)₂]₂), sovint abreujat com a Fp₂. La piròlisi de Fp₂ dóna el cúmul cuboïdal [FeCp(CO)]4.
Els lligands de ciclopentadienil substituïts molt obstaculitzats poden donar una espècie monomèrica Fe(I) aïllable. Per exemple, Cpi-PrFe(CO)₂ (Cpi-Pr = i-Pr5C5) s'ha caracteritzat cristal·logràficament.[18]
La reducció de Fp₂ amb sodi dóna NaFp, que conté un potent nucleòfil i precursor de molts derivats del tipus CpFe(CO)₂R.[19]
El derivat [FpCH₂S(CH₃)₂]+ s'ha utilitzat en ciclopropanacions.[20]
El complex Cp(CO₂)Fe+(η2-vinilèter]+ és un catió vinílic emmascarat.[21]
Els compostos Fp-R són proquirals i els estudis han explotat els derivats quirals CpFe(PPh₃)(CO)acil.[22]
Compostos alquil, al·lil i aril[modifica]
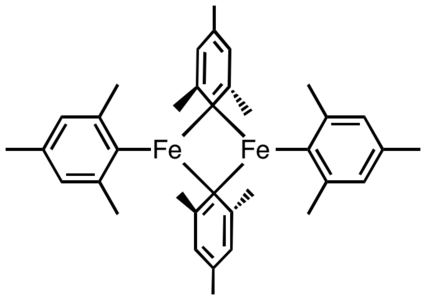
Els complexos simples de peralquil i peraril del ferro són menys nombrosos que els derivats de Cp i CO. Un exemple és el tetramesitildiferro.
-
El tetramesitildiferro és un exemple rar de complex de ferro perorgànic neutre
Els compostos del tipus [(η3-al·lil)Fe(CO)4]+X− són sintons de cations al·lílics en la substitució al·lílica.[6] En canvi, els compostos del tipus [(η5-C5H5)Fe(CO)₂(CH₂CH=CHR)] que posseeixen grups η1-al·lil són anàlegs a les espècies metàl·liques del grup principal (M = B, Si, Sn, etc.) i reaccionen amb electròfils de carboni per donar productes d'al·lació amb selectivitat SE2′.[23] De la mateixa manera, els complexos d'al·lenil(ciclopentadienilferro) dicarbonil presenten una reactivitat anàloga a les espècies d'al·lenilmetall del grup principal i serveixen com a sintons de propargil nucleòfils.[24]
Derivats dels sulfurs i fosfurs[modifica]
Es formen complexos del tipus Fe₂(SR)₂(CO)6 i Fe₂(PR₂)₂(CO)6, normalment per reacció de tiols i fosfines secundàries amb carbonils de ferro.[25]
Els tiolats també es poden obtenir a partir del complex tetraèdric Fe₂S₂(CO)6.
Fe(III)[modifica]
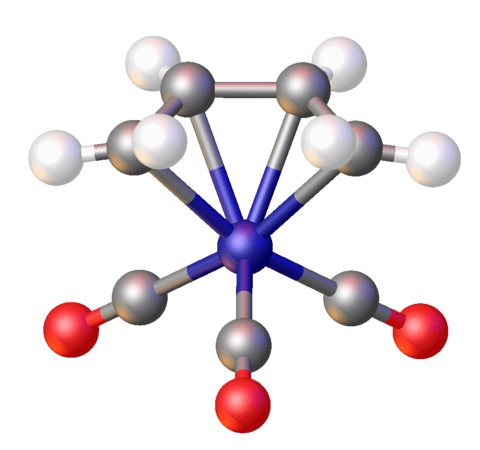
Alguns compostos d'organoferro(III) es preparen per oxidació de compostos d'organoferro(II). Un exemple conegut des de fa temps és el ferrocè [(C5H5)₂Fe]+. Els complexos de porfirina organoferro(III) són nombrosos.
-
Estructura de Fe(tetrafenilporfirina)C6H5.[26]
Fe(IV)[modifica]
En Fe(norbornil)4, el Fe(IV) està estabilitzat per un lligand alquil que resisteix l'eliminació de β-hidrur.[27]
-
Fe(4-norbornil)4 és un exemple rar de complex tetraèdric de baix gir
Sorprenentment, FeCy4, que és susceptible a l'eliminació de β-hidrur, també s'ha aïllat i caracteritzat cristal·logràficament i és estable a -20 °C. L'estabilitat inesperada es va atribuir a les forces dispersives estabilitzadores, així com als efectes conformacionals que desafavoreixen l'eliminació del β-hidrur.[28]
L'oxidació de dos electrons del decametilferrocè dóna el dicat [Fe(C5Me5)₂]2+, que forma un complex carbonil, [Fe(C5Me5)2(CO)](SbF6)₂.[29]
Compostos organoferro en síntesi orgànica i catàlisi homogènia[modifica]
En la catàlisi industrial, els complexos de ferro s'utilitzen poques vegades en contrast amb el cobalt i el níquel. A causa del baix cost i la baixa toxicitat de les seves sals, el ferro és atractiu com a reactiu estequiomètric. Algunes àrees d'investigació inclouen:
- Hidrogenació i reducció, exemple del complex de Knölker catalitzador.
- Reaccions d'acoblament creuat. Els compostos de ferro com el Fe(acac)₃ catalitzen una àmplia gamma de reaccions d'acoblament creuat amb un substrat un aril o alquil Grignard i l'altre substrat un aril, alquenil (vinil) o organohalogenur d'acil. En l'acoblament de Kumada relacionat, els catalitzadors es basen en pal·ladi i níquel.
- Els complexos derivats de les bases de Schiff són catalitzadors actius per a la polimerització d'olefines.[30]
Bioquímica[modifica]
A l'àrea de la química bioorganometàl·lica, les espècies d'organoferro es troben als llocs actius dels tres enzims hidrogenases, així com de la monòxid de carboni deshidrogenasa.
Referències[modifica]
- ↑ Komiya i Hurano, 1997.
- ↑ Bolm, 2004, p. 6217-6254.
- ↑ Enthaler, Junge i Beller, 2008, p. 3317-3321.
- ↑ Finke i Sorrell, 1979, p. 102.
- ↑ Brunet, 1990, p. 1041.
- ↑ 6,0 6,1 Enders, Jandeleit i Berg, 2002, p. 189.
- ↑ Pearson i Sun, 2008.
- ↑ Birch i Chamberlain, 1977a, p. 16.
- ↑ Birch i Chamberlain, 1977b, p. 107.
- ↑ Hoogzand i Hubel, 1968.
- ↑ Gerlach i Schunn, 1974.
- ↑ Lavallo i Grubbs, 2009, p. 559-562.
- ↑ Ellis, 2019, p. 9538-9563.
- ↑ Cunningham, 1997, p. 1114-1122.
- ↑ Astruc, 2017, p. 6-29.
- ↑ Malischewski et al., Dittrich, p. 13372-13376.
- ↑ Stepnicka, 2008.
- ↑ Sitzmann et al., Stalke, p. 2872-2875.
- ↑ Pannell i Sharma, 2010, p. 4741-4745.
- ↑ Mattson, O'Connor i Helquist, 1998, p. 372.
- ↑ Chang, Rosenblum i Simms, 1988, p. 95.
- ↑ Rück-Braun, 2004.
- ↑ Cutler et al., Marten, p. 3149-3157.
- ↑ Wang et al., Wang, p. 19594-19599.
- ↑ King, 1962, p. 2460.
- ↑ Doppelt, 1984, p. 4009-4011.
- ↑ Bower i Tennent, 1972, p. 2512-2514.
- ↑ Casitas et al., DeBeer, p. 10108-10113.
- ↑ Malischewski et al., Meyer, p. 14597-14601.
- ↑ Allan et al., 2007, p. 8963-8970.
Bibliografia[modifica]
- Allan, L. E. N.; Shaver, M. P.; White, A. J. P.; Gibson, V. C. «Correlation of Metal Spin-State in alpha-Diimine Iron Catalysts with Polymerization Mechanism» (en anglès). Inorg. Chem, 46, 2007.
- Astruc, Didier «Why is Ferrocene so Exceptional?» (en anglès). European Journal of Inorganic Chemistry, 2017(1), 2017. DOI: 10.1002/ejic.201600983. ISSN: 1099-0682.
- Birch, A. J.; Chamberlain, K. B. «Alkylation of Dimedone With A Tricarbonyl(Diene)iron Complex: Tricarbonyl[2-[(2,3,4,5-η)-4-methoxy-2,4-cyclohexadien-1-yl]-5,5-dimethyl-1,3-cyclohexanedione]iron». Org. Synth., 57, 1977a, pàg. 16. DOI: 10.15227/orgsyn.057.0016.
- Birch, A. J.; Chamberlain, K. B. «Tricarbonyl[(2,3,4,5-η)-2,4-cyclohexadien-1-one]iron and Tricarbonyl[(1,2,3,4,5-η)-2-methoxy-2,4-cyclohexadien-1-yl]iron(1+) Hexafluorophosphate(1−) From Anisole». Organic Syntheses, 57, 1977b, pàg. 107. DOI: 10.15227/orgsyn.057.0107.
- Bolm, Carsten «Iron-Catalyzed Reactions in Organic Synthesis» (en angles). Chemical Reviews, 104, 2004. DOI: 10.1021/cr040664h.
- Bower, B. K; Tennent, H. G «Transition metal bicyclo[2.2.1]hept-1-yls» (en anglès). J. Am. Chem. Soc., 94(7), 1972. DOI: 10.1021/ja00762a056.
- Brunet, J. J. «Tetracarbonylhydridoferrates, MHFe(CO)4: Versatile Tools in Organic Synthesis and Catalysis» (en anglès). Chem. Rev., 90(1041)-90(1059), 1990. DOI: 10.1021/cr00104a006.
- Casitas, Alicia; Rees, Julian A; Goddard, Richard; Bill, Eckhard; DeBeer, Serena «Two Exceptional Homoleptic Iron(IV) Tetraalkyl Complexes» (en anglès). Angewandte Chemie International Edition, 56(34), agost 2017. DOI: 10.1002/anie.201612299.
- Chang, Tony C. T; Rosenblum, Myron; Simms, Nancy «Vinylation Of Enolates with a Vinyl Cation Equivalent: trans-3-Methyl-2-vinylcyclohexanone» (en anglès). Org. Synth, 66, 1988. DOI: 10.15227/orgsyn.066.0095.
- Cunningham, Allan F. «Mechanism of Mercuration of Ferrocene: General Treatment of Electrophilic Substitution of Ferrocene Derivatives» (en anglès). Organometallics, 16(6), març 1997. DOI: 10.1021/om960815+. ISSN: 0276-7333.
- Cutler, A.; Ehnholt, D.; Lennon, P.; Nicholas, K.; Marten, David F. «Chemistry of dicarbonyl .eta.5-cyclopentadienyliron complexes. General syntheses of monosubstituted .eta.2-olefin complexes and of 1-substituted .eta.1-allyl complexes. Conformational effects on the course of deprotonation of (.eta.2-olefin) cations» (en anglès). Journal of the American Chemical Society, 97(11), maig 1975. DOI: 10.1021/ja00844a038. ISSN: 0002-7863.
- Doppelt, Pascal «Molecular stereochemistry of low-spin five-coordinate phenyl(meso-tetraphenylporphyrinato)iron(III)» (en anglès). Inorg. Chem, 23(24), 1984. DOI: 10.1021/ic00192a033}.
- Ellis, J. E «The Chatt reaction: conventional routes to homoleptic arenemetalates of d-block elements» (en anglès). Dalton Transactions, 48(26), 2019. DOI: 10.1039/C8DT05029E. PMID: 30724934.
- Enders, D.; Jandeleit, B.; Berg, S. von «(+)-(1R,2S,3R)-Tetracarbonyl[(1-3η)-1-(Phenylsulfonyl)- But-2-en-1-yl]iron(1+) Tetrafluoroborate» (en anglès). Org. Synth., 78, 2002. DOI: 10.15227/orgsyn.078.0189.
- Enthaler, S.; Junge, K.; Beller, M. (en anglès) Angew. Chem. Int. Ed., 47(18), 2008. DOI: 10.1002/anie.200800012. PMID: 18412184.
- Finke, Richard G.; Sorrell, Thomas N. «Nucleophilic Acylation with Disodium Tetracarbonylferrate: Methyl 7-oxoheptanoate and Methyl 7-oxoöctanoate» (en anglès). Organic Syntheses, 59, 1979. DOI: 10.15227/orgsyn.059.0102.
- Gerlach, D. H; Schunn, R. A «Bis(1,3,5,7-cyclooctatetraene)iron(0)» (en anglès). Inorg. Synth, 15(2), 1974. DOI: 10.1002/9780470132463.ch1.
- Hoogzand, C.; Hubel, W. «Cyclic Polymerization of Acetylenes by Metal Carbonyl Compounds». A: Organic Syntheses via Metal Carbonyls (en anglès). I. Wiley, 1968. ISBN 0-471-93367-8.
- King, R. B «Organosulfur Derivatives of Metal Carbonyls. I. The Isolation of Two Isomeric Products in the Reaction of Triiron Dodecacarbonyl with Dimethyl Disulfide» (en anglès). J. Am. Chem. Soc., 84, 1962.
- Koerner von Gustorf, E. A.; Grevels, F. W; Fischler, I. The Organic Chemistry of Iron (en anglès). Academic Press, 1978. DOI 10.1016/B978-0-12-417101-5.X5001-X. ISBN 978-0-12-417101-5.
- Komiya, S.; Hurano, M. Synthesis of Organometallic Compounds: A Practical Guide (en anglès). Sanshiro Komiya Ed, 1997.
- Lavallo, Vincent; Grubbs, Robert H «Carbenes As Catalysts for Transformations of Organometallic Iron Complexes» (en anglès). Science, 326(5952), 2009. Bibcode: 2009Sci...326..559L. DOI: 10.1126/science.1178919. PMC: 2841742. PMID: 19900894.
- Malischewski, Moritz; Seppelt, Konrad; Sutter, Jörg; Heinemann, Frank W; Dittrich, Birger; Meyer, Karsten «Protonation of Ferrocene: A Low-Temperature X-ray Diffraction Study of [Cp2FeH](PF6) Reveals an Iron-Bound Hydrido Ligand» (en anglès). Angewandte Chemie International Edition, 56(43), 2017. DOI: 10.1002/anie.201704854. ISSN: 1521-3773. PMID: 28834022.
- Malischewski, Moritz; Seppelt, Konrad; Sutter, Jörg; Munz, Dominik; Meyer, Karsten «A Ferrocene-Based Dicationic Iron(IV) Carbonyl Complex» (en anglès). Angewandte Chemie International Edition, 57(44), 2018. DOI: 10.1002/anie.201809464. ISSN: 1521-3773. PMID: 30176109.
- Mattson, Matthew N; O'Connor, Edward J; Helquist, Paul. Cyclopropanation using an Iron-Containing Methylene Transfer Reagent: 1,1-Diphenylcyclopropane (en anglès). 9, 1998, p. 372 (Inorganic Syntheses).
- Pannell, Keith H; Sharma, Hemant K «(Cyclopentadienyl)dicarbonylmethyliron ((η5-C5H5)Fe(CO)₂CH₃, FpMe), a Seminal Transition-Metal Alkyl Complex: Mobility of the Methyl Group» (en anglès). Organometallics, 29, 2010, pàg. 4741–4745. DOI: 10.1021/om1004594.
- Pearson, Anthony J.; Sun, Huikai «Cyclohexadieneiron Tricarbonyl» (en anglès). e-EROS (Encyclopedia of Reagents for Organic Synthesis), 2008. DOI: 10.1002/047084289X.rn00791.
- Rück-Braun, Karola. «Iron Acyl Complexes». A: Transition Metals for Organic Synthesis (en anglès). 1. Weinheim: Ed. M. Beller, C. Bolm; Eds. Wiley-VCH, 2004. ISBN 3-527-30613-7.
- Sitzmann, Helmut; Dezember, Thomas; Kaim, Wolfgang; Baumann, Frank; Stalke, Dietmar; Kärcher, Joerg; Dormann, Elmar; Winter, Hubert; Wachter, Christoph; Kelemen, Marc «Synthesis and Characterization of the Stable Dicarbonyl(cyclopentadienyl)iron Radical [(C5R5)Fe(CO)2 (R CHMe2)]» (en anglès). Angewandte Chemie International Edition in English, 35(23)-35(24), 1996. DOI: 10.1002/anie.199628721. ISSN: 1521-3773.
- Stepnicka, Petr. Ferrocenes: Ligands, Materials and Biomolecules (en anglès). Hoboken: J. Wiley, 2008. ISBN 0-470-03585-4.
- Wang, Yidong; Zhu, Jin; Durham, Austin C; Lindberg, Haley; Wang, Yi-Ming «α-C–H Functionalization of π-Bonds Using Iron Complexes: Catalytic Hydroxyalkylation of Alkynes and Alkenes» (en anglès). Journal of the American Chemical Society , 141(50), desembre 2019. DOI: 10.1021/jacs.9b11716. ISSN: 0002-7863. PMID: 31791121.




![Estructura de Fe(tetrafenilporfirina)C6H5.[26]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d9/CUHXAEFetppPh.png/489px-CUHXAEFetppPh.png)