Reacció de substitució

Una reacció de substitució és una reacció química on un àtom o un grup d'un compost químic és reemplaçat per un altre àtom o grup.
És una reacció que té lloc mitjançant l’establiment d’un enllaç covalent amb un àtom de carboni, desplaçant d’aquest un altre àtom o grup. La racionalització de les reaccions de substitució fou iniciada en el decenni 1940-50 amb els treballs del químic britànic Cristopher Kelk Ingold (1893-1970), el qual les classificà en reaccions de substitució nucleòfila i reaccions de substitució electrofila, atès el caràcter electrònic del reactiu.
Substitucions en composts orgànics
[modifica]En química orgànica les substitucions nucleòfiles o electròfiles són molt importants. Les reaccions de substitució es classifiquen en diferents tipus segons si el reactiu que porta a terme la substitució és un nucleòfil, un electròfil o un radical lliure o si el substrat químic és alifàtic o aromàtic.
Substitució radicalària
[modifica]
Una reacció de substitució de radicals és una reacció que es produeix per un mecanisme de radicals lliures i dona lloc al reemplaçament d'un o més dels àtoms o grups presents al substrat per altres àtoms o grups. A causa de la seva alta reactivitat, els radicals lliures tenen el potencial de ser alhora eines químiques extremadament potents i contaminants extremadament nocius. Gran part del poder de les espècies de radicals lliures prové de la tendència natural d'aquests processos a produir-se en forma de reacció en cadena amb tres fases diferenciades: iniciació, propagació i terminació.[1]
Iniciació
[modifica]

La fase d'inici descriu el pas que crea la primera espècie radical. En la majoria dels casos, es tracta d'un esdeveniment d'escissió homolítica (cada àtom s'emporta un electró dels dos de l'enllaç covalent que hi ha entre ells) i té lloc rarament a causa de les altes barreres energètiques implicades. Sovint, la influència de la calor, la radiació UV o un catalitzador 2que conté metalls és necessària per superar l'alta barrera energètica. El diclor Cl2 i el dibrom Br experimentaran una ruptura homolítica per formar radicals quan se sotmeten a la calor o la llum. Altres grups funcionals que també tendeixen a formar radicals quan s'exposen a la calor o la llum són els clorofluorocarburs, els peròxids i l'amida halogenada N-bromosuccinimida (NBS).[1]
Propagació
[modifica]
La fase de propagació descriu la part «en cadena» de les reaccions en cadena. Una vegada que es genera el primer radical lliure pot reaccionar amb molècules estables per formar nous radicals lliures. Aquests nous radicals lliures generen encara més radicals lliures, i així successivament. Els passos de propagació sovint impliquen també l'abstracció d'hidrogen o l'addició del radical als dobles enllaços.[1]
Terminació
[modifica]La terminació de la cadena es produeix quan dues espècies de radicals lliures reaccionen entre si per formar un aducte estable i no radical. Tot i que es tracta d'un esdeveniment de baixada d'energia, també és molt rar a causa de la reduïda concentració d'espècies radicals i la poca probabilitat que dos radicals xoquin entre ells. En altres paraules, la barrera d'energia de Gibbs és molt alta per a aquesta reacció, sobretot a causa de consideracions entròpiques més que entàlpiques.[1]
Substitució nucleòfila
[modifica]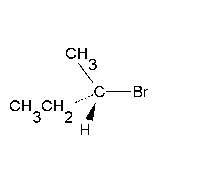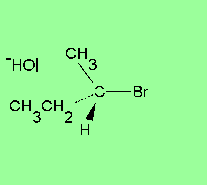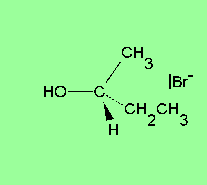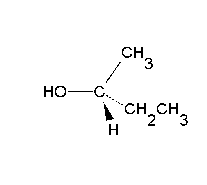
Les reaccions de substitució nucleòfila ocorren quan un nucleòfil (un reactiu que pot donar una parella d'electrons) reemplaça a un altre grup (dit grup sortint) en un carboni saturat (amb només enllaços simples). Els nucleòfils són anions, com ara l'hidròxid OH– o el clorur Cl–, i grups amb parelles d'electrons que no formen enllaç, com l'amoníac NH3 o el metanol CH3–OH. Se simbolitzen Nu:– i Nu:, respectivament. N'és un exemple característic la transformació d’un clorur d’alquil R–Cl en un alcohol R–OH per reacció amb un anió hidròxid OH–, segons la següent equació química:[2]

Les reaccions de substitució nucleòfila són experimentades per una gran varietat de tipus de composts enfront d’un bon nombre de reactius, i tenen una importància molt rellevant des del punt de vista pràctic. L’estudi cinètic de les reaccions d’aquest tipus mostra l’existència de dos mecanismes de reacció extrems coneguts com a SN1 i SN2. Entre els factors que determinen la preponderància de l’un o de l’altre mecanisme en un cas concret, cal esmentar l’estructura del substrat (així, mentre que els àtoms de carboni primaris afavoreixen el mecanisme SN2, en els terciaris és majoritari el SN1), la natura del reactiu que ataca (el nucleòfil) i la del grup desplaçat (grup sortint), i el dissolvent emprat.[3]

Substitució nucleòfila unimolecular SN1
[modifica]La substitució nucleòfila unimolecular (SN1) presenta una cinètica d'ordre 1, això és, la velocitat de reacció només depèn de la concentració d'un dels reactius. Implica la formació d’un carbocatió pla en el reactiu més pesant, amb menys mobilitat (el substrat), per pèrdua d'un grup que s'emporta la parella d'electrons de l'enllaç covalent amb el carboni, prèviament a l’entrada del reactiu atacant (el que té més mobilitat per ser el més petit i que és nucleòfil). La formació d'aquest carbocatió pla en els substrats òpticament actius fa que experimentin una racemització.[3]
Substitució nucleofílica bimolecular SN2
[modifica]
L’altre mecanisme, conegut com a SN2 (substitució nucleòfila bimolecular), presenta una cinètica d'ordre 2, és a dir, la velocitat de reacció depèn de la concentració dels dos reactius. Transcorre a través d’un estat de transició pentacoordinat (un carboni enllaçat a la vegada amb cinc àtoms) amb la participació del reactiu que ataca (el nucleòfil) i la del grup que serà desplaçat (grup sortint), pel qual fet els substrats òpticament actius que experimenten una reacció d’aquest tipus sofreixen una inversió de llur configuració en l’àtom de carboni (inversió de Walden).[3]
Substitució electròfila
[modifica]

Les reaccions de substitució electròfila són experimentades pels composts aromàtics gràcies a llur concentració de càrrega, i n'és un exemple característic la nitració del benzè. Des d’un punt de vista mecànic, la reacció transcorre amb un atac inicial de l’espècie electròfila (el reactiu amb més mobilitat, el més petit, és electròfil perquè accepta electrons) sobre l’anell aromàtic (el reactiu més pesant, amb electrons disponibles) amb formació d’un complex σ, conegut com a intermedi de Wheland, amb pèrdua parcial del caràcter aromàtic. El mecanisme continua amb eliminació de l'àtom d'hidrogen del carboni sobre el qual s’ha produït l’atac, amb recuperació de l’aromaticitat. D’aquesta manera, la substitució electròfila aromàtica és la resultant d’una addició seguida d'una eliminació. El mecanisme és:[3]



Les reaccions de substitució electròfila aromàtica més importants són: la nitració en la que l’espècie atacant és l’ió nitroni NO2+; l’halogenació, que ocorre generalment en presència d’àcids de Lewis; la sulfonació, l’agent actiu de la qual és el triòxid de sofre SO3; les reaccions de Friedel-Crafts; i la copulació de fenols amb sals de diazoni. Les substitucions electròfiles aromàtiques sobre derivats del benzè són afavorides pels substituents que cedeixen càrrega a l’anell, com –NH2, –OH, –C6H5 o –OCH3 (activants); i inhibides pels substituents acceptors de càrrega, com ara –NO2, –SO3H, –CN o –X (halògens) (desactivants). Pel que fa a l’orientació de la substitució, hi tenen influència tant factors de tipus estèric que obstrueixen l'accés del grup atacant al carboni, com de tipus electrònic exercits pels substituents preexistents.[3]
La presència de grups activants en un anell aromàtic fa que les substitucions es produeixin majoritàriament a les posicions orto i para del compost (carbonis 2 i 4, respectivament), i també els halògens que són desactivants. Per exemple, la nitració del fenol produeix el 44 % d'o-nitrofenol i el 56 % de p-nitrofenol.[4]

Els desactivants, excepte els halògens, dirigeixen l'entrada a la posició meta, perquè desactiven les posicions orto i para.[4]
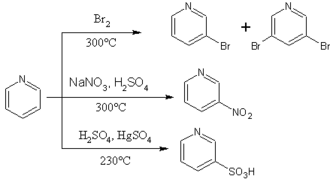
La gran varietat de tipus estructurals fa que el comportament dels composts heterocíclics aromàtics variï d'extremadament reactius a gairebé inerts cap a la substitució electròfila aromàtica. Així, la piridina es troba prop d'un extrem, ja que és molt menys reactiva que el benzè cap a la substitució per reactius electròfils. En això s'assembla als composts aromàtics fortament desactivats com el nitrobenzè. No es pot acilar o alquilar sota condicions de Friedel-Crafts, però pot ser sulfonada a temperatura elevada. La substitució electròfila a la piridina, quan passa, té lloc al carboni 3 (el 2n després del nitrogen).[4]
Una raó per a la baixa reactivitat de la piridina és que el seu àtom de nitrogen, pel fet que és més electronegatiu que un CH del benzè, ocasiona que els electrons π dels enllaços dobles es mantinguin amb més fermesa i s'elevi l'energia d'activació per a l'atac per un electròfil. Una altra raó és que el nitrogen de la piridina és protonat en l'àcid sulfúric i l'ió piridini resultant encara està més desactivat que la piridina en si. Els catalitzadors àcids de Lewis, com ara el clorur d'alumini AlCl3 i els halogenurs de ferro(III), també s'uneixen amb el nitrogen i es desactiva fortament l'anell cap a les reaccions de Friedel-Crafts i l'halogenació.[4]

El pirrole, el furan i el tiofè, per altra banda, tenen anells aromàtics rics en electrons i són en extrem reactius cap a la substitució electròfila aromàtica; més com el fenol i l'anilina que com el benzè. Com el benzè, tenen sis electrons π, però aquests estan deslocalitzats sobre cinc àtoms, no sis, i no es mantenen amb tanta força com els del benzè. Tot i que l'àtom de l'anell sigui tan electronegatiu com l'oxigen, la substitució té lloc amb rapidesa.[4]
Substitució nucleòfila aromàtica
[modifica]
D’altra banda, alguns composts aromàtics amb substituents atraients d’electrons són susceptibles d’experimentar un atac nucleòfil, amb producció de reaccions de substitució nucleòfila aromàtica. En són exemples característics l’atac hidroxílic sobre el nitrobenzè i l’aminació de la piridina (síntesi piridínica de Txitxibabin). Tanmateix, aquest tipus de substitució és també resultant d’una addició i una eliminació.[4]
Substitucions en complexos de coordinació
[modifica]En química inorgànica en els complexos de coordinació dels metalls de transició en dissolució també es produeixen reaccions de substitució amb un lligand per un altre:
On X és el grup sortint i Y el grup entrant. Si el grup entrant desplaça una molècula d'aigua, es coneix com a anació o anionització, i si és a l'inrevés, on una molècula d'aigua desplaça un lligand és una hidròlisi o aquatització.
Segons el seu mecanisme de reacció les reaccions de substitució de lligand poden ser de tipus: dissociatiu, associatiu i d'intercanvi.
Dissociatiu (D)
[modifica]
En el mecanisme dissociatiu, un complex MLnX primer perd el lligand X per formar un intermedi MLn, i el lligand entrant Y reacciona amb el fragment MLn:[5][6]

Associatiu (A)
[modifica]En el mecanisme associatiu, el lligand entrant Y ataca el complex MLnX, formant transitòriament un intermedi MLnXY on hi ha els dos lligands que s'intercanvien, i l'intermedi perd llavors un lligand X formant el producte MLnY:[5][6]
Intercanvi (I)
[modifica]
El mecanisme d'intercanvi és similar a les vies associativa i dissociativa, excepte que no es forma cap intermedi MLnY o MLn diferent. Aquest mecanisme concertat es pot considerar anàleg a la substitució nucleofílica a través de la via SN2 en un àtom de carboni tetraèdric en química orgànica. El mecanisme d'intercanvi es classifica a més com a associatiu (Ia) o dissociatiu (Id) depenent de la importància relativa de la unió M-Y i M-X a l'estat de transició. Si l'estat de transició es caracteritza per la formació d'un fort enllaç M-Y, aleshores el mecanisme és Ia. Per contra, si l'afebliment de l'enllaç M-X és més important per assolir l'estat de transició, aleshores el mecanisme és Id.[5][6]
Referències
[modifica]- ↑ 1,0 1,1 1,2 1,3 Carey, Francis A.; Sundberg, Richard J. Advanced Organic Chemistry: Part A: Structure and Mechanisms. Regne Unit: Springer, 2012.
- ↑ Ouellette, Robert J.; Rawn, J. David. Principles of organic chemistry. Amsterdam Boston: Elsevier, 2015. ISBN 978-0-12-802444-7.
- ↑ 3,0 3,1 3,2 3,3 3,4 «Reacció de substitució». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 Carey, Francis A.; Giuliano, Robert M. Química Orgánica. 9a. Mèxic: McGraw-Hill, 2014.
- ↑ 5,0 5,1 5,2 «Libro: Introducción a la Química Inorgánica (Wikibook)» (en castellà), 30-10-2022. [Consulta: 24 gener 2024].
- ↑ 6,0 6,1 6,2 Evans, M. «CHEM 3110: Descriptive Inorganic Chemistry» (en anglès), 28-05-2021. [Consulta: 24 gener 2024].
Bibliografia
[modifica]- K. Peter C. Vollhardt. Química Orgánica. Barcelona: Ediciones Omega S.A., 1994. ISBN 84-282-0882-4.
- A.G. Sharpe. Química Inorgánica. Barcelona: Editorial Reverté, S.A., 1993. ISBN 84-291-7501-6.
- D.F. Shriver, P.W. Atkins, C.H. Langford. Química Inorgánica. Barcelona: Editorial Reverté, S.A., 1998. ISBN 84-291-7006-5.





