Fenol
El fenol és un compost orgànic aromàtic amb la molècula formada per un anell de benzè en què un hidroxil ocupa el lloc d'un hidrogen, la fórmula molecular és C6H5OH. Malgrat que en la seva estructura conté el grup hidroxi –OH, característic dels alcohols, l'anell aromàtic fa que tengui moltes propietats diferents, per la qual cosa, juntament amb els seus derivats, es consideren una classe diferent dels alcohols de composts químics i se'ls anomena fenols. El fenol s'utilitza per a desinfectar, com a reactiu en anàlisis químiques i per a obtenir resines artificials.
Història
[modifica]
El fenol fou probablement preparat per primera vegada per l'alquimista alemany Johann Rudolph Glauber (1604–1668) a mitjan segle xvii. El seu nom original era «àcid carbòlic», un nom donat pel químic alemany Friedlieb Ferdinand Runge (1795–1867), qui aïllà el fenol de la destil·lació destructiva del betum de carbó el 1834. El nom «fenol» l'usà per primera vegada el 1841 el químic francès Charles Frédéric Gerhardt (1816–1856). «Fenol» prové del grec phaínō ‘brillar’, pel fet d’obtenir-se el producte en la fabricació del gas d’il·luminar, i de la terminació -ol, característica dels alcohols.[1]


Joseph Lister (1827–1912), metge britànic, l'emprà per primera vegada com a antisèptic. Al llarg de la història humana, les infeccions sovint provocaven la mort, fins i tot quan la ferida podia ser tractada quirúrgicament. Una ossada trencada que perforava la pell, avui en dia una lesió dolorosa, però no mortal, històricament provocava infecció i podia resultar en amputació o mort. Lister s'inspirà en la teoria dels gèrmens de la malaltia de Louis Pasteur (1822–1895) i començà a fer servir mètodes antisèptics a les cirurgies rutinàries durant la dècada de 1860. Lister tractava les ferides directament amb fenol i netejava instruments quirúrgics en solucions de fenol. També dissenyà un atomitzador que es podia utilitzar per difondre fenol a les sales d'operacions i de recuperació. Gràcies a les seves tècniques antisèptiques, Lister aconseguí reduir les taxes de mortalitat per infeccions quirúrgiques del 50 % a aproximadament el 15 %, i aquesta pràctica s'estengué mentre Lister educava altres sobre l'ús de les tècniques antisèptiques. Lister usava fenol diluït en aigua i olis a la seva pràctica quirúrgica.[1]
El fenol és tòxic i provoca bombolles blanques quan s'aplica directament a la pell. A causa de ser un bactericida potent, el fenol es pot trobar en nombrosos productes de consum, incloent-hi col·lutoris, ungüents antisèptics, pastilles per a la gola, ambientadors, gotes auriculars i bàlsams per als llavis.[1]
Propietats
[modifica]Propietats físiques
[modifica]A temperatura ambient, el fenol es presenta com un sòlid cristal·lí, amb cristalls incolors o lleugerament rosats, de densitat 1,06 g/cm³, punt de fusió 40,9 °C i punt d'ebullició 181,8 °C. És moderadament soluble en aigua (8,3 g per 100 ml d'aigua) i molt soluble en etanol, cloroform, èter dietílic, glicerol i disulfur de carboni.[2]
Propietats químiques
[modifica]El comportament químic del fenol és diferent en alguns aspectes del dels alcohols. Les reaccions de substitució i eliminació nucleòfiles són habituals en els alcohols alifàtics, però rares amb el fenol. Per a tots els efectes pràctics no es produeix la substitució i/o eliminació del grup hidroxi fenòlic.
El fenol és lleugerament àcid (pKa = 9,99 a 25 °C),[2] ja que té una tendència moderada a perdre l'ió H+ del grup hidroxi, i genera l'anió fenòxid o fenolat C₆H₅O−, altament soluble en aigua. És per aquest motiu que també se l'anomena àcid fènic. Comparat amb els alcohols alifàtics el fenol és molt més àcid, i fins i tot reacciona amb hidròxid de sodi NaOH per a perdre el catió H+, reacció que no es produeix amb els alcohols alifàtics. Aquesta reactivitat es deu a la superposició entre els orbitals del parell d'electrons de l'oxigen i el sistema aromàtic: ajuda a deslocalitzar la càrrega negativa de l'ió per l'anell i estabilitzant l'anió. Aquest efecte, però, es veu atenuat per la relativament alta electronegativitat de l'oxigen.[3]

La reacció amb hidròxid de sodi dona fenolat de sodi. També reacciona amb clorurs d'àcid per donar èsters de fenil.[4]


L'anell aromàtic permet reaccions de substitució electrofíliques amb el grup hidroxi –OH que orienta la substitució de les posicions orto i para (2, 4 i 6 respecte de la posició del grup hidroxil). Així la reacció del fenol amb àcid nítric HNO3 diluït dona 2-nitrofenol i 4-nitrofenol; la reacció amb àcid nítric concentrat en àcid sulfúric H2SO4 produeix el 2,4,6-trinitrofenol o àcid pícric; amb àcid sulfúric concentrat s'obté l'àcid 2-hidroxisulfònic i l'àcid 4-hidroxisulfònic; amb brom Br2 es pot sintetitzar el 4-bromofenol o el 2,4,6-tribromofenol.[4]
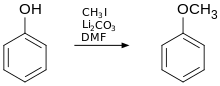
També són importants les reaccions d'acilació i alquilació de Friedel-Crafts, la reacció de Reimer-Tiemann amb cloroform i hidròxid de sodi que dona 2-hidroxibenzaldehid o salicilaldehid.[4]
Igual que amb els alcohols, l'hidrogen de l'hidroxi fenòlic es substitueix amb força facilitat per altres substituents. Per exemple, el fenol reacciona fàcilment amb l'anhídrid acètic per donar acetat de fenil. De la mateixa manera, l'anió fenolat és un nucleòfil efectiu en les reaccions SN2, per exemple reacciona amb hidrocarburs halogenats (síntesi de Williamson) i s'obtenen èters.[4]
Preparació
[modifica]El fenol es preparava abans de la Primera Guerra Mundial mitjançant la destil·lació del betum de carbó. El primer procés sintètic implicava la sulfonació del benzè seguida de la dessulfonació amb una base. En aquest procés, l'àcid benzosulfònic es prepara a partir de la reacció entre el benzè i l'àcid sulfúric i després es tracta amb hidròxid de sodi:

El 1920 Dow Chemical, i també Bayer, desenvoluparen un altre mètode consistent en la hidròlisi bàsica amb hidròxid de sodi del clorobenzè 300 °C i pressió elevada (272 atm),[5] que el mantingueren fins al 1975 i 1977, respectivament. El 1932 s'inicià el procés de producció del fenol a partir del clorobenzè per part de l'empresa Rhône-Poulenc amb hidròlisi àcida (procés Raschig-Hooker).[6] Primer es fa reaccionar benzè amb àcid clorhídric i oxigen amb un catalitzador de coure i ferro a 200-300 °C i s'obté clorobenzè. Aquest s'hidrolitza amb aigua a 500 °C amb un catalitzador de diòxid de silici.[5]

El mètode actual més comú de producció de fenol és el procés de reordenació d'hidroperòxid de cumè o isopropilbenzè (procés Hock comercialitzat el 1952). En aquest procés, el benzè reacciona amb el propè amb un catalitzador de clorur d'alumini per produir cumè.[5] El cumè s'oxida a hidroperòxid de cumè. Quan l'hidroperòxid de cumè es tracta amb àcid sulfúric diluït, es reorganitza i es divideix en fenol i acetona. Com que els reactius són econòmics i el procés és senzill, l'oxidació àcida del cumè s'utilitza per produir més del 95% del subministrament mundial de fenol.[6]

Aplicacions
[modifica]
Indústria química
[modifica]L'ús predominant del fenol avui és per a la producció de resines fenòliques. El fenol fou un dels reactius químics del primer plàstic sintètic, produït a principis del segle xx. El material fou obtingut el 1906 per un immigrant belga als Estats Units anomenat Leo Hendrik Baekeland (1863–1944). Baekeland aconseguí una petita fortuna venent paper fotogràfic a George Eastman (1854–1932), el fundador d'Eastman Kodak. Amb aquests diners, Baekeland estudià resines produïdes combinant fenol i formaldehid en una autoclau i sotmetent-los a calor i pressió. Baekeland anomenà «baquelita» a la resina que sintetitzà. La baquelita és un plàstic termoestable, un plàstic que s'endureix a la seva forma final en escalfar-se.[1]
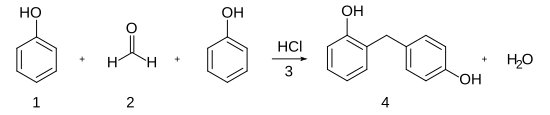
El fenol continua sent un dels reactius químics principals utilitzat per produir resines termoestables. Aquestes resines es fan combinant fenol amb aldehids, com el formaldehid. Les resines fenòliques troben el seu ús més ampli a la indústria de la construcció. S'usen com a aglutinants i farcits en productes de fusta com ara fusta contraxapada, taulers de partícules, mobles i panells. Les resines fenòliques s'impregnen en paper, que, després de l'enduriment, produeix làmines que es poden enganxar per formar laminats per emprar-los en panells de paret i taulells. Les cobertes d'embarcacions i molls estan fetes de compostos de resina fenòlica. Les resines fenòliques es fan servir com a segellants i com a aïllant. Com que les resines fenòliques tenen una alta resistència a la calor i són bons aïllants, es fan ús en nanses d'estris de cuina. També són bones aïllants elèctrics i s'utilitzen en interruptors, plaques de paret i per a altres aplicacions elèctriques. A la indústria de l'automòbil, les resines fenòliques es fan servir per a peces com ara politges motrius, carcasses de bombes d'aigua, frens i parts del cos.[1]


A més de la indústria de la construcció, el fenol té moltes altres aplicacions. S'usa en herbicides i pesticides, i com a germicida en pintures. Es pot fer servir per produir caprolactama, que és el monòmer emprat en la producció de niló 6. Un altre compost industrial important produït a partir de fenol és el bisfenol A, que es fa a partir de fenol i acetona. El bisfenol A es fa servir en la fabricació de resines de policarbonat. Les resines de policarbonat es fabriquen en peces estructurals utilitzades en la fabricació de diversos productes com ara peces d'automòbils, productes elèctrics i aparells de consum. Els articles com discos compactes, ulleres de lectura, ulleres de sol i ampolles d'aigua estan fets de policarbonats.[1]
Medicina
[modifica]El fenol és un antisèptic i desinfectant. És actiu contra una àmplia gamma de microorganismes, inclosos alguns fongs i virus, però només és eficaç lentament contra les espores. El fenol s'ha fet servir per desinfectar la pell i per alleujar la picor. El fenol també s'usa com a analgèsic o anestèsic oral en productes com el clorasèptic per tractar la faringitis. A més, el fenol i els seus compostos relacionats s'utilitzen en el tractament quirúrgic d'ungles encarnades, un procés anomenat fenolització.[7] La teràpia amb injecció de fenol té una llarga història d'ús en urologia. És eficaç per a la cistitis hemorràgica, la hiperplàsia benigna de pròstata, la bufeta hiperactiva, la hidrocele, els tumors de la bufeta urinària, la cistitis intersticial i altres malalties urològiques benignes, i també es fa servir com a eina per disminuir el sagnat durant la cirurgia de pròstata.[8]
Toxicologia
[modifica]La investigació indica que l'exposició dels pares al fenol i els seus compostos relacionats s'associa positivament amb l'avortament espontani. Durant la Segona Guerra Mundial, els nazis van fer ús de les injeccions de fenol com a mitjà d'execució. El fenol és un compost tòxic els vapors del qual són corrosius per a la pell, els ulls i les vies respiratòries.[7]
Referències
[modifica]- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 Myers, Richard Leroy. The 100 most important chemical compounds: a reference guide. Westport, Conn: Greenwood Press, 2007. ISBN 978-0-313-33758-1.
- ↑ 2,0 2,1 PubChem. «Phenol» (en anglès). Arxivat de l'original el 2023-12-15. [Consulta: 18 gener 2024].
- ↑ «The Acidity of Phenol». ChemGuide. Jim Clark. Arxivat de l'original el 2018-10-09. [Consulta: 28 octubre 2006].
- ↑ 4,0 4,1 4,2 4,3 Lumbhani, Dr Arvind N.; Geetha, Dr G.; Singh, Dr Arvind Kumar. Pharmaceutical Organic Chemistry-II: e-Book for B.Pharm 3rd Semester as per PCI Syllabus (en anglès). Thakur Publication Private Limited, 2021-03-12. ISBN 978-93-87880-70-2.
- ↑ 5,0 5,1 5,2 Ibeh, Christopher C. 2 - Phenol-Formaldehyde Resins. Westwood, NJ: William Andrew Publishing, 1998, p. 23–71. DOI 10.1016/b978-081551421-3.50005-9. ISBN 978-0-8155-1421-3. Arxivat 2022-10-05 a Wayback Machine.
- ↑ 6,0 6,1 Weissermel, Klaus; Arpe, Hans-Jürgen. Industrial organic chemistry. 4., compl. rev. ed. Weinheim: Wiley-VCH, 2003. ISBN 978-3-527-30578-0.
- ↑ 7,0 7,1 «Phenol» (en anglès). DrugBank. Arxivat de l'original el 2024-01-26. [Consulta: 21 gener 2024].
- ↑ Sadahira, Takuya; Maruyama, Yuki; Watanabe, Toyohiko; Sekito, Takanori; Mitsui, Yosuke «Medical uses for phenol in the urinary tract: A possible forgotten treatment (Review)». Medicine International, 1, 4, 31-08-2021. Arxivat de l'original el 2022-01-19. DOI: 10.3892/mi.2021.13. ISSN: 2754-1304. PMC: PMC9829081. PMID: 36698428 [Consulta: 21 gener 2024].


