Genètica mitocondrial humana
 El genoma mitocondrial humà de 16.569 pb de llarg amb els gens codificants de proteïnes (vermell, taronja, groc), ARN ribosòmic (blau) i gens de transferència d'ARN (blanc). Regió de control de l'ADNmt no codificant en gris. | |
| Característiques | |
|---|---|
| Longitud (bp) | 16,569 |
| Nombre de gens | 13 (gens codificants) 24 (gens no codificants) |
| Tipus | ADN mitocondrial |
| Posició del centròmer | |
| Llistes de gens | |
| HGNC | Llista de gens |
| NCBI | Llista de gens |
| Visualitzadors externs | |
| Ensembl | Cromosoma MT |
| Entrez | Cromosoma MT |
| NCBI | Cromosoma MT |
| UCSC | Cromosoma M |
| Seqüències senceres d'ADN | |
| RefSeq | NC_012920 (FASTA) |
| GenBank | J01415 (FASTA) |

La genètica mitocondrial humana és l'estudi de la genètica de l'ADN mitocondrial humà (l'ADN contingut en els mitocondris humans). El genoma mitocondrial humà és la totalitat de la informació hereditària continguda en els mitocondris humans. Els mitocondris són petites estructures de les cèl·lules que generen energia per a la cèl·lula per utilitzar-la i, per tant, s'anomenen les "centrales d'energia" de la cèl·lula.
L'ADN mitocondrial (ADNmt) no es transmet a través de l'ADN nuclear (ADNn). En els humans, com en la majoria dels organismes pluricel·lulars, l'ADN mitocondrial només s'hereta de l'òvul de la mare. Hi ha teories, però, que la transmissió paterna d'ADNmt en humans es pot produir en determinades circumstàncies.[3]
Per tant, l'herència mitocondrial és no mendeliana, ja que l'herència mendeliana suposa que la meitat del material genètic d'un òvul fecundat (zigot) deriva de cada progenitor.
El vuitanta per cent de l'ADN mitocondrial codifica l'ARN mitocondrial i, per tant, la majoria de les mutacions de l'ADN mitocondrial condueixen a problemes funcionals, que es poden manifestar com a trastorns musculars (miopaties).
Com que proporcionen 30 molècules d'ATP per molècula de glucosa en contrast amb les 2 molècules d'ATP produïdes per la glucòlisi, els mitocondris són essencials per a tots els organismes superiors per mantenir la vida. Les malalties mitocondrials són trastorns genètics transportats a l'ADN mitocondrial, o ADN nuclear que codifica components mitocondrials. Els problemes lleus amb qualsevol dels nombrosos enzims utilitzats pels mitocondris poden ser devastadors per a la cèl·lula i, al seu torn, per a l'organisme.
Quantitat[modifica]
En humans, l'ADN mitocondrial (ADNmt) forma molècules circulars tancades que contenen 16.569 [4][5] parells de bases d'ADN,[6] i cadascuna d'aquestes molècules normalment conté un conjunt complet de gens mitocondrials. Cada mitocondri humà conté, de mitjana, aproximadament 5 d'aquestes molècules d'ADNmt, amb una quantitat que oscil·la entre 1 i 15.[6] Cada cèl·lula humana conté aproximadament 100 mitocondris, la qual cosa dóna un nombre total de molècules d'ADNmt per cèl·lula humana d'aproximadament 500.[6] La quantitat de mitocondris per cèl·lula també varia segons el tipus de cèl·lula, amb alguns exemples:
- Eritròcits : 0 mitocondris per cèl·lula.[1]
- Limfòcits : 3 mitocondris per cèl·lula.[7]
- Òvuls : les cèl·lules d'òvul madures de la metafase II poden contenir 100.000 mitocondris i 50.000–1.500.000 còpies del genoma mitocondrial (corresponent a fins al 90% de l'ADN de l'òvul).[2]
Patrons d'herència[modifica]
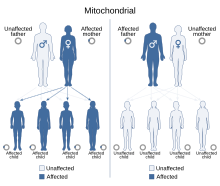

Com que les malalties mitocondrials (malalties degudes al mal funcionament dels mitocondris) es poden heretar tant per via materna com per herència cromosòmica, la forma en què es transmeten de generació en generació pot variar molt segons la malaltia. Les mutacions genètiques mitocondrials que es produeixen a l'ADN nuclear es poden produir en qualsevol dels cromosomes (segons l'espècie). Les mutacions heretades a través dels cromosomes poden ser autosòmiques dominants o recessives i també poden ser dominants o recessives vinculades al sexe. L'herència cromosòmica segueix les lleis mendelianes normals, malgrat que el fenotip de la malaltia pot estar emmascarat.
A causa de les complexes maneres en què l'ADN mitocondrial i nuclear "es comuniquen" i interactuen, fins i tot l'herència aparentment simple és difícil de diagnosticar. Una mutació en l'ADN cromosòmic pot canviar una proteïna que regula (augmenta o disminueix) la producció d'una altra proteïna determinada als mitocondris o al citoplasma; això pot provocar símptomes lleugers, si n'hi ha, notables. D'altra banda, algunes mutacions devastadores de l'ADNmt són fàcils de diagnosticar pel seu dany generalitzat als teixits musculars, neuronals i/o hepàtics (entre altres teixits d'alta energia i dependents del metabolisme) i perquè estan presents a la mare i a tots els teixits. la descendència.
El nombre de molècules d'ADNmt afectades heretades per una descendència específica pot variar molt perquè
- els mitocondris dins de l'oòcit fecundat és el que haurà de començar la nova vida (en termes d'ADNmt),
- el nombre de mitocondris afectats varia de cèl·lula (en aquest cas, l'oòcit fecundat) a cèl·lula en funció tant del nombre que ha heretat de la seva cèl·lula mare com de factors ambientals que poden afavorir l'ADN mitocondrial mutant o salvatge,
- el nombre de molècules d'ADNmt als mitocondris varia entre dos i deu.
És possible, fins i tot en els naixements de bessons, que un nadó rebi més de la meitat de molècules d'ADNmt mutants, mentre que l'altre bessó pot rebre només una petita fracció de molècules d'ADNmt mutants respecte al tipus salvatge (depenent de com es divideixen els bessons entre si i com molts mitocondris mutants es troben a cada costat de la divisió). En alguns casos, alguns mitocondris o un mitocondri de l'espermatozoide entra a l'oòcit, però els mitocondris paterns es descomponen activament.
Gens[modifica]
Els gens del genoma mitocondrial humà són els següents.
Cadena de transport d'electrons i humanina[modifica]
Originalment es creia incorrectament que el genoma mitocondrial contenia només 13 gens codificants de proteïnes, tots ells codificant proteïnes de la cadena de transport d'electrons. Tanmateix, l'any 2001, es va descobrir una catorzena proteïna biològicament activa anomenada humanina, i es va trobar que estava codificada pel gen mitocondrial MT-RNR2 que també codifica part del ribosoma mitocondrial (fet d'ARN):
| Nº del complex | Categoria | Gens | Posicions en el mitogenoma | Fil |
|---|---|---|---|---|
| I | NADH deshidrogenasa | |||
| MT-ND1 | 3.307–4.262 | L | ||
| MT-ND2 | 4.470–5.511 | L | ||
| MT-ND3 | 10.059–10.404 | L | ||
| MT-ND4L | 10.470–10.766 | L | ||
| MT-ND4 | 10.760–12.137 (superposició amb MT-ND4L) | L | ||
| MT-ND5 | 12.337–14.148 | L | ||
| MT-ND6 | 14.149–14.673 | H | ||
| III | Coenzim Q - citocrom c reductasa / Citocrom b | MT-CYB | 14.747–15.887 | L |
| IV | Citocrom c oxidasa | MT-CO1 | 5.904–7.445 | L |
| MT-CO2 | 7.586–8.269 | L | ||
| MT-CO3 | 9.207–9.990 | L | ||
| V | ATP sintasa | MT-ATP6 | 8.527–9.207 (superposició amb MT-ATP8) | L |
| MT-ATP8 | 8.366–8.572 | L | ||
| — | Humanina | MT-RNR2 | — | — |
A diferència de les altres proteïnes, la humanina no roman als mitocondris, i interactua amb la resta de la cèl·lula i els receptors cel·lulars. La humanina pot protegir les cèl·lules cerebrals inhibint l'apoptosi. Malgrat el seu nom, també existeixen versions d'humanina en altres animals, com el rattin a les rates.
ARNr[modifica]
Els següents gens codifiquen ARNr:
| Subunitat | ARNr | Gens | Posicions en el mitogenoma | Fil |
|---|---|---|---|---|
| Petita (SSU) | 12S | MT-RNR1 | 648–1.601 | L |
| Gran (LSU) | 16S | MT-RNR2 | 1.671–3.229 | L |
ARNt[modifica]
Els següents gens codifiquen els ARNt :
| Aminoàcid | 3-Lletres | 1-Lletra | ADM MT | Posicions | Fil |
|---|---|---|---|---|---|
| Alanina | Ala | A | MT-TA | 5,587–5,655 | H |
| Arginina | Arg | R | MT-TR | 10,405–10,469 | L |
| Asparagina | Asn | N | MT-TN | 5,657–5,729 | H |
| Àcid aspàrtic | Asp | D | MT-TD | 7,518–7,585 | L |
| Cisteïna | Cys | C | MT-TC | 5,761–5,826 | H |
| Àcid glutàmic | Glu | E | MT-TE | 14,674–14,742 | H |
| Glutamina | Gln | Q | MT-TQ | 4,329–4,400 | H |
| Glicina | Gly | G | MT-TG | 9,991–10,058 | L |
| Histidina | His | H | MT-TH | 12,138–12,206 | L |
| Isoleucina | Ile | I | MT-TI | 4,263–4,331 | L |
| Leucina | Leu (UUR) | L | MT-TL1 | 3,230–3,304 | L |
| Leucina | Leu (CUN) | L | MT-TL2 | 12,266–12,336 | L |
| Lisina | Lys | K | MT-TK | 8,295–8,364 | L |
| Metionina | Met | M | MT-TM | 4,402–4,469 | L |
| Fenilalanina | Phe | F | MT-TF | 577–647 | L |
| Prolina | Pro | P | MT-TP | 15,956–16,023 | H |
| Serina | Ser (UCN) | S | MT-TS1 | 7,446–7,514 | H |
| Serina | Ser (AGY) | S | MT-TS2 | 12,207–12,265 | L |
| Treonina | Thr | T | MT-TT | 15,888–15,953 | L |
| Triptòfan | Trp | W | MT-TW | 5,512–5,579 | L |
| Tirosina | Tyr | Y | MT-TY | 5,826–5,891 | H |
| Valina | Val | V | MT-TV | 1,602–1,670 | L |
Localització dels gens[modifica]
L'ADN mitocondrial tenia tradicionalment les dues cadenes d'ADN designades la cadena pesada i la cadena lleugera, a causa de les seves densitats flotants durant la separació en gradients de clorur de cesi,[8][9] que es va trobar que estava relacionada amb el contingut relatiu de nucleòtids G+T de el fil.[10] Tanmateix, la confusió de l'etiquetatge d'aquestes cadenes està molt estesa, i sembla que s'origina amb la identificació de la cadena de codificació majoritària com a pesada en un article influent el 1999.[11][10] En humans, la cadena lleugera de l'ADNmt porta 28 gens i la cadena pesada de l'ADNmt només porta 9 gens.[10] [12] Vuit dels 9 gens de la cadena pesada codifiquen les molècules d'ARNt mitocondrials. L'ADNmt humà està format per 16.569 parells de nucleòtids. Tota la molècula està regulada per una sola regió reguladora que conté els orígens de la replicació tant de cadenes pesades com lleugeres. S'ha cartografiat tota la molècula d'ADN mitocondrial humà.
Variants del codi genètic[modifica]
El codi genètic és, en la seva majoria, universal, amb poques excepcions: [13] la genètica mitocondrial inclou alguns d'aquests. Per a la majoria dels organismes, els " codons de parada " són "UAA", "UAG" i "UGA". En els mitocondris de vertebrats, "AGA" i "AGG" també són codons de parada, però no "UGA", que codifica el triptòfan. "AUA" codifica la isoleucina a la majoria d'organismes, però la metionina a l'ARNm mitocondrial de vertebrats.
Hi ha moltes altres variacions entre els codis utilitzats per altres m/ARNt mitocondrials, que no van resultar perjudicials per als seus organismes, i que es poden utilitzar com a eina (juntament amb altres mutacions entre el mtDNA/ARN de diferents espècies) per determinar proximitat relativa de l'ascendència comuna d'espècies relacionades. (Com més relacionades estiguin dues espècies, més mutacions d'ADNmt/ARN seran les mateixes en el seu genoma mitocondrial).
Mitjançant aquestes tècniques, s'estima que els primers mitocondris van sorgir fa uns 1.500 milions d'anys. Una hipòtesi generalment acceptada és que els mitocondris es van originar com un procariota aeròbic en una relació simbiòtica dins d'un eucariota anaeròbic.
Replicació, reparació, transcripció i traducció[modifica]
La replicació mitocondrial està controlada per gens nuclears i està específicament adequada per fer tantes mitocondris com necessiti aquella cèl·lula en concret en el moment.
La transcripció mitocondrial en humans s'inicia a partir de tres promotors, H1, H2 i L (cadena pesada 1, cadena pesada 2 i promotors de cadena lleugera). El promotor H2 transcriu gairebé tota la cadena pesada i el promotor L transcriu tota la cadena lleugera. El promotor H1 provoca la transcripció de les dues molècules d'ARNr mitocondrials.[14]
Quan la transcripció té lloc a la cadena pesada es crea una transcripció policistrònica. La cadena lleugera produeix petites transcripcions, que es poden utilitzar com a cebadors, o una transcripció llarga. La producció d'encebadors es produeix mitjançant el processament de transcripcions de cadena lleugera amb la RNasa Mitocondrial MRP (Processament de l'ARN mitocondrial). El requisit de transcripció per produir cebadors vincula el procés de transcripció amb la replicació de l'ADNmt. Les transcripcions de longitud completa es tallen en molècules funcionals d'ARNt, ARNr i ARNm.[15]
El procés d'inici de la transcripció en els mitocondris implica tres tipus de proteïnes: l'ARN polimerasa mitocondrial (POLRMT), el factor de transcripció mitocondrial A (TFAM) i els factors de transcripció mitocondrial B1 i B2 (TFB1M, TFB2M). POLRMT, TFAM i TFB1M o TFB2M s'assemblen als promotors mitocondrials i comencen la transcripció. Es desconeixen els esdeveniments moleculars reals implicats en l'inici, però aquests factors constitueixen la maquinària de transcripció basal i s'ha demostrat que funcionen in vitro.
La traducció mitocondrial encara no s'entén gaire bé. Les traduccions in vitro encara no han tingut èxit, probablement a causa de la dificultat d'aïllar suficient ARNm mt, ARNr mt funcional i possiblement pels canvis complicats que experimenta l'ARNm abans de ser traduït.
Polimerasa de l'ADN mitocondrial[modifica]
La polimerasa de l'ADN mitocondrial (Pol gamma, codificada pel gen POLG) s'utilitza en la còpia de l'ADNmt durant la replicació. Com que les dues cadenes (pesant i lleugera) de la molècula circular d'ADNmt tenen diferents orígens de replicació, es replica en un mode de bucle D. Una cadena comença a replicar-se primer, desplaçant l'altra cadena. Això continua fins que la replicació arriba a l'origen de la replicació a l'altra cadena, moment en què l'altra cadena comença a replicar-se en la direcció oposada. Això dóna lloc a dues noves molècules d'ADNmt. Cada mitocondri té diverses còpies de la molècula d'ADNmt i el nombre de molècules d'ADNmt és un factor limitant en la fissió mitocondrial. Després que el mitocondri tingui prou ADNmt, àrea de membrana i proteïnes de membrana, pot patir una fissió (molt similar a la que utilitzen els bacteris) per convertir-se en dos mitocondris. L'evidència suggereix que els mitocondris també poden patir fusió i intercanvi (en forma d'encreuament) de material genètic entre ells. De vegades, els mitocondris formen matrius grans en les quals es produeixen constantment fusió, fissió i intercanvis de proteïnes. ADNmt compartit entre els mitocondris (malgrat que poden patir fusió).
Danys i errors de transcripció[modifica]
L'ADN mitocondrial és susceptible al dany dels radicals lliures d'oxigen per errors que es produeixen durant la producció d'ATP a través de la cadena de transport d'electrons. Aquests errors poden ser causats per trastorns genètics, càncer i variacions de temperatura. Aquests radicals poden danyar les molècules d'ADNmt o canviar-les, cosa que dificulta la replicació de la polimerasa mitocondrial. Tots dos casos poden provocar supressions, reordenaments i altres mutacions. Evidències recents han suggerit que els mitocondris tenen enzims que corregeixen l'ADNmt i arreglen les mutacions que es poden produir a causa dels radicals lliures. Es creu que una recombinasa d'ADN que es troba a les cèl·lules de mamífers també està implicada en un procés de recombinació reparadora. Les supressions i mutacions degudes als radicals lliures s'han associat amb el procés d'envelliment. Es creu que els radicals causen mutacions que condueixen a proteïnes mutants, que al seu torn condueixen a més radicals. Aquest procés dura molts anys i està associat amb alguns processos d'envelliment implicats en teixits dependents de l'oxigen com el cervell, el cor, els músculs i els ronyons. Processos de millora automàtica com aquests són possibles causes de malalties degeneratives, com ara el Parkinson, l'Alzheimer i la malaltia de l'artèria coronària.
Errors de replicació de l'ADNmt mediats cromosòmicament[modifica]
Com que el creixement i la fissió mitocondrials estan mediats per l'ADN nuclear, les mutacions en l'ADN nuclear poden tenir una àmplia gamma d'efectes sobre la replicació de l'ADNmt. Malgrat que els loci d'algunes d'aquestes mutacions s'han trobat en cromosomes humans, encara no s'han aïllat gens i proteïnes específics implicats. Els mitocondris necessiten una determinada proteïna per sotmetre's a la fissió. Si aquesta proteïna (generada pel nucli) no està present, els mitocondris creixen però no es divideixen. Això condueix a mitocondris gegants i ineficients. Els errors en els gens cromosòmics o els seus productes també poden afectar la replicació mitocondrial de manera més directa mitjançant la inhibició de la polimerasa mitocondrial i fins i tot poden causar mutacions a l'ADNmt directament i indirectament. Les mutacions indirectes solen ser causades per radicals creats per proteïnes defectuoses fetes d'ADN nuclear.
Malalties mitocondrials[modifica]
Contribució del genoma mitocondrial versus el genoma nuclear[modifica]
En total, el mitocondri allotja uns 3000 tipus diferents de proteïnes, però només unes 13 d'elles estan codificades a l'ADN mitocondrial. La majoria dels 3000 tipus de proteïnes estan implicades en una varietat de processos diferents de la producció d'ATP, com ara la síntesi de porfirina. Només un 3% d'ells codifiquen proteïnes de producció d'ATP. Això significa que la major part de la informació genètica que codifica la composició proteica dels mitocondris es troba a l'ADN cromosòmic i està implicada en processos diferents de la síntesi d'ATP. Això augmenta les possibilitats que es produeixi una mutació que afectarà un mitocondri a l'ADN cromosòmic, que s'hereta en un patró mendelià. Un altre resultat és que una mutació cromosòmica afectarà un teixit específic a causa de les seves necessitats específiques, ja siguin grans requeriments energètics o una necessitat del catabolisme o anabolisme d'un neurotransmissor o àcid nucleic específic. Com que cada mitocondri (2-10 en humans) porta diverses còpies del genoma mitocondrial, les mutacions mitocondrials es poden heretar maternament per mutacions d'ADNmt que estan presents als mitocondris dins de l'oòcit abans de la fecundació, o (com s'ha dit anteriorment) a través de mutacions a l'oòcit. cromosomes.
Presentació[modifica]
Les malalties mitocondrials varien en gravetat des d'asimptomàtiques fins a mortals, i es deuen més sovint a mutacions hereditàries més que no adquirides de l'ADN mitocondrial. Una mutació mitocondrial determinada pot causar diverses malalties depenent de la gravetat del problema en els mitocondris i el teixit on es troben els mitocondris afectats. Per contra, diverses mutacions diferents poden presentar-se com la mateixa malaltia. Aquesta caracterització gairebé específica del pacient de les malalties mitocondrials (vegeu Medicina personalitzada) fa que siguin molt difícils de reconèixer, diagnosticar i rastrejar amb precisió. Algunes malalties són observables en o fins i tot abans del naixement (moltes causen la mort), mentre que d'altres no es manifesten fins a l'edat adulta tardana (trastorns d'inici tardà). Això es deu al fet que el nombre de mitocondris mutants versus de tipus salvatge varia entre cèl·lules i teixits, i canvia contínuament. Com que les cèl·lules tenen múltiples mitocondris, diferents mitocondris de la mateixa cèl·lula poden tenir diferents variacions de l'ADNmt. Aquesta condició s'anomena heteroplasmia. Quan un determinat teixit arriba a una certa proporció de mitocondris mutants versus de tipus salvatge, es presentarà una malaltia. La proporció varia de persona a persona i de teixit a teixit (segons els seus requisits específics d'energia, oxigen i metabolisme, i els efectes de la mutació específica). Les malalties mitocondrials són molt nombroses i diferents. A part de les malalties causades per anomalies en l'ADN mitocondrial, es sospita que moltes malalties estan associades en part a disfuncions mitocondrials, com la diabetis mellitus,[16] formes de càncer [17] i malalties cardiovasculars, acidosi làctica,[18] formes específiques de miopatia,[19] osteoporosi,[20] malaltia d'Alzheimer,[21] malaltia de Parkinson,[22] ictus,[23] infertilitat masculina [24] i que també es creu que tenen un paper en el procés d'envelliment.[25]
Ús en medicina forense[modifica]
L'ADNmt humà també es pot utilitzar per ajudar a identificar individus.[26] Els laboratoris forenses utilitzen ocasionalment la comparació d'ADNmt per identificar restes humanes, i especialment per identificar restes esquelètiques més antigues no identificades. Tot i que a diferència de l'ADN nuclear, l'ADNmt no és específic d'un individu, es pot utilitzar en combinació amb altres proves (evidència antropològica, evidència circumstancial i similars) per establir la identificació. L'ADNmt també s'utilitza per excloure possibles coincidències entre persones desaparegudes i restes no identificades.[27] Molts investigadors creuen que l'ADNmt és més adequat per a la identificació de restes esquelètiques més antigues que l'ADN nuclear perquè el nombre més gran de còpies d'ADNmt per cèl·lula augmenta les possibilitats d'obtenir una mostra útil i perquè és possible un aparellament amb un parent viu encara que hi hagi nombrosos generacions els separen.
Exemples[modifica]
Les restes del proscrit americà Jesse James es van identificar mitjançant una comparació entre l'ADNmt extret de les seves restes i l'ADNmt del fill de la besnéta de la línia femenina de la seva germana.[28]
De la mateixa manera, les restes d'Alexandra Feodorovna (Alix de Hesse), darrera emperadriu de Rússia, i els seus fills van ser identificades per comparació del seu ADN mitocondrial amb el del príncep Felip, duc d'Edimburg, l'àvia materna del qual era la germana d'Alexandra Victòria de Hesse.[29]
De la mateixa manera, per identificar les restes de l'emperador Nicolau II, el seu ADN mitocondrial es va comparar amb el de James Carnegie, 3r duc de Fife, la besàvia materna del qual Alexandra de Dinamarca (la reina Alexandra) era germana de la mare de Nicolau II Dagmar de Dinamarca (l'emperadriu Maria Feodorovna).[29][30]
De la mateixa manera les restes del rei Richard III.
Referències[modifica]
- ↑ 1,0 1,1 Shuster RC, Rubenstein AJ, Wallace DC Biochem Biophys Res Commun, 155, 3, 1988, pàg. 1360–5. DOI: 10.1016/s0006-291x(88)81291-9. PMID: 3178814.
- ↑ 2,0 2,1 Zhang D, Keilty D, Zhang ZF, Chian RC Facts Views Vis Obgyn, 9, 1, 2017, pàg. 29–38. PMC: 5506767. PMID: 28721182.
- ↑ Schwartz, Marianne; Vissing, John New England Journal of Medicine, 347, 8, 22-08-2002, pàg. 576–580. DOI: 10.1056/NEJMoa020350. PMID: 12192017.
- ↑ Anderson, S.; Bankier, A. T.; Barrell, B. G.; de Bruijn, M. H. L.; Coulson, A. R. Nature, 290, 5806, abril 1981, pàg. 457–465. Bibcode: 1981Natur.290..457A. DOI: 10.1038/290457a0. PMID: 7219534.
- ↑ «Untitled». Arxivat de l'original el 2011-08-13. [Consulta: 13 juny 2012].
- ↑ 6,0 6,1 6,2 Satoh, M; Kuroiwa, T Experimental Cell Research, 196, 1, setembre 1991, pàg. 137–140. DOI: 10.1016/0014-4827(91)90467-9. PMID: 1715276.
- ↑ Nagy G, Barcza M, Gonchoroff N, Phillips PE, Perl A J Immunol, 173, 6, 2004, pàg. 3676–83. DOI: 10.4049/jimmunol.173.6.3676. PMC: 4034140. PMID: 15356113.
- ↑ Zimmerman, Earl G.; Akins, Darrin R.; Planz, John V.; Schurr, Michael J. Gene Analysis Techniques, 5, 5, setembre 1988, pàg. 102–104. DOI: 10.1016/0735-0651(88)90004-0. PMID: 2847966.
- ↑ Welter, Cornelius; Meese, Eckart; Blin, Nikolaus Molecular Biology Reports, 13, 2, 1988, pàg. 117–120. DOI: 10.1007/BF00539059. PMID: 3221842.
- ↑ 10,0 10,1 10,2 Barroso Lima, Nicholas Costa; Prosdocimi, Francisco Mitochondrial DNA Part A, 29, 2, 17-02-2018, pàg. 300–302. DOI: 10.1080/24701394.2016.1275603. PMID: 28129726.
- ↑ Taanman, Jan-Willem Biochimica et Biophysica Acta (BBA) - Bioenergetics, 1410, 2, febrer 1999, pàg. 103–123. DOI: 10.1016/s0005-2728(98)00161-3. PMID: 10076021 [Consulta: free].
- ↑ Anderson, S.; Bankier, A. T.; Barrell, B. G.; de Bruijn, M. H. L.; Coulson, A. R. Nature, 290, 5806, 1981, pàg. 457–65. Bibcode: 1981Natur.290..457A. DOI: 10.1038/290457a0. PMID: 7219534.
- ↑ «The Genetic Codes». www.ncbi.nlm.nih.gov. National Center for Biotechnology Information. [Consulta: 16 març 2019].
- ↑ Asin-Cayuela, Jordi; Gustafsson, Claes M. Trends in Biochemical Sciences, 32, 3, 2007, pàg. 111–17. DOI: 10.1016/j.tibs.2007.01.003. PMID: 17291767.
- ↑ Frontiers in Microbiology, 13, 821638, 21-03-2022. DOI: 10.3389/fmicb.2022.821638. PMC: 8979003. PMID: 35387072.
- ↑ Tanaka, Masashi; Fuku, Noriyuki; Nishigaki, Yutaka; Matsuo, Hitoshi; Segawa, Tomonori Diabetes, 56, 2, febrer 2007, pàg. 518–521. DOI: 10.2337/db06-1105. PMID: 17259400 [Consulta: free].
- ↑ Theodoratou, Evropi; Din, Farhat V.N.; Farrington, Susan M.; Cetnarskyj, Roseanne; Barnetson, Rebecca A. Carcinogenesis, 31, 2, febrer 2010, pàg. 296–301. DOI: 10.1093/carcin/bgp237. PMID: 19945968 [Consulta: free].
- ↑ Goto, Y Nihon Rinsho. Japanese Journal of Clinical Medicine, 51, 9, setembre 1993, pàg. 2373–8. PMID: 8411715.
- ↑ Ahuja, Abhimanyu S. PeerJ, 6, 21-05-2018, pàg. e4790. DOI: 10.7717/peerj.4790. PMC: 5967365. PMID: 29844960.
- ↑ Angireddy, Rajesh; Kazmi, Hasan Raza; Srinivasan, Satish; Sun, Li; Iqbal, Jameel The FASEB Journal, 33, 8, agost 2019, pàg. 9167–9181. DOI: 10.1096/fj.201900010RR. PMC: 6662975. PMID: 31063702.
- ↑ Carrieri, Giuseppina; Bonafè, Massimiliano; De Luca, Maria; Rose, Giuseppina; Varcasia, Ottavia Human Genetics, 108, 3, març 2001, pàg. 194–198. DOI: 10.1007/s004390100463. PMID: 11354629.
- ↑ Martín-Jiménez, Rebeca; Lurette, Olivier; Hebert-Chatelain, Etienne DNA and Cell Biology, 39, 8, 01-08-2020, pàg. 1421–1430. DOI: 10.1089/dna.2020.5398. PMID: 32397749 [Consulta: free].
- ↑ Chinnery, Patrick F; Elliott, Hannah R; Syed, Anila; Rothwell, Peter M The Lancet Neurology, 9, 5, maig 2010, pàg. 498–503. DOI: 10.1016/S1474-4422(10)70083-1. PMC: 2855429. PMID: 20362514.
- ↑ Ruiz-Pesini, Eduardo; Lapeña, Ana-Cristina; Díez-Sánchez, Carmen; Pérez-Martos, Acisclo; Montoya, Julio The American Journal of Human Genetics, 67, 3, setembre 2000, pàg. 682–696. DOI: 10.1086/303040. PMC: 1287528. PMID: 10936107.
- ↑ Courtenay, Monique D.; Gilbert, John R.; Jiang, Lan; Cummings, Anna C.; Gallins, Paul J. Human Genetics, 131, 2, febrer 2012, pàg. 201–208. DOI: 10.1007/s00439-011-1060-3. PMC: 4834861. PMID: 21750925.
- ↑ Brown, W. M. Proceedings of the National Academy of Sciences, 77, 6, 01-06-1980, pàg. 3605–3609. Bibcode: 1980PNAS...77.3605B. DOI: 10.1073/pnas.77.6.3605. PMC: 349666. PMID: 6251473 [Consulta: free].
- ↑ «Paleo-DNA Laboratory – Forensic Services». Arxivat de l'original el 2012-03-13. [Consulta: 13 juny 2012].
- ↑ Stone, Anne C.; Starrs, James E.; Stoneking, Mark Journal of Forensic Sciences, 46, 1, 01-01-2001, pàg. 173–6. DOI: 10.1520/JFS14932J. PMID: 11210907.
- ↑ 29,0 29,1 Gill, Peter; Ivanov, Pavel L.; Kimpton, Colin; Piercy, Romelle; Benson, Nicola Nature Genetics, 6, 2, febrer 1994, pàg. 130–135. DOI: 10.1038/ng0294-130. PMID: 8162066.
- ↑ Ivanov, Pavel L.; Wadhams, Mark J.; Roby, Rhonda K.; Holland, Mitchell M.; Weedn, Victor W. Nature Genetics, 12, 4, abril 1996, pàg. 417–420. DOI: 10.1038/ng0496-417. PMID: 8630496.
Bibliografia[modifica]
- Li, Xiangqi; Liu, Lianyong; Xi, Qian; Zhao, Xuemei; Fang, Mingshuang Acta Biochimica et Biophysica Sinica, 48, 9, 2016, pàg. 862–4. DOI: 10.1093/abbs/gmw059. PMID: 27261779 [Consulta: free].
Enllaços externs[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Genètica mitocondrial humana |
- National Institutes of Health. «Mitochondrial DNA». Genetics Home Reference. [Consulta: 6 maig 2017].
- ^ «Societat Catalana de Neurologia». Arxivat de l'original el 18 novembre 2005. [Consulta: 5 desembre 2005].
- ^ «MITOMAP Genome». Arxivat de l'original el 8 abril 2005. [Consulta: 5 desembre 2005].
