Neutròfil
 Dos neutròfils segmentats i envoltats per nombrosos glòbuls vermells | |
 Representació en 3D d'un neutròfil. | |
| Detalls | |
|---|---|
| Llatí | Granulocytus neutrophilus; Neutrophilus; Granulocytus neutrophilus segmentonuclearis |
| Precursor | Neutròfil de banda (o de bastó) |
| Part de | sistema immunitari innat |
| Sistema | Immunitari |
| Identificadors | |
| MeSH | [1] |
| TH | H2.00.04.1.02012 |
| FMA | |
| Recursos externs | |
| EB Online | science/neutrophil |
| Terminologia anatòmica | |
Els neutròfils (també popularment micròfags) són glòbuls blancs de tipus granulòcit. Mesuren entre 9 i 12 micròmetres i signifiquen entre el 60% i el 70% dels leucòcits a la sang dels éssers humans.[1] Tenen una mitjana de vida curta, des de poques hores fins a alguns dies. La seva funció principal és la fagocitosi de bacteris i fongs. La seva concentració a la sang està compresa entre els 2.000 i 8.000 neutròfils per mm³.[2]
Es diuen «neutròfils» perquè no tenen capacitat de tinció amb colorants, àcids, ni bàsics, motiu pel qual el seu citoplasma es veu de color rosa suau. Es caracteritzen per presentar un nucli amb cromatina compacta, segmentada i multiovalada, i que conté de 2 a 5 lòbuls connectats per ponts prims. En neutròfils immadurs el nucli es presenta sense segmentar com una banda fortament tenyida. El citoplasma conté abundants grànuls fins de color porpra (tenyits amb tinció de Giemsa) que contenen abundants enzims lítics, així com una substància antibacteriana anomenada fagocitina, ambdós necessaris per a la lluita contra els patògens.
És una cèl·lula molt mòbil i la seva consistència gelatinosa li facilita travessar les parets dels vasos sanguinis per migrar cap als teixits, on ajuda en la destrucció de bacteris i fongs, i també respon a estímuls inflamatoris. Aquest fenomen es coneix com a diapedesi.[3]
Els neutròfils es troben normalment al flux sanguini, però durant l'inici agut de la inflamació, particularment com a resultat d'una infecció bacteriana, són uns dels primers agents immunitaris a migrar cap al lloc de la inflamació (primer a través de les artèries, després a través del teixit intersticial), dirigits per senyals químics com ara la interleucina-8 (IL-8) o l'interferó-gamma (IFN-γ), en un procés anomenat quimiotaxi. Són les cèl·lules predominants en el pus.
L'alliberament dels neutròfils des dels vasos sanguinis està condicionada per l'alliberament d'histamina (alliberada pels mastòcits) i TNF-α (alliberada pels macròfags). El TNF-α i la histamina actuen sobre les cèl·lules de l'endoteli del vas sanguini fent que s'activin els neutròfils mitjançant l'expressió de selectina-E.[4] Per altra banda, els que han estat activats mitjançant IL-8 poden unir-se a la selectina-E per mitjà del lligand glucídic. D'aquesta manera són capaços d'aglomerar-se i estar presents en teixits 5 hores després d'haver començat la infecció. A causa de les seves funcions fagocítiques els neutròfils també es coneixen com a micròfags, a fi de diferenciar-los de les cèl·lules fagocítiques més grans, els macròfags.[5]
Característiques[modifica]

Els neutròfils tenen un diàmetre aproximat d'entre 12 i 15 micròmetres (µm) en un frotis sanguini.[1] Quan s'analitza una suspensió de neutròfils purs en un comptador de cèl·lules automatitzat, tenen un diàmetre mitjà de 8-9 micròmetres.
Juntament amb els eosinòfils i els basòfils, constitueixen les cèl·lules polimorfonuclears, anomenades d'aquesta manera pels diferents lòbuls que formen el nucli (a diferència dels limfòcits, monòcits i altres tipus de glòbuls blancs). El nucli es caracteritza per tenir una aparença ovalada, i els lòbuls esmentats estan connectats per cromatina. Li manca el nuclèol, el qual desapareix durant la seva maduració.[6] Quant al citoplasma, l'aparell de Golgi és petit, els mitocondris i els ribosomes són escassos i no hi ha reticle endoplasmàtic rugós.[7] Conté aproximadament 200 grànuls, dels quals una tercera part són grànuls atzuròfils.[7]
Hi ha una petita diferència entre els neutròfils d'homes i dones. Els nuclis dels neutròfils femenins tenen una petita estructura addicional del cromosoma X, coneguda com a cuixa del neutròfil.[8]
Els neutròfils són els glòbuls blancs més abundants en els éssers humans (cada dia se'n produeixen aproximadament 1011); i constitueixen aproximadament el 40-75% dels glòbuls blancs. El recompte normal varia segons el laboratori on es faci, però un recompte normal es trobaria entorn els 2,5 i 7,5 × 109 neutròfils/L. Les persones d'origen africà i d'orient mitjà tenen uns recomptes més baixos que la resta de la població mundial.
Quan viatgen pel torrent sanguini i estan inactius tenen una forma esfèrica. Una vegada activats agafen una forma amorfa similar a la d'una ameba i estenen els seus pseudòpodes amb la finalitat de caçar patògens.[9]
Els neutròfils tenen preferència per engolir hidrats de carboni refinats[10][11][12] (glucosa, fructosa, sacarosa, mel i suc de taronja[10]) dels bacteris.[10] El 1973, Sánchez et al. van demostrar que la capacitat fagocitària dels neutròfils és afectada quan els sucres simples són digerits.[10] El dejuni enforteix aquesta capacitat fagocitària contra els bacteris.[10] No obstant això, la digestió dels midons normals no tenen cap efecte i van arribar a la conclusió que la funció i no pas el nombre de neutròfils és el que altera la digestió dels sucres.[10] El 2007, investigadors del Whitehead Institute of Biomedical Research van descobrir que fins i tot en una selecció de sucres, els neutròfils poden ser exigents i fagocitar en una primera instància un tipus de sucre en concret.[11][12]
Formació[modifica]

De la mateixa manera que la resta de glòbuls blancs, els neutròfils comencen el seu procés de formació a la medul·la òssia i s'originen a partir de cèl·lules mare mieloides. Segons el grau de desenvolupament, la cèl·lula rep un nom o altre:[1]
- Mieloblast: és la primera cèl·lula morfològicament recognoscible del neutròfil. La seva forma és arrodonida i el seu diàmetre està comprès entre 15 i 20 µm. Té un nucli gran i vermellós, el qual sol situar-se al centre. És freqüent trobar-lo amb forma de U. La seva cromatina és laxa i conté entre 2 i 5 nuclèols. El citoplasma és escàs i basòfil (queda tenyit de color blavós). Existeixen els mieloblasts de tipus I i de tipus II, i la diferència bàsica es troba en què el primer no té granulacions al citoplasma mentre que el segon si en té.[1]
- Promielòcit: s'origina per divisió i maduració del mieloblast. La seva forma continua sent arrodonida però augmenta la seva grandària. Té un diàmetre comprès entre els 16 i els 25 µm. El nucli perd part del color vermellós i tendeix a descentralitzar-se. Augmenta el volum citoplasmàtic, és blavós i està replè de grànuls primaris molt basòfils. Existeixen dos tipus de promielòcits, de tipus I i de tipus II: el segon té una major quantitat de grànuls primaris que el de tipus I.[13]
- Mielòcit neutròfil: s'origina per diverses divisions i maduració del promielòcit. Comença a disminuir la seva grandària, compresa entre 12 i 18 µm. El nucli continua sent més petit, menys rodó, més blavós i excèntric. La cromatina és més densa i esporàdicament es visualitzen nuclèols al seu interior. Els grànuls són bàsicament específics o secundaris i estan replets de muramidasa, col·lagenasa i fostasa alcalina entre altres. Continua conservant alguns grànuls primaris.[13]
- Metamielòcit: és la maduració del mielòcit neutròfil. La seva mida continua disminuint, ara entre els 10 i 15 µm de diàmetre. El citoplasma és rosat i el nucli presenta una petita invaginació (té forma de ronyó o mongeta) i una cromatina densa, especialment als pols.[13]
- Neutròfil de banda, de bastó, o de bastonet: és el precursor més immediat del neutròfil. La seva mida es redueix una mica més, entre 10 i 14 µm, la mateixa del neutròfil madur. El seu nucli de color violeta fosc té forma de C o S, però sense presentar les estrangulacions característiques dels neutròfils ja madurs. A vegades el nucli presenta un petit apèndix conegut com a bastonet de tambor. Continua trobant-se a la medul·la espinal, però un petit percentatge (del 3% al 5%) migra cap al torrent sanguini, lloc on aquest reducte de cèl·lules no finalitza el seu procés de maduració.[13]
El procés de maduració dels leucòcits és conegut com a leucopoiesi i en el cas dels neutròfils dura entre 8 i 11 dies. Per a cada precursor inicial, al final hi haurà entre 10 i 15 neutròfils.[14] Tot aquest procés és regulat per l'acció d'un compost glicoproteic produït pels macròfags i alguns limfòcits actius, i rep el nom de factor estimulant de colònies. Per contra, els granulòcits circulants per la sang poden inhibir aquest procés amb l'alliberació de xalones, pel que es coneix com un sistema de retroalimentació negativa.[14]
Esperança de vida[modifica]
La mitjana de vida dels neutròfils no activats en circulació al torrent sanguini és de 5,4 dies.[15] Després de l'activació, es marginen (posicionament al costat de l'endoteli dels vasos sanguinis) i se sotmeten a una captura depenent de selectina, seguida de l'adhesió depenent d'integrina en la majoria dels casos. A continuació migren als teixits, on sobreviuen 1 o 2 dies.[16]
Els neutròfils tenen una esperança de vida més llarga que altres fagòcits com els monòcits o els macròfags. Normalment és el primer fagòcit que coincideix amb els patògens. Alguns experts especulen que la seva curta esperança de vida és una adaptació evolutiva. D'aquesta manera es minimitza la propagació de patògens que parasiten els fagocitats: com més temps passen els paràsits fora d'una cèl·lula hoste, és més probable que siguin destruïts per alguns components de les defenses de l'organisme. A més a més, a causa dels productes antimicrobians dels neutròfils també es poden danyar els teixits del mateix individu, i és per això que la seva curta vida limita el dany produït per la inflamació.[16]
Els neutròfils sovint són fagocitats pels macròfags després de la digestió de patògens. La PECAM-1 i la fosfatidilserina estan implicades en aquest procés.
Quimiotaxi[modifica]
Els neutròfils se sotmeten a un procés anomenat quimiotaxi, el qual els permet migrar cap als llocs d'infecció o inflamació. Els receptors de la superfície cel·lular permeten als neutròfils detectar gradients químics de molècules com ara la interleucina-8 (IL-8), l'interferó gamma (IFN-γ), la C5a i la leucotrina B4 per a poder dirigir el camí de la seva migració.[2]
Els neutròfils tenen una gran varietat de receptors específics: receptors del complement, receptors de citocines per interleucines i l'IFN-γ, receptors de quimiocines, receptors per detectar i adherir-se a l'endoteli, receptors de leptines i proteïnes, i receptors de tipus Fc per opsonina.[17]
Funcions[modifica]
Donada la seva elevada velocitat de transport, els neutròfils es congreguen ràpidament en el focus de la infecció, atrets per les citocines expressades per l'endoteli activat, els mastòcits, i els macròfags. Els neutròfils expressen i alliberen citocines, i aquestes al mateix temps amplifiquen les reaccions inflamatòries per fer venir altres tipus de cèl·lules.[18]
A més a més del reclutament i l'activació d'altres cèl·lules del sistema immunitari, els neutròfils tenen un paper clau en la defensa corporal a primera línia contra la invasió de patògens. Tenen tres mètodes diferents d'atacar els microorganismes: la fagocitosi (ingestió), l'alliberament d'antimicrobians solubles (incloent-hi proteïnes de grànuls) i la generació de trampes extracel·lulars de neutròfils (NETs).[19]
Després de realitzar la seva tasca, els neutròfils moren convertint-se en pus, especialment al costat dels bacteris piògens.[20]
Fagocitosi[modifica]
Els neutròfils són fagòcits, tenen la capacitat de dirigir microorganismes o part d'ells.[2] Per a reconèixer el patogen, primer s'ha de recobrir-lo amb opsonina, procés conegut amb el nom d'opsonització.[9] Poden internalitzar i eliminar molts agents infecciosos; cada vegada que es realitza la fagocitosi es forma un fagosoma que segrega espècies reactives de l'oxigen (ROS) i enzims hidrolítics. El consum d'oxigen durant la generació d'espècies reactives de l'oxigen s'anomena esclat respiratori, tot i no estar relacionat amb la respiració o amb la producció d'energia.
La respiració implica l'activació de l'enzim NADPH oxidasa, la qual produeix grans quantitats de superòxid, un tipus d'oxigen reactiu. El superòxid es desintegra espontàniament i descompon l'enzim superòxid dismutasa (Cu/ZnSOD i MnSOD) a peròxid d'hidrogen, que més endavant esdevindrà àcid hipoclorós (HClO) per mitjà de l'enzim mieloperoxidasa (que conté un grup hemo de color verdós). Es creu que les propietats bactericides de l'HClO són suficients per matar els bacteris fagocitats pels neutròfils, però això pot ser un canvi necessari per a l'activació de proteases.[21]
La capacitat fagocitària dels neutròfils pot ser inhibida per diferents substàncies com els corticoides, el cloramfenicol, la fenilbutazona o l'alcohol etílic.[20]
Desgranulació[modifica]
Els neutròfils alliberen una gran varietat de proteïnes contingudes en un procés que rep el nom de desgranulació. Aquests grànuls, organitzats en tres tipus, tenen propietats antimicrobianes i ajuden a combatre les infeccions.[22][23]
| Tipus de grànuls | Proteïnes |
| Grànuls atzuròfis (o grànuls primaris) | mieloperoxidasa, proteïna bactericida/incrementadora de la permeabilitat (BPI), defensines, serina proteasa neutròfil elastases i catepsines G |
| Grànuls específics (o grànuls secundaris) | fosfatases alcalines, lisozimes, NADPH oxidases, col·lagenases, lactoferrines i catelicidines |
| Grànuls terciaris | catepsines i gelatinases |
Trampes extracel·lulars de neutròfils (NETs)[modifica]
El 2004, Brinkmann i el seu equip van descobrir que l'activació dels neutròfils provoca l'alliberament d'estructures en forma de banda de l'ADN, això representa una tercera manera de matar bacteris.[24] Aquestes trampes extracel·lulars de neutròfils (NETs) formen una tela de fibres compostes de cromatina i serina proteases en els teixits sanguinis que atrapen i maten els bacteris extracel·lulars. Es creu que les NETs proporcionen una alta concentració local de components antimicrobians. S'uneixen, desarmen i maten els microorganismes independentment de l'absorció de la fagocitosi. A més a més de les seves possibles propietats antimicrobianes, les NETs serveixen com una barrera física que prevé futures propagacions patògenes.[25] Recentment s'ha descobert que les NETs tenen un paper important en les malalties inflamatòries.[26] També que presenten efectes protrombòtics tan in vitro[27] com in vivo.[28][29]
Malalties[modifica]
La brucel·losi o febre de Malta és una malaltia produïda pel bacteri Brucella melitensis que afecta els grànuls dels neutròfils. Pot produir febre, artràlgia, peritonitis i eventualment amiloïdosi.[30]
En la deficiència d'alfa-1-antitripsina, l'enzim elastasa no és adequadament eliminat per l'alfa 1-antitripsina, i en conseqüència aquest produeix un dany excessiu al teixit durant el procés d'inflamació. El seu tret més característic és l'emfisema pulmonar.
Neutropènia[modifica]
Quan el nombre de neutròfils està per sota dels valors de referència (menys de 2.000 per mm³) es dona una neutropènia. Entre les seves característiques principals es dona l'agranulocitosi (absència de granulacions citoplasmàtiques), l'anèmia aplàstica i l'anèmia megaloblàstica, així com un gran nombre d'infeccions com la febre tifoide, l'hepatitis vírica o la brucel·losi esmentada anteriorment (entre altres).[31]
Neutrofília[modifica]
Quan el nombre de neutròfils està per sobre dels valors de referència (més de 8000 per mm³) es dona una neutrofília. Entre les seves característiques principals es donen les infeccions causades per bacteris com la sèpsia, les micosis, les hemorràgies greus, les destruccions tissulars extenses i les malalties metabòliques com la gota. La neutrofília es pot donar per causes d'embaràs, exercici intens, ansietat o per algunes teràpies que inclouen administració de corticoides o fàrmacs amb liti.[31]
Antígens[modifica]
Hi ha cinc conjunts reconeguts d'antígens dels neutròfils (HNA 1-5). Els tres antígens HNA-1 (a-c) es troben amb una baixa afinitat al receptor Fc-γ IIIb (FCGR3B CD16b). L'únic antigen de l'HNA-2a conegut es localitza al CD177. El sistema d'antigen HNA-3, format per dos antígens (3a i 3b), es troba localitzat en el setè exó del gen CLT2 (SLC44A2). Els sistemes d'antigen HNA-4 i HNA-5 tenen cadascun dos antígens coneguts (a i b) i es troben a la integrina β2. L'HNA-4 se situa a la cadena αM (CD11b) i l'HNA-5 ho fa a la unitat d'integrina αL (CD11a).[32]
Mèdia[modifica]
Galeria de vídeo[modifica]
-
Un neutròfil fagocitant diversos conidiòfors. Cada 30 segons del vídeo comprèn dues hores a la realitat.
-
Un neutròfil fagocitant selectivament diversos llevats Candida (tenyits de color verd fluorescent) malgrat haver-hi diversos Aspergillus fumigatus (de color blanc o transparent) en una matriu de col·lagen en 3D. Cada 30 segons del vídeo comprèn dues hores a la realitat.
Els neutròfils mostren una motilitat ameboide altament direccional que els porta a les infeccions.[33]
Galeria fotogràfica[modifica]
-
Imatge presa amb un microscopi electrònic de rastreig on s'observa un neutròfil (groc) fagocitant un bacteri d'àntrax (taronja).
-
Imatge presa amb un microscopi òptic on s'observen neutròfils envoltats de glòbuls vermells en un frotis sanguini.
-
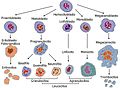
Llinatge de les cèl·lules sanguínies.
-
Llinatge més complet.
Referències[modifica]
- ↑ 1,0 1,1 1,2 1,3 Rubio Campal, García Espinosa i Carrasco Carrasco, 2004, p. 186.
- ↑ 2,0 2,1 2,2 Rubio Campal, García Espinosa i Carrasco Carrasco, 2004, p. 189.
- ↑ Jacobs et al., 2010, p. 64.
- ↑ Lawrence i Springer, 1993.
- ↑ Cohen i Burns, 2002, p. 465.
- ↑ Zucker-Franklin et al., 1988, p. 168.
- ↑ 7,0 7,1 Zucker-Franklin et al., 1988, p. 170.
- ↑ Zucker-Franklin et al., 1988, p. 174.
- ↑ 9,0 9,1 Edwards, 1994, p. 6.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 ; Albert Sanchez, J. L. Reeser, H. S. Lau, P. Y. Yahiku, R. E. Willard, P. J. McMillan, S. Y. Cho, A. R. Magie i U. D. Register«Role of sugars in human neutrophilic phagocytosis». The American Society for Clinical Nutrition, 1973. [Consulta: 15 febrer 2015]. «Aquestes dades suggereixen que la funció i no el nombre de fagòcits va ser alterada per la ingestió de sucres. Això implica que la glucosa i altres carbohidrats simples estan en el control de la fagocitosi i mostra que els efectes duren almenys cinc hores. Per altra banda, el dejuni de 36 o 60 hores augmenta (P <0,001) l'índex fagocític.»
- ↑ 11,0 11,1 Cell Host & Microbe, 11 de juliol de 2007 " La fagocitosi dels neutròfils humans és estimulada per un únic component fúngic de la paret cel·lular" Ifat Rubin-Bejerano(1), Claudia Abeijon(3^), Paula Magnelli(3), Paula Grisafi(1) & Gerald Fink(1,2) ^Adreça actual: Escola Cummings de Medicina Veterinària, Universitat Tufts, North Grafton, Massachusetts (1) Institut Whitehead per a la Recerca Biomèdica, Cambridge, Massachusetts (2) Departament de biologia, Institut Tecnològic de Massachusetts, Cambridge, Massachusetts (3) Departament de biologia molecular i cel·lular, Escola de medicina dental Goldman, Boston, Massachusetts
- ↑ 12,0 12,1 Kneller, Alyssa. «White blood cells». wi.mit.edu, 2007. [Consulta: 15 febrer 2015].
- ↑ 13,0 13,1 13,2 13,3 Rubio Campal, García Espinosa i Carrasco Carrasco, 2004, p. 187.
- ↑ 14,0 14,1 Rubio Campal, García Espinosa i Carrasco Carrasco, 2004, p. 188.
- ↑ Pillay J, den Braber I, Vrisekoop N, Kwast LM, de Boer RJ, Borghans JA, Tesselaar K, Koenderman L. In vivo labeling with 2H2O reveals a human neutrophil lifespan of 5.4 days. Juliol de 2010 29;116(4):625-7.
- ↑ 16,0 16,1 Wheater, Paul R.; Stevens, Alan. Wheater's basic histopathology: a colour atlas and text. Edinburgh: Churchill Livingstone, 2002. ISBN 0-443-07001-6 [Consulta: 15 febrer 2015]. Arxivat 2011-11-22 a Wayback Machine.
- ↑ Charles N. Serhan, Peter A. Ward, Derek W. Gilroy. Fundamentals of Inflammation. Cambridge University Press, 2010, p. 53–54. ISBN 0-521-88729-1.
- ↑ Ear T, McDonald PP «Cytokine generation, promoter activation, and oxidant-independent NF-kappaB activation in a transfectable human neutrophilic cellular model». BMC Immunol., 9, 2008, pàg. 14. DOI: 10.1186/1471-2172-9-14. PMC: 2322942. PMID: 18405381.
- ↑ Hickey, MJ; Kubes P «Intravascular immunity: the host–pathogen encounter in blood vessels». Nature Reviews Immunology. Nature Publishing Group, 9, (5), 2009, pàg. 364–75. DOI: 10.1038/nri2532. PMID: 19390567.
- ↑ 20,0 20,1 Rubio Campal, García Espinosa i Carrasco Carrasco, 2004, p. 190.
- ↑ Segal, AW «How neutrophils kill microbes». Annu Rev Immunol, 9, (5), 2005, pàg. 197–223. DOI: 10.1146/annurev.immunol.23.021704.115653. PMC: 2092448. PMID: 15771570.
- ↑ Faurschou M, Borregaard N «Neutrophil granules and secretory vesicles in inflammation». Microbes Infect, 5, 14, 2003, pàg. 1317–1327. DOI: 10.1016/j.micinf.2003.09.008. PMID: 14613775.
- ↑ Lominadze G, Powell D, Luerman G, Link A, Ward R, McLeish K «Proteomic analysis of human neutrophil granules». Mol Cell Proteomics, 4, 10, 2005, pàg. 1503–1521. DOI: 10.1074/mcp.M500143-MCP200. PMID: 15985654.
- ↑ Brinkmann, Volker «Neutrophil Extracellular Traps Kill Bacteria». Science. AAAS, 303, 5663, 05-03-2004, pàg. 1532–1535. DOI: 10.1126/science.1092385. ISSN: 0036-8075. PMID: 15001782 [Consulta: 15 febrer 2015].
- ↑ Clark SR, Ma AC, Tavener AS, McDonald B, Goodarzi Z, Kelly MM, Patel KD, Chakrabarti S, McAvoy E, Sinclair GD, Keys EM, Allen-Vercoe E, DeVinney R, Doig CJ, Green FHY and Kubes P «Platelet Toll-Like Receptor-4 Activates Neutrophil Extracellular Traps to Ensnare Bacteria in Endotoxemic and Septic Blood». Nature Medicine. Nature Publishing Group, 13, (4), Abril 2007, pàg. 463–9. DOI: 10.1038/nm1565. ISSN: 1078-8956. PMID: 17384648.
- ↑ Gupta, AK; Hasler, P; Holzgreve, W; Hahn, S «Neutrophil NETs: a novel contributor to preeclampsia-associated placental hypoxia?». Semin Immunopathol, 29, 2, Juny 2007, pàg. 163–7. DOI: 10.1007/s00281-007-0073-4. ISSN: 1863-2297. PMID: 17621701.
- ↑ Fuchs, TA «Extracellular DNA traps promote thrombosis». Proceedings of the National Academy of Sciences of the United States of America, 107, 36, 07-09-2010, pàg. 15880–5. DOI: 10.1073/pnas.1005743107. PMC: 2936604. PMID: 20798043.
- ↑ Brill, A «Neutrophil Extracellular Traps Promote Deep Vein Thrombosis in Mice». Journal of thrombosis and haemostasis : JTH, 10, 1, 01-11-2011, pàg. 136–44. DOI: 10.1111/j.1538-7836.2011.04544.x. PMC: 3319651. PMID: 22044575.
- ↑ Borissoff, JI «From neutrophil extracellular traps release to thrombosis: an overshooting host-defense mechanism?». Journal of thrombosis and haemostasis : JTH, 9, 9, setembre 2011, pàg. 1791–4. DOI: 10.1111/j.1538-7836.2011.04425.x. PMID: 21718435.
- ↑ Ozen, S «Familial mediterranean fever: revisiting an ancient disease». European Journal of Pediatrics, 162, 7–8, Juliol 2004, pàg. 449–54. Arxivat de l'original el 2019-09-12. DOI: 10.1007/s00431-003-1223-x. ISSN: 0340-6199. PMID: 12751000 [Consulta: 2 juny 2014]. Arxivat 2019-09-12 a Wayback Machine.
- ↑ 31,0 31,1 Rubio Campal, García Espinosa i Carrasco Carrasco, 2004, p. 232.
- ↑ Chu HT, Lin H, Tsao TT, Chang CF, Hsiao WW, Yeh TJ, Chang CM, Liu YW, Wang TY, Yang KC, Chen TJ, Chen JC, Chen KC, Kao CY (2013) Genotyping of human neutrophil antigens (HNA) from whole genome sequencing data. BMC Med Genomics 6(1):31
- ↑ Graham D.B., Zinselmeyer B.H., Mascarenhas F., Delgado R., Miller M.J., Swat W. «ITAM signaling by Vav family Rho guanine nucleotide exchange factors regulates interstitial transit rates of neutrophils in vivo». PLoS ONE, 4, 2, 2009, pàg. e4652. DOI: 10.1371/journal.pone.0004652. PMC: 2645696. PMID: 19247495.
Bibliografia[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Neutròfil |
- Cohen, Stephen; Burns, Richard C. Pathways of the Pulp. 8. St. Louis: Mosby, Inc., 2002.
- Edwards, Steven W. Biochemistry and physiology of the neutrophil. Cambridge University Press, 1994. ISBN 0-521-41698-1.
- Rubio Campal, Faustina; García Espinosa, Benjamín; Carrasco Carrasco, Manuel. Paraninfo. Fundamentos y técnicas de análisis hematológicos y citológicos, 2004. ISBN 978-84-9732-317-8.
- Jacobs, L.; Nawrot, Tim S; De Geus, Bas; Meeusen, Romain «Subclinical responses in healthy cyclists briefly exposed to traffic-related air pollution». Environmental Health, 9, 64, 2010 [Consulta: 10 juny 2015].
- Kumar; Altres autors. Robbins & Cotran Pathologic Basis of Disease «Ch.2 Acute and chronic inflammation» (en anglès). Saunders (Elsevier), 2009 [Consulta: 9 juny 2015].
- Lawrence, Michael B.; Springer, Timothy A. «Neutrophils Roll on E-Selectin» (en anglès). The Journal of Immunology. Center for Blood Research and Department of Pathology, Harvard Medical School, Boston., vol.151, núm.11, 1993, pp.6338-6346. Arxivat de l'original el 24 de setembre 2015 [Consulta: 4 juny 2015].
- Zucker-Franklin, Dorothy; Greaves, M.F.; Grossi, C.E.; Marmont, A.M.. «Neutrophils». A: Atlas of Blood Cells: Function and Pathology. 1. 2a edició. Philadelphia: Lea & Ferbiger, 1988. ISBN 0-8121-1094-3.