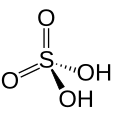
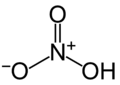
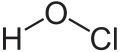
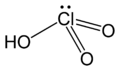
Àcid
Un àcid (del llatí acidus, 'agre') és considerat tradicionalment com qualsevol compost químic que, quan es dissol en aigua, produeix una solució amb una activitat de catió oxidani o oxoni, , major que l'aigua pura, és a dir, un pH menor que 7. Això s'aproxima a la definició moderna de Johannes Nicolaus Brønsted i Thomas Martin Lowry, que van definir de manera independent un àcid com un compost que dona un catió hidrogen (H+) a un altre compost (denominat base). Alguns exemples comuns són l'àcid acètic (al vinagre), l'àcid clorhídric (al salfumant i als sucs gàstrics), l'àcid acetilsalicílic (a l'aspirina) o l'àcid sulfúric (usat en bateries d'automòbil). Els sistemes àcid/base es diferencien de les reaccions redox en el fet que, en aquestes últimes, hi ha un canvi en l'estat d'oxidació. Els àcids poden existir en forma de sòlids, líquids o gasos segons de la temperatura, i també poden existir com a substàncies pures o en solució.
Les substàncies químiques que tenen la propietat d'un àcid es denominen àcides.
Teories[modifica]
La primera teoria sobre els àcids es deu al químic francès Antoine Laurent Lavoisier. Segons ell els àcids presenten en la seva composició sempre oxigen, essent el responsable de les propietats característiques dels àcids. Per aquesta raó Lavoisier anomenà a aquest element químic oxigen, que significa engendrador d'àcids a partir dels mots grecs ὀξύς àcid i -γενος engendrador.[1] Molts d'àcids contenen oxigen: el sulfúric, el nítric, el fosfòric, tots els àcids orgànics, etc. Els experiments de descomposició electrolítica realitzats per Humphry Davy demostraren que hi havia àcids que no contenien oxigen, com ara l'àcid clorhídric, amb la qual cosa s'abandonà la teoria de Lavoisier.
Àcid segons la teoria d'Arrhenius[modifica]

Les anomalies que tenien les propietats col·ligatives dels electròlits i la conductivitat elèctrica que presentaven les seves dissolucions varen dur al químic suec Svante August Arrhenius a proposar una teoria de la dissociació electrolítica el 1887[2] que indicava que els electròlits, en dissolució aquosa o fusos, es dissocien parcialment en ions carregats elèctricament. Amb aquesta hipòtesi va definir els àcids com:
- Electròlits que en dissolució aquosa donen cations hidrogen, H+.
Per tant, segons Arrhenius els àcids són electròlits que han de tenir necessàriament en la seva estructura hidrogens que es puguin rompre en dissolució aquosa. A continuació hi ha uns exemples:
La reacció de neutralització dels àlcalis s'explica per la formació d'una sal i aigua:
Àcid segons la teoria de Brønsted-Lowry[modifica]

El químic danès Johannes Nicolaus Brønsted i l'anglès Thomas Martin Lowry, el 1923, publicaren de forma independent, una teoria sobre el comportament dels àcids i que podia aplicar-se a qualsevol tipus de dissolvent mentre que la d'Arrhenius només podia emprar-se per a dissolucions aquoses.[3][4] Segons aquesta nova teoria:
- Un àcid és una substància que pot cedir protons.
A partir d'aquesta definició es fa necessària una altra substància que accepti els protons, que són les bases, i no és necessari que la reacció tengui lloc dins aigua, pot ser dins d'un altre dissolvent o en un altre estat, com ara gasós. Per exemple:
Àcid clorhídric en àcid acètic
Clorur d'hidrogen i amoníac en estat gasós
Els àcids poden ser espècies neutres però també ions:
Anió hidrogenocarbonat en aigua
El concepte d'àcid passa, amb la teoria de Brønsted-Lowry, a ser un concepte relatiu, ja que una mateixa substància pot actuar com àcid o com a base en funció de l'altra substància amb la qual reaccioni. Per exemple l'àcid acètic actua com àcid en dissolució aquosa quan reacciona amb l'aigua, però actua com a base si està dissolt en àcid sulfúric:
Àcid acètic en aigua
Àcid segons la teoria de Lewis[modifica]
La teoria àcid-base de Brønsted-Lowry no és suficientment àmplia per comprendre tots els casos de comportament àcid de les substàncies, ja que és limitat a les reaccions amb intercanvi de protons. Hi ha substàncies que no tenen hidrogen i tenen comportament àcid, per exemple el diòxid de carboni, CO₂, o el triòxid de sofre, SO₃, es comporten com àcids, ja que en presència d'òxids bàsics, com ara l'òxid de calci, CaO, o l'òxid de sodi, Na₂O, en absència de dissolvent i, per tant, sense transferència de protons, reaccionen per a formar sals, el carbonat de sodi, CaCO₃ o el sulfat de sodi, Na₂SO₄, per exemple. Les reaccions podem representar-les amb les següents equacions químiques:
Aquestes reaccions impliquen la cessió parcial, mitjançant enllaç covalent datiu, d'una parella d'electrons d'un àtom d'oxigen a un altre àtom i Gilbert Newton Lewis enuncià l'any 1923[5] i desenvolupà l'any 1938 una teoria més general d'àcids, segons la qual un àcid és tota substància, molecular o iònica, que pot acceptar un parell d'electrons.
Segons aquesta definició els àcids han de tenir àtoms que no tenguin complet l'octet d'electrons. La unió d'un àcid amb una base es produeix per formació d'un enllaç covalent datiu, és a dir, els dos electrons que formen l'enllaç provenen ambdós d'un àtom. Es pot representar amb l'equació:
La major o menor electronegativitat d'algun dels àtoms en un compost determina el seu caràcter àcid. L'afinitat pels electrons d'un àtom combinat es coneix com a electrofília i, inversament, la tendència a cedir electrons es coneix com a nucleofília. Un compost pot imaginar-se format per la combinació d'un radical electròfil amb un radical nucleòfil i les reaccions poden suposar-se produïdes pel desplaçament d'un radical electròfil o nucleòfil dèbil per un altre de més fort. Aquests conceptes permeten l'explicació de moltes reaccions orgàniques.
La teoria de Lewis elimina la posició única del protó en la teoria de Brønsted-Lowry però els àcids en aquesta teoria no ho són en la de Lewis, que assigna aquest caràcter al protó. Així en la teoria de Lewis l'àcid clorhídric, és la combinació de la base Cl- amb l'àcid H+ i quan reacciona amb l'aigua, que és una base, es produeix un desplaçament de la base Cl-, més dèbil, per la base més forta H₂O.[6]
Constant d'aciditat o acidesa[modifica]
Sigui un àcid dèbil, AH, que es dissol dins d'aigua. Segons la teoria àcid-base de Brønsted-Lowry l'àcid reacciona amb l'aigua segons la següent equació química:
Quan s'assoleix l'equilibri les concentracions de les espècies que intervenen es manté constant i es pot definir una constant d'equilibri, que s'anomena constant d'acidesa, al quocient entre el producte de les concentracions de la base conjugada de l'àcid i del catió oxoni o oxidani la concentració de l'àcid, totes a l'equilibri:
Àcid fort[modifica]
Un àcid fort és:
- segons la teoria d'Arrhenius, un àcid que en dissolució aquosa es dissocia completament, per exemple l'àcid clorhídric:
- segons la teoria de Brønsted-Lowry, és aquell que té una gran tendència a transferir un protó, per exemple l'àcid clorhídric:
una manera de quantificar aquesta força és a partir del valor de la constant d'acidesa. Un valor elevat indica un àcid fort, mentre que un valor baix indica un àcid feble.
Exemples d'àcids forts ordenats de més fort a menys fort: àcid perclòric - àcid iodhídric - àcid bromhídric - àcid sulfúric - àcid clorhídric - àcid nítric - àcid etanodioic - àcid iòdic - àcid cròmic
Àcid feble[modifica]
Un àcid feble és:
- segons la teoria d'Arrhenius, un àcid que en dissolució aquosa es dissocia parcialment, per exemple l'àcid acètic:
- segons la teoria de Brønsted-Lowry, és aquell que té poca tendència a transferir un protó, per exemple l'àcid acètic:
La constant d'acidesa (de símbol Ka), ens dona idea, per a cada àcid feble, fins a quin punt es dissocia en dissolució aquosa.
| pKa d'àcids febles[8] | ||||||||
| Àcid | Acètic | Làctic | Carbònic | Fluorhídric | Sulfhídric | Hipoclorós | Cianhídric | |
|---|---|---|---|---|---|---|---|---|
| pKa | 4,76 | 3,08 | 6,35 | 3,20 | 7,05 | 7,40 | 9,21 | |
Àcids polipròtics[modifica]
Els àcids que tenen més d'un hidrogen que es pot dissociar s'anomenen àcids polipròtics. La dissociació d'aquests àcids es realitza hidrogen a hidrogen, havent un equilibri per a cada hidrogen que es dissocia. L'exemple més típic d'àcid polipròtic és l'àcid fosfòric que té tres hidrògens àcids i que es dissocien segons les equacions:
Les constants d'acidesa sempre són majors pel primer hidrogen, de manera que el primer àcid és el més fort i el darrer el més fluix:
Altres àcids polipròtics: àcid sulfúric, H₂SO₄, àcid carbònic, H₂CO₃,...
Àcids inorgànics[modifica]
Àcids binaris[modifica]


Els àcids que no presenten oxigen en la seva estructura s'anomenen àcids binaris o hidràcids. Estan formats per molècules on l'hidrogen es troba enllaçat mitjançant un enllaç covalent a un àtom d'un element químic molt electronegatiu (halògens, sofre…) per la qual cosa l'enllaç està molt polaritzat i es romp fàcilment donant lloc a la dissociació de l'àcid. A les figures adjuntes hi ha els més importants. Els àcids binaris estan formats per un no-metall, concretament F, Cl, Br, I, S, Se i Te, i hidrogen. No contenen oxigen en la molècula.
Nomenclatura[modifica]
Són substàncies gasoses (halurs d'hidrogen, sulfur d'hidrogen…) que s'anomenen àcids quan estan en dissolució aquosa. La terminologia és àcid més l'arrel de l'element no-metall (o un derivat) acabat en hídric, per exemple: HCl(aq) àcid clorhídric.[9]
Formulació i nomenclatura dels anions hidràcids[modifica]
Quan una molècula d'un hidràcid perd un hidrogen o més en forma d'ions H+, es converteix en un anió amb una càrrega negativa igual al nombre d'hidrògens perduts.
- Els anions dels hidràcids s'anomenen substituint la terminació -hídric de l'àcid corresponent per -ur.
Exemple:
F– → ió fluorur
Cl– → ió clorur
Br– → ió bromur
I– → ió iodur
És possible que els àcids sulfhídric, selenhídric i tel·lurhídric perdin únicament un hidrogen e forma d'ió H+.
- Per anomenar aquests anions afegim el prefix hidrogen- al davant del nom de l'anió.
Exemple:
HS– → ió hidrogensulfur
HSe– → ió hidrogenselenur
Fórmula[modifica]
La fórmula d'un hidràcid és la mateixa que la del compost binari corresponent més el subíndex (aq) per indicar que es tracta d'una dissolució aquosa.
Hidràcids més importants[modifica]
Àcid fluorhídric, HF(aq) - àcid clorhídric, HCl(aq) - àcid bromhídric, HBr(aq) - àcid iodhídric, HI(aq) - àcid sulfhídric, H₂S(aq)- àcid cianhídric, HCN(aq)
Oxoàcids o àcid ternaris[modifica]
Els oxoàcids són composts inorgànics on un àtom central electronegatiu es troba enllaçat mitjançant enllaç covalent a diversos oxígens que amb enllaços dobles i simples completant les valències de l'àtom central. Els oxígens que es troben enllaçats mitjançant un enllaç simple a l'àtom central s'enllacen també a un àtom d'hidrogen. Aquest enllaç està molt polaritzat la qual cosa fa que sigui bo de dissociar. Els oxoàcids en la molècula, contenen hidrogen i oxigen.
- La seva fórmula general és HaEbOc, en què H és hidrogen; O és oxigen i E és un no-metall o algun metall de transició com el crom o el manganès. Les lletres a, b i c representen el nombre d'àtoms de cada element presents en la molècula de l'àcid.
- Per anomenar els principals oxoàcids és aconsellable utilitzar la nomenclatura tradicional, acceptada per la IUPAC.
Formulació i nomenclatura dels anions dels oxoàcids[modifica]
Quan una molècula d'un oxoàcid perd hidrògens en forma d'ions H+, es converteix en un anió amb una càrrega negativa al nombre d'ions d'hidrogen perduts.
- Per anomenar els anions dels oxoàcids, se substitueixen les terminacions -ós i -ic dels àcids corresponents per les terminacions -it i -at, respectivament.
Nomenclatura[modifica]
Els oxoàcids segueixen anomenant-se segons la nomenclatura tradicional. Per a posar un nom cal saber el nombre d'oxidació de l'àtom central, el que no és ni oxigen ni hidrogen. En conèixer el nombre d'oxidació s'ha de saber quins valors pot adoptar per l'element en qüestió i aplicar els prefixos i sufixes següents:
- L'element només té 1 valor de nombre d'oxidació: àcid acabat en -ic. Exemple H₂CO₃ àcid carbònic.
-
Àcid carbònic
-
H₂CO₃
- L'element té 2 nombres d'oxidació: pel menor àcid acabat en -ós i pel major en -ic. Exemple H₂SO₃ àcid sulfurós i H₂SO₄ àcid sulfúric.
-
Àcid sulfurós
-
H₂SO₃
-
Àcid sulfúric
-
H₂SO₄
- L'element té 3 nombres d'oxidació: pel menor àcid començat per hipo- i acabat en -ós, pel següent àcid acabat en -ós i pel major en -ic. Exemple H₂N₂O₂ àcid hiponitrós, HNO₂ àcid nitrós, i HNO₃ àcid nítric.
-
Àcid hiponitrós
-
H₂N₂O₂
-
Àcid nitrós
-
HNO₂
-
Àcid nítric
-
HNO₃
- L'element té 4 nombres d'oxidació: pel menor àcid començat per hipo- i acabat en -ós, pel següent àcid acabat en -ós, després àcid acabat en -ic i pel major àcid començat en per- i acabat en -ic. Exemple HClO àcid hipoclorós, HClO₂ àcid clorós, HClO₃ àcid clòric i HClO₄ àcid perclòric.[9]
-
Àcid hipoclorós
-
HClO
-
Àcid clorós
-
HClO₂
-
Àcid clòric
-
HClO₃
-
Àcid perclòric
-
HClO₄
Oxoàcids més importants[modifica]
Àcid arsènic, H₃AsO₄ - Àcid arsenós, H₃AsO₃ - Àcid bòric, H₃BO₃ - Àcid bròmic, HBrO₃ - Àcid carbònic, H₂CO₃ - Àcid clòric, HClO₃ - Àcid clorós, HClO₂ - Àcid cròmic, H₂CrO₄ - Àcid difosfòric, H₂P₂O₇ - Àcid fosfòric, H₃PO₄ - Àcid fosforós, H₃PO₃ - Àcid hipobromós, HOBr(aq) - Àcid hipoclorós, HOCl(aq) - Àcid hipofosforós, H₃PO₂ - Àcid iòdic, HIO₃ - Àcid nítric, HNO₃ - Àcid nitrós, HNO₂ - Àcid perclòric, HClO₄ - Àcid perdisulfúric, H₂S₂O₈ - Àcid periòdic, HIO₄ - Àcid permonosulfúric, H₂SO₅ - Àcid selènic, H₂SeO₄ - Àcid selenós, H₂SeO₃ - Àcid silícic, H₄SiO₄ - Àcid sulfàmic, NH₂SO₃H - Àcid sulfúric, H₂SO₄ - Àcid sulfurós, H₂SO₃ - Àcid tel·lúric, H₂TeO₄ - Àcid tel·lurós, H₂TeO₃
Obtenció[modifica]

Com que a la natura no hi ha jaciments d'àcids inorgànics cal produir-los industrialment. Els tres àcids inorgànics més importants s'obtenen segons els mètodes que es detallen a continuació. La resta d'àcids s'obtenen generalment per reacció d'una de les seves sals amb àcid sulfúric, com ara l'àcid fosfòric, H₃PO₄, que s'obté per reacció de la fosforita amb àcid sulfúric del 70-75%
- Àcid sulfúric, H₂SO₄. L'àcid més important des del punt de vista industrial és l'àcid sulfúric que s'obté actualment mitjançant el mètode de contacte a partir de sofre que s'oxida per a donar triòxid de sofre emprant catalitzadors de platí i pentaòxid de divanadi a uns 500 °C de temperatura. Després el triòxid de sofre es fa reaccionar amb aigua per a donar àcid sulfúric concentrat.
- Àcid nítric, HNO₃. Existeixen diversos mètodes per a la síntesi d'àcid nítric. Actualment predomina el mètode Ostwald, establert pel químic alemany Wilhelm Ostwald, en el qual l'oxidació de l'amoníac es provoca mesclant-lo amb excés d'aire. L'aire s'insufla en cremadors a través de malles tènues de platí, a una temperatura d'uns 780 °C i a pressions de 8 atm. Els vapors d'òxid de nitrogen que es formen es refreden en bescanviadors de calor fins a 20 °C i es dissolen en l'aigua de condensació. Posteriorment, passen a unes torres d'absorció àcida on són rentats amb aigua i oxidats amb aire.
- Àcid clorhídric, HCl. L'àcid clorhídric és un producte industrial molt interessant que es pot obtenir mitjançant dos processos. Un primer procés aprofita la reacció directa de l'àcid sulfúric concentrat i clorur de sodi, NaCl, a una temperatura de 150 °C. La reacció es produeix en uns forns especials dels quals surt el clorur d'hidrogen gasós, amb el sulfat i l'hidrogenosulfat de sodi com a subproductes. El segon procés és més corrent i dona un producte més pur. Aprofita l'alt grau d'afinitat entre l'hidrogen, H₂ i el clor, Cl₂. En cambres de combustió, refrigerades amb aigua, els dos gasos es cremen amb una flama que assoleix temperatures d'uns 2 600 °C. Seguidament, el vapor de clorur d'hidrogen que s'obté d'aquest procés es refreda, tal com succeeix en el primer tipus de procés, i posteriorment es dissol en aigua, la qual cosa genera quantitats considerables de calor.[10]
Aplicacions dels àcids inorgànics[modifica]
- Àcid sulfúric, H₂SO₄. L'àcid sulfúric és l'àcid que s'empra en major quantitat, s'empra en la indústria química per a la preparació d'altres àcids, de sulfats i de carbonats. En la producció de pintures, sulfonació de greixos, en la indústria tèxtil, en la refineria del petroli, en la producció de ferro i acer, en els acumuladors de plom i en la fabricació d'explosius.
- Àcid nítric, HNO₃. L'àcid nítric s'empra en la fabricació d'explosius, colorants, seda artificial, plàstics, fertilitzants i en la fabricació d'àcid sulfúric.
- Àcid clorhídric, HCl. S'empra en la indústria tèxtil, en la dels colorants, per a la neteja dels metalls en la indústria del galvanitzat i de l'estanyat, per a la manufactura l'alambres, en el procés de gravat, en la fabricació de dextrosa, gelatina i sabons, en la purificació d'arenes i argiles per a la fabricació de porcellanes i en l'elaboració de clor, clorurs i derivats.[11]
Àcids orgànics[modifica]

Els àcids carboxílics són els àcids orgànics i es caracteritzen per tenir una funció carboxil, -COOH, unida a una cadena de carbonis. L'hidrogen que té característiques àcides és el de la funció carboxil que està unit a un oxigen, els hidrogen units directament a carbonis que formen part de la cadena no es dissocien i no presenten propietats àcides.
-
Àcid metanoic o fòrmic
-
Àcid etanoic o acètic
-
Àcid propanoic
-
Àcid butanoic

Molts d'àcids carboxílics tenen noms comuns derivats de mots grecs o llatins que indiquen les seves fonts naturals. L'àcid metanoic s'anomena àcid fòrmic (del latí, formica o formiga). L'àcid etanoic s'anomena àcid acètic (del llatí, acetum o vinagre). L'àcid butanoic és un dels responsables de l'olor de la mantega rància, car el seu nom comú és àcid butílic (del llatí, butirum o mantega). L'àcid hexanoic és un dels composts associats amb l'olor de les cabres, d'on prové el nom comú, àcid caproic (del llatí, caper o cabra). L'àcid pentanoic, amb una olor entre la de la mantega rància i el de les cabres s'anomena àcid valèric (del llatí, valerum o fort). L'àcid octadecanoic pren el seu nom comú d'àcid esteàric, de la paraula grega estear, grumeig).
Si s'examinen les constants d'acidesa dels àcids carboxílics s'observa que la majoria tenen un valor de Ka entre 10-4 i 10-5. Això significa que són moderadament forts.[12]
Els àcids fòrmic i acètic tenen un marcat olor agre i un gust característic. Els àcids que tenen de quatre a vuit carbonis tenen olors excepcionalment desagradables. Tanmateix, per repulsius que puguin ser, en petites concentracions milloren molts d'aromes, és el cas del formatge Roquefort que no podria elaborar-se sense àcid valèric. Els cans poden distingir molt bé les mescles d'àcids carboxílics de baixa massa molecular que produïm els humans en el nostre metabolisme. Com que les proporcions de cada àcid són lleugerament diferents per a cada individu i es troben a la pell, els cans poden seguir els rstres de les persones.[13]
Nomenclatura[modifica]
Com tots els compostos orgànics els noms dels àcids es forma assenyalant el nombre de carbonis de la cadena principal amb els prefixos: met- 1 carboni, et- 2 carbonis, prop- 3 carbonis, but- 4 carbonis, etc. i amb el sufix -oic. El nom complet es forma posant al principi la paraula àcid.
Si l'àcid carboxílic té dues funcions carboxil s'indica amb el prefix di-. Per exemple l'àcid comunament anomenat àcid oxàlic és el HOOC-COOH, per tant el seu nom és àcid etanodioic.
Àcids grassos[modifica]
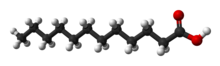


Un àcid gras és un tipus de molècula orgànica lipídica formada per una llarga cadena hidrocarbonada línia, la gran majoria són de nombre parell d'àtoms de carboni i d'entre ells; els més comuns els que tenen 16 i 18,[14] en l'extrem de la qual hi ha un grup carboxil (-COOH). Cada àtom de carboni s'uneix al següent i al precedent per mitjà d'un enllaç covalent senzill.
La fórmula bàsica d'una molècula d'àcid gras saturat és CH₃–(CH₂)n–COOH. A l'àtom del seu extrem li queden lliures tres enllaços que són ocupats per àtoms d'hidrogen (H₃C-). Els altres àtoms tenen lliures dos enllaços, que són ocupats igualment per àtoms d'hidrogen (...-CH₂-CH₂-CH₂-...). Els àcid grassos que a la cadena de carbonis només hi ha enllaços C-C simples se'ls anomena àcids grassos saturats. Si presenten dobles enllaços C=C se'ls anomena àcid grassos insaturats. En general els àcids grassos saturats es troben a les grasses animals, mentre que els insaturats es troben majoritàriament als olis vegetals.
Àcids grassos omega 3[modifica]
Els àcids grassos omega 3 constitueixen una família d'àcids grassos que es caracteritzen per tenir el seu primer doble enllaç (insaturació) a la posició tercera començant pel darrer àtom de carboni. Aquest tret estructural distintiu els atorga unes propietats físiques especials i els converteix en precursors insubstituïbles de molècules que els éssers vius utilitzen per a regular determinades funcions circulatòries.
La principal font alimentària d'aquests àcids grassos (i l'única que en conté quantitats nutricionalment significatives) és el peix blau; més concretament el seu greix i el seu oli. Actualment però, aquests àcids grassos han estat incorporats de manera artificial en altres aliments (com ara ous i làctics), oferint fonts alimentàries complementàries al peix blau per a la seva ingesta.
Aminoàcids[modifica]

Els aminoàcids són unes molècules que contenen un grup carboxil i un grup amino. Químicament són molt diversos. N'hi ha que formen part de proteïnes (proteics), mentre que d'altres mai s'hi presenten. Tots els aminoàcids que componen proteïnes presenten un carboni asimètric anomenat alfa on hi enllaça el grup carboxil, el grup amino, un hidrogen i un radical que és el que varia en cada aminoàcid. És aquesta mena de partícules a les que per antonomàsia la gent sol fer referència en parlar d'aminoàcids.
Aplicacions dels àcids carboxílics[modifica]
- El més important dels àcids carboxílics quant a la seva utilització és l'àcid acètic, que s'empra com a reactiu i com a dissolvent tant en processos industrials com de laboratori.
- Els àcids carboxílics s'empren en alimentació com a conservants, per donar un pH àcid al medi. Exemples amb el codi: Àcid sòrbic (E-200), àcid propiònic (E-280), àcid acètic (E-260), àcid màlic (E-266), àcid fumàric (E-267).
- Són emprats en síntesi orgànica per a l'obtenció d'altres compostos, ja que són molt reactius.[15]
Pluja àcida[modifica]

La pluja àcida és el fenomen consistent en una pluja que cau amb uns nivells de pH inferiors als normals. La pluja normalment presenta un pH d'aproximadament 5,6 (lleugerament àcid) a causa de la presència del CO₂ atmosfèric, que forma àcid carbònic, H₂CO₃. Es considera que és pluja àcida si presenta un pH inferior a 5, i pot arribar al pH del vinagre (pH 3).
Els causants de la pluja acida són el diòxid de sofre (SO₂) i els òxids de nitrogen (N₂O₃ i N₂O₅) que es generen amb la combustió dels combustibles fòssils, i que en combinació amb la humitat i l'aigua de la pluja produeixen microgotetes d'àcid sulfúric (H₂SO₄) i àcid nítric (HNO₃) que cremen les fulles de la vegetació i per això afecta bàsicament els ecosistemes vegetals, com ara els boscos, tot i que pot arribar a afectar també llacs i embassaments.
És un fenomen que al llarg de la història de la Terra havia ocorregut molts de cops de manera espontània com per exemple a causa de les erupcions volcàniques però que s'han vist accelerades i sovintegen d'ençà que l'era industrial ha dut a terme una crema en massa dels recursos de matèria orgànica del planeta. Els efectes de la pluja contaminada, poden convertir un exuberant bosc en un cementiri de troncs morts. El diòxid de sofre i els òxids de nitrogen que cauen en forma de pluja, s'instal·len sobre les fulles dels vegetals i actuen com un àcid perforant i matant al seu pas les plantes, arbres, flors...
Referències[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: àcids |
- ↑ Alcover, A.M.; Moll, F. de B.. Diccionari català-valencià-balear. Palma: Moll, 1962. Arxivat 2004-08-26 a Wayback Machine.
- ↑ Arrhenius, S.A. «On the Dissociation of Substances Dissolved in Water» (en anglès, traducció). Zeitschrift fur physikalische Chemie, I, 1887, pàg. 631.
- ↑ Brønsted, J.N. «Some Remarks on the Concept of Acids and Bases» (en anglès, traducció de l'original en francès). Recueil des Travaux Chimiques des Pays-Bas [Països Baixos], 42, 1923, pàg. 718-728.
- ↑ Lowry, T.M Chem. Ind. [Londres], 42, 43, 1923.
- ↑ Lewis, G.N.. Valence and the Structure of Molecules (en anglès). Nova York: The Chemical Catalogue Co., 1923.
- ↑ Babor, J.A.; Ibarz, J. Química General Moderna (en castellà). 8a ed.. Barcelona: Marín, 1979. ISBN 84-7102-997-9.
- ↑ Babor, J.A.; Ibarz, J. Química General Moderna (en castellà). 8a ed.. Barcelona: Marín, 1979, p. 417-418. ISBN 84-7102-997-9.
- ↑ Glasstone, S. Termodinámica para químicos (en castellà). 5a ed.. Madrid: Aguilar, 1977. ISBN 84-03-20059-5.
- ↑ 9,0 9,1 Sales, J.; Vilarrasa, J.. Introducció a la nomenclatura química. Reverté, 2003. ISBN 8429175512.
- ↑ Enciclopèdia Catalana. Proa enciclopèdia catalana temàtica, 2001. ISBN 8441226938.
- ↑ Cuevas, A. [et al.].. Química II. Umbral. ISBN 9685607206.
- ↑ Solomons, T.W.G. Química orgánica (en castellà). Mèxic: Limusa, 1982. ISBN 968-18-0982-3.
- ↑ Allinger, N.L [et al.].. Química orgánica (en castellà). I. Barcelona: Reverté, 1984. ISBN 84-291-7016-2.
- ↑ Marcel Mayol. Fonaments i Tècniques d'Anàlisi Bioquímica.
- ↑ Gorchs, R.; Galán, A. Química orgànica. Estudi, reactivitat i aplicació dels principals compostos. Barcelona: Edicions UPC, 2003. ISBN 8483017393.
















![{\displaystyle K_{a}={\frac {[A^{-}]\cdot [H_{3}O^{+}]}{[AH]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d7591c3a32250655f5e88b6867c795c1c4060293)