Radi atòmic

El radi atòmic és la meitat de la distància entre els nuclis dels àtoms veïns idèntics en la forma sòlida d'un element.

Segons la visió de la mecànica quàntica, els àtoms no tenen cap forma o grandària rígida i, per tant, la qüestió del radi atòmic senzillament no es planteja en el sentit veritable del terme. No obstant això, l'experiència química suggereix que els àtoms tenen una grandària efectiva, ja que no poden acostar-se més enllà d'una certa distància límit sota la influència de les forces que intervenen en les interaccions químiques. La determinació dels radis atòmics, basada en el model d'aproximació que l'àtom té forma d'esfera indeformable (esfera rígida), té una història que es remunta al treball del físic britànic W. Lawrence Bragg (1890-1971), a la dècada de 1920,[2] i al treball de l'estatunidenc John C. Slater (1900-1976) el 1964.[3][4] A partir d'aquest model, els cristal·lògrafs han publicat sèries de radis atòmics amb l'única finalitat de reproduir la distància mínima de separació entre àtoms i ions en xarxes cristal·lines. Investigadors primerencs com el suís Victor M. Goldschmidt (1888-1947), els estatunidencs Linus C. Pauling (1901-1994) i William H. Zachariasen (1806-1880) i el britànic W. Lawrence Bragg observaren una aproximació additiva dels radis atòmics. No obstant això, la distància entre àtoms depèn del tipus de cristall, la seva modificació al·lotròpica, el nombre de coordinació, la temperatura, etc.[4]

El valor dels radis atòmics depèn del tipus d'enllaç químic en què estan involucrats els àtoms (enllaç metàl·lic, iònic o covalent). Quan els àtoms veïns no són similars, com en el cas del clorur de sodi , una part de la distància observada entre els àtoms s'atribueix a un tipus d'àtom i la resta a l'altre tipus. El radi dels àtoms de sodi units en un tros de metall de sodi és més gran que el radi del sodi en el compost clorur de sodi. En el clorur de sodi, cada àtom de sodi ha perdut un electró per convertir-se en un catió de sodi de càrrega positiva . D'altra banda, cada àtom de clor ha guanyat un electró per convertir-se en un anió clorur de càrrega negativa . El radi del clor és gairebé el doble que el radi d'un àtom de clor neutre. En aquests casos es parla de radis iònics. L'enllaç entre el parell d'àtoms de clor en una molècula de diclor i entre els àtoms de carboni en el diamant són exemples d'enllaços covalents. En aquests i altres casos similars, el radi atòmic es designa com a radi covalent.[5]
Per altra banda, emprant la mecànica quàntica es poden fer càlculs teòrics per determinar el radi atòmic. En aquest cas, el químic canadenc Russell J. Boyd (1945) establí el 1977 que l'esfera de l'àtom es pot considerar que acaba quan la densitat electrònica disminueix fins a 0,001 electrons/, on és el radi de Bohr, i que equival a 0,675 electrons/nm³. Els resultats obtinguts són semblants als radis de van der Waals (la meitat de la mínima distància que separa els nuclis de dos àtoms adjacents no enllaçats.) calculats experimentalment.[6][7]

Variació dins la taula periòdica[modifica]
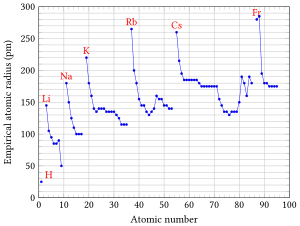
El concepte de radi atòmic s'ha demostrat molt útil per comprendre, explicar, correlacionar i fins i tot predir moltes propietats físico-químiques dels àtoms, ions i molècules. La periodicitat de les propietats químiques i físiques dels elements s'ha reconegut des dels primers moments de la història de la química. La corba de volum atòmic del químic alemany Julius Lothar Meyer (1830-1895) fou un exemple impressionant de la periodicitat de les propietats físiques dels elements. La grandària atòmica també ha estat una propietat periòdica important dels elements. Els valors dels radis atòmics són una entrada rellevant en molts càlculs de propietats físico-químiques dependents de la grandària dels àtoms aïllats.[4]
Malgrat que hi ha grans discrepàncies en els valors determinats per diferents investigadors, el radi atòmic d'un element en totes elles augmenta de dalt a baix i de dreta a esquerra en la taula periòdica. L'explicació d'aquesta tendència es troba en el fet que la força d'atracció electroestàtica que el nucli de l'àtom exerceix sobre els electrons és major al final de cada període, atès que hi ha més protons al nucli i més electrons als orbitals. Com que les càrregues elèctriques oposades s'atreuen, en haver-hi més càrrega hi ha una atracció més gran. Per tant, els electrons dels àtoms dels elements que es troben més a la dreta es troben més atrets pel nucli, de manera que, com que el nombre de nivells en el qual s'enllacen els àtoms és el mateix, el radi disminueix. Per exemple el radi del potassi val 234 pm segons càlculs teòrics i va disminuint en avançar dins del període fins a arribar als 212 pm del criptó.[7]
Paral·lelament a això, en cada període augmenta en una unitat el nombre de capes en les quals es distribuïxen els electrons de l'àtom, de manera que els àtoms dels elements de major període tenen major radi. És el cas dels halògens que el radi augmenta de 163 pm al fluor fins als 247 de l'àstat.[7]
| Grup | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Període | |||||||||||||||||||
| 1 | H 154 |
He 134 | |||||||||||||||||
| 2 | Li 220 |
Be 219 |
B 205 |
C 190 |
N 179 |
O 171 |
F 163 |
Ne 156 | |||||||||||
| 3 | Na 225 |
Mg 240 |
Al 239 |
Si 232 |
P 223 |
S 214 |
Cl 206 |
Ar 197 | |||||||||||
| 4 | K 234 |
Ca 270 |
Sc 263 |
Ti 257 |
V 252 |
Cr 233 |
Mn 242 |
Fe 226 |
Co 222 |
Ni 219 |
Cu 217 |
Zn 222 |
Ga 233 |
Ge 234 |
As 231 |
Se 224 |
Br 219 |
Kr 212 | |
| 5 | Rb 240 |
Sr 279 |
Y 274 |
Zr 268 |
Nb 251 |
Mo 244 |
Tc 241 |
Ru 237 |
Rh 233 |
Pd 215 |
Ag 225 |
Cd 238 |
In 246 |
Sn 248 |
Sb 246 |
Te 242 |
I 238 |
Xe 232 | |
| 6 | Cs 249 |
Ba 293 |
* | Lu 270 |
Hf 264 |
Ta 258 |
W 253 |
Re 249 |
Os 244 |
Ir 233 |
Pt 230 |
Au 226 |
Hg 229 |
Tl 242 |
Pb 249 |
Bi 250 |
Po 250 |
At 247 |
Rn 243 |
| 7 | Fr 258 |
Ra 292 |
** | Lr |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og |
| * | La 284 |
Ce 282 |
Pr 286 |
Nd 284 |
Pm 283 |
Sm 280 |
Eu 280 |
Gd 277 |
Tb 276 |
Dy 275 |
Ho 273 |
Er 272 |
Tm 271 |
Yb 277 | |||||
| ** | Ac 293 |
Th 289 |
Pa 285 |
U 283 |
Np 280 |
Pu 278 |
Am 276 |
Cm 264 |
Bk |
Cf |
Es |
Fm |
Md |
No | |||||
Referències[modifica]
- ↑ Shannon, R. D. «Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides». Acta Crystallographica Section A, 32, 5, 01-09-1976, pàg. 751-767. DOI: 10.1107/S0567739476001551. ISSN: 0567-7394.
- ↑ Bragg, W. Lawrence «XVIII. The arrangement of atoms in crystals». The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 40, 236, 1920-08, pàg. 169–189. DOI: 10.1080/14786440808636111. ISSN: 1941-5982.
- ↑ 3,0 3,1 Slater, J. C. «Atomic Radii in Crystals». The Journal of Chemical Physics, 41, 10, 02-07-2004, pàg. 3199–3204. DOI: 10.1063/1.1725697. ISSN: 0021-9606.
- ↑ 4,0 4,1 4,2 Ghosh, Dulal C.; Biswas, Raka «Theoretical Calculation of Absolute Radii of Atoms and Ions. Part 1. The Atomic Radii» (en anglès). International Journal of Molecular Sciences, 3, 2, 2002-02, pàg. 87–113. DOI: 10.3390/i3020087. ISSN: 1422-0067.
- ↑ «atomic radius» (en anglès). Encyclopædia Britannica, 2003.
- ↑ Boyd, R J «The relative sizes of atoms». Journal of Physics B: Atomic and Molecular Physics, 10, 12, 21-08-1977, pàg. 2283–2291. DOI: 10.1088/0022-3700/10/12/007. ISSN: 0022-3700.
- ↑ 7,0 7,1 7,2 7,3 Rahm, Martin; Hoffmann, Roald; Ashcroft, N. W. «Atomic and Ionic Radii of Elements 1 –96» (en anglès). Chemistry – A European Journal, 22, 41, 04-10-2016, pàg. 14625–14632. DOI: 10.1002/chem.201602949. ISSN: 0947-6539.








