Nombre atòmic
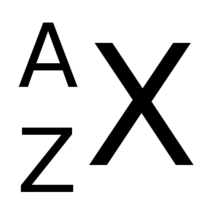
El nombre atòmic, representat per , és el nombre de protons presents en el nucli atòmic.
Els àtoms de diferents elements tenen diferents nombres d'electrons i protons. Un àtom en el seu estat natural és neutre i té un nombre igual d'electrons i protons. Per exemple: un àtom de sodi (Na), que té un nombre atòmic d'11; té 11 electrons i 11 protons. Un àtom de magnesi (Mg), que té un nombre atòmic 12, té 12 electrons i 12 protons; i un àtom d'urani (U), que té un nombre atòmic de 92, té 92 electrons i 92 protons.
El símbol prové de la paraula alemanya Zahl, que significa ‘nombre’, i s'utilitzava com abreviació en els texts en alemany. La referència més antiga cal cercar-la al llibre d'Arnold Sommerfeld Atombau und Spektrallinien del 1919.[1][2] El nombre atòmic es col·loca com a subíndex a l'esquerra del símbol de l'element corresponent. Per exemple, els àtoms de l'element hidrogen, que tenen 1 protó i Z = 1; s'expressarien com 1H; els de l'heli tenen 2 protons i Z = 2, és a dir: ₂He.
Història[modifica]

Els raigs X[modifica]
A la darrera dècada del segle xix, el físic alemany Wilhelm Röntgen (1845-1923) descobrí una nova forma de radiació penetrant emesa des de tubs de descàrrega quan els raigs catòdics d'alta energia impactaven en un ànode metàl·lic. La naturalesa d'aquests misteriosos ‘raigs X’ restà matèria de debat intens al primer decenni del segle xx. El físic anglès Charles G. Barkla (1877-1944) observà que es produïen ‘raigs X secundaris’ quan els raigs primaris xocaven contra un element; i que l'emissió secundària contenia un component ‘característic’ de l'element en el sentit que els raigs X de diferents elements tenien diferents capacitats de penetració a través de làmines metàl·liques primes. Barkla també descobrí que un mateix element podia emetre, de fet, dos tipus diferents de raigs X característics: uns més penetrants (durs) i uns menys penetrants (més suaus). Els físics alemanys Walter Friedrich (1883-1968) i Paul Knipping (1883-1935) veren que es formava un patró de taques quan els raigs X d'un tub de Crookes passaven a través d'un cristall fins a una placa fotogràfica, essent els primers experiments amb sulfat de coure(II) i sulfur de zinc. Després dels descobriments de Röntgen, hi havia hagut especulacions contínues sobre si els raigs X eren corpusculars o eren una forma de radiació electromagnètica ondulatòria d'alta energia. El físic alemany Max von Laue (1879-1960) proporcionà una explicació dels patrons de taques en termes d'efectes d'interferència d'ones electromagnètiques de longitud d'ona curta, fet que finalment el portà a rebre el Premi Nobel de Física el 1914.[3]

Experiment de Rutherford[modifica]
El físic alemany Hans Geiger (1882-1945) i l'anglès Ernest Marsden (1889-1970), que treballaven sota la direcció del físic neozelandès Ernest Rutherford (1871-1937) a la Universitat de Manchester, demostraren que les partícules α d'alta energia podien ser dispersades a grans angles quan impactaven en làmines d'or ultra primes.[4] Rutherford dissenyà una teoria de dispersió que requeria que la potència de dispersió P fos proporcional al quadrat de la càrrega positiva Q que suposà concentrada al centre de l'àtom. Per tant, Geiger i Marsden realitzaren un segon conjunt d'experiments on mesuraren la retrodispersió de partícules α en una sèrie de làmines d'elements diferents, des de carboni fins a or. L'opinió consensuada a Manchester en aquell moment era que la càrrega positiva Q era la meitat de la massa atòmica A (Q = A/2), i en conseqüència, Geiger i Marsden analitzaren les seves dades de dispersió dividint la potència de dispersió per àtom P per A2, essent A2 = Q2×4, esperant trobar una constant. Els valors de P/A2 no foren constants i s'atribuí a errors experimentals, tot i que hi havia indicis que P/A2 disminuïa amb l'augment de la massa atòmic.[3]

Hipòtesi de Van den Broek[modifica]
L'holandès Antonius Johannes Van den Broek (1879-1926), advocat de professió i físic aficionat que es mantenia al marge del corrent científic, el 1907 publicà que havia observat que el número d'ordre d'un element químic a la taula periòdica (actualment simbolitzat Z), on s'ordenaven els elements per ordre creixent de massa atòmica A, correspon aproximadament a la massa atòmica dividida per 2 (Z ≈ A/2).[5] Van den Broek havia desenvolupat les seves pròpies idees sobre la millor manera d'organitzar la taula periòdica. Els documents clau que introdueixen la idea del nombre atòmic se centraren en les dades de dispersió del Cu, Ag, Sn, Pt i Au publicades per Geiger i Marsden.[4][3] Les posicions a la taula periòdica dels elements més pesants (i en alguns casos les masses atòmics) estaven lluny de ser correctes, però reconeixent que la massa atòmica per a la majoria dels elements més pesants és poc més del doble del nombre ordinal Z, analitzà les dades de dispersió dividint la potència de dispersió per Z2 × 5,4 (√5,4 = 2,32) i argumentà que això produïa molta menys dispersió que usar A2. Van den Broek exclogué les dades de dispersió de l'alumini de la seva anàlisi. L'alumini clarament representava un valor atípic important que no s'ajustava als seus arguments: una anàlisi estadística senzilla demostra que la desviació tipus de la constant és en realitat més gran quan Z substitueix A si les dades de dispersió per a l'alumini s'inclouen en l'anàlisi. Retrospectivament, hom s'adona que Van den Broek arribà a la resposta correcta per motius equivocats.[3]
El nucli atòmic[modifica]

Els experiments de Geiger i Marsden portà Rutherford a proposar el març de 1911[7] un model d'estructura atòmica on la càrrega positiva estava concentrada en un petit «nucli», el qual era molt més petit que l'àtom. Això contrastava amb el model anterior de J.J. Thomson, presentat entre 1904 i 1907, on els electrons de càrrega negativa estaven incrustats dins d'un fons esponjós de càrrega positiva amb una grandària igual a la de l'àtom. Unes setmanes després de l'anunci de Rutherford, Van den Broek envià una carta a la revista Nature[8] on exposà la hipòtesi que la posició d'un element a la taula periòdica es corresponia amb la càrrega elèctrica del seu nucli atòmic en unitats de càrrega elemental (Z = Q), i que la massa atòmica era propera al doble d'aquest nombre (A ≈ 2×Z). Però Rutherford no li donà suport, en part perquè provenia d'un advocat, no d'un científic professional. Davant l'oposició de Rutherford, Van den Broek renuncià a la relació amb la massa atòmica en una carta a Nature el 1913, però mantingué que el número de la posició a la taula periòdica es corresponia amb la càrrega nuclear en unitats de càrrega elemental (Z = Q).[9]

Confirmació[modifica]
Poques setmanes després el químic anglès Frederik Sodyy, (1877-1956) que havia treballat amb Rutherford, publicà una carta a la mateixa revista indicant que la hipòtesi de Van den Broek podia explicar les lleis de desplaçament radioactiu (lleis de Soddy-Fajans)[11] i Rutherford canvià d'opinió i acceptà la hipòtesi de Van den Broek.[12]
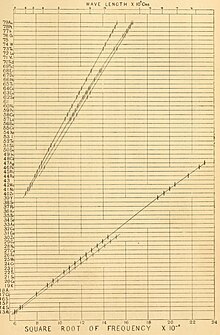
El mateix 1913 el físic anglès Henry Moseley (1887-1915) estudià l'espectre de raigs X dels elements, en concret les línies Kα, i comprovà que hi havia una relació entre la longitud d'ona o la freqüència i el número que ocupava l'element en qüestió a la taula periòdica. La llei de Moseley diu que l'arrel quadrada de la freqüència dels raigs X emesos pels elements és proporcional a la posició que ocupen els elements a la taula periòdica :
Moseley deixà buits per elements encara no descoberts, però predits per Dmitri I. Mendeléiev (1834-1907) en la seva taula periòdica, i mantingué l'ordre d'elements d'acord amb les seves propietats, com havia fet Mendeléiev, i no per estricte ordre de les seves masses atòmiques.[3] D'aquesta manera confirmà la hipòtesi de Van den Broek i anomenà nombre atòmic al nombre ordinal de cada element a la taula periòdica.[6][10]
Nombres atòmics dels elements[modifica]
Relació dels elements per ordre alfabètic amb els seus nombres atòmics:
Vegeu també[modifica]
Referències[modifica]
- ↑ Jensen, William B. «The Origins of the Symbols A and Z for Atomic Weight and Number» (en anglès). Journal of Chemical Education, 82, 12, 2005-12, pàg. 1764. DOI: 10.1021/ed082p1764. ISSN: 0021-9584.
- ↑ Arnold Sommerfeld. Atombau und Spektrallinien (en alemany). F. Vieweg & Sohn, 1921.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 Egdell, Russell G.; Bruton, Elizabeth «Henry Moseley, X-ray spectroscopy and the periodic table» (en anglès). Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences, 378, 2180, 18-09-2020, pàg. 20190302. DOI: 10.1098/rsta.2019.0302. ISSN: 1364-503X.
- ↑ 4,0 4,1 Geiger, H.; Marsden, E. «On a diffuse reflection of the α-particles» (en anglès). Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character, 82, 557, 31-07-1909, pàg. 495–500. DOI: 10.1098/rspa.1909.0054. ISSN: 0950-1207.
- ↑ van den Broek, A.J. «Das α-Teilchen und das periodische System der Elemente». Annalen der Physik, 4, 23, 1907, pàg. 199–203.
- ↑ 6,0 6,1 Moseley, H.G.J. «XCIII. The high-frequency spectra of the elements» (en anglès). The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 26, 156, 1913-12, pàg. 1024–1034. DOI: 10.1080/14786441308635052. ISSN: 1941-5982.
- ↑ Rutherford, E. «LXXIX. The scattering of α and β particles by matter and the structure of the atom». The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 21, 125, 01-05-1911, pàg. 669–688. DOI: 10.1080/14786440508637080. ISSN: 1941-5982.
- ↑ Van Den Broek, A. «The Number of Possible Elements and Mendeléff's “Cubic” Periodic System» (en anglès). Nature, 87, 2177, 1911-07, pàg. 78. DOI: 10.1038/087078b0. ISSN: 1476-4687.
- ↑ Van Der Broek, A. «Intra-atomic Charge» (en anglès). Nature, 92, 2300, 1913-11, pàg. 372–373. DOI: 10.1038/092372c0. ISSN: 1476-4687.
- ↑ 10,0 10,1 Moseley, H.G.J. «LXXX. The high-frequency spectra of the elements. Part II» (en anglès). The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 27, 160, 1914-4, pàg. 703–713. DOI: 10.1080/14786440408635141. ISSN: 1941-5982.
- ↑ Soddy, Frederick «The Structure of the Atom» (en anglès). Nature, 92, 2303, 1913-12, pàg. 452. DOI: 10.1038/092452c0. ISSN: 1476-4687.
- ↑ Kumar, Manjit.. Quántum : Einstein, Bohr y el gran debate sobre la naturaleza de la realidad. 2a ed. Barcelona: Editorial Kairos, 2012. ISBN 9788472459014.



