Gas noble
| Grup → | 18 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ Període | |||||||||||
| 1 | 2 He | ||||||||||
| 2 | 10 Ne | ||||||||||
| 3 | 18 Ar | ||||||||||
| 4 | 36 Kr | ||||||||||
| 5 | 54 Xe | ||||||||||
| 6 | 86 Rn | ||||||||||
| 7 | 118 Og | ||||||||||
| |||||||||||
Els gasos nobles són un grup d'elements químics que tenen propietats similars. En condicions estàndard, són gasos inodors, incolors, monoatòmics i de molt baixa reactivitat. Els sis gasos nobles presents a la natura són l'heli (He), el neó (Ne), l'argó (Ar), el criptó (Kr), el xenó (Xe) i el radó (Rn), que és radioactiu. L'oganessó (Og), un element sintètic del qual encara no s'han estudiat les propietats químiques, podria ser un gas noble o, al contrari, trencar la tendència a causa dels efectes relativistes.
En els sis primers períodes de la taula periòdica, els gasos nobles coincideixen exactament amb els membres del grup 18. Són molt poc reactius excepte en determinades condicions extremes.
Les propietats dels gasos nobles estan ben explicades per les teories modernes de l'estructura atòmica; es considera que la seva capa exterior d'electrons de valència està «plena», fent que tinguin poca tendència a participar en reaccions químiques, i només s'han elaborat uns quants centenars de compostos de gasos nobles. Els punts de fusió i d'ebullició dels gasos nobles són propers, i difereixen en menys de 10 °C; per consegüent, només són líquids en un interval de temperatures molt petit.
El neó, l'argó, el criptó i el xenó s'obtenen a partir de l'aire mitjançant els mètodes de liqüefacció de gasos i destil·lació fraccionada. L'heli se sol separar del gas natural, i el radó s'obté de la desintegració radioactiva de compostos dissolts de radi. Els gasos nobles tenen diverses aplicacions importants en indústries com ara la il·luminació, la soldadura i l'exploració espacial. Els bussos de gran profunditat utilitzen una mescla de gasos d'heli i nitrogen a profunditat com a gas respirable, per evitar patir toxèmia d'oxigen, l'efecte letal de l'oxigen a alta pressió, i el mal de fondària, l'efecte narcòtic del nitrogen a l'aire per sobre del llindar de pressió parcial. Després que el risc causat per la inflamabilitat de l'hidrogen es fes evident, fou substituït per heli als dirigibles i globus.
Història
[modifica]«Gas noble» és la traducció del mot alemany Edelgas, utilitzat per primer cop el 1898 per Hugo Erdmann[1] en referència a la seva reactivitat extremament baixa. El terme traça una analogia amb el terme «metalls nobles», com ara l'or, que estaven associats amb la riquesa i la noblesa, i també tenen una reactivitat baixa. Els gasos nobles també han estat denominats «gasos inerts», però aquest nom és actualment obsolet, car es coneixen molts compostos de gasos nobles.[2] «Gasos rars» és un altre terme que ha estat utilitzat,[3] però també és erroni, car l'argó forma una part bastant considerable (0,94% en volum, 1,3% en massa) de l'atmosfera terrestre.[4]

Pierre Janssen i Joseph Norman Lockyer foren els primers a descobrir un gas noble el 18 d'agost del 1868, mentre observaven la cromosfera del Sol, i l'anomenaren heli en referència al mot grec per dir «sol», ήλιος (helios).[5] Abans d'ells, el 1784, el químic i físic Henry Cavendish havia descobert que l'aire conté una petita proporció d'una substància menys reactiva que el nitrogen.[6] Un segle més tard, el 1895, Lord Rayleigh descobrí que mostres de nitrogen de l'aire tenien una densitat diferent de la del nitrogen que resultava de reaccions químiques. Juntament amb el científic William Ramsay a l'University College de Londres, Lord Rayleigh teoritzà que el nitrogen extret de l'aire estava barrejat amb un altre gas, duent a un experiment que aïllà amb èxit un nou element, l'argó, del mot grec αργός (argós, 'inactiu').[6] Amb aquest descobriment, s'adonaren que mancava una classe sencera de gasos a la taula de periòdica. Durant la seva recerca d'argó, Ramsay també aconseguir aïllar heli per primer cop escalfant cleveïta, un mineral. El 1902, havent acceptat les proves pels elements heli i argó, Dmitri Mendeléiev inclogué aquests gasos nobles com el grup 0 de la seva disposició dels elements, que més tard esdevindria la taula periòdica.[7]
Ramsay continuà buscant aquests gasos utilitzant el mètode de destil·lació fraccionada per separar aire líquid en diversos components. El 1898, descobrí els elements criptó, neó i xenó, i els anomenà en referència als mots grecs κρυπτός (kriptós, 'amagat'), νέος (neos, 'nou') i ξένος (xenos, 'desconegut'), respectivament. El radó fou identificat per primer cop el 1898 per Friedrich Ernst Dorn,[8] i fou anomenat «emanació de radi», però no se'l considerà un gas noble fins al 1904, quan es descobrí que les seves característiques eren similars a la de la resta de gasos nobles.[9] Rayleigh i Ramsay reberen els Premis Nobel del 1904 de Física i Química, respectivament, pel seu descobriment dels gasos nobles;[10][11] citant J. E. Cederblom, aleshores president de la Reial Acadèmia de les Ciències de Suècia, «el descobriment d'un grup d'elements completament nou, del qual no s'havia conegut ni un sol representant amb certesa, és quelcom de totalment únic en la història de la química, sent intrínsecament un avenç científic de particular importància».[11]
El descobriment dels gasos nobles contribuí al desenvolupament d'una comprensió general de l'estructura atòmica. El 1895, el químic francès Henri Moissan intentà formar una reacció entre el fluor, l'element més electronegatiu, i l'argó, un dels gasos nobles, però fracassà. Els científics foren incapaços de preparar compostos d'argó fins a finals del segle xx, però aquests intents contribuïren a desenvolupar noves teories de l'estructura atòmica. Aprenent d'aquests experiments, el físic danès Niels Bohr suggerí el 1913 que els electrons dels àtoms estan distribuïts en capes que envolten el nucli, i que en tots els gasos nobles tret de l'heli, la capa exterior sempre conté vuit electrons.[9] El 1916, Gilbert Newton Lewis formulà la regla de l'octet, que concloïa que un octet d'electrons a la capa exterior era la configuració més estable per qualsevol àtom; aquesta configuració fa que no reaccionin amb altres elements, car no necessiten més electrons per omplir la capa exterior.[12]
No fou fins al 1962 que Neil Bartlett descobrí el primer compost químic d'un gas noble, l'hexafluoroplatinat de xenó.[13] Poc després es descobriren compostos d'altres gasos nobles: el 1962 li tocà al radó amb el fluorur de radó,[14] i el 1963 al criptó, amb el difluorur de criptó (KrF₂).[15] El primer compost estable d'argó fou observat el 2000, quan es formà fluorohidrur d'argó (HArF) a una temperatura de 40K.[16]
Al desembre de 1998, científics de l'Institut de Recerca Nuclear de Dubna (Rússia) bombardejaren plutoni (Pu) amb calci (Ca) per produir un únic àtom de l'element 114,[17] al qual donaren el nom temporal d'ununquadi (Uuq) (actualment conegut com a 'flerovi').[18] Experiments químics preliminars han indicat que aquest element podria ser el primer element superpesant a presentar propietats anormals semblants a les dels gasos nobles, tot i que és un membre del grup 14 de la taula periòdica.[19] A l'octubre del 2006, científics de l'Institut de Recerca Nuclear i el Laboratori Nacional Lawrence Livermore aconseguiren sintetitzar l'oganessó (Og), el setè element del grup 18,[20] bombardejant californi (Cf) amb calci (Ca).[21]
Propietats físiques i atòmiques
[modifica]| Propietat[9][22] | Heli | Neó | Argó | Criptó | Xenó | Radó |
|---|---|---|---|---|---|---|
| Densitat (g/dm³) | 0,1786 | 0,9002 | 1,7818 | 3,708 | 5,851 | 9,97 |
| Punt d'ebullició (K) | 4,4 | 27,3 | 87,4 | 121,5 | 166,6 | 211,5 |
| Punt de fusió (K) | 0,95[23] | 24,7 | 83,6 | 115,8 | 161,7 | 202,2 |
| Calor de vaporització (kJ/mol) | 0,08 | 1,74 | 6,52 | 9,05 | 12,65 | 18,1 |
| Solubilitat en aigua a 20 °C (cm³/kg) | 8,61 | 10,5 | 33,6 | 59,4 | 108,1 | 230 |
| Nombre atòmic | 2 | 10 | 18 | 36 | 54 | 86 |
| Radi atòmic (calculat) (pm) | 31 | 38 | 71 | 88 | 108 | 120 |
| Energia d'ionització (kJ/mol) | 2.372 | 2.080 | 1.520 | 1.351 | 1.170 | 1.037 |
| Electronegativitat d'Allen | 4,16 | 4,79 | 3,24 | 2,97 | 2,58 | 2,60 |
Els gasos nobles tenen una força interatòmica feble, i per tant tenen un punt de fusió i d'ebullició molt baixos. Tots són gasos monoatòmics en condicions estàndard, incloent-hi els elements amb una massa atòmica més gran que la d'elements normalment sòlids.[9] L'heli té diverses qualitats úniques en comparació amb altres elements: els seus punts d'ebullició i de fusió són més baixos que els de qualsevol altra substància coneguda; és l'únic element conegut que presenti superfluïdesa; és l'únic element que no es pot solidificar per refredament en condicions estàndard - cal aplicar-hi una pressió de 25 atm a una temperatura de 0,95 K per convertir-lo en sòlid.[24] Els gasos nobles fins al xenó tenen múltiples isòtops estables. El radó manca d'isòtops estables; el seu isòtop més longeu, 222Rn, té un període de semidesintegració de 3,8 dies i es desintegra per formar heli i poloni, que finalment es desintegra en plom.[9]

Els àtoms de gasos nobles, com els àtoms de la majoria de grups, augmenten constantment en radi atòmic d'un període al següent, a causa del nombre creixent d'electrons. La mida de l'àtom està relacionada amb diverses propietats. Per exemple, el potencial d'ionització minva amb el creixement del radi, car els electrons de valència dels gasos nobles més grans es troben més lluny del nucli i per tant no estan subjectes tan fermament a l'àtom. Els gasos nobles tenen el potencial d'ionització més elevat dels elements de cada període, cosa que reflecteix l'estabilitat de la seva configuració electrònica i està relacionada amb la seva manca relativa de reactivitat.[22] Tanmateix, alguns dels gasos nobles més pesants tenen un potencial d'ionització prou baix com per comparar-lo amb el d'altres elements i molècules. Fou el coneixement que el xenó té un potencial d'ionització semblant al de la molècula d'oxigen el que conduí Bartlett a intentar oxidar el xenó utilitzant hexafluorur de platí, un agent oxidant que se sabia que era prou fort com per reaccionar amb l'oxigen.[13] Els gasos nobles no poden acceptar un electró per formar anions estables; és a dir, tenen una afinitat electrònica negativa.[25]
Les propietats físiques macroscòpiques dels gasos nobles estan dominades per forces de Van der Waals febles entre els àtoms. La força d'atracció augmenta amb la mida de l'àtom com a resultat de l'augment de la polaritzabilitat i la reducció del potencial d'ionització. Això resulta en tendències sistemàtiques de grup; a mesura que es baixa pel grup 18, el radi atòmic, i amb ell les forces interatòmiques, creix, resultant en un punt de fusió, un punt d'ebullició, una calor de vaporització i una solubilitat més elevats. L'increment en densitat es deu a la massa atòmica.[22]
En condicions estàndard, els gasos nobles són gairebé gasos ideals, però la seva desviació de la llei dels gasos ideals proporcionà pistes importants per l'estudi de les interaccions intermoleculars. El potencial de Lennard-Jones, utilitzat sovint per modelar interaccions intermoleculars, fou deduït el 1924 per John Lennard-Jones a partir de dades experimentals sobre l'argó, abans que el desenvolupament de la mecànica quàntica oferís les eines per comprendre les forces intermoleculars a partir dels primers principis.[26] L'anàlisi teòrica d'aquestes interaccions esdevingué tractable perquè els gasos nobles són monoatòmics i els àtoms són esfèrics, cosa que significa que la interacció entre els àtoms és independent de la direcció, o isotròpica.
Propietats químiques
[modifica]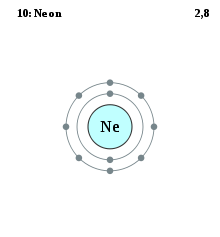
En els sis primers períodes de la taula periòdica, els gasos nobles són exactament els membres del grup 18 (8A) de la taula periòdica (anteriorment conegut com a grup 0). Tanmateix, això ja no és cert al setè període (degut a efectes relativistes): el següent membre del grup 18, l'oganessó, probablement no és un gas noble.[27] En canvi, el flerovi, un membre del grup 14, presenta propietats similars a les dels gasos nobles.[28]
Els gasos nobles són incolors, inodors, insípids i no inflamables en condicions estàndard. Antigament se'ls assignava el grup 0 de la taula periòdica perquè es creia que tenien una valència zero, és a dir, que els seus àtoms no es poden combinar amb els d'altres elements per formar compostos. Tanmateix, més tard es descobrí que alguns sí que formen compostos, fent que aquesta denominació fos abandonada.[9] Es coneix molt poc sobre les propietats del membre més recent del grup 18, l'oganessó (Og).[29]
Com altres grups, els membres d'aquesta família presenten patrons en la seva configuració electrònica, especialment les capes més exteriors, resultant en tendències en el comportament químic:
| Z | Element | Electrons per capa |
|---|---|---|
| 2 | heli | 2 |
| 10 | neó | 2, 8 |
| 18 | argó | 2, 8, 8 |
| 36 | criptó | 2, 8, 18, 8 |
| 54 | xenó | 2, 8, 18, 18, 8 |
| 86 | radó | 2, 8, 18, 32, 18, 8 |
| 118 | oganessó | 2, 8, 18, 32, 32, 18, 8 |
Els gasos nobles tenen capes d'electrons de valència plenes. Els electrons de valència són els electrons més exteriors dels àtoms i normalment són els únics que participen en els enllaços químics. Els àtoms amb capes d'electrons de valència plenes són extremament estables i per tant no tendeixen a formar enllaços químics i tenen poca tendència a guanyar o perdre electrons.[30] Tanmateix, els gasos nobles més pesants, com ara el radó, estan units menys fermament per la força electromagnètica que els més lleugers, com l'heli, fent que sigui més fàcil retirar electrons exteriors dels gasos nobles pesants.
Degut a la capa plena, els gasos nobles es poden utilitzar en conjunció amb la notació de configuració electrònica per formar la "notació de gasos nobles". Per fer-ho, primer s'escriu el gas noble més proper que precedeix l'element en qüestió, i es continua la configuració electrònica a partir d'aquell punt. Per exemple, la notació electrònica del carboni és 1s²2s²2p², i la seva notació de gas noble és [He]2s²2p². Aquesta notació fa que resulti més fàcil identificar elements, i és més curta que si cal escriure tota la notació d'orbitals atòmics.[31]
Compostos
[modifica]
Els gasos nobles tenen una reactivitat extremament baixa; per consegüent, només s'han format uns quants centenars de compostos de gasos nobles. No s'han format compostos neutres en què l'heli i el neó estan implicats en els enllaços químics (tot i que hi ha proves teòriques d'alguns compostos d'heli), mentre que el xenó, el criptó i l'argó només presenten una reactivitat baixa.[32] La reactivitat segueix l'ordre Ne < He < Ar < Kr < Xe < Rn.
El 1933, Linus Pauling predigué que els gasos nobles més pesants podien formar compostos amb el fluor i l'oxigen. Predigué l'existència de l'hexafluorur de criptó (KrF₆) i l'hexafluorur de xenó (XeF₆), especulà que XeF₈ podia existir com a compost inestable, i suggerí que l'àcid xènic podia formar sals de perxenat.[33][34] S'ha demostrat que aquestes prediccions eren generalment precises, excepte que actualment es creu que XeF₈ és termodinàmicament i cinètica inestable.[35]
Els compostos de xenó són els més nombrosos dels compostos de gas noble que s'han format.[36] La majoria d'ells tenen l'àtom de xenó a l'estat d'oxidació +2, +4, +6, o +8 unit a àtoms molt electronegatius com ara el fluor o l'oxigen, com en el difluorur de xenó (XeF₂), el tetrafluorur de xenó (XeF₄), l'hexafluorur de xenó (XeF₆), el tetraòxid de xenó (XeO₄) i el perxenat de sodi (Na₄XeO₆). Alguns d'aquests compostos han estat utilitzats en la síntesi química com a agents oxidants; XeF₂, en particular, està disponible comercialment i es pot utilitzar com a agent fluorador.[37] El 2007, s'havien identificat uns cinc-cents compostos de xenó units a altres elements, incloent-hi compostos organoxenons (units amb carboni), així com xenó unit a nitrogen, clor, or, mercuri i el mateix xenó.[32][38] També s'han observat compostos de xenó unit a bor, hidrogen, brom, iode, beril·li, sofre, titani, coure i plata, però només a temperatures baixes en matrius de gasos nobles, o en jets supersònics de gasos nobles.[32]
En teoria, el radó és més reactiu que el xenó, i per tant hauria de formar enllaços químics més fàcilment que el xenó. Tanmateix, a causa de la gran radioactivitat i la curta semivida dels isòtops del radó, a la pràctica només s'han format uns pocs fluorurs i òxids de radó.[39]
El criptó és menys reactiu que el xenó, però se n'han observat diversos compostos amb el criptó a l'estat d'oxidació +2.[32] El difluorur de criptó n'és el més notable i fàcil de caracteritzar. També s'han caracteritzat compostos en què el criptó forma un enllaç únic amb nitrogeni oxigen,[40] però només són estables per sota de -60 °C i -90 °C, respectivament.
S'han observat àtoms de criptó units químicament a altres no metalls (hidrogen, clor, carboni), així com a alguns metalls de transició tardans (coure, plata, or), però només o bé a temperatures baixes en matrius de gasos nobles, o bé en jets supersònics de gasos nobles.[32] S'utilitzaren condicions similars per obtenir els primers pocs compostos d'argó el 2000, com ara el fluorohidrur d'argó (HArF), i alguns units als metalls de transició tardans coure, plata i or.[32] El 2007, no es coneixien molècules neutres estables amb àtoms d'heli o neó amb enllaços covalents.[32]
Els gasos nobles, incloent-hi l'heli, poden formar ions moleculars estables a la fase gasosa. El més simple és l'hidroheli, HeH+, descobert el 1925.[41] Com que està compost dels dos elements més abundants de l'Univers, l'hidrogen i l'heli, es creu que es dona naturalment al medi interestel·lar, tot i que encara no ha estat detectat.[42] A més d'aquests ions, hi ha molts excímers neutres coneguts d'aquests gasos. Hi ha compostos com ara ArF i KrF que només són estables quan es troben en un estat electrònic excitat; alguns d'ells són utilitzats en els làsers d'excímers.
A més dels compostos en què un àtom de gas noble està implicat en un enllaç covalent, els gasos nobles també formen compostos no covalents. Els clatrats, descrits per primer cop el 1949,[43] consisteixen en un àtom de gas noble atrapat dins de cavitats de l'estructura cristal·lina de determinades substàncies orgàniques i inorgàniques. La condició essencial perquè es formin és que els àtoms convidats (els del gas noble) han de tenir la mida adequada per encaixar a les cavitats de l'estructura cristal·lina de l'hoste. Per exemple, l'argó, el criptó i el xenó formen clatrats amb la hidroquinona, però l'heli i el neó no, car són massa petits o tenen una polaritzabilitat insuficient per ser retinguts.[44] El neó, l'argó, el criptó i el xenó també formen hidrats de clatrats, en què el gas noble queda atrapat dins del glaç.[45]

Els gasos nobles poden formar compostos ful·lerens endohèdrics, en què l'àtom de gas noble està atrapat dins d'una molècula de ful·lerè. El 1993, es descobrí que quan s'exposa C60, una molècula esfèrica composta de 60 àtoms de carboni, a gasos nobles a una pressió elevada, es poden formar complexos com ara He@C60 (@ indica que He es troba contingut dins de C60, però que no hi està unit covalentment).[46] El 2008, s'han obtingut complexos endohèdrics amb heli, neó, argó, criptó i xenó.[47] Aquests compostos s'utilitzen en l'estudi de l'estructura i la reactivitat dels ful·lerens mitjançant la ressonància magnètica nuclear de l'àtom de gas noble.[48]

Es considera que els compostos de gasos nobles, com el difluorur de xenó (XeF₂), són hipervalents, car violen la regla de l'octet. Es pot explicar els enllaços en aquests compostos amb un model de tres centres i quatre electrons.[49][50] Aquest model, proposat per primera vegada el 1951, considera la unió de tres àtoms col·lineals. Per exemple, els enllaços de XeF₂ es descriuen per un conjunt de tres orbitals moleculars derivats dels orbitals p de cada àtom. Els enllaços resulten de la combinació d'un orbital p ple de Xe amb un orbital p mig ple de cada àtom de F, resultant en un orbital d'enllaç ple, un orbital no d'enllaç ple, i un orbital d'antienllaç. L'orbital molecular ocupat més alt es troba als dos àtoms terminals. Això representa una localització de la càrrega que és facilitada per l'alta electronegativitat del fluor.[51]
La química dels gasos nobles més pesants, el criptó i el xenó, està ben determinada. La dels més lleugers, l'heli i l'argó, encara es troba en un estadi primerenc, mentre que encara no s'ha identificat cap compost de neó.
Abundància i producció
[modifica]L'abundància dels gasos nobles a l'Univers minva a mesura que augmenta el seu nombre atòmic. L'heli és l'element més comú a l'Univers després de l'hidrogen, amb una proporció de massa d'aproximadament el 24%. La majoria de l'heli de l'Univers es formà durant la nucleosíntesi primordial, però la quantitat d'heli augmenta constantment a causa de la fusió d'hidrogen en la nucleosíntesi estel·lar.[52][53] L'abundància a la Terra mostra tendències diferents; per exemple, l'heli és només el tercer gas noble més abundant de l'atmosfera. El motiu d'això és que no hi ha heli primordial a l'atmosfera; a causa de la petita massa de l'àtom, l'heli no pot ser retingut pel camp gravitatori terrestre.[54] L'heli de la Terra deriva de la desintegració alfa d'elements pesants com l'urani o el tori de l'escorça terrestre, i tendeix a acumular-se en jaciments de gas natural.[54] D'altra banda, l'abundància de l'argó creix com a resultat de la desintegració alfa del potassi-40, que també es troba a l'escorça terrestre, per formar argó-40, que és l'isòtop de l'argó més abundant a la Terra tot i ser relativament rar al sistema solar. Aquest procés és la base del mètode de datació per potassi-argó.[55] El xenó té una abundància relativament baixa a l'atmosfera, en el que ha estat anomenat el "problema del xenó desaparegut"; una teoria és que el xenó que falta podria estar atrapat en minerals dins de l'escorça terrestre.[56] El radó es forma a la litosfera per la desintegració alfa del radi. Es pot filtrar en edificis a través d'esquerdes als fonaments i acumular-se en àrees mal ventilades. A causa de la seva gran radioactivitat, el radó és un risc per la salut significatiu; només als Estats Units, està associat amb unes 21.000 morts per càncer de pulmó cada any.[57]
| Abundància | Heli | Neó | Argó | Criptó | Xenó | Radó |
|---|---|---|---|---|---|---|
| Sistema solar (per cada àtom de silici)[58] | 2.343 | 2,148 | 0,1025 | 5,515 × 10−5 | 5,391 × 10−6 | – |
| Atmosfera terrestre (proporció en volum en ppm)[59] | 5,20 | 18,20 | 9.340,00 | 1,10 | 0,09 | (0,06 – 18) × 10−19[60] |
| Roca ígnia (proporció en massa en ppm)[22] | 3 × 10−3 | 7 × 10−5 | 4 × 10−2 | – | – | 1,7 × 10−10 |
| Gas | Preu el 2004 en (USD/m³)[61] |
|---|---|
| Heli (grau industrial) | 4,20-4,90 |
| Heli (grau de laboratori) | 22,30-44,90 |
| Argó | 2,70–8,50 |
| Neó | 60–120 |
| Criptó | 400–500 |
| Xenó | 4.000–5.000 |
El neó, l'argó, el criptó i el xenó s'obtenen a partir de l'aire utilitzant els mètodes de liqüefacció de gasos, per convertir els elements a un estat líquid, i de destil·lació fraccionada, per separar les mescles en els seus components. L'heli es produeix generalment separant-lo del gas natural, i el radó s'aïlla de la desintegració radioactiva dels compostos de radi.[9] El preu dels gasos nobles està influït per la seva abundància natural, sent l'argó el més barat i el xenó el més car. Ho il·lustra la taula de la dreta, amb els preus en USD del 2004 per quantitats de laboratori de cada gas.
Usos
[modifica]
Els gasos nobles tenen un punt d'ebullició i de fusió molt baix, cosa que els fa útils com a refrigerants criogènics.[62] En particular, l'heli líquid, que bull a 4,2K, s'utilitza per imants superconductors, com els que es fan servir per a la imatge per ressonància magnètica i la ressonància magnètica nuclear.[63] El neó líquid, tot i que no arriba a temperatures tan baixes l'heli líquid, també té aplicacions en la criogènia, car té una capacitat de refrigeració més de 40 vegades superior a la de l'heli líquid i més de tres vegades superior a la de l'hidrogen líquid.[60]
L'heli és utilitzat com a component dels gasos respirables per substituir el nitrogen, gràcies a la seva baixa solubilitat en fluids, especialment en lípids. Els gasos són absorbits per la sang i els teixits corporals quan hi ha pressió, com en el submarinisme, cosa que provoca un efecte anestèsic conegut com a mal de fondària.[64] A causa de la seva baixa solubilitat, poc heli entra a les membranes cel·lulars, i quan s'utilitza heli per substituir part dels gasos respirables, com en el trímix o l'hèliox, s'aconsegueix una reducció de l'efecte narcòtic del gas en profunditat.[65] La baixa solubilitat de l'heli ofereix més avantatges pel trastorn conegut com a malaltia per descompressió.[9][66] La menor quantitat de gas dissolt al cos significa que es formen menys bombolles de gas durant la reducció de la pressió durant l'ascens. Un altre gas noble, l'argó, és considerat la millor opció com a gas d'inflació del vestit sec en el submarinisme.[67]

Des del desastre del Hindenburg del 1937,[68] l'heli ha substituït l'hidrogen com a gas de sustentació en els dirigibles i globus, gràcies a la seva lleugeresa i incombustibilitat, malgrat una reducció en la flotabilitat d'un 8,6%[69][9]
En moltes aplicacions, els gasos nobles es fan servir per formar una atmosfera inerta. L'argó s'utilitza en la síntesi de compostos sensibles a l'aire que són sensibles al nitrogen. L'argó sòlid també es fa servir per estudiar compostos molt estables, com ara intermedis reactius, atrapant-los en una matriu inerta a temperatures molt baixes.[70] L'heli és utilitzat com a medi portador en la cromatografia de gasos, com a gas de rebliment en els termòmetres, i en aparells per mesurar la radiació, com ara el comptador Geiger i la cambra de bombolles.[61] Tant l'heli com l'argó s'utilitzen habitualment per protegir arcs de soldadura i el metall base que els envolta de l'atmosfera durant la soldadura i l'ablació, així com en altres processos metal·lúrgics i la producció de silici per la indústria dels semiconductors.[60]

Els gasos nobles es fan servir habitualment per la il·luminació a causa de la seva manca de reactivitat química. L'argó, mesclat amb nitrogen, és utilitzat com a gas de rebliment de les bombetes incandescents.[60] El criptó es fa servir en bombetes d'alt rendiment, que tenen una temperatura de color més elevada i una major eficàcia, car redueix la velocitat d'evaporació del filament més que l'argó; les làmpades d'halogen, en particular, utilitzen criptó mesclat amb petites quantitats de compostos de iode o brom.[60] Els gasos nobles llueixen amb colors característics quan se'ls utilitza en làmpades de descàrrega, com ara els fars de neó, que produeixen un color taronja-vermell. El xenó és utilitzat habitualment en fars xenó que, a causa del seu espectre gairebé continu que s'assembla a la llum del dia, es fan servir en projectors de pel·lícules i com a fars d'automòbil.[60]
Els gasos nobles es fan servir en làsers d'excímers, que es basen en molècules excitades electrònicament de vida curta conegudes com a excímers. Els excímers utilitzats en els làsers poden ser dímers de gasos nobles com ara Ar₂, Kr₂ o Xe₂, o més habitualment, el gas noble és combinat amb un halogen en excímers com ArF, KrF, XeF o XeCl. Aquests làsers produeixen una llum ultraviolada que, a causa de la seva longitud d'ona curta (193 nm per ArF i 248 nm per KrF), permet una imatge d'alta precisió. Els làsers d'excímers tenen molts usos industrials, mèdics i científics. Se'ls fa servir en la microlitografia i la microfabricació, essencials per la manufactura de circuits integrats, i per la cirurgia làser, incloent-hi l'angioplàstia làser i la cirurgia ocular.[71]
Alguns gasos nobles tenen un ús directe en la medicina. A vegades es fa servir l'heli per millorar la facilitat de respiració dels pacients d'asma.[60] El xenó és utilitzat com a anestèsic a causa de la seva alta solubilitat en lípids, que el fa més potent que l'habitual òxid de dinitrogen, i com que és eliminat fàcilment pel cos, permet un restabliment més ràpid.[72] El xenó s'utilitza en la imatgeria mèdica dels pulmons per IRM hiperpolaritzada.[73] El radó, que és molt radioactiu i només està disponible en quantitat mínimes, es fa servir en la radioteràpia.[9]
- Colors produïts per diferents gasos nobles en tubs de neó
Referències
[modifica]- ↑ Renouf, Edward «Gasos Nobles». Science, 13, 15-02-1901, pàg. 268–270. DOI: 10.1126/science.13.320.268.
- ↑ Ozima 2002, p. 30
- ↑ Ozima 2002, p. 4
- ↑ «argon». A: Encyclopædia Britannica, 2008.
- ↑ Oxford English Dictionary (1989), s.v. «helium». Consultat el 16 de desembre del 2006, d'Oxford English Dictionary Online. També de la següent citació: Thomson, W. (1872). Rep. Brit. Assoc. xcix: «Frankland i Lockyer troben que les prominències grogs emeten una línia brillant molt marcada no gaire lluny de D, però que fins ara no s'ha identificat amb cap flama terrestre. Sembla indicar una nova substància, que proposen anomenar heli».
- ↑ 6,0 6,1 Ozima 2002, p. 1
- ↑ Mendeléiev 1903, p. 497
- ↑ Partington, J. R. «Discovery of Radon». Nature, 179, 4566, Maig 1957, pàg. 912. DOI: 10.1038/179912a0.
- ↑ 9,00 9,01 9,02 9,03 9,04 9,05 9,06 9,07 9,08 9,09 «Noble Gas». A: Encyclopædia Britannica, 2008.
- ↑ Cederblom, J. E. «The Nobel Prize in Physics 1904 Presentation Speech», 1904.
- ↑ 11,0 11,1 Cederblom, J. E. «The Nobel Prize in Chemistry 1904 Presentation Speech», 1904.
- ↑ Gillespie, R. J.; Robinson, E. A. «Gilbert N. Lewis and the chemical bond: the electron pair and the octet rule from 1916 to the present day». J Comput Chem, 28, 1, Gener 2007, pàg. 87–97. DOI: 10.1002/jcc.20545. PMID: 17109437.
- ↑ 13,0 13,1 Bartlett, N. «Xenon hexafluoroplatinate Xe+[PtF6]–». Proceedings of the Chemical Society, 6, 1962, pàg. 218. DOI: 10.1039/PS9620000197.
- ↑ Fields, Paul R.; Stein, Lawrence; Zirin, Moshe H. «Radon Fluoride». Journal of the American Chemical Society, 84, 21, 1962, pàg. 4164–4165. DOI: 10.1021/ja00880a048.
- ↑ Grosse, A. V.; Kirschenbaum, A. D.; Streng, A. G.; Streng, L. V. «Krypton Tetrafluoride: Preparation and Some Properties». Science, 139, 1963, pàg. 1047–1048. DOI: 10.1126/science.139.3559.1047. PMID: 17812982.
- ↑ Khriachtchev, Leonid; Pettersson, Mika; Runeberg, Nino; Lundell, Jan; Räsänen, Markku «A stable argon compound». Nature, 406, 406, 24-08-2000, pàg. 874–876. DOI: 10.1038/35022551.
- ↑ Oganessian, Yu. Ts. «Synthesis of Superheavy Nuclei in the 48Ca + 244Pu Reaction». Physical Review Letters. American Physical Society, 83, 1999, pàg. 3154. DOI: 10.1103/PhysRevLett.83.3154.
- ↑ Woods, Michael. «Chemical element No. 110 finally gets a name—darmstadtium». Pittsburgh Post-Gazette, 06-05-2003. [Consulta: 26 juny 2008].
- ↑ «Gas Phase Chemistry of Superheavy Elements» (PDF). Texas A&M University. Arxivat de l'original el 2012-02-20. [Consulta: 31 maig 2008].
- ↑ Wilson, Elaine «Making Meaning in Chemistry Lessons». Electronic Journal of Literacy through Science, 4, 2, 2005.
- ↑ Oganessian, Yu. Ts. «Synthesis of the isotopes of elements 118 and 116 in the 249Cf i 245Cm + 48Ca fusion reactions». Physical Review C, 74, 4, 09-10-2006, pàg. 44602. DOI: 10.1103/PhysRevC.74.044602.
- ↑ 22,0 22,1 22,2 22,3 Greenwood 1997, p. 891
- ↑ A una pressió de 25 bar
- ↑ «Solid Helium». University of Alberta. Arxivat de l'original el 2008-05-31. [Consulta: 22 juny 2008].
- ↑ Wheeler, John C. «Electron Affinities of the Alkaline Earth Metals and the Sign Convention for Electron Affinity». Journal of Chemical Education, 74, 1997, pàg. 123–127.; Kalcher, Josef; Sax, Alexander F. «Gas Phase Stabilities of Small Anions: Theory and Experiment in Cooperation». Chemical Reviews, 94, 1994, pàg. 2291–2318. DOI: 10.1021/cr00032a004.
- ↑ Mott, N. F. «John Edward Lennard-Jones. 1894-1954». Biographical Memoirs of Fellows of the Royal Society, 1, 1955, pàg. 175–184. DOI: 10.1098/rsbm.1955.0013.
- ↑ Clinton S. Nash «Atomic and Molecular Properties of Elements 112, 114, and 118». J. Phys. Chem. A, 109, 15, 2005, pàg. 3493–3500 [Consulta: 18 gener 2008].
- ↑ Gas Phase Chemistry of Superheavy Elements Arxivat 2012-02-20 a Wayback Machine., conferència de Heinz W. Gäggeler, novembre del 2007. Consultat el 12 de desembre del 2008.
- ↑ «Scientists Announce Creation of Atomic Element, the Heaviest Yet». Washington Post, 17-10-2006. [Consulta: 26 juny 2008].
- ↑ Ozima 2002, p. 35
- ↑ CliffsNotes 2007, p. 15
- ↑ 32,0 32,1 32,2 32,3 32,4 32,5 32,6 Grochala, Wojciech «Atypical compounds of gases, which have been called noble». Chemical Society Reviews, 36, 36, 2007, pàg. 1632–1655. DOI: 10.1039/b702109g.
- ↑ Pauling, Linus «The Formulas of Antimonic Acid and the Antimonates». Journal of the American Chemical Society, 55, 5, Juny 1933, pàg. 1895–1900. DOI: 10.1021/ja01332a016.
- ↑ Holloway 1968
- ↑ Seppelt, Konrad «Recent developments in the Chemistry of Some Electronegative Elements». Accounts of Chemical Research, 12, Juny 1979, pàg. 211–216. DOI: 10.1021/ar50138a004.
- ↑ Moody, G. J. «A Decade of Xenon Chemistry». Journal of Chemical Education, 51, 10, octubre 1974, pàg. 628-630 [Consulta: 16 octubre 2007].
- ↑ Zupan, Marko; Iskra, Jernej; Stavber, Stojan «Fluorination with XeF₂. 44. Effect of Geometry and Heteroatom on the Regioselectivity of Fluorine Introduction into an Aromatic Ring». J. Org. Chem, 63, 3, 1998, pàg. 878–880. DOI: 10.1021/jo971496e.
- ↑ Harding 2002, pàg. 90–99
- ↑ .Avrorin, V. V.; Krasikova, R. N.; Nefedov, V. D.; Toropova, M. A. «The Chemistry of Radon». Russian Chemical Review, 51, 1, 1982, pàg. 12–20. DOI: 10.1070/RC1982v051n01ABEH002787.
- ↑ http://dx.doi.org/10.1016/S0010-8545(02)00202-3 doi:10.1016/S0010-8545(02)00202-3
- ↑ Hogness, T. R.; Lunn, E. G. «The Ionization of Hydrogen by Electron Impact as Interpreted by Positive Ray Analysis». Physical Review, 26, 1925, pàg. 44–55. DOI: 10.1103/PhysRev.26.44.
- ↑ Fernandez, J.; Martin, F. «Photoionization of the HeH₂+ molecular ion». J. Phys. B: At. Mol. Opt. Phys, 40, 2007, pàg. 2471–2480. DOI: 10.1088/0953-4075/40/12/020.
- ↑ H. M. Powell and M. Guter «An Inert Gas Compound». Nature, 164, 1949, pàg. 240-241. DOI: 10.1038/164240b0.
- ↑ Greenwood 1997, p. 893
- ↑ Iuri A. Diadin, Eduard G. Larionov, Andrei Yu. Manakov, Fridrich V. Zhurko, Evgeny Ya. Aladko, Tamara V. Mikina, Vladislav Yu. Komarov «Clathrate hydrates of hydrogen and neon». Mendeleev Communications, 9, 5, 1999, pàg. 209–210. DOI: 10.1070/MC1999v009n05ABEH001104.
- ↑ Saunders, M.; Jiménez-Vázquez, H. A.; Cross, R. J.; Poreda, R. J. «Stable compounds of helium and neon. He@C60 and Ne@C60». Science, 259, 1993, pàg. 1428–1430. DOI: 10.1126/science.259.5100.1428. PMID: 17801275.
- ↑ Saunders, Martin; Jimenez-Vazquez, Hugo A.; Cross, R. James; Mroczkowski, Stanley; Gross, Michael L.; Giblin, Daryl E.; Poreda, Robert J. «Incorporation of helium, neon, argon, krypton, and xenon into fullerenes using high pressure». J. Am. Chem. Soc., 116, 5, 1994, pàg. 2193–2194. DOI: 10.1021/ja00084a089.
- ↑ Frunzi, Michael; Cross, R. James; Saunders, Martin «Effect of Xenon on Fullerene Reactions». Journal of the American Chemical Society, 129, 2007, pàg. 13343. DOI: 10.1021/ja075568n.
- ↑ Greenwood 1997, p. 897
- ↑ Weinhold 2005, pàg. 275–306
- ↑ Pimentel, G. C. «The Bonding of Trihalide and Bifluoride Ions by the Molecular Orbital Method». The Journal of Chemical Physics, 19, 4, 1951, pàg. 446–448. DOI: 10.1063/1.1748245.
- ↑ Weiss, Achim. «Elements of the past: Big Bang Nucleosynthesis and observation». Max Planck Institute for Gravitational Physics. Arxivat de l'original el 2007-02-08. [Consulta: 23 juny 2008].
- ↑ Coc, A.; et al. «Updated Big Bang Nucleosynthesis confronted to WMAP observations and to the Abundance of Light Elements». Astrophysical Journal, 600, 2004, pàg. 544. DOI: 10.1086/380121.
- ↑ 54,0 54,1 Morrison, P.; Pine, J. «Radiogenic Origin of the Helium Isotopes in Rock». Annals of the New York Academy of Sciences, 62, 3, 1955, pàg. 71–92. DOI: 10.1111/j.1749-6632.1955.tb35366.x.
- ↑ Scherer, Alexandra. «40Ar/39Ar dating and errors». Technische Universität Bergakademie Freiberg, 16-01-2007. [Consulta: 26 juny 2008].
- ↑ Sanloup, Chrystèle [et al]. «Retention of Xenon in Quartz and Earth's Missing Xenon». Science, 310, 5751, 2005, pàg. 1174–1177. DOI: 10.1126/science.1119070. PMID: 16293758.
- ↑ «A Citizen's Guide to Radon». U.S. Environmental Protection Agency, 26-11-2007. [Consulta: 26 juny 2008].
- ↑ Lodders, Katharina «Solar System Abundances and Condensation Temperatures of the Elements». The Astrophysical Journal, 591, 2003, pàg. 1220–1247. DOI: 10.1086/375492.
- ↑ «The Atmosphere». National Weather Service. [Consulta: 1r juny 2008].
- ↑ 60,0 60,1 60,2 60,3 60,4 60,5 60,6 Häussinger, Peter; Glatthaar, Reinhard; Rhode, Wilhelm; Kick, Helmut; Benkmann, Christian; Weber, Josef; Wunschel, Hans-Jörg; Stenke, Viktor; Leicht, Edith; Stenger, Hermann. «Gasos Nobles». A: Ullmann's Encyclopedia of Industrial Chemistry. Wiley, 2002. DOI 10.1002/14356007.a17_485.
- ↑ 61,0 61,1 Hwang, Shuen-Chen; Lein, Robert D.; Morgan, Daniel A.. «Gasos Nobles». A: Kirk Othmer Encyclopedia of Chemical Technology. Wiley, 2005, p. 343–383. DOI 10.1002/0471238961.0701190508230114.a01.
- ↑ «Neon». A: Encarta, 2008.
- ↑ Zhang, C. J.; Zhou, X. T.; Yang, L. «Demountable coaxial gas-cooled current leads for MRI superconducting magnets». Magnetics, IEEE Transactions on. IEEE, 28, 1, Gener 1992, pàg. 957–959. DOI: 10.1109/20.120038.
- ↑ Fowler, B; Ackles, K. N.; Porlier, G. «Effects of inert gas narcosis on behavior—a critical review». Undersea Biomed. Res., 12, 4, 1985, pàg. 369–402. Arxivat de l'original el 2010-12-25. ISSN: 0093-5387. OCLC: 2068005. PMID: 4082343 [Consulta: 8 abril 2008]. Arxivat 2010-12-25 a Wayback Machine.
- ↑ Bennett 1998, p. 176
- ↑ Vann, R. D. (ed) «The Physiological Basis of Decompression». 38th Undersea and Hyperbaric Medical Society Workshop, 75(Phys)6-1-89, 1989, pàg. 437. Arxivat de l'original el 2010-01-05 [Consulta: 31 maig 2008]. Arxivat 2010-01-05 a Wayback Machine.
- ↑ Maiken, Eric. «Why Argon?». Decompression, 01-08-2004. [Consulta: 26 juny 2008].
- ↑ «Disaster Ascribed to Gas by Experts». The New York Times, 07-05-1937, p. 1.
- ↑ Freudenrich, Craig. «How Blimps Work». HowStuffWorks, 2008. [Consulta: 3 juliol 2008].
- ↑ Dunkin, I. R. «The matrix isolation technique and its application to organic chemistry». Chem. Soc. Rev., 9, 1980, pàg. 1–23. DOI: 10.1039/CS9800900001.
- ↑ Basting, Dirk; Marowsky, Gerd. Excimer Laser Technology. Springer, 2005. ISBN 3540200568.
- ↑ Sanders, Robert D.; Ma, Daqing; Maze, Mervyn «Xenon: elemental anaesthesia in clinical practice». British Medical Bulletin, 71, 1, 2005, pàg. 115–135. DOI: 10.1093/bmb/ldh034. PMID: 15728132 [Consulta: 2 octubre 2007].
- ↑ Albert, M. S.; Balamore, D. «Development of hyperpolarized noble gas MRI». Nuclear Instruments and Methods in Physics Research A, 402, 1998, pàg. 441–453. DOI: 10.1016/S0168-9002(97)00888-7 [Consulta: 1r octubre 2007].
Bibliografia
[modifica]- Bennett, Peter B.; Elliott, David H.. The Physiology and Medicine of Diving. SPCK Publishing, 1998. ISBN 0702024104.
- Bobrow Test Preparation Services. CliffsAP Chemistry. CliffsNotes, 05-12-2007. ISBN 047013500X.
- Greenwood, N. N.; Earnshaw, A.. Chemistry of the Elements. 2a ed.. Oxford:Butterworth-Heinemann, 1997. ISBN 0-7506-3365-4.
- Harding, Charlie J.; Janes, Rob. Elements of the P Block. Royal Society of Chemistry, 2002. ISBN 0854046909.
- Holloway, John H. Noble-Gas Chemistry. Londres: Methuen Publishing, 1968. ISBN 0412211009.
- Mendeléiev, D. Osnovy Khimii (Els principis de la química) (en rus). 7a edició, 1902–1903.
- Ozima, Minoru; Podosek, Frank A.. Noble Gas Geochemistry. Cambridge University Press, 2002. ISBN 0521803667.[Enllaç no actiu]
- Weinhold, F.; Landis, C.. Valency and bonding. Cambridge University Press, 2005. ISBN 0521831288.





