Darmstadti
| Darmstadti | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
110Ds
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||
| Desconegut | |||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Darmstadti, Ds, 110 | ||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Desconeguda (però probablament un metall de transició) | ||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 10, 7, d | ||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | [281] | ||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Rn] 5f14 6d8 7s2 (predit)[1] 2, 8, 18, 32, 32, 16, 2 (predit)[1] 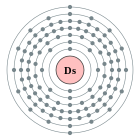
| ||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||
| Fase | Sòlid (predit[2]) | ||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
34,8 (predit)[1] g·cm−3 | ||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 8, 6, 4, 2, 0 (predit)[1][3] | ||||||||||||||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 955,2 (estimat)[1] kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| 2a: 1.891,1 (estimat)[1] kJ·mol−1 | |||||||||||||||||||||||||||||||||||||
| 3a: 3.029,6 (estimat)[1] kJ·mol−1 | |||||||||||||||||||||||||||||||||||||
| Radi atòmic | 132 (predit)[1][3] pm | ||||||||||||||||||||||||||||||||||||
| Radi covalent | 128 (estimat)[4] pm | ||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Cúbica centrada en el cos (predit)[2] 
| ||||||||||||||||||||||||||||||||||||
| Nombre CAS | 54083-77-1 | ||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del darmstadti | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
El darmstadti és un element químic sintètic el símbol del qual és Ds i el seu nombre atòmic és 110. Forma part del 7è període de la taula periòdica i del grup 10, situant-se sota el platí. Tots els isòtops sintetitzats es desintegren ràpidament, per sota els 11 s, essent impossible estudiar-ne les seves propietats de forma experimental. Fou sintetitzat per primera vegada el 1994 a la ciutat alemanya de Darmstadt, estat de Hessen, d'on prové el nom.
Història[modifica]
El primer intent de síntesi de darmstadti fou realitzat el 1987 per un grup internacional de científics dirigits per Iuri Oganessian a l'Institut de Recerca Nuclear de Dubnà, aleshores Unió Soviètica. Provaren dues reaccions nuclears: bombardejaren nuclis d'urani amb argó 40 i nuclis de tori amb calci 44, i anunciaren haver obtingut el darmstadti 276. El 1991, l'equip de l'estatunidenc Albert Ghiorso, del Laboratori Nacional Lawrence Berkeley de la Universitat de Califòrnia a Berkeley, també anunciaren la síntesi de l'isòtop 276. Però cap d'aquests experiments fou concloent.[5]
El darmstadti fou sintetitzat per primera vegada al 9 de novembre de 1994 per un equip internacional de científics dirigits per Peter Armbruster i Gottfried Munzenber al laboratori de la Societat per a la Investigació en Ions Pesants (GSI) a Darmstadt, Hessen, Alemanya, mitjançant la fusió de nuclis de l'isòtop plom 208 bombardejats amb nuclis de níquel 62 i, en un altre experiment posterior, amb níquel 64. Obtingueren l'isòtop darmstadti 269 en un cas i l'isòtop darmstadti 271 en l'altre i l'emissió d'un neutró en cada cas. Les reaccions foren:[5]

El 1995 a Dubnà un equip de científics russos i estatunidencs, liderats per Iuri Lazarev, aconseguiren sintetitzar l'isòtop 273 bombardejant plutoni amb sofre 34.[5]
El 13 d'agost de 2003 la Unió Internacional de Química Pura i Aplicada ((IUPAC) decidí anomenar-lo darmstadti segons el nom de la ciutat de Darmstadt a Alemanya en honor de la societat GSI, establerta a aquesta ciutat, que havia descobert i sintetitzat 6 elements nous.[6] Darmstadti s'insereix aleshores a la sèrie d'elements dels quals el nom deriva del nom d'una ciutat: Dubna (dubni), Berkeley (berkeli), París (luteci), Copenhaguen (hafni), Estocolm (holmi) i Strontian (estronci) Ytterby (itri, iterbi, terbi, erbi).[7] El 2007, la ciutat de Darmstadt batejà el seu centre de congressos darmstadtium.
Propietats[modifica]
Propietats físiques[modifica]
A causa de la ràpida desintegració dels isòtops sintetitzats, la major part de les propietats d'aquest element es basen en prediccions i estudis relativistes, i per comparació amb elements menys pesats. Amb nombre atòmic 110, es troba en el 7è període i en el grup 10 de la taula periòdica, situant-se en la zona dels metalls de transició. S'ha calculat que té configuració electrònica . Amb aquesta ubicació, s'espera que les seves propietats s'assemblin a les d'altres metalls d'aquest tipus. Així, es prediu que ha de ser un sòlid metàl·lic gris o blanc a temperatura ambient, amb gran densitat, una estructura cristal·lina cúbica centrada en el cos, amb elevada duresa i alts punts de fusió i ebullició, així com bon conductor de l'electricitat.[8]
Propietats químiques[modifica]
Quant a la química d'aquest element, tot el que se sap es basa en estudis d'efectes relativistes segons la teoria funcional de densitat. Així, en trobar-se en el mateix grup que el platí, s'han realitzat models de complexos amb els grups cianur, carbur i carbonil, a més d'estudis basats en la predicció de compostos com el tetraclorur de darmstadti i l'hexafluorur de darmstadti. Per als compostos amb carboni i carbur, i , s'han trobat similituds quant a la longitud d'enllaç i a la freqüència vibracional havent estat comparats amb els seus homòlegs del platí, no obstant això, mentre que el platí forma un complex amb el grup cianur amb estat d'oxidació +2, el darmstadti el formaria preferentment amb l'estat metàl·lic, resultant el complex . També, composts com el clorur de darmstadti(IV) posseeixen teòricament la mateixa estructura electrònica i el mateix potencial de ionització que els compostos amb platí. D'altra banda, s'han realitzat estudis sobre l'energia de descomposició basats en la reacció del fluorur de darmstadti(VI) donant lloc a difluor i clorur de darmstadti(IV) , donant suport a les concordances entre tots dos metalls.[8]
Isòtops[modifica]
El darmstadti és un element altament radioactiu, el qual es desintegra per fissió espontània el 85% de les vegades i per desintegració alfa el 15%, donant lloc al hassi 277.[8] Actualment s'han sintetitzat 18 isòtops diferents.[9]
Encara que posseeix isòtops amb un període de semidesintegració molt curt, de l'ordre dels microsegons, recentment s'han aconseguit sintetitzar els isòtops de nombre màssic 279 i 281, amb períodes de semidesintegració de 180 mil·lisegons i 11 segons, respectivament. D'altra banda, malgrat que encara no han estat descoberts, es pensa que els isòtops 292 i 293 tenen una vida mitjana de 30 i de 100 anys respectivament, així com de 311 anys per a l'isòtop 294.[8]
Referències[modifica]
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria. «Transactinides and the future elements». A: The Chemistry of the Actinide and Transactinide Elements. 3a edició. Dordrecht (Països Baixos): Springer Science+Business Media, 2006. ISBN 1-4020-3555-1.
- ↑ 2,0 2,1 Östlin, A.; Vitos, L. «First-principles calculation of the structural stability of 6d transition metals». Physical Review B, 84, 11, 2011. Bibcode: 2011PhRvB..84k3104O. DOI: 10.1103/PhysRevB.84.113104.
- ↑ 3,0 3,1 Fricke, Burkhard «Superheavy elements: a prediction of their chemical and physical properties». Recent Impact of Physics on Inorganic Chemistry, 21, 1975, pàg. 89–144. DOI: 10.1007/BFb0116498 [Consulta: 4 octubre 2013].
- ↑ Chemical Data. Darmstadtium - Ds, Royal Chemical Society
- ↑ 5,0 5,1 5,2 Emsley, John.. Nature's building blocks: an A-Z guide to the elements. Oxford: Oxford University Press, 2001. ISBN 0-19-850341-5.
- ↑ Element 110 is named darmstadtium Comunicat de premsa del IUPAC del 16 d'agost de 2003, consultat el 18 de gener de 2012
- ↑ Von der Verleihung der Stadtrechte zum „Darmstadtium“. (en alemany) Arxivat 2006-06-22 a Wayback Machine. (en català: La història des de l'atorgament dels drets de ciutat cap al Darmstadtium)
- ↑ 8,0 8,1 8,2 8,3 Manchado Cascón, A. «Z = 110, darmstatio, Ds. El desconocido metal pesado de tan solo unos pocos años de edad». An. Quím., 115, 2, 2019, pàg. 172. Arxivat de l'original el 2020-02-07 [Consulta: 21 abril 2020]. Arxivat 2020-02-07 a Wayback Machine.
- ↑ «Nudat 2». National Nuclear Data Center, Brookhaven National Laboratory. [Consulta: 22 abril 2020].
Enllaços externs[modifica]
- webelements.com - Darmstadti (anglès)
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Darmstadti |



![{\displaystyle {\ce {[Rn] 5f^14 6d^9 7s^1}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8c1a6dfa0427bce6c2ca7d359f04f5fa27e2d032)






