Reni
| Reni | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
75Re
| ||||||||||||||||||||||
| ||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||
Blanc platejat Barres de cristall de reni i un cub d'1 cm³  Línies espectrals del reni | ||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||
| Nom, símbol, nombre | Reni, Re, 75 | |||||||||||||||||||||
| Categoria d'elements | Metalls de transició | |||||||||||||||||||||
| Grup, període, bloc | 7, 6, d | |||||||||||||||||||||
| Pes atòmic estàndard | 186,207 | |||||||||||||||||||||
| Configuració electrònica | [Xe] 4f14 5d5 6s2 2, 8, 18, 32, 13, 2 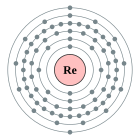
| |||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||
| Fase | Sòlid | |||||||||||||||||||||
| Densitat (prop de la t. a.) |
21,02 g·cm−3 | |||||||||||||||||||||
| Densitat del líquid en el p. f. |
18,9 g·cm−3 | |||||||||||||||||||||
| Punt de fusió | 3.459 K, 3.186 °C | |||||||||||||||||||||
| Punt d'ebullició | 5.869 K, 5.596 °C | |||||||||||||||||||||
| Entalpia de fusió | 60,43 kJ·mol−1 | |||||||||||||||||||||
| Entalpia de vaporització | 704 kJ·mol−1 | |||||||||||||||||||||
| Capacitat calorífica molar | 25,48 J·mol−1·K−1 | |||||||||||||||||||||
| Pressió de vapor | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||
| Estats d'oxidació | 7, 6, 5, 4, 3, 2, 1, 0, -1 (òxid àcid feble) | |||||||||||||||||||||
| Electronegativitat | 1,9 (escala de Pauling) | |||||||||||||||||||||
| Energies d'ionització (més) |
1a: 760 kJ·mol−1 | |||||||||||||||||||||
| 2a: 1.260 kJ·mol−1 | ||||||||||||||||||||||
| 3a: 2.510 kJ·mol−1 | ||||||||||||||||||||||
| Radi atòmic | 137 pm | |||||||||||||||||||||
| Radi covalent | 151±7 pm | |||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal 
| |||||||||||||||||||||
| Ordenació magnètica | Paramagnètic[1] | |||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 193 nΩ·m | |||||||||||||||||||||
| Conductivitat tèrmica | 48,0 W·m−1·K−1 | |||||||||||||||||||||
| Dilatació tèrmica | 6,2 µm/(m·K) | |||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 4.700 m·s−1 | |||||||||||||||||||||
| Mòdul d'elasticitat | 463 GPa | |||||||||||||||||||||
| Mòdul de cisallament | 178 GPa | |||||||||||||||||||||
| Mòdul de compressibilitat | 370 GPa | |||||||||||||||||||||
| Coeficient de Poisson | 0,30 | |||||||||||||||||||||
| Duresa de Mohs | 7,0 | |||||||||||||||||||||
| Duresa de Vickers | 2.450 MPa | |||||||||||||||||||||
| Duresa de Brinell | 1.320 MPa | |||||||||||||||||||||
| Nombre CAS | 7440-15-5 | |||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||
| Article principal: Isòtops del reni | ||||||||||||||||||||||
| ||||||||||||||||||||||
El reni és un element químic amb el símbol Re i el nombre atòmic 75. És un metall de transició de tercera fila de color gris platejat, pesat, del grup 7 de la taula periòdica. Amb una concentració mitjana estimada d'1 part per mil milions (ppb), el reni és un dels elements més rars de l'escorça terrestre. El reni té el tercer punt de fusió més alt i el segon punt d'ebullició més alt de qualsevol element a 5869 K.[2] El reni s'assembla químicament al manganès i al tecneci i s'obté principalment com a subproducte de l'extracció i refinament de minerals de molibdè i coure. El reni mostra en els seus compostos una gran varietat d'estats d'oxidació que van de -1 a +7.
Descobert per Walter Noddack, Ida Tacke i Otto Berg el 1925,[3] el reni va ser l'últim element estable que es va descobrir. Va rebre el nom del riu Rin a Europa, del qual s'havien obtingut les primeres mostres i es van treballar comercialment.[4]
Els superaliatges de reni a base de níquel s'utilitzen a les cambres de combustió, les pales de les turbines i els broquets d'escapament dels motors de reacció. Aquests aliatges contenen fins a un 6% de reni, cosa que fa que la construcció de motors de reacció sigui el principal ús de l'element. El segon ús més important és com a catalitzador: el reni és un excel·lent catalitzador per a la hidrogenació i isomerització, i s'utilitza, per exemple, en el reformat catalític de la nafta per al seu ús en gasolina (procés de reniformació). A causa de la baixa disponibilitat en relació a la demanda, el reni és car, amb un preu que va assolir un màxim històric el 2008/2009 de 10.600 dòlars per quilogram (4.800 dòlars per lliura). A causa dels augments en el reciclatge de reni i una caiguda de la demanda de reni en els catalitzadors, el preu del reni havia baixat a 2.844 dòlars per quilogram (1.290 dòlars per lliura) al juliol de 2018.[5]
Història[modifica]

A principis del segle xx la taula periòdica tenia dos llocs vacants per sota del manganès, al grup 7è períodes 5 i 6, i la troballa d'aquests elements que mancaven, el tecneci i el reni, fou difícil. El reni era el situat més avall i, de fet, fou el darrer element estable natural, no radioactiu, que es descobrí. El 1905, el químic japonès Masataka Ogawa (1865-1930) trobà un element desconegut al mineral torianita, òxid de tori, de Sri Lanka, a partir de les línies del seu espectre atòmic. Pensà erròniament que era l'element situat a sota del manganès (l'actual tecneci) i l'anomenà niponi, símbol Np, en honor del Japó. D'altre científic trobà aquest suposat nou element i la recerca d'Ogawa fou oblidada. Tanmateix, una revisió dels espectres fotogràfics originals d'Ogawa el 2004 demostraren que no havia observat l'espectre del tecneci sinó el reni.[6][7]
El matrimoni de químics alemanys Walter Noddack (1893-1960) i Ida Tacke (1896-1978), que treballaven al Physikalisch-Technischen Reichsanstalt de l'Institut de Fisicoquímica de la Universitat de Berlín, aconseguiren aïllar el reni el maig del 1925.[8] Fou confirmat espectroscòpicament pel químic alemany Otto Berg (1873-1939) de la companyia Siemens i Halske de Berlín. El concentraren a partir del mineral gadolinita on hi era present com una impuresa. El 1928 aconseguiren aïllar-ne un gram a partir de 660 kg de molibdenita.[9] El batejaren reni, a partir del llatí Rhenus, el nom el riu Rin, que travessa Alemanya de sud a nord.[7]
Estat natural i obtenció[modifica]

El reni és un element molt rar, ocupa la posició 77a en l'ordre d'abundància dels elements químics a l'escorça de la Terra. A l'aigua de la mar hi ha una concentració mitjana de 4 ppt i no se'l troba a l'atmosfera.[7] Hom el troba només al reni natiu i a dos minerals a la natura, a la reniïta, sulfur de reni(IV) on representa el 74,38 % en massa i a la tarkianita, un altre sulfur de reni i altres elements de fórmula , on hi és present en un 54,73%.[10] Fins al 1994 no hi hagué evidència de l'existència de cap mineral de reni i només se'l trobava com a impuresa en altres minerals, especialment els de molibdè. Aquest any un grup de mineralogistes russos estudiaren els minerals de les fumaroles del volcà Kudriavi, a l'illa d'Iturup, a la costa del Pacífic, i hi descobriren la reniïta.[11][7]

El reni s'extreu majoritàriament de la molibdenita on es troba en molt baixa proporció, com una impuresa, en unes 20 ppm. La separació del reni es duu a terme per la concentració de l'òxid de reni(VII) , que és volàtil, de la pols de combustió i els gasos que es produeixen durant la fosa de molibdenita o de la seva concentració amb els metalls de platí als fangs de l'ànode durant la refinació electrolítica de coure. La pols de metall negre s'extreu dels gasos i de la pols mitjançant la lixiviació o fregament amb aigua per dissoldre l'òxid de reni(VII), que al seu torn es pot convertir en perrenat d'amoni , i després reduir-se al metall amb hidrogen. La pols es pot comprimir i sinteritzar en barres en hidrogen a temperatures elevades. El treball en fred i el recuit permeten la fabricació de filferro o làmina.[12]
El principal productor de reni el 2019 fou Xile, amb 27 tones; seguit de Polònia amb 9,3 tones i els EUA amb 8,4 tones. La producció total el 2019 fou de 49 tones. Les reserves mundials es calculen en 2 400 tones (1300 a Xile, 400 als EUA, 310 a Rússia, 190 al Kazakhstan i la resta en altres països).[13]
Propietats principals[modifica]
Propietats físiques[modifica]
El reni és un metall blanc argentat, brillant, amb una densitat molt alta de 20,8 g/cm³, només superat pel platí, l'iridi i l'osmi, i té un dels punts de fusió més alts de tots els metalls, 3.185 °C, només superat pel wolframi. El seu punt d'ebullició també és elevat, 5.596 °C. Es presenten en un ampli rang d'estats d'oxidació: -1, +1, +2, +3, +4, +5, +6 i +7, i els més comuns en són el +7, +6, +4, +2 i -1.[14]
Se sol comercialitzar en forma de pols, però es pot obtenir en forma compacta, amb una major densitat. Quan s'escalfa i es torna a refredar, resulta ser dúctil, per la qual cosa es pot treballar amb aquest. Els aliatges de reni-molibdè són superconductors a 10 K.[14]
Propietats químiques[modifica]
La configuració electrònica del reni és [Xe]4f145d⁵6s2. El reni és menys reactiu a l'aire que el manganès, que es troba a dos llocs per sobre del reni a la taula periòdica. És tan reactiu com el tecneci, que es troba immediatament per sobre del reni a la taula periòdica. Com a tal, reacciona molt lentament en aire humit. A la pràctica, sovint el reni se subministra com a pols o com a esponja, i en aquesta forma és molt més reactiu. Quan s'escalfa amb oxigen el resultat és l'òxid de reni(VII):[15]
Si la reacció amb el fluor es realitza a pressió a 400 °C, l'únic producte és el fluorur de reni(VII) . Es dissol en aigua de brom tèbia.[15]

De forma similar al tecneci, immediatament per sobre del reni a la taula periòdica, el reni és insoluble en àcid clorhídric i àcid fluorhídric. Es dissol en àcid nítric i en àcid sulfúric concentrat, ambdós oxidants, per formar solucions d'àcid perrènic, . D'aquesta forma, el reni està en estat d'oxidació formal + 7.[15]
Els òxids que es coneixen del reni són: , i . L'òxid més comú és l'òxid de reni(VII) , és un sòlid groguenc volàtil que és l'anhídrid de l'àcid perrènic . És la matèria primera de tots els composts de reni, sent la fracció volàtil formada durant el torrat del mineral. En forma cristal·lina és un polímer inorgànic que consisteix a alternar centres de Re octaèdrics i tetraèdrics. En escalfar-se, el polímer s'esquerda per donar molecular (no polimèric). Aquesta espècie molecular és molt semblant a l'oxid de manganès(VII), que consisteix en un parell de tetraedres que comparteixen un vèrtex, és a dir, . L'òxid de reni(VII) es produeix quan el reni metàl·lic o els seus òxids o sulfurs s'oxiden a 500 °C-700 °C a l'aire. És molt reactiu amb l'aigua i es dissol en aigua per formar àcid perrènic. És un precursor del triòxid de metilreni (MTO), un catalitzador de reaccions d'oxidació. També es fa servir en síntesi orgànica com a catalitzador per a l'etenòlisi, la reducció de carbonil i la reducció d'amides.[16]
L'òxid de reni(VI) és un sòlid vermellós amb una brillantor metàl·lica, que s'assembla al coure i que presenta una estructura semblant a la perovskita (ABO₃). És l'únic triòxid estable del grup 7. Es pot preparar reduint l'òxid de reni(VII) amb monòxid de carboni o amb dioxà.[16]
El diborur de reni és un compost extremadament dur, tant com el diamant.[7][17]
Isòtops[modifica]
A la naturalesa hom troba dos isòtops del reni, el reni 185, amb una abundància del 37,40 % i que és estable; el reni 187, el més abundant, 62,6 %, que és inestable i es desintegra per emissió β–, però amb un període de semidesintegració molt elevat, de 4,5 × 1010 anys.[10]
Es coneixen uns altres 26 isòtops inestables que van del nombre màssic 159 al 199. Els primers es desintegren per emissió d'un protó per donar uns núclids de tungstè:[18]
A partir del reni 162 fins al reni 164 la desintegració majoritària és l'emissió de partícules α, donant un radionúclid de tàntal:[18]
A continuació i fins al reni 184 els radionúclids de reni es desintegren per captura electrònica donant radionúclids de tungstè:[18]
Finalment, els darrers es desintegren en radionúclids d'osmi emetent electrons, això és, desintegració β–:[18]
Aplicacions[modifica]
Indústria metal·lúrgica[modifica]

La principal aplicació del reni (70 %) és la fabricació de superaliatges, amb níquel, cobalt i molibdè, molt resistents a la calor, per a motors de reacció d'avions. Si els àleps de les turbines d'aquests motors no portessin reni, no podrien superar temperatures per sobre dels 1.500 °C; amb reni, poden arribar a 1.610 °C, millorant l'estalvi de combustible entre el 40 % i el 60 %, a més de duplicar la potència, l'empenta i reduir l'emissió de diòxid de carboni fins al 64 %.[19]
Altres usos[modifica]
Amb aliatges de reni i tungstè es fabriquen termoparells per mesurar temperatures de fins a 2.760 °C.[19] La vida útil dels elements de calefacció d'aliatge de reni és de 5 a 10 vegades més llarga que la dels elements de calefacció de tungstè o molibdè. L'element calefactor de reni té l'avantatge excepcional de treballar a altes temperatures i pressions; també pot produir molles sensibles i indeformables a altes temperatures i necessàries per als instruments de mesura d'alta temperatura. A més, com a colorant fotosensible que absorbeix l'energia solar, el reni té àmplies perspectives d'aplicació a les cèl·lules solars.[20]
S'usa també com a catalitzador en la destil·lació del cru del petroli per produir benzines d'alt octanatge i primeres matèries d'hidrocarburs aromàtics (benzè, toluè, xilè).[20]
Referències[modifica]
- ↑ Magnetic susceptibility of the elements and inorganic compounds, a Handbook of Chemistry and Physics, 81a edició, CRC press. (anglès)
- ↑ Zhang, Yiming Journal of Chemical & Engineering Data, 56, 11-01-2011.
- ↑ (en alemany) Naturwissenschaften, 13, 26, 01-06-1925, pàg. 567–574. Bibcode: 1925NW.....13..567.. DOI: 10.1007/BF01558746. ISSN: 1432-1904.
- ↑ «From Hydrogen to Darmstadtium & More». American Chemical Society, 2003.
- ↑ «BASF Catalysts - Metal Prices». apps.catalysts.basf.com. Arxivat de l'original el 2021-04-12. [Consulta: 3 juny 2023].
- ↑ Yoshihara, H.K. «Discovery of a new element ‘nipponium’: re-evaluation of pioneering works of Masataka Ogawa and his son Eijiro Ogawa» (en anglès). Spectrochimica Acta Part B: Atomic Spectroscopy, 59, 8, 2004-08, pàg. 1305–1310. DOI: 10.1016/j.sab.2003.12.027.
- ↑ 7,0 7,1 7,2 7,3 7,4 Emsley, John.. Nature's building blocks: an A-Z guide to the elements. Oxford: Oxford University Press, 2001. ISBN 0-19-850341-5.
- ↑ Noddack, W.; Tacke, I. «Die Ekamangane» (en alemany). Die Naturwissenschaften, 13, 26, 1925-06, pàg. 567–574. DOI: 10.1007/BF01558746. ISSN: 0028-1042.
- ↑ Noddack, J.; Noddack, W. «Die Herstellung von einem Gram Rhenium» (en anglès). Zeitschrift für anorganische und allgemeine Chemie, 183, 1, 1929, pàg. 353–375. DOI: 10.1002/zaac.19291830126. ISSN: 1521-3749.
- ↑ 10,0 10,1 Barthelmy, David. «Mineral Species sorted by the element Re Rhenium». Mineralogy Database, 1997-2014. [Consulta: 25 febrer 2020].
- ↑ Korzhinsky, M. A.; Tkachenko, S. I.; Shmulovich, K. I.; Taran, Y. A.; Steinberg, G. S. «Discovery of a pure rhenium mineral at Kudriavy volcano». Nature, 369, 6475, 1994-05, pàg. 51–52. DOI: 10.1038/369051a0. ISSN: 0028-0836.
- ↑ «Rhenium | chemical element» (en anglès). Encyclopædia Britannica. Encyclopædia Britannica, inc., 06-05-2019. [Consulta: 24 febrer 2020].
- ↑ «Rhenium Statistics and Information». U.S. Geological Survey, 2020. [Consulta: 24 febrer 2020].
- ↑ 14,0 14,1 W.M. Haynes. CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data.. 95a edició. Boca Raton, Florida: CRC Press, 2014. ISBN 978-1-4822-0867-2.
- ↑ 15,0 15,1 15,2 15,3 Winter, Mark. «Rhenium, reactions of elements». Webelements. [Consulta: 24 febrer 2020].
- ↑ 16,0 16,1 Kloprogge, J. Theo; Ponce, Concepción C.; Loomis, Tom. The periodic table: nature's building blocks. An introduction to the naturally occurring elements, their origins and their uses. Amsterdam: Elsevier, 2021. ISBN 978-0-12-821538-8.
- ↑ Yinghuai Zhu. Fundamentals and applications of boron chemistry. Amsterdam: Elsevier, 2022. ISBN 978-0-12-822126-6.
- ↑ 18,0 18,1 18,2 18,3 «NuDat 3». National Nuclear Data Center (NNDC) at Brookhaven National Laboratory. [Consulta: 9 març 2023].
- ↑ 19,0 19,1 Sanz Balagué, J.; Tomasa Guix, O. Elements i recursos minerals: aplicacions i reciclatge. 3a. Iniciativa Digital Politècnica, 2017. ISBN 978-84-9880-666-3.
- ↑ 20,0 20,1 «Rhenium Applications | What Is Rhenium Used For?» (en anglès americà), 08-11-2019. [Consulta: 9 març 2023].
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||





















