Cobalt
| Cobalt | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
27Co
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||
Metall gris llustrós  Línies espectrals del cobalt | |||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Cobalt, Co, 27 | ||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | ||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 9, 4, d | ||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 58,933195(5) | ||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Ar] 4s2 3d7 2, 8, 15, 2 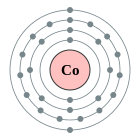
| ||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||
| Color | Gris metàl·lic | ||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
8,90 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
7,75 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.768 K, 1.495 °C | ||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 3.200 K, 2.927 °C | ||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 16,06 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 377 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 24,81 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 5, 4 , 3, 2, 1, -1 (òxid amfòter) | ||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,88 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 760,4 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| 2a: 1.648 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||
| 3a: 3.232 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||
| Radi atòmic | 125 pm | ||||||||||||||||||||||||||||||||||||
| Radi covalent | 126±3 (espín baix), 150±7 (espín alt) pm | ||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal 
| ||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Ferromagnètic | ||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 62,4 nΩ·m | ||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 100 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 13,0 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 4.720 m·s−1 | ||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 209 GPa | ||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 75 GPa | ||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 180 GPa | ||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,31 | ||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 5,0 | ||||||||||||||||||||||||||||||||||||
| Duresa de Vickers | 1.043 MPa | ||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 700 MPa | ||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-48-4 | ||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del cobalt | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
El cobalt és l'element químic de símbol Co i nombre atòmic 27. Està situat en el grup 9 de la taula periòdica dels elements. El cobalt és un metall dur, ferromagnètic, de color blanc blavós. La seva temperatura de Curie és de 1388 K. Normalment es troba junt amb níquel, i ambdós solen formar part dels meteorits de ferro. És un element químic essencial per als mamífers en petites quantitats. El Co-60, un radioisòtop de cobalt, és un important traçador i agent en el tractament del càncer. El cobalt metàl·lic està comunament constituït d'una mescla de dos formes al·lotròpiques amb estructures cristal·lines hexagonal i cúbica centrada en les cares sent la temperatura de transició entre ambdós de 722 K. Presenta estats d'oxidació baixos. Els compostos en els que el cobalt té un estat d'oxidació de +4 són poc comuns. L'estat d'oxidació +2 és molt freqüent, així com el +3. També hi ha complexos importants amb l'estat d'oxidació +1. La seva electronegativitat és 1,8, el radi covalent (Á) és 1,26, el radi iònic (Á) és 0,63, el radi atòmic (Á) és 1,25, la seva configuració [Ar]3d⁷ 4s², la seva massa atòmica (g/mol) és 58,93, la seva densitat (g/ml) és 8,9, el punt d'ebullició (°C) és 2900, el punt de fusió (°C) és 1495.[1]
La massa atòmica és de 58,9332. Amb propietats magnètiques similars al ferro com la duresa, resistència a la tensió i propietats tèrmiques. El cobalt es pot trobar en aigües dolces, sòls, plantes, meteorits i als nòduls de manganès trobats al fons de l'oceà. Els compostos de cobalt es fan servir per crear un color blau densa en vidres, ceràmiques, porcellanes, vidriar i en esmalts.[1]
Etimologia
[modifica]Se'l denominava kobold a l'edat mitjana pels miners que consideraven aquest metall sense valor i tenien la creença que un bon follet (un kobold) ho substituïa de la plata que havia robat.[2]
Aplicacions
[modifica]- Aliatges entre les que cal assenyalar superaliatges usades en turbines de gas d'aviació, aliatges resistents a la corrosió, acers ràpids, i carburs cementats i eines de diamant.
- Imants (Alnico) i cintes magnètiques.
- Catàlisi del petroli i indústria química.
- Recobriments metàl·lics per deposició electrolítica pel seu aspecte, duresa i resistència a l'oxidació.
- Assecant per a pintures, vernissos i tintes.
- Recobriment base d'esmalts vitrificats.
- Pigments (cobalt blau i cobalt verd).
- Elèctrodes de bateries elèctriques
- Cables d'acer de pneumàtics.
- L'Isòtop Co-60 s'usa com a font de radiació gamma en radioteràpia, esterilització d'aliments (pasteurització freda) i radiografia industrial per al control de qualitat de metalls (detecció de clavilles).
Rol biològic
[modifica]El cobalt en petites quantitats és essencial per a nombrosos organismes, inclosos els humans. La presència de quantitats entre 0,13 i 0,30 ppm en el sòl millora ostensiblement la salut dels animals de pasturatge. El cobalt és un component central de la vitamina B₁₂ (cianocobalamina).
Història
[modifica]
Els compostos de cobalt s’utilitzen des de fa segles per donar color blau al vidre, als esmalts i a la ceràmica. El cobalt s’ha detectat a l'escultura egípcia, a joies perses del tercer mil·lenni aC, a les ruïnes de Pompeia, destruïdes el 79 dC i a la Xina, a la dinastia Tang (618–907 dC) i a la dinastia Ming (1368–1644 dC).[3]
El cobalt s’utilitza per acolorir el vidre des de l'edat del bronze. L'excavació del naufragi d'Uluburun va donar un lingot de vidre blau, colat durant el segle xiv aC.[4][5] El vidre blau d’Egipte estava colorejat amb coure, ferro o cobalt. El vidre de color cobalt més antic és de la dinastia XVIII d’Egipte (1550–1292 aC). No es coneix la font del cobalt que feien servir els egipcis.[6][7]
L'element va ser descobert per Georg Brandt. La data del descobriment varia en les diverses fonts entre 1730 i 1737. Brandt va ser capaç de demostrar que el cobalt era el responsable del color blau del vidre que prèviament s'atribuïa al bismut.
El seu nom prové de l'alemany kobalt o kobold, esperit maligne, anomenat així pels miners per la seua toxicitat i els problemes que ocasionava, ja que igual que el níquel contaminava i degradava els elements que es desitjava extraure.
Durant el segle xix, entre el 70 i 80% de la producció mundial de cobalt s'obtenia en la fàbrica noruega Blaafarveværket de l'industrial prussià Benjamin Wegner.[8][9]
El 1938 John Livingood i Glenn Seaborg van descobrir el cobalt-60.[10] La primera màquina de radioteràpia, bomba de cobalt, construïda al Canadà per un equip liderat per Ivan Smith i Roy Errington es va utilitzar en un pacient el 27 d'octubre de 1951; l'equip es troba actualment exposat en el Saskatoon Càncer Centre, a la ciutat de Saskatoon (Saskatchewan).
Abundància i obtenció
[modifica]
El metall no es troba en estat natiu, sinó en diversos minerals, raó per la qual s'extreu usualment junt amb altres productes, especialment com a subproducte del níquel i el coure. Les principals menes de cobalt són la cobaltita, eritrita, cobaltocalcita i skutterudita.
Els majors productors de cobalt són la República Democràtica del Congo, Xina, Zàmbia, Rússia i Austràlia.
Compostos
[modifica]A causa dels diversos estats d'oxidació que presenta, hi ha un abundant nombre de compostos de cobalt. Els òxids CoO (temperatura de Néel 291 K) i Co₃O₄ (temperatura de Néel 40 K) són ambdós antiferromagnètics a baixa temperatura.
Isòtops
[modifica]El cobalt natural només té un isòtop estable, el Co-59. S'han caracteritzat 22 radioisòtops sent els més estables el Co-60, el Co-57 i el Co-56 amb períodes de semidesintegració de 5,2714 anys, 271,79 dies i 70,86 dies respectivament. En els altres isòtops radioactius són inferiors a 18 hores i la majoria menors d'1 segon. El cobalt presenta a més quatre metaestats, tots ells amb períodes de semidesintegració menors de 15 minuts.
La massa atòmica dels isòtops del cobalt oscil·la entre 50 uma (Co-50) i 73 uma (Co-73). Els isòtops més lleugers que l'estable (Co-59) es desintegren principalment per captura electrònica originant isòtops de ferro, mentre que els més pesats que l'isòtop estable es desintegren per emissió beta donant lloc a isòtops de níquel.
El cobalt-60 s'usa en radioteràpia en substitució del radi pel seu menor preu. Produeix dos rajos gamma amb energies d'1,17 MeV i 1,33 MeV i en ser la font emprada d'uns dos centímetres de radi provoca l'aparició de zones de penombra dispersant la radiació entorn de la direcció de radiació. El metall tendeix a produir una pols molt fina que dificulta la protecció enfront de la radiació. La font de Co-60 té una vida útil d'aproximadament 5 anys, però superat aquest temps continua sent molt radioactiu, per la qual cosa aquestes fonts han perdut, en certa manera, la seva popularitat a occident.
Precaucions
[modifica]El cobalt metàl·lic en pols finament dividit és inflamable. Els compostos de cobalt en general han de manipular-se amb precaució per la lleugera toxicitat del metall. El Co-60 és radioactiu i l'exposició a la seva radiació pot provocar càncer. La ingestió de Co-60 comporta l'acumulació d'alguna quantitat en els teixits, quantitat que s'elimina molt lentament. En una eventual confrontació nuclear, l'emissió de neutrons convertiria el ferro en Co-60 multiplicant els efectes de la radiació després de l'explosió i prolongant en el temps els efectes de la contaminació radioactiva; amb aquest propòsit es dissenyen algunes armes nuclears denominades bombes brutes (de l'anglès dirty bomb). En absència de guerra nuclear, el risc prové de la inadequada manipulació o manteniment de les unitats de radioteràpia.
A més en respirar elevades quantitats de Cobalt podem arribar a experimentar problemes en els pulmons com a asma i pneumònia això passa més en les persones que treballen amb el cobalt.
Els aliments que tinguis partícules de cobalt també poden arribar a fer-nos malbé especialment els vegetals que creixin a partir de sòls contaminats amb aquestes partícules, això pot portar grans efectes en la nostra salut com per exemple:[1]
- Vòmits i nàusees
- Problemes de visió
- Problemes del cor
- Dany de la tiroide
Cobalt a la tecnologia
[modifica]El cobalt conté característiques d'estabilitat, duresa, anti corrosió i resistència a altes temperatures que el fa ideal per al desenvolupament tecnològic com la producció de dispositius electrònics que fem servir diàriament com els telèfons intel·ligents, ordinadors o tauletes.
La funció del cobalt a la tecnologia és que a les bateries que es construeixen amb el cobalt s'utilitza el component d'elèctrode positiu (càtode) i elèctrode negatiu (ànode) això pot ser gràcies al grafit o al carbó. Gràcies al cobalt es pot assolir un rendiment de capacitat d'emmagatzematge tres vegades més gran a les bateries que no utilitzen el cobalt en la seva fabricació. Gràcies al cobalt es busca potenciar el rendiment del liti a les bateries que usem als dispositius electrònics diaris augmentant la seva autonomia.
A mesura que el món avança cap a un futur de zero emissions de gasos d'efecte hivernacle, les bateries a base de cobalt seran cada cop més sol·licitades per ajudar a “descarbonitzar” aquests components i ajudar a integrar l'energia renovable a les xarxes elèctriques.[11]
Un dels problemes del cobalt és que la majoria dels vehicles elèctrics depenen de grans bateries de ions de liti, això porta el dubte sobre la continuïtat del subministrament mundial del metall. Tot i això, el cobalt és un dels elements amb més inquietud. Olivetti científica confirma que els millors càtodes de les bateries de liti contenen cobalt i la seva producció és escassa, per tant, es calcula que passarà el mateix amb el subministrament de cobalt si els cotxes elèctrics fossin tan coneguts com s'espera i els resultats no són confortadors. El càtode de les bateries de liti formen una combinació de cobalt i altres metalls. Les propietats atòmiques d‟aquest element permeten que el càtode guardi una gran quantitat d‟energia en poc espai i ajuden a conservar la seva forma laminar. El cobalt és un subproducte de la mineria de coure i níquel, de manera que la producció depèn de la demanda d'aquests metalls. També, més de la meitat del cobalt del planeta es troba a la inestable República Democràtica del Congo. Reutilitzar bateries de liti és summament difícil, amb prou feines es duu a terme. Però fins i tot amb més taxes de reciclatge i processos més econòmics. Gaines, analista de sistemes, assegura que “el reciclatge no tindrà un impacte significatiu fins deu anys o més després de la introducció en massa dels vehicles elèctrics”. Diversos prototips recents amb alt contingut en níquel reduirien la demanda de cobalt. Els investigadors esperen fer més pràctic el desenvolupament de càtodes sense cobalt.[12]
El cobalt s'utilitza també en imants de ferrita, coneguts com a imants de ceràmica, juntament amb altres metalls com l'òxid de ferro i diversos metalls. Aquests imants es fan servir en ràdios, altaveus, microones, relés, discos, motors d'imant permanent i la cinta magnètica, per emmagatzemar informació.
Altres imants que utilitzen cobalt són els imants d'Alnico, format per alumini i níquel. Aquests ofereixen una bona resistència magnètica i suporten temperatures de fins a 425 °C. Es fan servir en motors elèctrics, pastilles de guitarres elèctriques, coixinets i acoblaments magnètics, sistemes ABS i en aplicacions militars i aeroespacials. A causa de la seva sensibilitat a la desmagnetització, la forma i la longitud són fonamentals.
Actualment, aquest tipus de superaliatges, així com per a certs aliatges ceràmics i cobalt, s'obre camí al camp tecnològic de fabricació de vehicles aeroespacials o estacions orbitals.[13]
Referències
[modifica]- ↑ 1,0 1,1 1,2 «Cobalto - Co». Arxivat de l'original el 2024-05-22. [Consulta: 2 agost 2024].
- ↑ Breve diccionario etimológico de la lengua castellana, Joan Corominas, Madrid, Gredos, 1961.
- ↑ Cobalt Arxivat 2015-05-18 a Wayback Machine., Encyclopædia Britannica Online.
- ↑ Pulak, Cemal «The Uluburun shipwreck: an overview». International Journal of Nautical Archaeology, 27, 3, 1998, pàg. 188–224. DOI: 10.1111/j.1095-9270.1998.tb00803.x.
- ↑ Henderson, Julian. «Glass». A: The Science and Archaeology of Materials: An Investigation of Inorganic Materials. Routledge, 2000, p. 60. ISBN 978-0-415-19933-9. Arxivat 2024-08-03 a Wayback Machine.
- ↑ Rehren, Th. «Aspects of the Production of Cobalt-blue Glass in Egypt». Archaeometry, 43, 4, 2003, pàg. 483–489. DOI: 10.1111/1475-4754.00031.
- ↑ Lucas, A. Ancient Egyptian Materials and Industries. Kessinger Publishing, 2003, p. 217. ISBN 978-0-7661-5141-3.[Enllaç no actiu]
- ↑ Ramberg, Ivar B.. The making of a land: geology of Norway. Geological Society, 2008, p. 98–. ISBN 978-82-92394-42-7. Arxivat 2024-08-03 a Wayback Machine.
- ↑ Cyclopaedia. C. Tomlinson. 9 divs. Cyclopædia of useful arts & manufactures, 1852, p. 400–. Arxivat 2024-08-03 a Wayback Machine.
- ↑ Livingood, J.; Seaborg, Glenn T. «Long-Lived Radio Cobalt Isotopes». Physical Review, 53, 10, 1938, pàg. 847–848. Bibcode: 1938PhRv...53..847L. DOI: 10.1103/PhysRev.53.847.
- ↑ «¿Cuál es la importancia del cobalto en la tecnología?». Arxivat de l'original el 2022-10-21. [Consulta: 2 agost 2024].
- ↑ «El problema del cobalto». Arxivat de l'original el 2023-01-29. [Consulta: 2 agost 2024].
- ↑ «El papel de los imanes en la industria y todas sus aplicaciones». Arxivat de l'original el 2023-07-09. [Consulta: 2 agost 2024].
Vegeu també
[modifica]Enllaços externs
[modifica]- Enciclopèdia Lliure - Cobalt (castellà)
- Los Alamos National Laboratory - Cobalt Arxivat 2004-06-12 a Wayback Machine. (anglès)
- webelements.com - Cobalt (anglès)
- environmentalchemistry.com - Cobalt (anglès)
- Londres celebra 50 anys de Radioteràpia amb Cobalt-60 Arxivat 2007-09-27 a Wayback Machine.
 PDF
PDF
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||

