Fòsfor
| Fòsfor | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
15P
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||
Incolor, blanc cera, groc, escarlata, vermell, violat, negre Fòsfor blanc cerós (tall groc), fòsfor vermell (granulat a l'esquerra i sencer a la dreta) i fòsfor violeta  Línies espectrals del fòsfor | |||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||
| Nom, símbol, nombre | Fòsfor, P, 15 | ||||||||||||||||||||||||
| Categoria d'elements | No metalls | ||||||||||||||||||||||||
| Grup, període, bloc | 15, 3, p | ||||||||||||||||||||||||
| Pes atòmic estàndard | 30,973762(2) | ||||||||||||||||||||||||
| Configuració electrònica | [Ne] 3s2 3p3 2, 8, 5 
| ||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
(blanc) 1,823, (vermell) ≈ 2,2 – 2,34, (violat) 2,36, (negre) 2,69 g·cm−3 | ||||||||||||||||||||||||
| Punt de fusió | (blanc) 44,2 °C, (negre) 610 °C | ||||||||||||||||||||||||
| Punt de sublimació | (vermell) ≈ 416 – 590 °C, (violat) 620 °C | ||||||||||||||||||||||||
| Punt d'ebullició | (blanc) 280,5 °C | ||||||||||||||||||||||||
| Entalpia de fusió | (blanc) 0,66 kJ·mol−1 | ||||||||||||||||||||||||
| Entalpia de vaporització | (blanc) 12,4 kJ·mol−1 | ||||||||||||||||||||||||
| Capacitat calorífica molar | (blanc) 23,824 J·mol−1·K−1 | ||||||||||||||||||||||||
| Pressió de vapor (blanc) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Pressió de vapor (red, p.e. 431 °C) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||
| Estats d'oxidació | 5, 4, 3, 2[1], 1 [2], −1, −2, −3 (òxid àcid suau) | ||||||||||||||||||||||||
| Electronegativitat | 2,19 (escala de Pauling) | ||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 1.011,8 kJ·mol−1 | ||||||||||||||||||||||||
| 2a: 1.907 kJ·mol−1 | |||||||||||||||||||||||||
| 3a: 2.914,1 kJ·mol−1 | |||||||||||||||||||||||||
| Radi covalent | 107±3 pm | ||||||||||||||||||||||||
| Radi de Van der Waals | 180 pm | ||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||
| Estructura cristal·lina | Triclínica 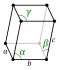
| ||||||||||||||||||||||||
| Ordenació magnètica | (blanc, vermell, violat, negre) diamagnètic[3] | ||||||||||||||||||||||||
| Conductivitat tèrmica | (blanc) 0,236, (negre) 12,1 W·m−1·K−1 | ||||||||||||||||||||||||
| Mòdul de compressibilitat | (blanc) 5, (vermell) 11 GPa | ||||||||||||||||||||||||
| Nombre CAS | 7723-14-0 | ||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||
| Article principal: Isòtops del fòsfor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
El fòsfor és l'element químic de símbol P i nombre atòmic 15. És un no-metall multivalent pertanyent al grup del nitrogen (grup 15) que es troba en la natura combinat en fosfats inorgànics i en organismes vius, però mai en estat natiu. Tot i ésser relativament poc abundant en la natura (l’escorça terrestre en conté només un 0,1%), té una importància considerable en els regnes animal i vegetal. És un component de certes proteïnes del sistema nerviós i de la sang, les quals, en forma de fosfats, constitueixen la part mineral dels ossos; la proporció de fòsfor en els teixits vivents és constant en relació amb la del calci. És molt reactiu i s'oxida espontàniament en contacte amb l'oxigen atmosfèric emetent llum, donant nom al fenomen de la fosforescència. La principal aplicació són els fertilitzants en forma de diferents fosfats.
Història[modifica]

El fòsfor —del llatí phosphorus, i aquest del grec φωσφóρος, 'portador de llum'— antic nom del planeta Venus, fou descobert per l'alquimista alemany Hennig Brand (1630-1710) el 1669 a Hamburg en destil·lar una mescla d'orina i arena, mentre buscava la pedra filosofal,[4] malgrat que hi ha fonts que indiquen que ja era conegut per Jean Fernel (1497-1558), el metge de la cort del rei Enric II de França (1519-1559).[5]
L'orina evaporada conté fosfat d'amoni i de sodi (NaNH4HPO4) i urea (NH2)2CO. Quan Brandt escalfà molt aquesta barreja s'emeteren vapors de fòsfor que condensà sota l'aigua en forma de sòlid blanc tou, el qual brillava en la foscor i cremava amb una flama brillant; des de llavors, les substàncies que brillen en la foscor sense cremar s'anomenen fosforescents. Brandt mantingué en secret el seu descobriment, pensant que havia descobert la pedra filosofal que podria convertir els metalls bàsics en or.[6] El 1675 Brandt fou pressionat per Johann Kunckel (1630-1703), el farmacèutic de la Cort de Prússia, per divulgar el secret de la seva obtenció. Quan es quedà sense doblers, vengué fòsfor a un amic de Kunckel, Daniel Kraft, que l'exposà arreu d'Europa, inclòs Londres davant el rei Carles II (1630-1685) el 1677 on Robert Boyle (1627-1691) quedà fascinat. Boyle intentà obtenir el secret de la seva preparació però Kraft no volgué revelar-lo, tot i que, a canvi d'altres informacions de Boyle, li digué que provenia de «quelcom que pertanyia al cos de l'home». Per molt que ho intentessin, Boyle i el seu ajudant, Ambrose Godfrey (1660-1741), no foren capaços d'obtenir fòsfor a partir de l'orina, que havien deduït amb raó que era el «quelcom» al qual Kraft es referia. Només fou com a resultat d'investigacions posteriors realitzades per Godfrey durant una visita a Alemanya que descobriren les temperatures molt altes (foc roig) necessàries per a la reacció. Amb aquesta informació aconseguiren fabricar el nou material, que Boyle anomenà «noctiluca» ‘llum de nit’.[4] Boyle obtingué decaòxid de tetrafòsfor, P4O10, fent reaccionar el fòsfor amb oxigen i en posar-lo dins d'aigua obtingué àcid fòsfòric H3PO4.[7]

També Boyle volia mantenir en secret el mètode d'obtenció del fòsfor i, per tant, diposità la recepta a la Royal Society el 14 d'octubre de 1680 en un sobre segellat que no s'havia d'obrir fins a la seva mort.[4] El 1688 el metge Johann Christopher Kletwich identificà fòsfor a la cendra de mostassa i, per tant, a les plantes.[5][a] Mentre tant, Godfrey continuà fabricant fòsfor blanc de gran qualitat a partir d'orina i fems animals. Venia el producte a la seva botiga a Covent Garden i la seva empresa tengué un virtual monopoli del mercat durant 100 anys.[4]
Abans que Kraft viatgés a Londres el 1677, Kunckel havia pressionat Brand i Kraft per aconseguir el secret del fòsfor i Kunckel li donà la mateixa insunuació que després donà a Boyle. Kunckel en sis mesos de recerca descobrí el mètode d'obtenció i entrà en el negoci, venent «pastilles lluminoses», cadascuna de les quals contenia 200 mg de fòsfor. Es deia que tenien un efecte calmant i es recomanaven com a tractament adequat per a l'asma, el tètanus, l'apoplexia i la gota. Si el fòsfor hagués estat pur, cada pastilla hauria contingut el doble de la dosi letal! Es pot suposar que els enverinaments s'evitaven perquè la major part del fòsfor s'oxidava a fosfat inofensiu quan es prenia la pastilla.[4]
En menys de cinquanta anys des de la seva descoberta, el fòsfor ja es produïa i es venia a apotecaris, filòsofs naturals i exhibicionistes, que feien que aquest element fos el centre de demostracions a les corts dels prínceps i les societats científiques. En menys de cent anys, el fòsfor ja es trobava als llibres de química, com ara l'Élémens de chymie théorique del químic francès Pierre J. Macquer (1718-1784), que fou molt popular. En cinquanta anys més, l'element ja s'estava utilitzant en la producció de llumins, fertilitzants i bombes, un cop els fosfats minerals havien reemplaçat l'orina com a la millor font de material.[8]

La popularitat del fòsfor com a medicament rebé un impuls el 1719 quan el químic alemany Johann Thomas Hensing (1683–1726) n'extragué del teixit cerebral. Aquest descobriment portà a la teoria popular que el fòsfor estava relacionat amb la intel·ligència; es suposava que una intel·ligència mitjana indicava massa poc fòsfor, però massa estimulava el cervell fins a la bogeria. No obstant això, en els éssers vius no és la forma elemental del fòsfor la que és un component essencial, sinó l'ió fosfat PO43–. De fet, el fosfat afegit es convertí eventualment en una moda alimentària i en un compost medicinal al segle xix. No obstant això, el fòsfor blanc, per perillós que fos, continuà sent part del repertori de medicaments durant gairebé 300 anys. La quantitat prescrita es reduí a un màxim de 8 mg al segle XIX, i a 3 mg en el segle xx. Les pastilles que contenien fòsfor no desaparegueren de les farmacopees fins després de la Segona Guerra Mundial. És sorprenent que el tractament que implicava fòsfor elemental fos beneficiós per a cap afecció i que hagi perdurat durant tant de temps.[4]

Les petites quantitats de fòsfor requerides pels primers químics i metges es podien produir a partir d'excrements d'animals i es produïren d'aquesta manera durant gairebé 100 anys. Després, el 1769, el ric mineralòleg i químic suec Johan Gottlieb Gahn (1745-1818) descobrí que els ossos contenien principalment fosfat de calci Ca3(PO4)2[4] i descobrí el primer mineral que contenia fòsfor, la piromorfita Pb5(PO4)3Cl.[7] L'any següent, el seu amic i col·laborador, el químic suec Carl Wilhelm Scheele (1742-1786), publicà aquesta informació i la seguí amb els detalls del seu propi procés pel qual es podia produir fòsfor a partir de les cendres d'ossos.[4] El seu mètode, lleugerament modificat, es convertí en la base de la incipient indústria del fòsfor. Consistia en tractar les cendres d'ossos amb àcid sulfúric H₂SO4 per convertir-les en àcid fosfòric H3PO4 i sulfat de calci CaSO4 insoluble:
L'àcid fosfòric s'evaporava fins a obtenir un xarop i després s'escalfava amb carbó i sorra en retortes de terrissa.
S'alliberava vapor de fòsfor i es condensava sota l'aigua.[9] El mètode s'adaptà més tard als fosfats minerals com a matèria primera en el següent segle, però romangué fonamentalment inalterat durant uns 100 anys.[4]

El 1831 el francès Marc Charles Sauria (1812-1895) fabricà el primers llumins amb fòsfor blanc. El 1848 el químic austríac Anton Schrötter von Kristelli (1802-1875) obtingué el fòsfor vermell. El 1855 el suec Johan Edvard Lundström (1815-1888) produí els primers mistos de seguretat (en encendre'ls es converteix el fòsfor vermell en blanc per la calor de la fricció; el fòsfor blanc s'encén). El 1898 els francesos Henri Sevene i Emili David Cahen sunstitueixen el fòsfor dels mixtos de seguretat per trisulfur de pentafòsfor P4S3. El 1906 la Convenció de Berna prohibeix l'ús de fòsfor blanc als llumins. El 1914 P.W. Bridgeman descobrí el fòsfor negre.[7]
Estat natural i obtenció[modifica]

Estat natural[modifica]
El fòsfor és un element molt àmpliament distribuït. La seva elevada reactivitat química assegura que no es trobi en estat lliure (excepte en algunes meteorits) i es presenta sempre en forma de fosfat. Ocupa el 12è lloc en abundància a l'escorça terrestre, contribuint-hi amb aproximadament un 0,10 % de la seva massa i una concentració mitjana de 1 050 ppm a les roques (la roca fosfatada en té un 10,5-15,0 % i el guano un 10,0 %) i 500 ppm als sòls.[7] En aquests es troba en forma de fosfats de calci, de ferro o d'alumini: strengita FePO4·2H₂O, vivianita Fe₃(PO4)₂·8H₂O, berlinita AlPO4, taranakita K₃Al5H6(PO4)₂·8H₂O, fluorapatita 3Ca3(PO4)2·CaF2, oxiapatita 3Ca3(PO4)2·CaO, apatita carbonatada 3Ca3(PO4)2·CaCO3 i hidroxilapatita 3Ca3(PO4)2·Ca(OH)2.[10]
A l'aigua de la mar la concentració és de només 0,07 ppm, majoritàriament el forma d'hidrogenfosfat HPO42– (79,2 %) i fosfat PO43– (20,4 %). En el cos humà hi és en un 1,0 %, majoritàriament als ossos (12 %) i a les dents (8 %). Al sistema solar hi ha un àtom de fòsfor per cada 100 àtoms de silici, l'element estàndard. Minerals de la sèrie de l'apatita s'han trobat a la Lluna i també florenskiïta FeTiP i schreibersita (Fe,Ni)3P; el fosfà PH3 a les atmosferes de Venus, Júpiter (el colors vermells de la seva atmosfera poden ser deguts al fòsfor vermell) i Saturn. A l'atmosfera de Venus també s'ha detectat l'òxid de fòsfor(III) P4O6; i a l'espai interestel·lar s'han detectat les molècules PH, PN, PO, PC i HCP.[7]

S'han trobat al voltant de 550 minerals diferents que contenen fòsfor, però la font principal de fòsfor és la sèrie d'apatites, en què coexisteixen cations calci(2+) juntament amb anions fosfat i quantitats variables d'anions fluorur, clorur o hidròxid, segons la fórmula Ca10(PO4)6(F,Cl,OH). Altres minerals importants que contenen fòsfor són la wavel·lita Al₃[(OH)₃(PO4)₂·5H₂O i la vivianita Fe2+₃(PO4)₂·8H₂O. Sovint àtoms de magnesi, manganès, estronci o plom substitueixen el catió calci(2+) en el mineral, i anions com el silicat, el sulfat, el vanadat i similars substitueixen els anions fosfat. Es troben immenses acumulacions sedimentàries de fluorapatita Ca10(PO4)6F₂ en moltes parts de la Terra. El fosfat present en ossos i esmalt dental és hidroxilapatita Ca10(PO4)6(OH)₂.[11]

Obtenció[modifica]
La principal font comercial del fòsfor és la roca fosfatada, una forma massiva impura d'apatita que conté carbonat. Les estimacions de la quantitat total de roca fosfatada a l'escorça terrestre es troben al voltant de 72 Gt, de les quals Marroc (jaciments de Youssoufia i Khouribga) i el Sàhara Occidental (jaciment de Bucraa) en contenen aproximadament un 70 % (50 Gt). Aquesta estimació només inclou els minerals que són prou rics en fosfat per ser convertits en productes útils mitjançant els mètodes actuals. Existeixen també quantitats enormes de material amb un contingut més baix de fòsfor. Els principals productors mundials el 2022 foren la Xina (85 Mt), Marroc (40 Mt), Estats Units (21 Mt), Rússia (13 Mt) i Jordània (10 Mt). La producció total mundial fou de 220 Mt.[12]
La principal tècnica per convertir la roca fosfatada en materials utilitzables implica l'acidulació de la roca triturada amb àcid sulfúric o àcid fosfòric per formar fosfats de calci hidrogenats crus que, sent solubles en aigua, són addicions valuoses als fertilitzants. La majoria de la producció es converteix en decaòxid de tetrafòsfor P4O10 i posteriorment es tracta amb aigua per formar àcid fosfòric, H₃PO4. La major part de la roca fosfatada s'utilitza per produir fertilitzants o suplements alimentaris per als animals. No obstant això, han sorgit preocupacions sobre l'ús del fòsfor. La major part del fòsfor es malbarata en el seu trajecte des de la mineria fins a la seva consumició per part dels humans, i el fòsfor malbaratat acaba en vies aquàtiques on pot causar floracions d'algues. Una altra preocupació és que l'augment de l'ús del fòsfor esgotarà les existències no renovables de roca fosfatada.[11]
L'obtenció de fòsfor blanc es pot realitzar escalfant fluorapatita amb diòxid de silici i carboni a temperatures entre 1 200 °C i 1 500 °C segons la següent reacció:[13]
També es pot obtenir a partir de fosfat de calci escalfant a 1 500 °C:[13]
Característiques[modifica]
La configuració electrònica de l'àtom de fòsfor és 1s2 2s22p6 3s23p³. La capa de valència és com la del nitrogen (2s22p³), amb tres orbitals p semi-plens cadascun capaç de formar un únic enllaç covalent i una parella de electrons solitaris addicionals. Depenent de l'electronegativitat dels elements amb els quals es combina, el fòsfor pot exhibir estats d'oxidació de +3 o –3, igual que fa el nitrogen. Les principals diferències entre el nitrogen i el fòsfor resideixen en que aquest últim té una electronegativitat considerablement més baixa (2,19 front a 3,04 del nitrogen) i àtoms més grans (radi covalent de 107 pm front als 71 pm del nitrogen) amb orbitals d disponibles a la capa externa. Per aquestes raons, les similituds entre la química del nitrogen i del fòsfor són en gran part formals i tendeixen a ocultar les diferències reals i significatives. Els orbitals d externs en el fòsfor permeten una expansió de l'octet, la qual cosa condueix a l'estat +5, amb la formació de cinc unions covalents reals en compostos, una condició impossible d'assolir pel nitrogen.[11]

Propietats físiques[modifica]
La primera diferència sorprenent en la química del nitrogen i del fòsfor és que aquest existeix en condicions normals en deu formes al·lotròpiques, totes sòlides; els tres al·lòtrops principals són el fòsfor blanc, el vermell i el negre. Les molècules de fòsfor de fórmula P₂, estructuralment anàlogues a les molècules de N₂ i evidentment també amb un enllaç triple, només existeixen a molt altes temperatures. Aquestes molècules P₂ no persisteixen a temperatures més baixes, per sota d'aproximadament 1 200 °C, a causa del fet que tres enllaços simples en el fòsfor, en contraposició a la situació amb el nitrogen, són energèticament més favorables que un enllaç triple. En refredar-se, les molècules P₂ amb enllaç triple es condensen per formar molècules tetraèdriques P4, en les quals cada àtom està situat en un vèrtex d'un tetràedre i unit als altres tres mitjançant enllaços covalents σ.[11]
Fòsfor blanc[modifica]
El fòsfor blanc, fòsfor groc o fòsfor ordinari, és de color d'ambre i d'olor al·liàcia i té dos al·lòtrops: la forma α, que és estable a temperatures normals, té una estructura cristal·lina cúbica; i la forma β, que és estable per sota de –78 °C, té una estructura cristal·lina hexagonal. A causa de les atraccions intermoleculars relativament febles (forces de van der Waals) entre les molècules P4 separades, el sòlid es fon fàcilment a 44,15 °C i bull aproximadament a 280,5 °C. La seva densitat és d'1,82 g/cm³. La formació de tetràedres requereix angles d'enllaç de 60° en lloc dels angles preferits de 90°–109°, de manera que el fòsfor blanc és una forma relativament inestable o metaestable. El fòsfor blanc es dissol fàcilment en solvent com el disulfur de carboni, en el qual manté la composició P4.[11]
Fòsfor vermell[modifica]
El fòsfor blanc canvia espontàniament, però lentament, a temperatures d'aproximadament 200 °C o superiors, a una forma polimèrica anomenada fòsfor vermell, de color que varia del rosa al morat. Aquesta substància és amorfa quan es forma a temperatures més baixes, però pot esdevenir cristal·lina, amb un punt de fusió d'aproximadament 590 °C. És insoluble i molt menys volàtil que el fòsfor blanc. El fòsfor vermell és relativament inert, tot i que grans quantitats de la forma comercial usual poden encendre's espontàniament a l'aire i reaccionar amb l'aigua per formar fosfina i oxiàcids de fòsfor.[11]
Fòsfor negre[modifica]
A temperatures i pressions més altes, o amb l'ajuda d'un catalitzador, a pressions normals i una temperatura d'aproximadament 200 °C, el fòsfor es converteix en una forma cristal·lina negra (fòsfor negre) i escamosa, que es sembla en certa manera al grafit. Això pot demostrar ser la forma més estable de fòsfor, malgrat la relativa dificultat de la seva preparació. En les formes vermella i negra, cada àtom de fòsfor forma tres enllaços simples, els quals estan prou separats per ser relativament lliures de tensions. El fòsfor negre és més inert i és capaç de conduir electricitat. És insoluble i molt menys volàtil que el fòsfor blanc.[11]
Propietats químiques[modifica]

En consonància amb la condició metaestable de la forma blanca i l'amuntegament dels seus enllaços covalents, aquesta forma és molt més reactiva químicament que les altres. És altament tòxica, reacciona amb virulència amb la majoria dels reactius i s'inflama a l'aire a només 35 °C per a produir decaòxid de tetrafòsfor segons la reacció:[14]
Per aquesta raó ha de ser emmagatzemat sota aigua o altres líquids inerts. Si es controlen les condicions (75 % O₂, 25 % N₂, 50 °C i 90 mmHg) es pot obtenir un altre òxid, l'hexaòxid de tetrafòsfor:[14]
El fòsfor és utilitzat gairebé exclusivament en forma de composts, generalment en els estats d'oxidació de +3, +5 i –3. A diferència del nitrogen i d'altres elements del seu grup de la taula periòdica, el fòsfor tendeix a mostrar una preferència per l'estat +5.

D'una gran importància econòmica és el fosfà o trihidrur de fòsfor, PH₃. Aquest compost gasós es produeix ja sigui per l'acció d'una base forta (o aigua calenta) sobre el fòsfor blanc, per exemple amb l'hidròxid de potassi s'obté:
o per la hidròlisi d'un fosfur metàl·lic (fosfur d'alumini o fosfur de calci, habitualment):
Una altra reacció que produeix fosfà és la reacció directa d'hidrogen amb fòsfor. La reacció s'afavoreix a altes pressions i baixes temperatures.[15]

Entre els compostos de fòsfor més importants comercialment es troben els òxids i els àcids. Molta part del fòsfor blanc produït industrialment es crema per formar decaòxid de tetrafòsfor, P4O10. Aquest compost es pot obtenir en forma de pols blanca tova o sòlid cristal·lí incolor. Grans quantitats es tracten amb aigua per obtenir àcid fosfòric H₃PO4, que té diverses aplicacions industrials, incloent la producció de fosfats, sals que contenen l'io fosfat PO43–, l'io hidrogenfosfat HPO42– o l'io dihidrogenfosfat H₂PO4–. Una altra sal, preparada per l'acció de l'àcid fosfòric sobre la roca fosfat, és el dihidrogenfosfat de calci o superfosfat, Ca(H₂PO4)₂, el fertilitzant de fòsfor més utilitzat.[11]
Amb els elements halògens, el fòsfor forma diversos halurs; PX₃ (en què X és F, Cl, Br o I) i PX5 (en què X és F, Cl o Br) són les dues sèries simples. És interessant notar que els sòlids PCl5 i PBr5 contenen cations PX4+ i anions PX6– en lloc de molècules PX5. Aquests halurs s'utilitzen per a la síntesi de compostos orgànics de fòsfor. El fòsfor reacciona amb el sofre per formar diversos sulfurs, com el el trisulfur de tetrafòsfor P4S₃, i que s'utilitzen en la fabricació de compostos orgànics i fòsfor.[11] Es combina també, en calent, amb gairebé tots els metalls, que transforma en fosfurs, com el fosfur de calci Ca₃P₂. És un reductor que descompon el vapor d’aigua, amb producció d’hidrogen i de diferents òxids de fòsfor; a la temperatura ordinària redueix les sals dels metalls poc oxidables: un bastonet de fòsfor immergit en una solució de sulfat de coure(II) es recobreix d’una capa de coure metàl·lic. El fòsfor descompon les solucions alcalines, amb despreniment de fosfà PH₃, que s’inflama espontàniament amb producció d’hipofosfits dissolts.[16]

Els àtoms de fòsfor poden unir-se amb àtoms d'oxigen per formar grups èster. Aquests poden unir-se amb àtoms de carboni, donant lloc a una gran quantitat de compostos orgànics de fòsfor. Aquests es troben en molts processos biològics importants. Els fosfoglicèrids, per exemple, són necessaris per a la fermentació. Els fosfats d'adenosina (AMP, ADP i ATP) són essencials en la fotosíntesi i per a l'acció muscular; el trifosfat d'adenosina (ATP) juga un paper central en el metabolisme i es troba a les cèl·lules de tots els éssers vius.[11]
Isòtops[modifica]
A la natura només hom troba un isòtop del fòsfor, el fòsfor 31, que és estable. Tanmateix, s'han obtingut vint-i-dos isòtops des del fòsfor 24 al fòsfor 46, tots inestables. Els que tenen un període de semidesintegració més llarg són el fòsfor 33 (T½ = 25,35 d), el fòsfor 32 (T½ = 14,27 d) i el fòsfor 30 (T½ = 2,5 min). Els de nombre màssic superior a 31 es desintegren tots per emissió de partícules β– i la resta, els que tenen nombre màssic inferior a 31 per captura electrònica (excepte el fòsfor 25 que ho fa per emissió de protons).[17] De tots aquests isòtops l'únic que té aplicacions significatives és el fòsfor 32.[18]
Aplicacions[modifica]
Indústria química[modifica]

L'àcid fosfòric concentrat es fa servir en l'obtenció dels fosfats usats en la producció de fertilitzants agrícoles: superfosfat ordinari Ca(H₂PO4)₂·CaSO4, superfosfat triple Ca(H₂PO4)₂, fosfat de monoamoni NH4H₂PO4, fosfat de diamoni (NH4)₂HPO4, polifosfat d'amoni (NH4)4P₂O7, dihidrogenfosfat de potassi KH₂PO4.[10]
Un gran nombre d'insecticides organofosfats com diclorvós, malathion i parathion, són agents nerviosos (inhibidors de l'acetilcolinesterasa). Hi ha una creixent preocupació pels seus efectes a llarg termini i els efectes en els treballadors de les plantes de la seva fabricació i en els agricultors. En alguns llocs del món la seva ingestió és el mètode preferit per suïcidar-se.[19]
Indústria electrònica[modifica]
El fòsfor s'utilitza en la fabricació de díodes i de tubs de raigs catòdics, on és excitat per un feix d'electrons i produeix fluorescència. El fòsfor genera la major part de la intensitat de llum en les làmpades fluorescents. El fòsfor, activat per metalls de terres rares, és un material fosforescent que s'empra en la fabricació de pantalles de cristall líquid i de plasma.[20]
Medicina[modifica]
Les emissions β– del fòsfor 32 es poden utilitzar en la teràpia farmacològica de masses òssies canceroses. Mitjançant la injecció d'un pacient amb un farmac que contingui P-32, es poden dirigir als tumors i provocar la mort cel·lular. Per exemple, la policitèmia vera és una malaltia que consisteix en un excés de glòbuls vermells a la medul·la òssia. Amb P-32 es pot tractar aquesta malaltia reduint-ne la quantitat de glòbuls vermells. No obstant això, actualment no hi ha cap cura per a aquesta malaltia. També, mitjançant l'ús d'un producte de bio-silicona marcat amb P-32, aquest isòtop s'ha utilitzat com a blanc radioactiu en la braquiteràpia de tumors sòlids al pulmó.[18]

Per a tractar l'engrandiment de la pròstata s'utilitza el làser Nd:YAG amb fosfat de potassi i titanil KTiOPO4 amb uns resultats molt bons, semblants als obtinguts amb el làser d'holmi, ja que no provoca hemorràgies ni complicacions i té una gran afinitat amb l’hemoglobina i, per tant, suposa una estada de poques hores en el centre hospitalari. També té molta utilitat en dermatologia.[20]
Indústria militar[modifica]

El fòsfor blanc ha estat utilitzat amb fins militars com a font de fum i per omplir granades i projectils incendiaris. El fòsfor vermell s'utilitza en la preparació de la superfície de fricció per a les bengales de seguretat.[20]
Composts organofosforats s'han emprat com a agents nerviosos (inhibidors de l'acetilcolinesterasa) en concflictes bèlics, especialment durant la Segona Guerra Mundial, i en algun atentat terrorista. Els alemanys obtingueren el 1936 el tabun, el GB o gas sarín el 1939, després el GD o soman el 1944 i finalment el GF o ciclosarín el 1949. A Anglaterra sintetitzaren altres tipus de composts organofosforats, essent el més conegut l'agent VX.[21]
Altres camps[modifica]
El fòsfor s'utilitza en la fabricació de pintures fluorescents. El fòsfor vermell s'utilitza en la fabricació de llumins. Les bateries d'ió liti, amb càtode d'òxid de cobalt(III) i liti, s'escalfen molt i hi ha perill d'incendi si se sobrecarreguen. Actualment s’experimenta amb bateries d'ió liti amb fosfat de ferro (més pesades però més segures i més econòmiques), per a segons quines aplicacions.[20]
El fòsfor 32 s'empra en bioquímica com a traçador per estudiar les reaccions buioquímiques dels éssers vius. Per exemple, una solució de fosfat que conté P-32 (que té el mateix comportament que el P-31 natural i no radioactiu) es pot injectar a les arrels d'una planta, i a continuació, es pot seguir el seu desplaçament a través de la planta mitjançant l'ús d'un comptador Geiger. Aquest estudi de detecció de moviment ajuda els científics a comprendre millor com les plantes utilitzen el fòsfor per reproduir-se i créixer.[18]
Rol biològic[modifica]
El fòsfor és un component fonamental de tots els organismes vius. És un dels components estructurals principals dls ossos i les dents en forma d'hidroxiapatita. Els fosfolípids, com ara la fosfatidilcolina, són components estructurals importants de les membranes cel·lulars. Tota la producció i emmagatzematge d'energia depèn de compostos fosforilats, com el trifosfat d'adenosina (ATP) i la fosfocreatina. Els àcids nucleics (ADN i ARN), els quals són responsables de l'emmagatzematge i transmissió de la informació genètica, són llargues cadenes de molècules fosforades. Un cert nombre d'enzims, hormones i molècules de senyalització cel·lular depenen de la fosforilació per a la seva activació. El fòsfor també ajuda a mantenir l'equilibri àcid-base (pH) normal en actuar com un dels reguladors més importants de l'organisme. A més, el 2,3-difosfoglicerat (2,3-DPG), una molècula fosforada, s'uneix a l'hemoglobina en els glòbuls vermells i regula la distribució d'oxigen als teixits del cos.[22] És eliminat per l’orina en forma de fosfats alcalins i alcalinoterris que provenen dels aliments i de la metabolització dels derivats orgànics del fòsfor; l’eliminació normal és de 2 a 3 g/l d’orina, i augmenta exageradament en els casos patològics.[16]

Cicle del fòsfor[modifica]
Les plantes dissolen formes ionitzades de fòsfor que han estat rentades de les roques i immobilitzades en el sòl, i les incorporen. El pas d’aquest element pels herbívors i els carnívors és molt ràpid, i retorna al sòl per l’acció de microorganismes. A diferència d’altres elements com el nitrogen, el seu pas per la litosfera i la hidrosfera és molt lent, i no es troba en quantitats significatives a l’atmosfera.[23]
El fòsfor en els aliments[modifica]

El fòsfor es troba en la majoria dels aliments perquè és un component fonamental de tots els organismes vius. Els productes lactis, els productes de cereals, la carn i el peix són fonts particularment riques en fòsfor. El fòsfor també és un component de molts additius alimentaris utilitzats en el processament d'aliments i es troba en la majoria de les begudes gasoses com àcid fosfòric.[22]
El fòsfor en les llavors vegetals (fesols, pèsols, cereals i nous) es troba present en una forma d'emmagatzematge de fosfat anomenada àcid fític o fitat. Només al voltant del 50 % del fòsfor en els fitats es troba disponible per als éssers humans, ja que manquem de les enzims (fitases) que alliberar-lo. Els llevats posseeixen fitases, per la qual cosa els grans sencers incorporats al pa amb llevat tenen una major biodisponibilitat del fòsfor que els grans sencers incorporats als cereals de l'esmorzar o als pans sense llevat. A causa que la reducció de l'absorció dietètica de fòsfor pot beneficiar individus amb insuficiència renal que es troben en risc d'hiperfosfatèmia (fòsfor en el sèrum en o per damunt del rang normal-alt), les fonts de proteïna del fòsfor en dietes vegetarianes a base de grans poden ser preferides sobre les dietes a base de carn.[22]
Toxicologia[modifica]
Una deficiència de fòsfor als humans pot provocar manca d'apetit, anèmia (baix nivell de glòbuls vermells), debilitat muscular, problemes de coordinació, dolor òs, ossos toves i deformats, un major risc d'infecció, una sensació de cremor o picor a la pell i confusió. Tanmateix, la deficiència de fòsfor és molt rara.[24]
Quan es pateix una insuficiència renal crònica greu, els ronyons deixen de funcionar adequadament i no poden eliminar l'excedent de fòsfor. El fòsfor s'acumula a la sang i pot afectar la salut òssia i agreujar la malaltia renal, augmentant el risc de mort.[24]
Precaucions[modifica]
Pictogrames de perill del GHS pel fòsfor blanc[25]
-
Perillós pel medi ambient.
El fòsfor és extremadament tòxic, només 50 mg constitueixen una dosi letal. L'exposició al fòsfor blanc no ha de superar els 0,1 mg/m³ (mitjana ponderada pel temps de 8 hores per a una setmana laboral de 40 hores). Per altra banda, el fòsfor blanc s'ha d'emmagatzemar submergit en aigua (ja que és perillosament reactiu a l'aire) i ha de ser manipulat amb pinces, ja que el contacte amb la pell pot causar greus cremades.[18]
Quan s'exposa a la llum solar o s'escalfa a 250 °C, el fòsfor blanc es converteix en fòsfor vermell, que no fosforeix a l'aire com ho fa el fòsfor blanc. Aquesta forma no s'enflama de manera espontània i no és tan perillosa com el fòsfor blanc. No obstant això, ha de ser manipulada amb precaució ja que pot convertir-se en la forma blanca a certes temperatures i emet fums altament tòxics dels òxids de fòsfor quan s'escalfa. El fòsfor vermell és bastant estable, sublima amb una pressió de vapor de 1 atm a 17 °C.[18]
Notes[modifica]
- ↑ Algunes fonts d'informació indiquen que l'autor de la tesi doctoral és Bernhard Siegfried Albinus (1653–1721), confonent el president del tribunal amb el seu autor Johann Christopher Kletwich.
Referències[modifica]
- ↑ webelements
- ↑ Ellis, Bobby D.; MacDonald, Charles L. B. «Phosphorus(I) Iodide: A Versatile Metathesis Reagent for the Synthesis of Low Oxidation State Phosphorus Compounds». Inorganic Chemistry, 45, 17, 2006, pàg. 6864–74. DOI: 10.1021/ic060186o. PMID: 16903744.
- ↑ Magnetic susceptibility of the elements and inorganic compounds
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 4,8 Emsley, J. «The shocking history of phosphorus». New Scientist, 30-06-1977.
- ↑ 5,0 5,1 Kletwich, J.C. Dissertatio de Phosphoro Liquido & Solido (tesi) (en llatí). Typis Zeitlerianis. Francofurti ad Oderam, 1688.
- ↑ «Phosphorus - Element information, properties and uses | Periodic Table». [Consulta: 6 octubre 2023].
- ↑ 7,0 7,1 7,2 7,3 7,4 Corbridge, Derek Edgar Charles. Phosphorus: chemistry, biochemistry and technology. 6th ed. Boca Raton: CRC press, 2013. ISBN 978-1-4398-4088-7.
- ↑ «Hennig Brandt and the Discovery of Phosphorus» (en anglès americà). [Consulta: 6 octubre 2023].
- ↑ Ptáček, Petr. Apatites and their Synthetic Analogues - Synthesis, Structure, Properties and Applications (en anglès). InTech, 2016-04-13. DOI 10.5772/62215. ISBN 978-953-51-2265-4.
- ↑ 10,0 10,1 Osman, Khan Towhid. Soils: principles, properties and management. Dordrecht Heidelberg: Springer, 2013. ISBN 978-94-007-5662-5.
- ↑ 11,00 11,01 11,02 11,03 11,04 11,05 11,06 11,07 11,08 11,09 Britannica, The Editors of Encyclopaedia. «phosphorus». Encyclopedia Britannica, 11-08-2023. [Consulta: 8 octubre 2023.].
- ↑ «Phosphate Rock Statistics and Information». U.S. Geological Survey, Gener 2023. [Consulta: 8 octubre 2023].
- ↑ 13,0 13,1 Kloprogge, J. Theo; Ponce, Concepcion P.; Loomis, Tom A. The periodic table, nature's building blocks: an introduction to the naturally occurring elements, their origins and their uses. Amsterdam: Elsevier, 2020. ISBN 978-0-12-821538-8.
- ↑ 14,0 14,1 Winter, Mark. «Phosphorus. Reactions». WebElements Periodic Table. The University of Sheffield and WebElements Ltd. [Consulta: 9 octubre 2023].
- ↑ Toy, Arthur D. F.. The Chemistry of Phosphorus: Pergamon Texts in Inorganic Chemistry. Elsevier, 2016. ISBN 9781483139593.
- ↑ 16,0 16,1 «fòsfor». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ «Z = 15». NuDat 3. National Nuclear Data Center (NNDC) at Brookhaven National Laboratory. [Consulta: 16 octubre 2023].
- ↑ 18,0 18,1 18,2 18,3 18,4 «Phosphorus | P (Element) - PubChem». [Consulta: 16 octubre 2023].
- ↑ Buckley, Nick A «Overcoming apathy in research on organophosphate poisoning"». BMJ, 329, 18-11-2004, pàg. 1231-1233.
- ↑ 20,0 20,1 20,2 20,3 Sanz Balagué, J.; Tomasa Guix, O. Elements i recursos minerals: aplicacions i reciclatge (en iniciativa politècnica). 3a. Barcelona: Iniciativa Digital Politècnica, 2017. ISBN 978-84-9880-666-3.
- ↑ Emergency Nurses Association. Sheehy. Enfermería de Urgencias: Principios y práctica. Elsevier España, 2020. ISBN 9788491138556.
- ↑ 22,0 22,1 22,2 «Fósforo» (en anglès). Institut Linus Pauling, 20-05-2014. [Consulta: 15 octubre 2023].
- ↑ «Cicle del fòsfor». Gran Enciclopèdia Catalana. Grup Enciclopèdia. [Consulta: 15 octubre 2023].
- ↑ 24,0 24,1 «Fósforo» (en castellà). National Institutes of Health. [Consulta: 16 octubre 2023].
- ↑ PubChem. «Phosphorus» (en anglès). [Consulta: 16 octubre 2023].
Enllaços externs[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Fòsfor |
- Enciclopèdia Lliure (castellà)
- Los Alamos National Laboratory - fòsfor Arxivat 2004-06-11 a Wayback Machine. (anglès)
- webelements.com - fòsfor (anglès)
- environmentalchemistry.com - fòsfor (anglès)
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||




















