Química atmosfèrica

La química atmosfèrica és la branca de la química centrada en processos químics dins de l'atmosfera terrestre. La recerca en aquesta àrea és fonamental per millorar la comprensió de la força climàtica, la qualitat de l'aire i les interaccions recíproques entre l'atmosfera i la biosfera. Aquest camp de recerca se situa, per tant, en l{a intersecció de la química amb la física i la biologia, i inclou processos que actuen en escales temporals i espacials per sota dels segons i mm a les que es produeixen a escales de dècades i globals. El camp està evolucionant ràpidament a causa dels avenços en la comprensió fonamental dels processos químics a l'atmosfera, noves innovacions tant en tecnologies de mesurament in situ com en teledetecció i millores en descripcions de processos clau en models numèrics.
L'atmosfera terrestre es compon de quatre capes:
- La troposfera comença a nivell del terra i s'estén aproximadament fins a 16 km.
- La capa següent és l'estratosfera, que es troba aproximadament a 16-48 km per sobre de la superfície de la Terra.
- Per sobre de l'estratosfera hi ha la mesosfera (48–97 km per sobre de la superfície de la Terra).
- Més enllà de la mesosfera hi ha la termosfera.[1]
Tot i que cada capa té una composició diferent, la troposfera i l'estratosfera són les capes crítiques als problemes del canvi climàtic. Des de l'inici del desenvolupament industrial i l'augment associat de la crema de combustibles fòssils, els humans han anat alterant la composició i la química de l'atmosfera. Més recentment, la introducció d'halocarburs sintètics també ha tingut un impacte en la composició atmosfèrica. L'atmosfera és una barreja de gasos que inclou al voltant del 78 % de nitrogen i un 21 % d'oxigen a la superfície terrestre. La resta de l'atmosfera propera a la superfície terrestre està formada per diòxid de carboni i quantitats traça d'altres gasos. És l'augment del diòxid de carboni i altres gasos que ha alterat la química atmosfèrica. El diòxid de carboni, el metà i l'òxid nitrós són gasos d'efecte hivernacle. L'augment de la concentració a l'atmosfera està contribuint a l'escalfament global. Els gasos amb efecte hivernacle provoquen l'escalfament global absorbint la calor reflectida de la superfície terrestre escalfant així l'atmosfera.[1]
- El contingut de diòxid de carboni de l'atmosfera ha crescut significativament en els últims cinquanta anys com a subproducte de la crema de combustibles fòssils. Des de mitjan del segle xix s'ha produït un augment del diòxid de carboni atmosfèric del 36 %, amb gairebé la totalitat de l'increment a causa de les activitats humanes.
- El metà es troba de forma natural a l'atmosfera en quantitats traça com a producte de la matèria orgànica en descomposició. La concentració de metà a l'atmosfera ha augmentat fins a un 148 % per sobre del seu nivell d'edat preindustrial. Les fonts de metà antropogèniques inclouen abocadors, gestió del bestiar i processament de gas natural i petroli.
- L'òxid de dinitrogen és un altre gas que es troba de forma natural en quantitats de traça a l'atmosfera. Prové en gran part de fonts agrícoles, però també d'emissions de vehicles. La concentració d'òxid de dinitrogen a l'atmosfera ha augmentat aproximadament un 18 % en els últims 200 anys.[1]
A més del diòxid de carboni, el metà i l'òxid de dinitrogen, hi ha traces de gasos totalment humans a l'atmosfera que s'han afegit significativament a l'escalfament global. Els hidrocarburs halogenats, particularment els clorofluorocarbonis (CFC) i els hidroclorofluorocarbonis (HCFCs), es troben en una varietat de productes i substàncies, inclosos els propulsors d'aerosols, dissolvents i refrigerants, i s'alliberen a l'atmosfera a partir d'aquestes fonts. Altres gasos fluorats —com l'hexafluorur de sofre que s'ha escapat de les aplicacions en equips d'energia elèctrica i perfluorocarbonis que s'han escapat del processament d'alumini i la fabricació de semiconductors— també es troben en quantitats de traces a l'atmosfera.[1]
Química de l'estratosfera[modifica]

El 1881 Hartley havia descobert que l'ozó absorbeix fortament la llum ultraviolada i argumentà que l’ozó atmosfèric és responsable de limitar l'espectre solar observat a longituds d’ona inferiors als 295 nm. El 1902 Léon Philippe Teisserenc de Bort i Richard Assmann, de forma independent, observaren mitjançant termòmetres enlairats en globus que la temperatura de l'atmosfera, en lloc de continuar disminuint a altituds més altes, arriba al mínim i després comença a pujar de nou a altituds encara més altes. De Bort proposà els termes "troposfera" i "estratosfera" i reconegué que les dues regions atmosfèriques han de diferir en la seva dinàmica. El 1913, Fabry i Buisson mesuraren el coeficient d’absorció de l’ozó en funció de la longitud d’ona i confirmaren el suggeriment de Hartley. El 1921 presentaren de la primera mesura quantitativa de l’abundància de columna total d’ozó atmosfèric.[2]
A principis de la dècada de 1920, Gordon M. B. Dobson (1889-1975) i col·laboradors de la Universitat d’Oxford iniciaren un ambiciós programa de mesura de l'espectre solar i l’absorció de l’ozó atmosfèric El seu aparell consistia primer en un filtre i, posteriorment, en un espectrògraf de prisma de quars i combinació de filtres que havien desenvolupat. El 1926, Dobson envià un espectròmetre calibrat a F. W. Paul Götz per controlar l’ozó atmosfèric al Lichtklimatisches Observatorium, Arosa, Suïssa, on havia començat a controlar l’ozó atmosfèric el 1921, però mitjançant una tècnica de filtre de resolució més baixa. Amb el nou l’instrument el 1926 començà a recollir mesures sistemàtiques de la columna d’ozó, i aquesta data marca el començament del registre més llarg d’ozó de columna total del món.[2]
El 1929, Götz observà que la proporció de la transmitància atmosfèrica a dues longituds d'ona veïnes passa per un mínim (el pendent de la línia s'inverteix) en funció de l'angle zenital solar (l '"efecte umkehr"; en alemany, umkehr significa "inversió"). Amb el desenvolupament per Dobson d'un nou monocromador de prisma de quars equipat amb un detector fotoelèctric, Götz, Dobson i A. R. Meetham desenvoluparen conjuntament un "mètode umkehr" millorat, que utilitzava la dispersió de l'aire ultraviolat en aire clar. La llum solar a parells de longituds d'ona seleccionats (per exemple, 305,5 i 325,4 nm) escollits per estar relativament a prop, de manera que el flux solar que entra a l'atmosfera és similar, però a longituds d'ona on hi ha una gran diferència en l'absorció per l'ozó. La relació d’intensitat corregeix automàticament les variacions d’intensitat solar degudes a la boira i altres efectes. La tècnica millorada permeté demostrar que la majoria de l'ozó atmosfèric resideix a l'estratosfera. Aquesta troballa fou confirmada per E. Regener i V. Regener el 1934, quan llançà el primer globus sonda d'ozó. Als anys 1940, Dobson substituí la cèl·lula fotoelèctrica per un tub fotomultiplicador disponible comercialment, que permetia mesurar parells de longituds d'ona a longituds d'ona més curtes i amb una sensibilitat més alta. Durant l'Any Geofísic Internacional (1957-58) s'organitzà una xarxa mundial de control de l’ozó, inclosa la instal·lació d’un instrument Dobson a l'estació de la badia de Halley, a l'Antàrtida, del British Antarctic Survey.[2]
El 1973, uns cent espectròmetres Dobson havien estat distribuïts per tot el món i la climatologia de l'ozó atmosfèric havia estat raonablement ben establerta. Es trobà que la columna total d'ozó i el perfil vertical depenien tant de la latitud com de l'estació de l'any. A latituds altes, la base de la capa d’ozó es trobà a cotes més baixes, coincidint amb la tropopausa. Estacionalment, la concentració d'ozó variava generalment amb la insolació com s'esperava, però les variacions detallades només es podrien explicar invocant una circulació atmosfèrica meridional. Els perfils verticals obtinguts mitjançant el mètode umkehr s'obtenien de forma rutinària, però es trobà que les mesures químiques in situ de globus i coets sonors proporcionaven una millor resolució vertical i una major precisió, obtenint així dades a altituds més altes.[2]
Origen de l'ozó estratosfèric[modifica]

El 1930 Sydney Chapman (1888-1970), de l'Imperial College London, descobrí que, gràcies a la llum ultraviolada solar, l'ozó es produeix i es destrueix a l'estratosfera de forma contínua mitjançant reaccions ràpides que mantenen una concentració més o manco constant. La formació d’ozó és, en última instància, el resultat de la fotòlisi del dioxigen . El mecanisme proposat per Chapman és:[3]

A principis dels anys 30, les dades de cinètica fotoquímica sobre les reaccions que constitueixen el mecanisme de Chapman eren fragmentàries, en el millor dels casos. Des d’un punt de vista modern, ara se sap que la constant de velocitat de la darrera reacció és massa lenta perquè la reacció sigui important a qualsevol lloc de l’atmosfera terrestre, però les altres quatre reaccions són suficient ràpides per incloure's en tots els models de química estratosfèrica moderns. La primera reacció depèn de la intensitat de la llum, que queda fortament atenuada a altituds més baixes. La quarta reacció destrueix dues molècules d', mentre que les reaccions segona i tercera no produeixen ni destrueixen , sinó que simplement controlen les concentracions relatives d’àtoms d’ i . Les reaccions que impliquen l’absorció d’energia solar, aquesta s’allibera com a energia química i, finalment, com a calor, escalfant així l'estratosfera.[2]
Lindemann i Dobson preveien que l'escalfament de l'estratosfera per absorció de l'ozó per la llum del Sol, però Chapman assenyalà que la intensitat de la llum solar disminueix a mesura que penetra a través de l'atmosfera i que la concentració d' augmenta a altituds més baixes. Com que els gradients verticals de la intensitat de llum solar i la concentració d’ tenen signes oposats, la velocitat de volum d’absorció de llum arriba al màxim en una capa a una altitud intermèdia. Com que la fotòlisi d’ produeix àtoms d’, és evident que l' es produeix en una capa. Aquest model de "capa de Chapman" dóna un compte semiquantitatiu de la deposició d'energia atmosfèrica i la producció d'espècies químiques reactives.[2]
Als anys seixanta i setanta, es començaren a desenvolupar noves tècniques de laboratori per detectar de forma més sensible àtoms reactius en fase gasosa i radicals lliures, cosa que permeté mesurar una taxa de velocitat millorada i fer proves més estrictes dels models de Chapman. En particular, Benson i Axworthy realitzaren mesures acurades de les constants de velocitat de les reaccions i arribaren a la conclusió que el mecanisme de Chapman amb coeficients de velocitat moderns sobreestima la concentració d’ozó atmosfèric almenys en un factor 2.[2]
Cicles de destrucció de l'ozó[modifica]
Radical hidroxil HO●[modifica]
El 1950 Meinel identificà els radicals lliures hidroxil com a responsables d'una línia d'emissió a la longitud d'ona 656 nm observada en la resplendor nocturna. David R. Bates (1916-1994) i Marcel Nicolet (1912-1996) analitzaren les reaccions químiques que podrien produir i destruir i identificaren diverses reaccions que poden catalitzar la disminució de l'ozó , inclosos els cicles catalítics següents, que s'han confirmat que són importants a l'estratosfera. En tots dos cicles, el catalitzador es regenera i es destrueixen dues molècules de durant cada repetició:[4]
1)
2)
Bates i Nicolet suposaren que els radicals (diòxid d'hidrogen i triòxid d'hidrogen) deriva de la fotòlisi ultraviolada (UV) de longitud d'ona curta de les molècules d'aigua . No obstant això, a altituds més baixes on la longitud d’ona curta dels UV no penetra, la velocitat de fotòlisi de les molècules d' és massa lenta per ser important. En canvi, es forma a l'estratosfera per reacció d’àtoms d’, excitats electrònicament, amb i altres espècies traça que contenen hidrogen, tal com descobriren el 1960 McGrath i Norrish. Els àtoms estratosfèrics d’ es produeixen principalment per fotòlisi d’ seguida de la reacció amb per produir radicals lliures hidroxil :
Òxid de dinitrogen N₂O[modifica]
El 1967 David R. Bates i Paul Hays demostraren que l'òxid de dinitrogen biogènic es transporta a l'estratosfera, on és fotodissociat per la llum ultraviolada i també reacciona amb (la majoria prové de la fotòlisi de l’ atmosfèric) per produir òxid de nitrogen , a més de dinitrogen i dioxigen:[5]

L’òxid de nitrogen reacciona amb l’ozó com a primer pas d’un important cicle catalític que, juntament amb d’altres, fou completament dilucidat el 1971 per Paul Crutzen (1933-2021) i per Harold Johnston:[6][7]
Aquest cicle catalític regenera el catalitzador de i destrueix dues molècules de en cada repetició; la seva velocitat es regeix per la concentració de . Pel seu treball sobre la comprensió dels cicles catalítics atmosfèrics, Paul Crutzen fou guardonat amb el Premi Nobel de Química del 1995.
El 1971 Harold Johnston assenyalà que una flota d’avions de transport supersònic, que volen a l'estratosfera, emetrien gran quantitat d', resultant en l'esgotament catalític de l’ozó estratosfèric. Com a resultat d’aquesta anàlisi científica, el Congrés dels Estats Units es negà a proporcionar subvencions de finançament per donar suport a la fabricació d’una flota d'avions supersònics. L'impacte econòmic d'aquesta controvèrsia posà de manifest la necessitat d'una millor comprensió de la química estratosfèrica, que motivà un augment del suport a la investigació governamental a tot el món.
Òxids de clor[modifica]

Richard S. Stolarski (1943) i Ralph J. Cicerone (1943-2016) comunicaren[8] que la família química (àtoms de clor i clorur d'oxigen ) podria catalitzar l'esgotament de l’ozó estratosfèric, igual que la família química dels . Els preocupava l’ozó a l'estratosfera, perquè el clor s’injecta a l'estratosfera per l'escapament de coets de combustible sòlid, a més de fonts naturals, com ara erupcions volcàniques. El cicle catalític de Stolarski i Cicerone és similar als de les altres famílies químiques i en conjunt produeix la reacció: :
Com en els altres cicles catalítics, la velocitat de destrucció del depèn de la concentració del catalitzador . El clor total disponible es defineix com la suma de i les espècies de dipòsit de clor, nitrat de clor i clorur d'hidrogen . Aquestes espècies de dipòsits es formen mitjançant les reaccions:
i es destrueixen alliberant mitjançant les reaccions:
A l'estratosfera inferior, on les temperatures són baixes, gairebé tot el clor disponible s’emmagatzema en aquests dipòsits, però a l'estratosfera superior, on les temperatures i la intensitat dels raigs ultraviolats són més altes, s’emmagatzema molt menys en forma inerta, i el és més important en el cicle.

Mario J. Molina (1943-2020) i Frank Sherwood Rowland (1937-2012), de la Universitat de Califòrnia a Irvine, estudiaren el destí atmosfèric dels clorofluorocarbonis (CFC) antropogènics, que s’utilitzaven àmpliament comercialment com dissolvents, refrigerants i propelents per a llaunes d’aerosol a pressió. Els CFC són econòmics, incolors, inodors, no inflamables, bons dissolvents i no tòxics, cosa que explica el seu ús generalitzat. El 1973 Lovelock i col·laboradors demostraren mitjançant un mostreig atmosfèric directe que els CFC s’acumulaven a l'entorn, cosa que suggerí que no tenien embornals ambientals (processos de pèrdua, com la reacció i la dissolució en aigües naturals). Molina i Rowland estudiaren aquest problema i arribaren a la conclusió que, tot i que els CFC són essencialment inerts a la troposfera i no es dissolen significativament a les aigües superficials de la Terra, poden ser destruïts per fotòlisi ultraviolada. Així, el 1974 indicaren que els CFC experimenten un transport lent a l'estratosfera, on són fotolitzats per la llum ultraviolada de longitud d'ona curta.[9] Aquesta proposta fou confirmada el mateix any per Lovelock. A més d’abordar el destí dels CFC, Molina i Rowland també assenyalaren que els àtoms de clor procedents de la fotòlisi de CFC esgotarien l’ozó catalíticament mitjançant el cicle catalític dels de Stolarski i Cicerone. En reconeixement a aquesta recerca, Molina i Rowland reberen el Premi Nobel de Química del 1995 amb Paul J. Crutzen.

La destrucció de la capa d'ozó pels CFCs[modifica]
El treball de Molina i Rowland el 1974 publicat a Nature, suposà l’inici d'un debat entre grups científics a favor i en contra. El debat sobre l’ozó estava motivat en gran part per una preocupació per a la salut: la incidència del càncer de pell, melanoma, en humans es correlaciona amb l'exposició a la llum ultraviolada, que, al seu torn, està limitada per la capa d’ozó estratosfèrica. El suport d’aquest argument és la correlació entre la incidència del melanoma i la latitud, amb una intensitat de llum solar més elevada i un major temps dedicat a l’aire lliure combinant-se per donar una major exposició i una major incidència de càncer per a poblacions a latituds més baixes. Això motivà el llançament de satèl·lits artificials per mesurar l'ozó.
Durant aquests anys s'avançà molt en la comprensió de l'estratosfera. Els estudis de laboratori de reaccions elementals determinaren moltes constants de velocitat de reacció amb alta precisió, els estudis de laboratori d'espectroscòpia i rendiments quàntics de fotòlisi afegiren nous coneixements considerables i es desenvoluparen models detallats de reaccions químiques. Juntament amb noves tècniques de mesura, es desenvoluparen mètodes computacionals per resoldre amb precisió el conjunt d'equacions diferencials ordinàries acoblades que descriuen un mecanisme de reacció acoblat.

Les noves constants de velocitat permeteren fer proves crítiques sobre la hipòtesi que els CFC transportats a l'estratosfera podrien provocar l'esgotament de l’ozó estratosfèric. Els paràmetres de velocitat crítica es combinaren amb models de transport atmosfèric per obtenir models químics atmosfèrics que es poguessin utilitzar per entendre la química estratosfèrica i per a comparacions amb observacions. La majoria de models prediren que l’ozó estratosfèric s’estava esgotant lentament. Tanmateix, com que els models teòrics contenien molts paràmetres, cadascun amb una incertesa associada, la possible acumulació d’incertesa també impedí conclusions definitives. Tot i que molts defensaven la regulació dels CFC, els qui s'interessaven més pels impactes econòmics aprofitaren les incerteses científiques com a justificació per retardar l’acció reguladora. Així i tot, els governs proporcionaren un fort suport a la investigació atmosfèrica. Les tècniques de mesura que s’havien desenvolupat i provat al laboratori es traduïren en mesures atmosfèriques. Els instruments basats en aquestes tècniques eren transportats per globus i coets a gran altitud per provar l'atmosfera superior.
La dècada de 1980 obrí un nou capítol de química estratosfèrica. El gran debat sobre l’ozó havia arribat a un punt mort, tot i que es continuava avançant científicament. S’havia après molt sobre la climatologia de l’ozó i les mesures seguien als observatoris de tot el món, un segle després que Hartley observés per primera vegada la presència d’ozó a l’atmosfera. Gran part de la motivació per a les mesures de l’ozó era acumular històries de temps més llargues i reduir el “soroll” en les observacions de l’ozó, de manera que es poguessin detectar les petites pertorbacions antròpiques predites. A principis dels anys vuitanta, a la comunitat química de l’atmosfera se sentia generalment que l’ozó estratosfèric s’entenia àmpliament i només quedaven per detallar els detalls. L’oxigen senar es produeix per fotòlisi d’ a longituds d’ona inferiors a 242 nm i la seva pèrdua es controla mitjançant cicles catalítics en fase gasosa que involucren diverses famílies químiques: , , , i .
El forat de la capa d'ozó a l'Antàrtida[modifica]

L'estació de la badia de Halley de la British Antarctic Survey havia estat recopilant regularment dades d’ozó d’octubre a març (quan el sol era prou alt) des del 1957. Durant el període del 1957 al 1973, la densitat de la columna d’ozó era gairebé la mateixa en tots els cicles anuals durant els mesos d’octubre (primavera austral) i març (tardor austral), però aquest patró començà a canviar el 1974, quan les mesures d’octubre (originalment ~ 320 ± 30 unitats Dobson) començaren a disminuir notablement, mentre que les del març es mantenien més o menys sense canvis. A l’octubre de 1984, la densitat de columna d’octubre havia caigut més d’un terç, la qual cosa suposava una disminució molt superior a la prevista pertorbació antròpica d’un petit percentatge. Farman, Gardiner i Shanklin publicaren aquestes dades el maig de 1985.[2]
El forat d’ozó estratosfèric, en què el ~ 40 % de la columna d’ozó s'esgotà en només tres setmanes durant la primavera austral, fou una sorpresa completa i s'iniciaren diferents projectes de recerca. El 1995 Anderson dóna un bon relat de la seqüència lògica a mesura que es resolia el trencaclosques del forat d’ozó. Les mesures d’espectrometria de microones a terra trobaren que les concentracions de radicals lliures de estratosfèric eren elevades. Un espectròmetre visible a terra basat en UV mostrà que les concentracions d’ i eren superiors a la normal i inferiors a la normal, respectivament. Un espectròmetre infraroig terrestre detectà concentracions pertorbades d’ i , l'espècie de reservori estratosfèric . Totes aquestes observacions s'associaren a una característica meteorològica anomenada vòrtex polar, i la majoria implicaven la química del clor, però no revelaren el mecanisme responsable.[2]
El cicle del de Stolarski i Cicerone era conegut, però no proporcionava els àtoms d’oxigen necessaris i per completar el cicle es requeriria la llum ultraviolada, que no és abundant a latituds altes durant la primavera austral. Durant el 1986 i el 1987 es proposar almenys tres cicles alternatius que no requereixen llum ultraviolada, els quals donen la reacció global :
| Cicle de Solomon | Cicle de McElroy | Cicle de Molina |
|---|---|---|


Després d’un suggeriment de Susan Solomon (1956) i col·laboradors el 1986,[10] diversos grups començaren a investigar el possible paper de les reaccions heterogènies en els núvols estratosfèrics polars, que es poden observar visualment des del sòl a latituds altes. Només es formen en les condicions extremadament fredes que es troben a l'estratosfera inferior polar. L'estratosfera és extremadament seca, amb unes proporcions típiques de barreja d'aigua inferior a 10 ppmv, de manera que els núvols composts de gel pur d'aigua només es poden produir poques vegades, quan la temperatura és prou baixa. No obstant això, al voltant de 10-20 ppmv d'àcid nítric en fase gasosa també està present a l'estratosfera i els di- i trihidrats d'àcid nítric i tenen pressions de vapor molt baixes. Així, aquest núvols es troben en capes ben definides, on la temperatura és prou freda, i solen consistir en gran part en partícules d’àcid nítric hidratat. Independentment, els grups de Molina i de Tolbert, el 1987 informaren de proves de laboratori sobre reaccions ràpides de les espècies del dipòsit de , suggerint que aquestes reaccions a les superfícies dels núvols polars són la clau per explicar les observacions atmosfèriques. Les reaccions tenen lloc a la foscor a temperatures fredes, alliberant productes en fase gasosa ( i ) que poden ser fotolitzats per la llum visible per produir espècies de :[2]
Com a resultat de les missions NOZE (National Ozone Expedition) I i AAOE (Airborne Antarctic Ozone Experiment) que investigaren l'estratosfera polar tant a l'Àrtic com a l'Antàrtida, es demostrà sense dubtes que les activitats humanes conduirien a l'esgotament de l'ozó. Amb la constatació que l'emissió de CFC antropogènics proporcionava el vehicle per transportar clor a l'estratosfera, s'arribà a un acord internacional per prendre mesures per protegir la capa d’ozó. El Protocol de Montreal sobre substàncies que esgoten la capa d'ozó es va signar el 16 de setembre de 1987 a Montreal, Canadà. Des de llavors, ha estat aprovat per prop de 200 països i modificat periòdicament per reflectir el coneixement científic millorat i la realitat de la seva implementació. El tractat ha conduït a la substitució dels CFC per compostos menys impactants. El clor total estratosfèric disponible (la suma de i l'espècie del dipòsit de clor) té tendència a la baixa i s’espera que torni al nivell de 1980 en poques dècades. Més enllà dels seus èxits científics, el Protocol de Montreal ha tingut un èxit excepcional en demostrar que es poden arribar a acords internacionals efectius sobre qüestions ambientals. Malgrat la capa d’ozó i el forat d’ozó presenten signes de recuperació, continua l’interès per la composició estratosfèrica i els forats d’ozó. S’estan realitzant observacions directes de l'estratosfera per provar models teòrics i identificar els buits de comprensió. Les noves plataformes, com ara avions autònoms no tripulats i globus a pressió de llarga durada, són cada vegada més importants.[2]
Química de la troposfera[modifica]
El boirum fotoquímic[modifica]
La troposfera, la regió de l'atmosfera terrestre en què vivim i respirem, està composta per molts diferents tipus de gasos, essent els majoritaris són el dinitrogen i el dioxigen. Són importants els compostos orgànics volàtils (COV), les quals concentracions poden assolir una part per milió per volum en regions d'origen (ciutats i prop d'incendis) i per sota d'un part per bilió de volum (10–12 o pptv) a regions distants. Molts COV són importants a la química de la troposfera fins i tot a baixes concentracions de pptv. Juntament amb la llum solar i els òxids de nitrogen ( i ), els COV experimenten una complicada sèrie de transformacions químiques i físiques al llarg d’un tota una gamma d’escales espacials. Diverses classes de COV tenen un gran impacte en la química atmosfèrica, contribuint al boirum urbà localitzat, a escala regional contaminació fotoquímica per ozó, deposició d'àcids i formació de partícules i degradació de la visibilitat i, en definitiva, canvis globals en la capacitat oxidant de la troposfera. Els COV també són útils com a traçadors per al transport atmosfèric, vies químiques, i distribució de fonts.[11]

El boirum fotoquímic s’ha detectat en gairebé tots els principals centres urbans i industrials del món, a nivells que sovint superen el llindar de valors acordat internacionalment per protegir la salut humana. Probablement el terme en anglès, smog, fou emprat per primera vegada el 1905 per H.A. Des Voeux per descriure les condicions atmosfèriques de moltes ciutats britàniques. Fou popularitzat el 1911 per l’informe de Des Voeux a la Conferència de Manchester de la Lliga de Reducció del Fum de Gran Bretanya sobre les més de 1 000 morts de “boira de fum” ocorregudes a Glasgow i Edimburg durant la tardor de 1909.[12] La comprensió del mecanisme de la fotoquímica de formació de boirum es desenvolupà a partir d’estudis pioners del boirum de Los Angeles, Califòrnia, a la dècada de 1950 mitjançant la combinació d'estudis de laboratori, experiments de camp, supervisió de la qualitat de l’aire i estudis de modelatge per ordinador. Los Angeles visqué episodis de contaminació atmosfèrica severa a la dècada de 1940 amb una visibilitat reduïda a només algunes illes de la ciutat. Es reconegué que el tipus de contaminació de l'aire urbà a Los Angeles era químicament diferent de l'experimentat en altres llocs. El boirum de Los Angeles era altament oxidant; a la dècada de 1940 i 1950 es sabia que contenia ozó , però les contribucions d'altres oxidants, com ara el diòxid de nitrogen i el peròxid d'hidrogen , eren poc clares. Blacet el 1952 reconegué que la fotòlisi del podria ser una font important d’ozó en l’aire urbà contaminat. Haagen-Smit dugueren a terme experiments que demostren la formació fotoquímica d’ozó i altres oxidants i aerosols a partir de reaccions d’òxids de nitrogen i hidrocarburs a la llum del sol i foren investigar els seus impactes sobre la salut humana i ecològica. La contaminació atmosfèrica a Los Angeles és el resultat de la fotoquímica i s'anomenà "boirum fotoquímic". Un nombre creixent de dades a la dècada de 1950 demostrà que les emissions de compostos orgànics volàtils (COV) i de la flota d’automòbils a Califòrnia contribuïen de manera important a la formació del boirum. Això va portar a la regulació a Califòrnia per limitar les emissions de COV i de vehicles i altres fonts a partir dels anys seixanta i estenent-se a la resta del món en les dècades següents.[2] Els COV comprenen tot tipus de composts orgànics de fins a 12 carbonis (s’exclouen el diòxid de carboni i el monòxid de carboni), però els que en tenen més més de 10 carbonis tendeixen a dividir-se en atmosfèrics partícules (aerosols). Els COV s’alliberen a l’atmosfera per part de nombrosos tipus de fonts, tant naturals com procedents diverses activitats humanes (antròpiques): processos de combustió (per exemple, fuites de vehicles i biomassa ardent); producció, tractament, emmagatzematge i distribució de combustibles fòssils; i emissions naturals de les plantes i l’oceà.[11]
La primera noció que l’oxidació atmosfèrica de compostos orgànics volàtils pot conduir a material orgànic condensat es troba en un article publicat el 1952[13] per Arie Jan Haagen-Smit (1900-1977). Haagen-Smit observà que en els experiments de fumigació s'havia notat que l'oxidació en fase vapor de les olefines sempre anava acompanyada de formació d'aerosols i aquests efectes es noten especialment amb compostos orgànics cíclics que contenen doble enllaços a l'anell, com ara ciclohexè, indè i diciclopentadiè. En aquests casos, l'obertura de l'anell produeix productes d'oxidació no volàtils. A causa de la introducció de diversos grups polars, la volatilitat disminueix tan radicalment que la formació d’aerosols és inevitable.

El 1960 F. W. Went assenyalà que a zones allunyades de les ciutats, encara hi ha una boira blava, generalment molt més blava que els fums industrials i les bromes i conclogué que les havien de consistir en minúscules partícules submicroscòpiques. Quan les partícules aerotransportades són més petites que la longitud d’ona de la llum, dispersen més fortament les longituds d’ona blaves que les longituds d’ona vermelles. Això s’anomena difusió de Rayleigh. Per a les partícules més grans que la longitud d'ona de la llum, la dispersió és més intensa, no depèn gaire de la longitud d'ona de la llum incident i, per tant, produeix una boira més blanca. Això es coneix com a dispersió de Mie. Ara sabem que a les regions boscoses els arbres són abundants emissors de monoterpens, com l'alfa i el beta-pinè, l’oxidació dels quals produeix partícules de mida nanomètrica que dispersen la llum i donen una boira blava. En referència a les observacions de Haagen-Smit publicades vuit anys abans, Went assenyalà que quan s'injecten baixes concentracions de terpens en una atmosfera amb ozó, es desenvolupa una boira blava. Determinà una taxa d’emissions globals a l’atmosfera d’1,75 × 108 tones d’hidrocarburs similars al terpè o hidrocarburs lleugerament oxigenats. Suggerí que la llum ultraviolada o visible en presència d'òxids de nitrogen causaria la formació de peròxids i ozònids i assenyalà que, com més diluït sigui el vapor orgànic, més blau es formarà la boira i més tardarà a formar-se. Tornant a les observacions de John Tyndall (1820-1893) el 1869, Went suggerí que aquestes partícules acabessin creixent fins a obtenir una mida al voltant d'1 μm. També observà que Leonardo da Vinci (1452-1519) ja havia descrit la boira blava segles abans. Tot i que sense coneixement de química orgànica, da Vinci atribuí la presència d'aquestes boires a l'exhalació d'humitat de les plantes.[2]
L'oxidació atmosfèrica de COV en fase gasosa s'inicia en gran part per reacció amb el radical , l'ozó i el radical nitrat . L’oxidació dels COV condueix principalment a productes volàtils, però, com s’ha assenyalat anteriorment, una fracció d’aquestes reaccions pot produir espècies de pressió de vapor suficientment baixa per tal que el seu estat preferit estigui en una fase condensada. La pressió de vapor d'una espècie, determinada en gran manera per la seva polaritat i mida molecular, és el principal determinant de la mesura en què residirà l'espècie en la fase de partícules. Un determinant important de la pressió de vapor d’una espècie és la presència de grups funcionals a la molècula. L’oxidant (, , ) que inicia la degradació atmosfèrica d’un COV té un paper important a l’hora de determinar la distribució dels seus productes d’oxidació i, per tant, la seva volatilitat.[2]
Les reaccions d’, i amb COV condueixen a la creació de grups funcionals a la molècula: hidroxil , carbonil , nitrooxi , hidroperoxi , carboxil i èster , o descomposició del COV original. La presència de grups funcionals condueix a molècules més polars i menys volàtils que els COV pares i, per tant, tenen una major tendència a condensar-se en la fase de partícules. Un cop a la fase de partícules, aquests compostos poden experimentar altres reaccions químiques com ara isomerització, deshidratació i dimerització, que condueixen a compostos en fase de partícules de volatilitat encara menor.[2]
Els radicals hidroxil HO●[modifica]
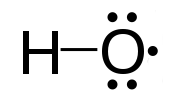
El radical hidroxil es considera el principal "detergent" de l'atmosfera perquè exerceix la funció d'oxidar tots els gasos que la contaminen i degradar-los.[14] El 1970, Pressman i Warneck assenyalaren que, tot i que l'emissió de monòxid de carboni havia anat augmentant constantment durant els anys 50 i 60, no havia augmentat la seva concentració a la troposfera.[15] L'explicació la donà el 1971 Hiram Levy II,[16] que assenyalà que la fotòlisi de l'ozó produeix àtoms d'oxigen excitats electrònicament, , i que mentre la majoria d'ells es desactiven xocant amb àtoms de l'estat fonamental, una petita fracció reacciona amb vapor d'aigua per produir radicals hidroxil . Aquest radicals hidroxil, posteriorment, reaccionen amb el monòxid de carboni, l'ozó i el metà per donar el radical hidroperòxil i el radical . El mateix any, McConnell i col·laboradors confirmaren la importància d'aquestes reaccions en la química atmosfèrica del metà i del monòxid de carboni. El mecanisme fotoquímic de formació de radicals hidroxil és:[17]
Als anys seixanta i setanta del segle XX es desenvoluparen noves tècniques experimentals revolucionàries per estudiar reaccions de radicals rellevants per a la química troposfèrica. Aquestes inclouen fotòlisi de flaix, flux de descàrrega, fluorescència induïda per làser, espectroscòpia FTIR de llarga trajectòria i tècniques de cambra de boira. Als anys vuitanta del mateix segle, estudis de laboratori de cinètica de reaccions del radical combinats amb estudis de modelització de la química troposfèrica demostraren que els radicals eren els responsables d’iniciar l'oxidació atmosfèrica de la majoria dels compostos orgànics i inorgànics emesos a l’atmosfera.[17]
L'1,1,1-tricloroetà (metilcloroform), és el resultat de les activitats humanes, està ben documentat i es pot utilitzar per estimar els nivells mitjans d’ troposfèric, per la qual cosa s'empraren les seves concentracions atmosfèriques observades, estimacions d’emissions i dades cinètiques per a la reacció amb radicals per deduir que la concentració troposfèrica mitjana global de radicals era aproximadament de 10⁶ cm−3. La mesura directa del radical hidroxil a la troposfera és extremadament difícil a causa de la seva baixa concentració (per sota de les pptv) i la seva alta reactivitat. Les tècniques d’espectroscòpia de masses de fluorescència i ionització química induïdes per làser per mesurar les concentracions d’ ambient es desenvoluparen als anys vuitanta i noranta del segle XX i perfeccionar al principi del segle XXI. Tot i que aquestes mesures encara són lluny de la rutina, ara són components habituals de les campanyes de camp de química atmosfèrica. Les concentracions de radicals hidroxíl troposfèrics varien segons la ubicació, l'estació, l’hora del dia, la nuvolositat i la presència de fonts (per exemple, ozó) i embornals (per exemple, hidrocarburs reactius) i normalment van des de zero a la nit fins als màxims d’aproximadament 107 cm−3 durant el dia.[2]
Ozó troposfèric[modifica]

Als anys cinquanta i seixanta del segle XX es dugueren a terme els primers estudis cinètics en fase gasosa de les reaccions de radicals a l'atmosfera. Es descobrí que la fotòlisi del diòxid de nitrogen es produeix en pocs minuts a la troposfera il·luminada pel Sol i dóna monòxid de nitrogen i un àtom d’oxigen que es combina amb el dioxigen en pocs microsegons per donar ozó . També es descobrí que la ràpida reacció de amb impedeix l'existència simultània d'altes concentracions tant de com d'ozó en la mateixa parcel·la d'aire:[18]

La constatació de la importància de l’ozó en la contaminació atmosfèrica urbana i en la troposfera, conduí a estudis sobre la cinètica i els mecanismes de les reaccions en fase gasosa de l’ozó amb compostos orgànics. Als anys vuitanta del segle XX es disposava de nombroses dades de cinètica de les reaccions de l'ozó amb compostos orgànics. S'establí que les reaccions d'ozó amb alcans, compostos orgànics oxigenats i compostos aromàtics eren lentes i no tenien importància atmosfèrica. No obstant això, la presència d'un enllaç doble carboni-carboni provoca un augment espectacular de la reactivitat. La reacció amb l'ozó és una pèrdua atmosfèrica important per a compostos orgànics insaturats com isoprè, terpens i sesqüiterpens que les plantes emeten en grans quantitats. Les reaccions de l’ozó amb els productes biogènics són una font important d’aerosols atmosfèrics.[18]
Rudolph Criegee (1902-1975) proposà que l'ozonòlisi dels alquens es produís mitjançant la formació d'un ozonur primari que, tot seguit, es descompon per donar un compost carbonílic i un òxid carbonílic.[19]


L'òxid de carbonil té característiques diradicals i de zwitterió i es coneix com a biradical de Criegee, zwitterió de Criegee o intermedi de Criegee. Els zwitterió de Criegee més senzill és . La reacció és altament exotèrmica i produeix productes intermedis excitats de Criegee, que poden isomeritzar-se, descompondre's o experimentar estabilització col·lisional. Els zwitterions de Criegee estabilitzats reaccionen amb importants components atmosfèrics com el diòxid de sofre , el diòxid de nitrogen , vapor d’aigua i àcids inorgànics com el nítric i el clorur d'hidrogen i orgànics. La cinètica i els mecanismes de reaccions atmosfèriques rellevants en fase gasosa s’han estudiat utilitzant mètodes indirectes des dels anys setanta del segle xx, però els zwitterions de Criegee només es detectaren recentment i es mesuraren directament en experiments de laboratori. Les reaccions que impliquen zwitterions de Criegee són importants en l’oxidació atmosfèrica del , la producció en fase gasosa d’àcids orgànics i la formació de radicals . Amb la recent disponibilitat de noves tècniques de laboratori, la química dels zwitterions de Criegee és una de les àrees més actives de la investigació de la química atmosfèrica en fase gasosa.[19]
Radicals triòxid de nitrogen NO₃●[modifica]

Els radicals triòxid de nitrogen es formen per la reacció del radical diòxid de nitrogen amb l'ozó i estan en equilibri amb el pentaòxid de dinitrogen :[20]
Leighton fou el primer a reconèixer la importància potencial de les reaccions dels radicals triòxid de nitrogen amb espècies diferents dels òxids de nitrogen en l'aire urbà contaminat. Estudis de la cinètica de reaccions de radicals amb aldehids i olefines a partir dels anys setanta, juntament amb observacions espectroscòpiques d’altes concentracions de radicals a l’aire contaminat, demostraren que la reacció amb els radicals és un important procés de pèrdua de compostos orgànics a l'atmosfera nocturna.[20]
Els radicals tenen una vida mitjana de només ~ 4 s respecte a la fotòlisi d’un sol a sobre i això deprimeix les concentracions de radicals a nivells baixos durant el dia. Els radicals reaccionen ràpidament amb el . A la nit, en absència de fotòlisi i quan les concentracions de baixen a nivells baixos (generalment a causa de la reacció ràpida amb l'ozó), la concentració de radicals pot augmentar a 100 pptv, 2,5 × 10⁹ cm−3, en aire contaminat. La formació de seguida d’hidròlisi és un mecanisme important per a la conversió de en . La reacció dels radicals amb compostos orgànics insaturats com l'isoprè és una font important de nitrats orgànics.[2]
Halògens[modifica]
El descobriment a finals dels anys vuitanta del segle XX de reaccions a les superfícies de gel que convertien formes inactives de clor en formes actives al forat de l’ozó antàrtic conduí a la qüestió de si aquests processos es podrien produir a la troposfera. El 1974 Schroeder i Urone havien demostrat que la reacció de (a les concentracions de diòxid de nitrogen utilitzades hi ha una presència significativa del dímer tetraòxid de dinitrogen ) amb partícules de clorur de sodi produeix , que pot fotolitzar-se donant àtoms de clor.[21] Finlayson-Pitts i col·laboradors demostrar que en condicions troposfèriques la reacció de pentaòxid de dinitrogen amb partícules de clorur de sodi dóna nitrit de clor , que es fotolitza ràpidament per donar àtoms de clor.[2]
La reacció de l'àcid hipoclorós amb clorur de sodi produeix diclor , que es fotolitza per donar àtoms de clor:[2]

A la troposfera s’han observat concentracions significatives de i . Durant l'última dècada, ha quedat clar que la química dels àtoms de clor pot ser important a nivell local i regional a la troposfera. Els àtoms de clor reaccionen ràpidament amb la majoria dels compostos orgànics. L'impacte de la química del clor a la troposfera no està completament definit i continua sent una àrea d'investigació actual.[22]
Les grans pèrdues d'ozó a la sortida del sol polar al març i abril a l'atmosfera àrtica inferior (0-2 km) s'han explicat per reaccions autocatalítiques que impliquen àtoms de brom i radicals bromur d'oxigen alliberats dels ions bromur solvatats en aerosols de sal marina i / o neu i gel. S'observen altes concentracions de dibrom i clorur de brom a l'Àrtic a la sortida del sol polar. Aquest procés de vegades es coneix com a "explosió de brom":[22]
La química dels halògens associats a compostos que contenen brom i iode emesos de fonts en oceà obert és responsable de la pèrdua significativa d’ozó a la capa límit tropical marina. L'equip d'Alonso Saiz López del Centro de Investigación de la Atmósfera y el Clima (CIAC), CSIC, Toledo, han investigat la importància de la química dels halògens (principalment brom i iode) per a l'ozó troposfèric a nivell mundial. Les emissions de derivats halogenats del metà: , , , , , , i quan s’inclouen en un model de química atmosfèrica global redueixen la mitjana anual de la columna d’ozó troposfèric tropical en un 10%. En comparació amb els àtoms de clor, els àtoms de brom són molt menys reactius i els de iode són essencialment poc reactius cap als compostos orgànics. L'impacte de la química dels àtoms de brom troposfèric i clor es limita en gran manera a la destrucció de l'ozó.[22]
Canvi climàtic[modifica]
La química atmosfèrica contribueix al canvi climàtic i el canvi climàtic influeix en la química atmosfèrica. El canvi climàtic ja ha provocat un augment de les concentracions de vapor d’aigua, que afecta tant les concentracions troposfèriques tant de radicals hidroxil com d'ozó . Com que el propi és un gas amb efecte hivernacle, qualsevol canvi induït químicament en l’ es retroalimentarà per alterar el clima. Donada la importància de les molècules , , , i per a l’abundància d’ troposfèric, si el canvi climàtic afecta els nivells d’aquestes espècies, un canvi climàtic podria alterar els nivells globals d’. Les reaccions entre i i cicle dins de la família i afecten la proporció predominant . La retroalimentació química no lineal dominant a l’atmosfera implica el metà . L’augment de , amb la seva oxidació per , condueix a la formació addicional de . El propi i el format actuen per suprimir , el principal embornal del . Com a resultat, la vida útil per a l'eliminació de addicional s’allarga d’uns 8-10 anys a uns 12 anys. Una reducció d’ augmenta la vida útil d’altres gasos traça que són eliminats per l’. El alliberat de la superfície es barreja bé a la troposfera, una part de la qual es transporta a l'estratosfera, on s’entrellaça amb la química estratosfèrica que controla l’abundància d’. El reacciona amb els àtoms de Cl per produir HCl, una espècie de dipòsit que segresta el clor actiu, alentint els cicles catalítics de ClOx i augmentant així l’. Al mateix temps, l’oxidació d’aquest augmenta el vapor de estratosfèric. A més, els canvis a i estratosfèrics tenen impactes forçadors radiatius.[23]

El 1990 Cardelino i Chameides mostraren la dificultat que suposa el canvi climàtic per assolir els objectius de qualitat de l’aire ambiental per a l’ozó a les zones urbanes. A més dels impactes sobre la meteorologia, la humitat i les emissions biogèniques de composts orgànics volàtils (COV), l’augment de la temperatura afecta les taxes de reaccions clau associades a la producció fotoquímica d’ozó. L’augment de la temperatura comporta un augment de la dissociació del nitrat de peroxiacetil, (PAN). El PAN és un dipòsit important tant de radicals com de en l’aire contaminat. La velocitat de descomposició tèrmica del PAN augmenta exponencialment amb la temperatura i, en un clima més càlid, la descomposició del PAN alliberarà més radicals i accelerant les reaccions fotoquímiques a les masses d’aire urbanes. Les taxes de reaccions d’ amb COV saturats que impulsen la formació d’ozó generalment augmenten amb la temperatura, mentre que la velocitat de reacció d’ amb disminueix amb l’augment de la temperatura. La reacció de l’ amb el genera àcid nítric , que és un radical important i de , i alenteix la seqüència de reaccions que condueixen a la formació d’ozó. Els impactes combinats del canvi climàtic sobre la meteorologia (augment de la freqüència dels períodes d’aire estancat), l’augment de la humitat (augment de la fracció d’àtoms d’ que reaccionen amb per donar ), l’augment de les emissions de composts orgànics volàtils biogènics i l’activitat fotoquímica augmentada dels estàndards de qualitat de l’aire ambient més difícils.[2]
Les observacions dels nivells d’ozó superficial suggereixen que els nivells d’ozó de fons han augmentat sensiblement durant el darrer segle a les latituds mitjanes de l’hemisferi nord, però no hi ha hagut canvis apreciables en altres llocs. L’ozó troposfèric és un potent gas d’efecte hivernacle; en termes de forçament radiatiu del canvi climàtic, la seva contribució és la tercera més important per darrere del diòxid de carboni i el metà. L’augment dels nivells d’ozó troposfèric ha contribuït a un forçament radiatiu de 0,3-0,5 W·m−2 i 0,3 ° C de l'escalfament aproximat de 0,5 ° C del 1890 al 1990. La disminució de l’ozó estratosfèric resultant de les activitats humanes, principalment les emissions de compostos que contenen clor i brom, ha provocat un petit forçament radiatiu negatiu d’aproximadament −0,05 W·m−2 des de la Revolució Industrial. Sembla inevitable que el canvi climàtic tingui un impacte important en la societat humana durant els propers cent anys. La comprensió del paper futur de la química atmosfèrica en el canvi climàtic i, al seu torn, l’impacte del canvi climàtic en la química atmosfèrica serà fonamental per desenvolupar polítiques eficaces per protegir el nostre entorn global.[2]
Química de la pluja àcida[modifica]
La pluja àcida és una precipitació que conté en dissolució àcids sulfúric i nítric produïts per la combinació dels òxids de sofre i de nitrogen, despresos en els processos industrials o per emissions naturals, amb el vapor d'aigua atmosfèric. Té efectes altament corrosius i provoca un augment de l'acidesa de rius i llacs i, en general, del sòl, el qual priva del calci per lixiviació. Provoca la mort de la flora i de la fauna aquàtica, degrada els boscos, així com destrueix les construccions amb pedra calcària (mal de la pedra).
pH àcid[modifica]

La pluja no contaminada normalment presenta un pH lleugerament àcid d'aproximadament 5,65. Això és degut a la presència del diòxid de carboni atmosfèric, que forma àcid carbònic tot i que la pluja no contaminada conté altres substàncies químiques.[24] L'aigua destil·lada que no conté diòxid de carboni té un pH neutre de 7,00. La reacció de formació de l'àcid carbònic és la següent:
Aleshores l'àcid carbònic s'ionitza, formant concentracions baixes d'anions carbonat i cations oxoni o oxidani, :
Es considera pluja àcida si la precipitació presenta valors de pH inferiors a 5,00. Aquests valors de pH s'assoleixen per la presència d'altres àcids addicionals a l'àcid carbònic com són l'àcid sulfúric i l'àcid nítric formats a partir de les reaccions amb el vapor d'aigua del òxids de sofre i de nitrogen. Altres substàncies naturals com la pols, que conté carbonat de calci, pot millorar l'acidesa, ja que en solució resulta ser lleugerament alcalina.
Formació d'àcid sulfúric[modifica]

Una part del diòxid de sofre emès a l'atmosfera terrestre es deu a les erupcions volcàniques, que són fenòmens irregulars naturals. La font principal del diòxid de sofre antropogènic a l'atmosfera és la combustió de carbó i de petroli, que inclou l'ús de vehicles amb motors dièsel, centrals tèrmiques, explotació i manipulació de certs minerals de sofre, indústria del paper i del carbó (incloent embalatges, etc.), síntesi d'àcid sulfúric, etc. En aquests tractaments el sofre s'oxida a diòxid de sofre durant les combustions:

Una vegada dispersat a l'atmosfera es transforma en àcid sulfúric mitjançant diferents vies:
- A la primera via el reacciona amb radicals hidroxil en presència de partícules de metalls que actuen com a catalitzadors, donant radicals hidrogensulfit . Aquests reaccionen amb el dioxigen i es produeix triòxid de sofre i radicals dioxidoanils . El és molt soluble en aigua i es dissol en les gotetes que formen els niguls donant lloc a àcid sulfúric :[20]

- Una altra via té lloc per reacció del amb molècules de peròxid d'hidrogen dissolt en les gotetes d'aigua dels niguls, de la boira o de la pluja. El peròxid d'hidrogen es forma per reacció de dos radicals dioxidoanil i, en reaccionar amb el diòxid de sofre dona àcid sulfúric dissolt en les gotes d'aigua:[20]
- Finalment la tercera via el en primer lloc es dissol en aigua formant àcid sulfurós per després oxidar-se mitjançant diferents reaccions i arribar a l'àcid sulfúric:[20]
Formació d'àcid nítric[modifica]

L'òxid de nitrogen es forma per la reacció que té lloc entre oxigen i nitrogen de l'aire a alta temperatura en processos de combustió, i en particular en els motors de combustió interna dels cotxes i avions.
Si la concentració d'oxigen és suficient el monòxid de nitrogen pot oxidar-se i donar lloc a diòxid de nitrogen:
Aquest òxid reacciona amb l'aigua dels niguls i de les gotes de pluja i dona lloc a àcid nítric que queda dissolt en l'aigua, i òxid de nitrogen que pot transformar-se en diòxid de nitrogen:
Referències[modifica]
- ↑ 1,0 1,1 1,2 1,3 «Atmospheric Chemistry | Encyclopedia.com». [Consulta: 8 juliol 2021].
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 2,11 2,12 2,13 2,14 2,15 2,16 2,17 2,18 2,19 2,20 Wallington, T.J.; Seinfeld, J.H.; Barker, J.R. «100 Years of Progress in Gas-Phase Atmospheric Chemistry Research». Meteorological Monographs, 59, 1, 01-01-2019, pàg. 10.1-10.52.
- ↑ F.R.S, S. Chapman «XXXV. On ozone and atomic oxygen in the upper atmosphere». The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 10, 64, 01-09-1930, pàg. 369–383. DOI: 10.1080/14786443009461588. ISSN: 1941-5982.
- ↑ Bates, David R.; Nicolet, Marcel «The photochemistry of atmospheric water vapor» (en anglès). Journal of Geophysical Research, 55, 3, 01-09-1950, pàg. 301–327. DOI: 10.1029/JZ055i003p00301. ISSN: 2156-2202.
- ↑ Bates, D.R.; Hays, P.B. «Atmospheric nitrous oxide» (en anglès). Planetary and Space Science, 15, 1, 01-01-1967, pàg. 189–197. DOI: 10.1016/0032-0633(67)90074-8. ISSN: 0032-0633.
- ↑ Crutzen, P. J. «Ozone production rates in an oxygen-hydrogen-nitrogen oxide atmosphere» (en anglès). Journal of Geophysical Research (1896-1977), 76, 30, 1971, pàg. 7311–7327. DOI: 10.1029/JC076i030p07311. ISSN: 2156-2202.
- ↑ Johnston, Harold «Reduction of Stratospheric Ozone by Nitrogen Oxide Catalysts from Supersonic Transport Exhaust» (en anglès). Science, 173, 3996, 06-08-1971, pàg. 517–522. DOI: 10.1126/science.173.3996.517. ISSN: 0036-8075. PMID: 17738433.
- ↑ Stolarski, R. S.; Cicerone, R. J. «Stratospheric Chlorine: a Possible Sink for Ozone» (en anglès). Canadian Journal of Chemistry, 52, 8, 15-04-1974, pàg. 1610–1615. DOI: 10.1139/v74-233. ISSN: 0008-4042.
- ↑ Molina, Mario J.; Rowland, F. S. «Stratospheric sink for chlorofluoromethanes: chlorine atom-catalysed destruction of ozone» (en anglès). Nature, 249, 5460, 1974-06, pàg. 810–812. DOI: 10.1038/249810a0. ISSN: 1476-4687.
- ↑ Solomon, Susan; Garcia, Rolando R.; Rowland, F. Sherwood; Wuebbles, Donald J. «On the depletion of Antarctic ozone». Nature, 321, 6072, 1986-06, pàg. 755–758. DOI: 10.1038/321755a0. ISSN: 0028-0836.
- ↑ 11,0 11,1 Blake, N.J.; Blake, D.R.. TROPOSPHERIC CHEMISTRY AND COMPOSITION | VOCs: Overview. Elsevier, 2003, p. 2438–2446. ISBN 978-0-12-227090-1.
- ↑ Britannica, The Editors of Encyclopaedia. "Smog". Encyclopedia Britannica, 17 Dec. 2019, {{format ref}} https://www.britannica.com/science/smog. Accessed 14 July 2021.
- ↑ Haagen-Smit, A. J. «Chemistry and Physiology of Los Angeles Smog». Industrial & Engineering Chemistry, 44, 6, 01-06-1952, pàg. 1342–1346. DOI: 10.1021/ie50510a045. ISSN: 0019-7866.
- ↑ Ball, Philip «Fast-acting atmospheric detergent» (en anglès). Nature, 03-11-2000. DOI: 10.1038/news001109-1. ISSN: 1476-4687.
- ↑ «Tropospheric Chemistry». [Consulta: 12 juliol 2021].
- ↑ 16,0 16,1 Levy, H. «Normal Atmosphere: Large Radical and Formaldehyde Concentrations Predicted» (en anglès). Science, 173, 3992, 09-07-1971, pàg. 141–143. DOI: 10.1126/science.173.3992.141. ISSN: 0036-8075.
- ↑ 17,0 17,1 Ehhalt, D. H.; Dorn, H.-P.; Poppe, D. «The chemistry of the hydroxyl radical in the troposphere» (en anglès). Proceedings of the Royal Society of Edinburgh, Section B: Biological Sciences, 97, 1990/ed, pàg. 17–34. DOI: 10.1017/S0269727000005273. ISSN: 2053-5910.
- ↑ 18,0 18,1 18,2 Finlayson-Pitts, B. J.; Jr, J. N. Pitts «Atmospheric Chemistry of Tropospheric Ozone Formation: Scientific and Regulatory Implications». Air & Waste, 43, 8, 01-08-1993, pàg. 1091–1100. DOI: 10.1080/1073161X.1993.10467187. ISSN: 1073-161X.
- ↑ 19,0 19,1 Khan, M. A. H.; Percival, C. J.; Caravan, R. L.; Taatjes, C. A.; Shallcross, D. E. «Criegee intermediates and their impacts on the troposphere» (en anglès). Environmental Science: Processes & Impacts, 20, 3, 2018, pàg. 437–453. DOI: 10.1039/C7EM00585G. ISSN: 2050-7887.
- ↑ 20,0 20,1 20,2 20,3 20,4 Platt, Ulrich; Heintz, Frank «Nitrate Radicals in Tropospheric Chemistry» (en anglès). Israel Journal of Chemistry, 34, 3-4, 1994, pàg. 289–300. DOI: 10.1002/ijch.199400033. ISSN: 1869-5868.
- ↑ Schroeder, William H.; Urone, Paul «Formation of nitrosyl chloride from salt particles in air». Environmental Science & Technology, 8, 8, 01-08-1974, pàg. 756–758. DOI: 10.1021/es60093a015. ISSN: 0013-936X.
- ↑ 22,0 22,1 22,2 Saiz-Lopez, Alfonso; Glasow, Roland von «Reactive halogen chemistry in the troposphere» (en anglès). Chemical Society Reviews, 41, 19, 10-09-2012, pàg. 6448–6472. DOI: 10.1039/C2CS35208G. ISSN: 1460-4744.
- ↑ Wuebbles, Donald J.; Grant, Keith E.; Connell, Peter S.; Penner, Joyce E. «The Role of Atmospheric Chemistry in Climate Change» (en anglès). JAPCA, 39, 1, 1989-01, pàg. 22–28. DOI: 10.1080/08940630.1989.10466502. ISSN: 0894-0630.
- ↑ Likens, G. E., W. C. Keene, J. M. Miller i J. N. Galloway. 1987. "Chemistry of precipitation from a remote, terrestrial site in Australia". J. Geophys. Res. 92(D11):13,299-13,314.




































































































































![{\displaystyle {\ce {SO2\;+\;HO^{\bullet }\;->[M]\;HSO3^{\bullet }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/de853cf7c125b51e2408b53bd3f329255207ca33)








![{\displaystyle {\ce {HSO3^-_{(aq)}\; + \; 1/2O2 \; ->[M] \; HSO4^-_{(aq)}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/31bd2ca8ab2c97cb83ae792dba76e9c757461a69)


