Vidre

Un vidre és una matèria sòlida aconseguida a partir del refredament d'un líquid evitant-ne la cristal·lització. El vidre comú és una matèria amorfa, relativament dura, químicament inerta i biològicament inactiva. El primers humans el consideraven un material semipreciós, ja que tenia una certa semblança amb les pedres precioses, a més de la dificultat d'obtenir-lo. Al principi, només servia per a guarniment. A mesura que es va dominar el foc, les aplicacions es van ampliar, encara que ara el plàstic el substitueix per a certes funcions.[1]
En disminuir la temperatura, la densitat i la viscositat d'un líquid augmenten progressivament. Si durant el procés de refredament s'aconsegueix evitar la cristal·lització del material, el líquid adquireix una viscositat suficientment alta per a ser considerat un sòlid. El valor de viscositat en el qual es considera que hi ha la transició líquid-vidre o transició vítria es defineix arbitràriament amb Pa·s. El vidre no té, doncs, una estructura cristal·lina sinó que les seves molècules estan ordenades de forma similar a un líquid, és a dir, sense ordre a llarg abast.
Els vidres més comuns i utilitzats per la tecnologia humana des de fa milers d'anys són els formats per òxid de silici () i òxid de bor () com a substàncies principals. Tanmateix, la vitrificació pot aconseguir-se en molts tipus de substàncies incloent-hi compostos iònics, molècules orgàniques (per ex., etanol), metalls, polímers, etc. Les característiques i propietats de l'estat vitri i la transició vítria en les diferents substàncies tenen múltiples aplicacions tècniques, i van des de la producció clàssica d'utensilis domèstics de vidre fins als discs compactes o els pneumàtics d'automòbil. S'estima que la major part de l'aigua existent a l'univers es troba en forma sòlida amorfa, és a dir, en estat vitri.
Història del vidre[modifica]

El vidre en l'antiguitat[modifica]
Els primers objectes de vidre que es van fabricar van ser peces de collar o grans de vidre. És probable que fossin artesans asiàtics els que van establir la manufactura del vidre a Egipte, d'on procedeixen els primers vasos produïts durant el regnat de Tuthmosis III (1504-1450 aC). La fabricació del vidre va florir a Egipte i Mesopotàmia fins al 1200 aC i posteriorment va cessar gairebé per complet durant diversos segles. Egipte va produir un vidre clar, que contenia sílice pura; l'acolorien de blau i verd. Durant l'època hel·lenística, Egipte es va convertir en el principal proveïdor d'objectes de vidre de les corts reials. Tanmateix, va ser a les costes fenícies on es va desenvolupar l'important descobriment del vidre bufat al segle i aC. Durant l'època romana, la manufactura del vidre es va estendre per l'imperi, des de Roma fins a Alemanya.
Tractats sobre el vidre[modifica]
Hi ha alguns tractats antics sobre el vidre de díficil consulta que tingueren poca influència sobre la indústria vidrera(cal recordar que una de les obres del benedictí Teòfil esmenta una fórmula del vidre i alguns detalls sobre el color).[2] N'hi dos però que estàn ben estudiats i que sí que tingueren una difusió i influència importants.
El primer tractat a considerar és català: La “Sedacina”, obra del frare carmelità Guillem Sedacer, de Barcelona, datada el 1378.[3] L'orde del Carmel es relaciona amb la muntanya del Carmel (Mont Carmel), molt a prop de l'antiga ciutat d'Acre i del riu Belos (actual riu Na’aman), llegendària ubicació del descobriment del vidre. La Sedacina és important perqué parla d'aspectes reals amb detalls escrits a peu de forn. Un dels aspectes cabdals és la fabricació d'un vidre molt transparent, susceptible de ser emprat en casos concrets (ampolleta nàutica, ulleres i lents, lupes i telescopis). Un dels objectius de Sedacer era la fabricació de gemmes de diversos colors, la base de les quals era un vidre transparent. Uns altres aspecte a destacar són les diverses fórmules de Sedacer basades en el plom. (Cal tenir en compte que les històries “oficials” daten el “cristallo” inventat a Venècia per Barovier el 1463; i el vidre “flint” a base de plom patentat a Anglaterra per Ravencroft el 1672. L'obra de Sedacer es va avançar en totes dues innovacions).
L'altre tractat a considerar és “Arte vetraria” d'Antonio Neri.[4] L'obra esmenta la barrella (“soda di Spagna”) i el salicorn, ben coneguts i documentats en les nostres terres.
Composició i fabricació tradicionals[modifica]
La fabricació del vidre tradicional exigeix unes materies primeres (sorra silícea, sosa=barrella o salicorn), un forn adequat (amb totxos refractaris) i una gran quantitat de llenya. Entre les materies primeres hom hi pot afegir alguns components calcaris i alguns additius que, tot i la seva petita proporció, poden millorar les qualitats del vidre final. Entre les sorres més antigues i més preuades hi havia les del riu Belos, a prop del Mont Carmel. La llegenda de la invenció del vidre per part dels fenicis fou explicada per Plini, Estrabó, Flavius Josephus i altres. El fundent, anomenat genèricament “sosa”, no era altre que les cendres de la barrella (en els vidres ordinaris) o les cendres del salicorn (en els vidres de luxe ; hi ha algun autor que recomanava beure en copes de vidre de salicorn). El forn o fornal del vidre i el vidre transparent ja foren esmentats per Ramon Llull. Els forns situats enmig de les ciutats (com ara la de Barcelona) eren un perill i un destorb per als veïns. També la necessitat de proveir-se de llenya en els boscos propers suposava una competència per a altres aplicacions. A Catalunya hi ha documentats forns, prohibicions i decrets referents al vidre.
Estat vitri[modifica]
Tradicionalment, s'ha considerat que la matèria podia presentar-se sota tres formes: la sòlida, la líquida i la gasosa. Nous mitjans d'investigació de la seva estructura íntima -particularment durant el segle xx- han posat al descobert altres formes o estats en els quals la matèria pot presentar-se. Per exemple, l'estat mesomorf (una forma líquida amb les seves fases emèctiques, pneumàtiques i colestèriques), l'estat de plasma (o estat plasmàtic, propi de gasos ionitzats a temperatures molt altes) o l'estat vítric, entre d'altres.
Els cossos en estat vitri es caracteritzen per presentar un aspecte sòlid amb certa duresa i rigidesa i que davant d'esforços externs moderats es deformen de manera generalment elàstica. Tanmateix, igual com els líquids, aquests cossos són òpticament isòtrops, transparents a la major part de l'espectre electromagnètic de radiació visible. Quan s'estudia la seva estructura interna amb mitjans com la difracció de raigs X, dona lloc a bandes de difracció difuses similars a les dels líquids. Si s'escalfen, la seva viscositat va disminuint gradualment -com la major part dels líquids- fins a assolir valors que permeten la seva deformació sota l'acció de la gravetat, i per exemple prendre la forma del recipient que els conté com a verdaders líquids. No obstant això, no presenten un punt clarament marcat de transició entre l'estat sòlid i el líquid o punt de fusió.
Totes aquestes propietats han portat alguns investigadors a definir l'estat vitri no com un estat de la matèria diferent, sinó simplement com el d'un líquid subrefredat o líquid amb una viscositat tan alta que li confereix aspecte de sòlid, sense ser-ho. Aquesta hipòtesi implica la consideració de l'estat vitri com un estat metaestable en què una energia d'activació suficient de les seves partícules hauria de conduir al seu estat d'equilibri, és a dir, al de sòlid cristal·lí.

En suport d'aquesta hipòtesi, s'addueix el fet experimental que, escalfat un cos en estat vitri fins a obtenir un comportament clarament líquid (a una temperatura prou elevada perquè la seva viscositat sigui inferior als 500 poises, per exemple), si es refreda lentament i acurada, aportant-li alhora l'energia d'activació necessària per a la formació dels primers corpuscles sòlids (sembra de microcristalls, presència de superfícies activadores, catalitzadors de nucleació, etc.), sol solidificar-se donant lloc a la formació de conjunts de verdaders cristalls sòlids.
Tot sembla indicar que els cossos en estat vitri no presenten una ordenació interna determinada, com ocorre amb els sòlids cristal·lins. Tanmateix, en molts casos, s'observa un desordre ordenat, és a dir, la presència de grups ordenats que es distribueixen en l'espai de manera totalment o parcialment aleatòria.
Això ha conduït diferents investigadors a plantejar diverses teories sobre l'estructura interna de l'estat vitri, tant de tipus geomètric, basades tant en les teories atòmiques com en les de tipus energètic.
Procés d'obtenció[modifica]

Els primers materials per a obtenir vidre són potassi, silici i calcària. Per obtenir-lo, s'han de barrejar les matèries primeres, en la proporció adequada. S'hi afegeix vidre ja usat i esmicolat i s'introdueix tot al forn a 1.500 graus. Dins del forn, les matèries primeres es fonen i es tornen líquides. Quan la massa es refreda, es torna sòlida, i té les qualitats del vidre. Les tècniques més importants de donar forma al vidre són: el bufat, el premsat i el laminat.
Sílice vítria[modifica]

Es denomina sílice un òxid de silici de fórmula química SiO₂. Es presenta en estat sòlid cristal·lí sota diferents formes enanciotrópiques. Les més conegudes són el quars (la més freqüent i estable a temperatura ambient), la cristobalita i les tridimites. A més d'aquestes formes, se n'han arribat a identificar fins a vint-i-dues fases diferents, cada una d'aquestes estable a partir d'una temperatura perfectament determinada.
Quan s'escalfa el quars lentament, aquest va passant per diferents formes enanciotròpiques fins a abastar el seu punt de fusió a 1.723 °C. A aquesta temperatura, s'obté un líquid incolor i molt viscós que, si es refreda amb relativa rapidesa, es converteix en una substància de naturalesa vítria a la qual se sol denominar vidre de quars.
Aquest vidre de quars presenta un conjunt de propietats de gran utilitat i aplicació en múltiples disciplines: en la investigació científica, tecnològica, en la vida domèstica i, en general, en tot tipus d'indústria. Es destaquen com a més rellevants les següents:
- Gran resistència a l'atac per agents químics, per la qual cosa és molt utilitzat com a material de laboratori. Només és atacat, de manera important a temperatura ambient, per l'àcid fluorhídric en les seves diferents formes (gasosa o dissolució). A temperatures superiors a 800 °C, reacciona a velocitats apreciables amb sals alcalines o alcalinotèrries, en particular amb sals sòdiques, tals com el carbonat o el sulfat sòdic.
- Si bé la seva densitat a temperatura ambient és relativament alta (2,2 g/cm³), el seu coeficient de dilatació lineal mitjà a temperatures inferiors als 1.000 °C és extremadament petit: se situa en 5,1.10-7 K-1, la qual cosa permet, per exemple, escalfar-lo al roig i submergir-lo bruscament en aigua, sense que es fracturi. El nombre d'aplicacions que aquesta propietat suscita és elevat.
- El seu índex de refracció a la radiació electromagnètica visible és 1,4589, cosa que el fa apte per a instruments òptics en general.
- La seva resistivitat elèctrica és de l'ordre dels 1020 ohm·cm en condicions normals, cosa que el converteix en un dels millors aïllants elèctrics coneguts, amb totes les aplicacions que se'n deriven en la indústria moderna.
- L'absorció de la radiació electromagnètica del vidre de quars mostra una gran transparència a la llum visible així com a les bandes corresponents a l'espectre ultraviolat, cosa que el fa especialment apte per a la fabricació de làmpades i altres instruments generadors d'aquest tipus de radiació.

- El punt de fusió de la sílice cristal·litzada depèn de la varietat enanciotròpica de què es tracti. Per a la varietat estable a partir dels 1.470 °C (la cristobalita) aquest és de 1.723 °C. Aquestes són temperatures que no poden assolir-se fàcilment, llevat d'instal·lacions molt especialitzades. Per aquesta raó, la fabricació del vidre de quars ha estat sempre rara i cara. Industrialment, la seva producció és bastant limitada si se la compara amb altres tipus de vidre.
- La seva viscositat en estat vitri presenta una gran variació de temperatura, passant de valors superiors a 107 poises (aspecte totalment sòlid) per sota dels 1.800 °C, a 103,5 poises a 2.758 °C (aspecte pastós i mal·leable).
- Les viscositats prenen valors tan summament elevats que s'han d'expressar com a potències de deu. En general, les viscositats dels vidres solen donar-se sota la forma del seu logaritme decimal. Per a obtenir el vidre de quars és necessari partir d'un quars cristal·litzat de gran puresa, finament molt, que se sotmet a altes temperatures. El líquid que s'obté presenta gran quantitat de bombolles diminutes d'aire clos entre els grans del quars, que li donen un aspecte lletós, translúcid, al qual se sol denominar gres de quars i les aplicacions del qual com a recipient resistent a l'atac químic o als canvis bruscos de temperatura són freqüents. Tanmateix, resulta totalment inútil per a aplicacions en les quals es necessiti una gran transparència (làmpades de raigs UVA, làmpades de quars i òptica en general). Per a aquestes últimes, és necessari que durant el procés de fusió es puguin desprendre aquestes bombolles gasoses closes. Perquè aquest despreniment fos efectiu sota la pressió atmosfèrica i a una velocitat aplicable industrialment, cal que el líquid presenti una viscositat per sota dels 200 poises, la qual cosa en el cas de la sílice líquida implicaria temperatures de l'ordre dels 3.600 °C. En la pràctica, per poder desgasar el vidre de sílice es fon el quars a temperatures pròximes als 2.000 °C en recipients on es fa el buit, complicant molt la tecnologia de la seva producció i, per tant, encarint el producte.
- La resistència a la tracció en estat pur, en condicions normals i amb una superfície perfectament lliure de tota fissura, és d'uns 60 kbar. Aquesta gran resistència (superior a la de l'acer) es veu fortament disminuïda per imperfeccions a la superfície de l'objecte, per petites que aquestes siguin.
- El seu mòdul de Young a 25 °C és de 720 kbar i el de torsió 290 kbar. Quan se'l sotmet a un esforç de tracció mecànica a temperatures pròximes a l'ambient, es comporta com un cos perfectament elàstic amb una funció allargament/esforç lineal, però sense zona pràcticament plàstica propera al seu límit de ruptura. Aquesta propietat, unida a la resistència mecànica a la tracció anteriorment citada, el converteixen en un producte fràgil. En colpejar-lo, o es deforma elàsticament i la seva forma no s'altera o, si se sobrepassa el seu límit d'elasticitat, es fractura.
Silicat sòdic[modifica]
Les sals més comunes de sodi tenen punts de fusió per sota dels 900 °C. Quan s'escalfa una mescla íntima de quars finament dividit amb una sal d'aquests metalls alcalins, per exemple Na₂CO₃, a una temperatura superior als 800 °C, s'obté inicialment una fusió de la sal alcalina, el líquid de la qual envolta els grans de quars, i es produeix una sèrie de reaccions que poden englobar-se en el resultant següent:
SiO₂ + CO₃Na₂ SiO₃Na₂ + CO₂ -5,12 kcal/mol
Aquesta reacció, lleument exotèrmica, desprèn diòxid de carboni que bombolleja entre la massa en fusió i condueix a un primer silicat sòdic, de punt de fusió 1.087 °C.
D'acord amb la termodinàmica, la mescla de dues substàncies de punts de fusió diferents presenta un "punt de liquidus" que se situa entre els de les dues substàncies en contacte. D'aquesta forma, la mescla de la sílice i el silicat sòdic format dona lloc a un producte de SiO₂ i silicats, ja en estat líquid a temperatures que no ultrapassen els 1.200 °C, lluny dels més de 2.000 °C necessaris per a preparar el vidre de quars.
Vidres de silicat sòdic[modifica]
A fi d'obtenir un producte amb propietats similars a les del vidre de quars a temperatures assequibles amb mitjans tècnicament rendibles, es produeix un vidre de silicat sòdic a què se li afegeixen altres components que el facin més resistent mecànicament, inert als agents químics a temperatura ambient -molt particularment a l'aigua- i que guardin la seva transparència a la llum, almenys en l'espectre visible.
Aquests components són metalls alcalinoterris, en particular magnesi, calci o bari, a més d'alumini i altres elements en menors quantitats, alguns dels quals apareixen aportats com a impureses per les matèries primeres (cas del ferro, el sofre o d'altres). Les matèries primeres que s'utilitzen per a l'elaboració de vidres d'aquest tipus s'escullen entre aquelles que presentin un menor cost:
- Per al sodi:
- Carbonat de sodi natural (jaciments dels EUA i Àfrica).
- Carbonat de sodi sintètic, el més utilitzat a Europa.
- Sulfat de sodi sintètic, subproducte de la indústria química.
- Nitrat de sodi natural (nitrat de Xile).
- Clorur de sodi o sal comuna.
- Aquests tres últims, utilitzats en petites proporcions, a causa del despreniment de gasos contaminants durant l'elaboració del vidre: SOX, NOX, Cl₂.
- Per al calci: calcàries naturals.
- Per al magnesi: dolomites naturals.
- Per a l'alumini: feldespats naturals (caolins).
- Per al bari: sulfat de bari natural (baritina).
La producció industrial d'aquest tipus de vidres es realitza, igual com en el cas dels silicats de sodi, en forns per a vidre, generalment de bassa, escalfats mitjançant la combustió de derivats del petroli amb suport, en molts casos, d'energia elèctrica a temperatures que oscil·len entre els 1.450 °C i els 1.600 °C. En aquests forns, s'introdueix una barreja en pols lleugerament humitejada (5% d'aigua) i prèviament dosificada de les matèries primeres ja esmentades. Aquesta mescla de matèries minerals reacciona (a velocitats apreciables i, evidentment, com més grans millor) per formar el conjunt de silicats que, combinats i barrejats, donaran lloc a aquesta substància a la qual es denomina vidre comú.
Propietats del vidre comú[modifica]
Les propietats del vidre comú són una funció tant de la naturalesa de les matèries primeres com de la composició química del producte obtingut. Aquesta composició química se sol representar en forma de percentatges en pes dels òxids més estables a temperatura ambient de cada un dels elements químics que el formen. Les composicions dels vidres silicat sòdics més utilitzats se situen dins dels límits que s'estableixen a la taula adjunta:
| Component | Des de ... % | ... fins a % |
| SiO₂ | 68,0 | 74,5 |
| Al₂O₃ | 0,0 | 4,0 |
| Fe₂O₃ | 0,0 | 0,45 |
| CaO | 9,0 | 14,0 |
| MgO | 0,0 | 4,0 |
| Na₂O | 10,0 | 16,0 |
| K₂O | 0,0 | 4,0 |
| SO₃ | 0,0 | 0,3 |
Molts estudis, molt particularment en la primera meitat del segle xx, han intentat establir correlacions entre el que es va denominar l'estructura interna del vidre, generalment basada en teories atòmiques, i les propietats observades en els vidres. Producte d'aquests estudis van ser un conjunt de relacions, de naturalesa absolutament empírica, que representen de manera sorprenentment precisa moltes d'aquestes propietats mitjançant relacions lineals entre el contingut dels elements químics que formen un vidre determinat (expressat sota la forma del contingut percentual en pes dels seus òxids més estables) i la magnitud que representa l'esmentada propietat. Curiosament, les correlacions amb les composicions expressades en forma molar o atòmica són molt menys fiables.
| SiO₂ | Al₂O₃ | Fe₂O₃ | CaO | MgO | Na₂O | K₂O | SO₃ |
| 73,20 | 1,51 | 0,10 | 10,62 | 0,03 | 13,22 | 1,12 | 0,20 |
NOTA: En aquest cas, els continguts en MgO, Fe₂O₃ i SO₃ són conseqüència de les impureses de la calcària, sorra i el sulfat sòdic, respectivament.
| Propietat | Valor | Unitats | Font |
| Densitat a 25 °C(1) | 2,49 | g/cm³ | Gilard & Dubrul |
| Coeficient de dilatació lineal a 25 °C(2) | 8,72•10-6 | °C-1 | Wilkelman & Schott |
| Conductivitat tèrmica a 25 °C | 0,002 | cal/cm.s.°C | Russ |
| Tensió superficial a 1.200 °C | 319 | dinas/cm | Rubenstein |
| Índex de refracció (a 589,3 nm)(3) | 1,52 | - | Gilard & Dubrul |
| Mòdul d'elasticitat a 25 °C | 719 | kbar | Appen |
| Mòdul de Poisson a 25 °C | 0,22 | - | Wilkelman & Schott |
| Resistència a la tracció a 25 °C(4) | (900) | bar | Wilkelman & Schott |
| Constant dielèctrica (4.5.188 Hz) | 7,3 | - | Appen & Bresker |
| Resistència elèctrica a 1.100 °C | 1,06 | Ώ.cm | |
| Resistència elèctrica a 1.500 °C | 0,51 | Ώ.cm |
- La viscositat s'expressa en la figura 3:(6)[5]

L'absorció (o transparència)(7) de la llum dels vidres de silicat sòdic a la zona de l'espectre visible (0,40 a 0,70) depèn del seu contingut en elements de transició (Ni i Fe en l'exemple). Tanmateix, tant en l'ultraviolat com en l'infraroig, el vidre es comporta pràcticament com un objecte gairebé opac, independentment de qualsevol d'aquests elements.
- (1) La densitat n'és una mica més elevada que en el quars fos 2,5 davant 2,2 g/cm³).
- (2) El coeficient de dilatació tèrmica lineal a temperatura ambient és notablement més alt que el de la sílice fosa (unes 20 vegades més), per la qual cosa els objectes de vidres de silicat sòdic són menys resistents al "xoc tèrmic".
- (3) El seu índex de refracció és lleugerament més gran que el del vidre de quars, i pot augmentar-se mitjançant l'ús d'additius.
- (4) La resistència a la tracció en qualsevol tipus de vidre és una magnitud que depèn extraordinàriament de l'estat de la superfície de l'objecte en qüestió, per la qual cosa la seva quantificació és complexa i poc fiable.
- (5) La resistència a l'atac químic o físic (dissolució) dels vidres comuns és una funció de la seva composició química fonamentalment. No obstant això, en tots aquests, aquesta resistència és elevada. Se sol mesurar mitjançant una sèrie de proves tipificades internacionalment. Entre les més usades:
- DIN 12116
- DIN 52322
- DIN 12111
- L'atacabilitat dels vidres també es modifica mitjançant tractaments superficials: amb SO₂, Sn, Ti, i d'altres.
- (6) Per a modelar un vidre, és necessària una viscositat que se situa entre 1.000 poises i 5.000 poises. En el cas de la sílice, calen temperatures de més de 2.600 °C, en tant que per als vidres comuns n'hi ha prou amb 1.200 °C, aproximadament.
- (7) L'absorció de la llum es veu influïda per l'estructura íntima d'aquestes matèries transparents. En el cas d'una estructura Si-O, l'absorció de fotons és baixa, fins i tot per a longituds petites d'ona (transparència als raigs UVA). No és així quan a aquesta senzilla estructura se li afegeixen altres elements (Na, Mg Ca, etc.) que incideixen decisivament en l'absorció a les longituds d'ona petites (menors de 200 nm) i en les infraroges (superiors a 700 nm). D'altra banda, la presència a la xarxa vítria d'elements de transició (vegeu taula periòdica dels elements) produeix absorcions selectives de radiació visible, cosa que permet, entre altres coses, acolorir els vidres amb una àmplia gamma de matisos.
Els altres vidres[modifica]
Per extensió, el nom de vidre s'utilitza també per a altres materials amorfs.
Per exemple, les mescles que contenen fluorur de zirconi, bari, lantani i alumini produeixen cristalls de fluorur més transparents en l'ultraviolat i proper a l'infraroig que el vidre de sílice. D'aquesta manera, serveixen per a fer els instruments per a aquestes radiacions òptiques.[6]
Moltes lents estan fetes de lents de plàstic, que són polímers basats en carboni, com ara policarbonats.
Alguns aliatges de metall poden ser solidificats amb una estructura amorfa gràcies a un refredament molt ràpid, llavors s'anomenen vidres metàl·lics. Es pot, per exemple, projectar metall fos sobre un tambor de coure que gira a alta velocitat. Aquests aliatges s'usen, per exemple, en els nuclis dels transformadors. De fet, el seu cicle d'histèresi és molt baix, reduint-ne les pèrdues.
Alguns acers poden solidificar en forma amorfa. A causa de la seva isotropia, tenen interessants propietats no magnètiques que els fan apropiats per a la construcció de submarins furtius. També tenen una alta duresa i una excel·lent resistència a la corrosió.
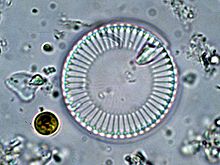
L'espècie més productora de vidre no és l'ésser humà, sinó la família de les diatomees. De fet, aquestes algues són unicel·lulars protegides per una fina capa de vidre i de sorprenents i delicades formes. Són un component del plàncton i la seva massa de vidre és elevada i molt superior a la producció humana. Des de 2008, els científics estan començant a identificar els detalls de la seva síntesi química: parteix dels silicats presents a l'aigua de mar, i ara es comença a aprendre a reproduir en laboratori les reaccions similars.[7] Aquesta producció es fa en les condicions físiques de la química suau, és a dir, que no requereix temperatura o pressió altes.
El principal avantatge del vidre per a la diatomea és no impedir la fotosíntesi en permetre el pas de la llum. Se sintetitza molt ràpidament durant la meiosi.
Reciclatge i reutilització del vidre[modifica]

Hi ha dues maneres d'aprofitar el vidre usat:
- Reutilització
- Hi ha envasos de vidre retornables que, després d'un procés adient de rentat, poden ser tornats a utilitzar per a la mateixa finalitat. Una ampolla de vidre pot ser reutilitzada entre 40 i 60 vegades, amb una despesa energètica del 5% de la del reciclatge. Aquesta és la millor opció.
- Reciclatge
- El vidre és reciclable. El reciclatge consisteix a fondre el vidre vell per fer-ne de nou.
Referències[modifica]
- ↑ Diccijonario de Arte II (en castellà). Barcelona: Biblioteca de Consulta Larousse. Spes Editorial SL (RBA), 2003, p.295. DL M-50.522-2002. ISBN 84-8332-391-5 [Consulta: 8 desembre 2014].
- ↑ John Shuman, III. Art Glass Identification & Price Guide. Krause Publications, 28 febrer 2011, p. 1–. ISBN 1-4402-2739-X.[Enllaç no actiu]
- ↑ Pascale Barthélémy. La Sedacina ou l'Oeuvre au crible 2 volumes: L'alchimie de Guillaume Sedacer, carme catalan de la fin du XIVème siècle. Arché, 2002. ISBN 978-88-7252-239-4.
- ↑ Antonio Neri; Giacomo Manzoni L'arte vetraria distinta in libri sette del r. p. Antonio Neri fiorentino. Ne quali si scoprono, effetti marauigliosi, & insegnano segreti bellissimi, del vetro nel fuoco & altre cose curiose. nella stamperia de' Giunti, 1612, p. 42–.
- ↑ «Coeficients per al càlcul de propietats del vidre (quadre)». Arxivat de l'original el 2011-07-18. [Consulta: 1r juny 2009].
- ↑ El vidre flourat (en francès)
- ↑ Livage, Jacques «Le verre biologique inspire les chimistes» (en francès). POUR LA SCIENCE, setembre-2008 [Consulta: 26 febrer 2012].
Vegeu també[modifica]
- Cristalleria Planell
- Vidre soluble.
- Cristall de Bohèmia.
- Vidre bufat.
- Vidre català.
- Vidre venecià.
- Vidre del bosc.
- Vidre d'Hebron.
- Vidre romà.
- Fibra de vidre.
- Granadura.
Enllaços externs[modifica]








