Microquimerisme
El microquimerisme és la presència d'un petit nombre de cèl·lules en un individu que s'han originat d'un altre individu i, per tant, són genèticament diferents. Aquest fenomen pot estar relacionat amb certs tipus de malalties autoimmunitàries encara que els mecanismes responsables no estan clars.
El terme prové del prefix «micro» + «quimerisme» basat en l'híbrid Quimera de la mitologia grega. El concepte es va descobrir per primera vegada a la dècada del 1960 amb el terme guanyant ús a la dècada del 1970.[1]
Tipus
[modifica]Humana
[modifica]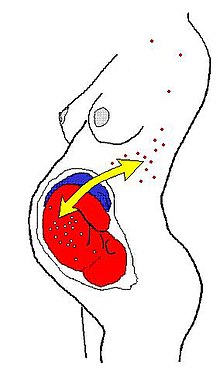
En humans (i potser en tots els mamífers placentaris), la forma més comuna és el microquimerisme fetoternal (també conegut com a microquimerisme de cèl·lules fetals o quimerisme fetal) pel qual les cèl·lules d'un fetus travessen la placenta i estableixen llinatges cel·lulars dins de la mare. S'ha documentat que les cèl·lules fetals persisteixen i es multipliquen a la mare durant diverses dècades.[2][3] Es desconeix el fenotip exacte d'aquestes cèl·lules, tot i que s'han identificat diversos tipus de cèl·lules diferents, com ara diversos llinatges immunitaris, cèl·lules mare mesenquimals i cèl·lules derivades de la placenta.[4] Un estudi de 2012 al Fred Hutchinson Cancer Research Center, Seattle, ha detectat cèl·lules amb el cromosoma Y en múltiples àrees del cervell de dones mortes.[5]
El microquimerisme fetoternal es produeix durant l'embaràs i poc després del part per a la majoria de les dones. Tanmateix, no totes les dones que han tingut fills contenen cèl·lules fetals. Els estudis suggereixen que el microquimerisme fetoternal podria estar influenciat per lligands semblants a les immunoglobulines de cèl·lules assassines (KIR).[6]
Els limfòcits també influeixen en el desenvolupament del microquimerisme fetomaternal persistent, ja que les cèl·lules assassines naturals componen al voltant del 70% dels limfòcits en el primer trimestre de l'embaràs. Els patrons KIR a les cèl·lules assassines naturals maternes de la mare i els lligands KIR a les cèl·lules fetals podrien tenir un efecte sobre el microquimerisme fetoternal. En un estudi, les mares amb KIR₂DS1 van mostrar nivells més alts de microquimerisme fetomaternal en comparació amb les mares que eren negatives per a aquest KIR activador.[6]
Es desconeixen les possibles conseqüències per a la salut d'aquestes cèl·lules. Una hipòtesi és que aquestes cèl·lules fetals podrien desencadenar una reacció empelt contra hoste que condueixi a una malaltia autoimmune. Això ofereix una possible explicació de per què moltes malalties autoimmunes són més freqüents en dones de mitjana edat.[7] Una altra hipòtesi és que les cèl·lules fetals alberguen teixit matern lesionat o malalt on actuen com a cèl·lules mare i participen en la reparació.[8][9] També és possible que les cèl·lules fetals siguin només espectadores innocents i no tinguin cap efecte sobre la salut materna.[10]
Després del part, entre el 50 i el 75% de les dones porten llinatges cel·lulars immunes fetals. Les cèl·lules immunitàries maternes també es troben en la descendència que produeixen en el «microquimerisme matern -> fetal», tot i que aquest fenomen és aproximadament la meitat més freqüent que el primer.[11] També s'havia demostrat que el microquimerisme existia després de transfusions de sang a una població de pacients greument immunodeprimits que van patir trauma.[12] Altres possibles fonts de microquimerisme inclouen la gestació,[13] el germà gran d'un individu, el germà bessó o el bessó desaparegut, amb les cèl·lules rebudes a l'úter. El microquimerisme fetal-matern és especialment freqüent després de l'avortament o l'avortament involuntari.[14]
Animal
[modifica]El microquimerisme es produeix en la majoria de parelles de bessons del bestiar. En el bestiar boví (i altres bovins), les placentes dels bessons fraterns solen fusionar-se i els bessons comparteixen la circulació sanguínia, donant lloc a un intercanvi de llinatges cel·lulars. Si els bessons són una parella mascle-femella, es produeix un microquimerisme XX/XY i les hormones masculines masculinitzen parcialment la vedella (femella), creant una vaca martin o Freemartin. Les Freemartins semblen femelles, però són infèrtils i, per tant, no es poden utilitzar per a la cria ni la producció de lactis. El microquimerisme proporciona un mètode per diagnosticar l'afecció, perquè es pot detectar material genètic masculí en una mostra de sang.[15]
Microquimerisme fetoternal al cervell
[modifica]Diversos estudis han identificat l'ADN masculí tant en el cervell humà com en el de ratolí de mares després de l'embaràs d'un fetus masculí.[5][16] S'ha suggerit que les cèl·lules derivades del fetus poden diferenciar-se en aquelles capaces de presentar immunomarcadors neurotípics a la seva superfície.[16] No hi ha evidència sòlida que digui que el microquimerisme del cervell matern condueixi a malalties; tanmateix, la malaltia de Parkinson es correlaciona amb una major incidència de microquimeres cerebrals.[16] Els estudis sobre la malaltia d'Alzheimer donen suport gairebé a la correlació oposada: com més cèl·lules derivades del fetus hi hagi, menor és la probabilitat que la pacient hagi tingut Alzheimer.[5]
Tolerància materna als antígens paterno-fetals
[modifica]Hi ha molts mecanismes a la interfície maternofetal per prevenir el rebuig immunitari de les cèl·lules fetals. No obstant això, es produeixen canvis immunològics sistèmics en dones embarassades. Per exemple, la condició de les dones que pateixen trastorns autoimmunitaris (per exemple, artritis reumatoide, esclerosi múltiple) millora durant l'embaràs.[17][18] Aquests canvis en les respostes immunitàries durant l'embaràs s'estenen als components materns específics dels antígens fetals, a causa de la transferència de cèl·lules feto-maternes i la seva retenció en els teixits de la mare. Durant l'embaràs, el nombre de cèl·lules fetals dels teixits materns augmenta i es correlaciona amb l'expansió de les cèl·lules T reguladores CD4+ (Tregs).[19] La disminució de l'expansió i l'acumulació decidual de Treg causen complicacions de l'embaràs (preeclàmpsia, avortaments).[19] En els models de ratolins, la majoria de les cèl·lules T CD8+ específiques del fetus de la mare pateixen una supressió clonal[20] i expressen nivells baixos de receptors i lligands de quimiocines; això impedeix que les cèl·lules T CD8+ específiques del fetus restants entrin a la interfície materno-fetal.[21][22] Les cèl·lules T CD4+ específiques del fetus de la mare proliferen i, a causa de l'expressió de FOXP3, es diferencien en cèl·lules Treg.[23] Els models de ratolins mostren que les cèl·lules Treg específiques del fetus són necessàries per a un embaràs reeixit.[24]
Tolerància fetal als antígens materns no heretats
[modifica]Les cèl·lules T fetals s'acumulen durant el desenvolupament in utero. Tot i que el fetus està exposat a antígens materns no heretats (NIMA), les cèl·lules T CD4+ fetals són capaces de proliferar induïda per al·loantigen, diferenciant-se preferentment a les cèl·lules Treg i impedint una resposta immune fetal als antígens materns.[25] Aquesta tolerància immune ampliada persisteix tant en la mare com en la descendència després del naixement i permet que les cèl·lules microquimèriques es retinguin als teixits.
Tolerància postnatal als NIMA
[modifica]La tolerància específica d'antígens materns no heretats (NIMA) provoca alguns fenotips immunològics interessants: la sensibilització als antígens del factor Rhesus (Rh) dels eritròcits es redueix entre les dones Rh nascudes de dones Rh+,[26] la supervivència a llarg termini de l'al·loempelt de ronyó es millora en parelles de germans donant-receptor coincidents amb els NIMA,[27] o quan el trasplantament de medul·la òssia es redueix el rebuig quan els receptors de cèl·lules mare del donant coincideixen amb wla NIMA.[28]
Els estudis d'acollida creuada en animals mostren que quan s'elimina l'exposició postnatal als NIMA a través de la lactància materna, es redueix la supervivència dels al·loempelts coincidents amb els NIMA. Això suggereix que per mantenir la tolerància específica dels NIMA en la descendència, la lactància materna és essencial, però la ingestió de cèl·lules de la mare per si sola no augmenta la tolerància específica dels NIMA. L'exposició prenatal i postnatal a les cèl·lules de la mare és necessària per mantenir la tolerància específica dels NIMA.[29]
Beneficis de les cèl·lules microquimèriques
[modifica]La gravetat dels trastorns autoimmunitaris preexistents es redueix durant l'embaràs i és més evident quan els nivells de cèl·lules microquimèriques fetals són més alts, durant l'últim trimestre.[17][18] Aquestes cèl·lules també poden substituir les cèl·lules maternes lesionades i recuperar la funció del teixit (el model de ratolí amb diabetis tipus I va mostrar la substitució de cèl·lules defectuoses dels illots materns per cèl·lules pancreàtiques derivades del fetus).[30] Les cèl·lules microquimèriques fetals es poden diferenciar en tipus cel·lulars que s'infiltren i substitueixen les cèl·lules lesionades en models de malaltia de Parkinson o infart de miocardi. També ajuden a la cicatrització de ferides per neoangiogènesi. S'ha proposat sembrar cèl·lules microquimèriques fetals als teixits materns per promoure la cura de la descendència després del naixement (la sembra de teixit mamari matern pot promoure la lactància i la sembra del cervell pot millorar l'atenció materna).[29]
Relació amb malalties autoimmunes i càncer de mama
[modifica]El microquimerisme ha estat implicat en malalties autoimmunitària. Estudis independents van suggerir repetidament que les cèl·lules microquimèriques d'origen fetal poden estar implicades en la patogènesi de l'esclerosi sistèmica.[2][31] A més, les cèl·lules microquimèriques d'origen matern poden estar implicades en la patogènesi d'un grup de malalties autoimmunes que es troben en nens, és a dir, miopaties inflamatòries idiopàtiques juvenils (un exemple seria la dermatomiositis juvenil).[32] El microquimerisme s'ha implicat encara més en altres malalties autoimmunes, inclòs el lupus eritematós sistèmic.[33] Al contrari, una hipòtesi alternativa sobre el paper de les cèl·lules microquimèriques en les lesions és que poden estar facilitant la reparació dels teixits de l'òrgan danyat.[34]
A més, també s'han trobat amb freqüència cèl·lules immunitàries fetals a l'estroma del càncer de mama en comparació amb mostres preses de dones sanes. No està clar, però, si els llinatges cel·lulars fetals afavoreixen el desenvolupament de tumors o, per contra, protegeixen les dones del desenvolupament del carcinoma de mama.[35][36]
Lupus eritematós sistèmic
[modifica]La presència de cèl·lules fetals a les mares es pot associar amb beneficis quan es tracta de certes malalties autoimmunitàries. En particular, les cèl·lules fetals masculines estan relacionades amb ajudar les mares amb lupus eritematós sistèmic. Quan es van prendre biòpsies renals de pacients amb nefritis lúpica, es va extreure ADN i es va executar amb PCR. Es va quantificar l'ADN fetal masculí i es va trobar la presència de seqüències específiques del cromosoma Y. Les dones amb nefritis lúpica que contenien cèl·lules fetals masculines a les seves biòpsies renals van mostrar un millor funcionament del sistema renal. Els nivells de creatinina sèrica, que està relacionada amb la insuficiència renal, eren baixos en mares amb nivells elevats de cèl·lules fetals masculines.[37] En canvi, les dones sense cèl·lules fetals masculines que tenien nefritis lúpica van mostrar una forma més greu de glomerulonefritis i nivells més alts de creatinina sèrica.[37]
El paper específic que tenen les cèl·lules fetals en el microquimerisme relacionat amb determinades malalties autoimmunitàries no s'entén del tot. Tanmateix, una hipòtesi afirma que aquestes cèl·lules subministren antígens, provocant inflamació i desencadenant l'alliberament de diferents antígens forans.[37] Això desencadenaria una malaltia autoimmunitària en lloc de servir com a terapèutic. Una hipòtesi diferent afirma que les cèl·lules microquimèriques fetals estan implicades en la reparació dels teixits. Quan els teixits s'inflamen, les cèl·lules microquimèriques fetals van al lloc danyat i ajuden a la reparació i regeneració del teixit.[37]
Malaltia de la tiroide
[modifica]El microquimerisme matern fetal pot estar relacionat amb malalties autoimmunitàries de la tiroide. Hi ha hagut informes de cèl·lules fetals al revestiment de la sang i de les glàndules tiroides de pacients amb malalties tiroïdals autoimmunitàries. Aquestes cèl·lules es podrien activar després del part del nadó després de la pèrdua de la supressió immune a la mare, cosa que suggereix un paper de les cèl·lules fetals en la patogènesi d'aquestes malalties.[38] Dos tipus de malaltia de la tiroides, la tiroïditis de Hashimoto i la malaltia de Graves, mostren similituds amb la malaltia de l'empelt contra l'hoste que es produeix després dels trasplantaments de cèl·lules mare hematopoètiques. Les cèl·lules fetals colonitzen els teixits materns com la glàndula tiroide i són capaços de sobreviure molts anys després del part. Aquestes cèl·lules microquimèriques fetals de la tiroide apareixen a la sang de les dones afectades per malalties de la tiroide.[38]
Síndrome de Sjogren
[modifica]La síndrome de Sjögren és una malaltia reumàtica autoimmunitària de les glàndules exocrines. L'augment de la incidència de la síndrome de Sjögren després del part suggereix una relació entre la síndrome de Sjögren i l'embaràs, i això va conduir a la hipòtesi que el microquimerisme fetal pot estar implicat en la patogènesi de la síndrome de Sjögren. Els estudis van mostrar la presència de cèl·lules fetals positives per al cromosoma Y a les glàndules salivals menors en 11 de 20 dones amb la síndrome de Sjögren , però només en un dels vuit controls normals. Les cèl·lules fetals en les glàndules salivals suggereixen que poden estar implicades en el desenvolupament de la síndrome de Sjögren.[39]
Liquen pla oral
[modifica]El liquen pla és una malaltia crònica autoimmunitària mediada per cèl·lules T d'etiologia desconeguda. Les dones tenen una prevalença tres vegades més gran que els homes. El liquen pla es caracteritza per la infiltració de limfòcits T als nivells inferiors de l'epiteli, on danyen les cèl·lules basals i provoquen apoptosi. El microquimerisme fetal pot desencadenar una reacció fetus vers hoste i, per tant, pot tenir un paper en la patogènesi de malalties autoimmunitàries inclòs el liquen pla.[40]
Càncer de mama
[modifica]L'embaràs té un efecte positiu en el pronòstic del càncer de mama segons diversos estudis[41][42][43] i aparentment augmenta les possibilitats de supervivència després del diagnòstic de càncer de mama.[44] Els possibles efectes positius de l'embaràs es podrien explicar per la persistència de cèl·lules fetals a la sang i els teixits materns.[3] Les cèl·lules fetals probablement migren activament de la sang perifèrica al teixit tumoral[45] on s'instal·len preferentment a l'estroma del tumor[36] i una concentració disminueix a mesura que s'apropen al teixit mamari sa.[46]
Hi ha dos mecanismes suggerits pels quals les cèl·lules fetals podrien tenir un efecte positiu en el pronòstic del càncer de mama. El primer mecanisme suggereix que les cèl·lules fetals només supervisen les cèl·lules canceroses i que atrauen components del sistema immunitari si cal. La segona opció és que la regulació a la baixa del sistema immunitari induïda per la presència de cèl·lules fetals podria conduir en última instància a la prevenció del càncer, perquè les dones en les quals hi ha FMC (5-fluorouracil, metotrexat, ciclofosfamida) produeixen concentracions més baixes de mediadors inflamatoris, que poden conduir al desenvolupament de teixit neoplàstic.[47] L'efecte també depèn del nivell de microquimerisme: l'hiperquimerisme (un índex elevat de microquimerisme) i l'hipoquimerisme (un índex baix de microquimerisme) poden estar relacionats amb l'efecte negatiu de la FMC i, per tant, poden promoure un pitjor pronòstic del càncer de mama.[48][49] Pel que sembla, les dones amb càncer de mama poden fracassar en el procés d'obtenció i manteniment de cèl·lules fetals al·logèniques. La baixa concentració i/o l'absència total de cèl·lules fetals poden indicar una predisposició al desenvolupament del procés maligne.
Altres càncers
[modifica]L'estudi de S. Hallum mostra una associació entre les cèl·lules fetals d'origen masculí i el risc de càncer d'ovari. La presència del cromosoma Y es va utilitzar per detectar cèl·lules estranyes a la sang de les dones. El microquimerisme és conseqüència de l'embaràs, la possibilitat que les cèl·lules estranyes fossin d'origen per transfusió o trasplantament va ser rebutjada per la salut de la dona. Les dones que van donar positiu per a les cèl·lules de microquimerisme d'origen masculí havien reduït les taxes de risc de càncer d'ovari que les dones que van donar negatiu.[50] L'embaràs a edats més grans pot reduir el risc de càncer d'ovari. El nombre de cèl·lules microquimèriques disminueix després de l'embaràs, i el càncer d'ovari és més freqüent en dones postmenopàusiques. Això suggereix que el microquimerisme fetal també pot tenir un paper protector en el càncer d'ovari.
Les cèl·lules microquimèriques també s'agrupen diverses vegades més en els tumors pulmonars que en el teixit pulmonar sa circumdant. Les cèl·lules fetals de la medul·la òssia van als llocs del tumor on poden tenir funcions de reparació de teixits.[51]
El microquimerisme d'origen del tràfic de cèl·lules fetomaternes podria estar associat amb la patogènesi o la progressió del càncer de coll uterí. Es van observar cèl·lules masculines en pacients amb càncer de coll uterí però no en controls positius. Les cèl·lules microquimèriques poden induir l'alteració del sistema immunitari de la dona i fer que el teixit cervical sigui més susceptible a la infecció pel VPH o proporcionar un entorn adequat per al creixement del tumor.[52]
Paper del microquimerisme en la cicatrització de ferides
[modifica]Les cèl·lules fetals microquimèriques expressaven col·lagen I, III i TGF-β3 i es van identificar en cicatrius de cesària materna guarides. Això suggereix que aquestes cèl·lules migren al lloc del dany a causa dels senyals de lesions de la pell materna i ajuden a reparar el teixit.[53]
Cèl·lules mare
[modifica]Models animals
[modifica]El microquimerisme fetomatenal s'ha demostrat en investigacions experimentals sobre si les cèl·lules fetals poden creuar la barrera hematoencefàlica en ratolins. Les propietats d'aquestes cèl·lules els permeten creuar la barrera hematoencefàlica i dirigir-se al teixit cerebral lesionat.[54] Aquest mecanisme és possible perquè les cèl·lules sanguínies del cordó umbilical expressen algunes proteïnes semblants a les neurones. Quan aquestes cèl·lules sanguínies del cordó umbilical s'injecten en rates amb lesió cerebral o ictus, entren al cervell i expressen certs marcadors de cèl·lules nervioses. A causa d'aquest procés, les cèl·lules fetals podrien entrar al cervell durant l'embaràs i diferenciar-se en cèl·lules neuronals. El microquimerisme fetal es pot produir al cervell matern del ratolí, responent a determinades senyals del cos matern.[54]
Implicacions per a la salut
[modifica]El microquimerisme fetal podria tenir una implicació en la salut materna. L'aïllament de cèl·lules en cultius pot alterar les propietats de les cèl·lules mare, però durant l'embaràs es poden investigar els efectes de les cèl·lules mare fetals sense cultius in vitro. Un cop caracteritzades i aïllades, les cèl·lules fetals que són capaces de creuar la barrera hematoencefàlica podrien afectar certs procediments.[54] Per exemple, es pot aïllar les cèl·lules mare prenent-les de fonts com el cordó umbilical. Aquestes cèl·lules mare fetals es poden utilitzar en infusió intravenosa per reparar el teixit cerebral. Els canvis hormonals en l'embaràs alteren la neurogènesi, la qual cosa podria crear entorns favorables perquè les cèl·lules fetals responguin a lesions.[54]
La veritable funció de les cèl·lules fetals de les mares encara no es coneix completament, però hi ha hagut informes d'efectes positius i negatius per a la salut. L'intercanvi de gens entre el fetus i la mare pot comportar beneficis. Com que no es comparteixen tots els gens, poden sorgir complicacions de salut com a resultat de l'assignació de recursos.[55] Durant l'embaràs, les cèl·lules fetals són capaces de manipular el sistema matern per extreure recursos de la placenta, mentre que el sistema matern intenta limitar-lo.[55]
Referències
[modifica]- ↑ Naik et al., 2019, p. 311.
- ↑ 2,0 2,1 Evans et al., Moore, p. 2033-2037.
- ↑ 3,0 3,1 Bianchi et al., DeMaria, p. 705-708.
- ↑ Pritchard et al., Bianchi, p. 42.
- ↑ 5,0 5,1 5,2 Chan et al., Guthrie, p. e45592.
- ↑ 6,0 6,1 Kruchen et al., Oezcan, p. 1242.
- ↑ Nelson, 1996, p. 191-194.
- ↑ Khosrotehrani et al., Bianchi, p. 75-80.
- ↑ Nguyen Hu et al., Mortier, p. 630-637.
- ↑ Johnson i Bianchi, 2004, p. 497-502.
- ↑ Loubière et al., Yan, p. 1185-1192.
- ↑ Reed et al., Busch, p. 24-31.
- ↑ Shree et al., Cousin, p. 24-31.
- ↑ Khosrotehrani et al., Cha, p. 3237-3241.
- ↑ Fujishiro et al., 1995, p. 883-891.
- ↑ 16,0 16,1 16,2 Zeng et al., Tan, p. 1819-1830.
- ↑ 17,0 17,1 Confavreux et al., Moreau, p. 285-291.
- ↑ 18,0 18,1 Østensen i Villiger, 2007, p. 185-191.
- ↑ 19,0 19,1 Jiang et al., Clark, p. 4949-4956.
- ↑ Erlebacher et al., Glimcher, p. 1399-1441.
- ↑ Chaturvedi et al., Xin, p. 1713-1725.
- ↑ Nanch et al., Levy, p. 1317-1321.
- ↑ Rowe et al., 2012, p. 102-106.
- ↑ Xin et al., Kinder, p. 2970-2974.
- ↑ Mold et al., Beckerman, p. 1562-1566.
- ↑ Owen et al., Baldwin, p. 420-424.
- ↑ Burlingham et al., Norman, p. 1657-1664.
- ↑ Rood et al., Claas, p. 1572-1577.
- ↑ 29,0 29,1 Kinder et al., 2017, p. 483-494.
- ↑ Sunami et al., Hirata, p. 117-123.
- ↑ Artlett, Smith i Jimenez, 1998, p. 1186-1191.
- ↑ Artlett et al., Miller, p. 2155-2156.
- ↑ Johnson et al., 2001, p. 2107-2011.
- ↑ Gilliam, 2006, p. 239-241.
- ↑ Gadi i Nelson, 2007, p. 9035-9038.
- ↑ 36,0 36,1 Dubernard et al., Mathieu, p. R14.
- ↑ 37,0 37,1 37,2 37,3 Florim et al., Fernandes, p. 101.
- ↑ 38,0 38,1 Lepez, Vandewoestyne i Deforce, 2013, p. 111-118.
- ↑ Endo, Negishi i Ishikawa, 2002, p. 490-495.
- ↑ Shrivastava et al., 2019, p. 311.
- ↑ Rosenberg et al., 2004, p. 772-776.
- ↑ Olson et al., 1998, p. 669-671.
- ↑ Anderson et al., 2004, p. 225-231.
- ↑ Warren Andersen et al., Egan, p. 975-980.
- ↑ Dubernard et al., Rouzier, p. 1054-1059.
- ↑ Nemescu et al., 2016, p. e0147675.
- ↑ Coussens i Werb, 2002, p. 860-867.
- ↑ Gadi et al., Nelson, p. e1706.
- ↑ Dhimolea et al., Aziz-Zaman, p. 835-842.
- ↑ Hallum et al., Tjønneland, p. 87-94.
- ↑ Sawicki, 2008, p. 9567-9569.
- ↑ Cha, 2003, p. 774-781.
- ↑ Mahmood, 2014, p. 40-52.
- ↑ 54,0 54,1 54,2 54,3 Tan et al., Xiao, p. 1443-1452.
- ↑ 55,0 55,1 Boddy et al., 2015, p. 1106-1118.
Bibliografia
[modifica]- Anderson, Penny R.; Hanlon, Alexandra L.; Freedman, Gary M.; Nicolaou, Nicos «Parity Confers Better Prognosis in Older Women with Early-Stage Breast Cancer Treated with Breast-Conserving Therapy» (en anglès). Clinical Breast Cancer, 5(3), agost 2004. DOI: 10.3816/cbc.2004.n.026. PMID: 15335456.
- Artlett, Carol M.; Smith, J. Bruce; Jimenez, Sergio A. «Identification of Fetal DNA and Cells in Skin Lesions from Women with Systemic Sclerosis» (en anglès). New England Journal of Medicine, 338(17), abril 1998. DOI: 10.1056/NEJM199804233381704. PMID: 9554859.
- Artlett, C. M; Ramos, R; Jimenez, S. A; Patterson, K; Miller, F. W «Chimeric cells of maternal origin in juvenile idiopathic inflammatory myopathies. Childhood Myositis Heterogeneity Collaborative Group» (en anglès). Lancet, 356(9248), 2000, pàg. 2155–6. DOI: 10.1016/S0140-6736(00)03499-1. PMID: 11191545.
- Bianchi, D. W; Zickwolf, G. K; Weil, G. J; Sylvester, S; DeMaria, M. A «Male fetal progenitor cells persist in maternal blood for as long as 27 years postpartum» (en anglès). Proceedings of the National Academy of Sciences, 93(2), gener 1996, pàg. 705–708. Bibcode: 1996PNAS...93..705B. DOI: 10.1073/pnas.93.2.705. PMC: 40117. PMID: 8570620.
- Boddy, A. M; Fortunato, A; Wilson Sayres, M; Aktipis, A «Fetal microchimerism and maternal health: a review and evolutionary analysis of cooperation and conflict beyond the womb» (en anglès). BioEssays, 37(10), octubre 2015. DOI: 10.1002/bies.201500059. PMC: 4712643. PMID: 26316378.
- Burlingham, William J; Grailer, Alan P; Heisey, Dennis M; Claas, Frans H. J; Norman, Douglas «The Effect of Tolerance to Noninherited Maternal HLA Antigens on the Survival of Renal Transplants from Sibling Donors» (en anglès). New England Journal of Medicine, 339(23), desembre 1998. DOI: 10.1056/NEJM199812033392302. PMID: 9834302.
- Cha, D «Cervical cancer and microchimerism» (en anglès). Obstetrics & Gynecology, 102(4), octubre 2003. DOI: 10.1016/S0029-7844(03)00615-X. PMID: 14551008.
- Chan, W. F; Gurnot, C; Montine, T. J; Sonnen, J. A; Guthrie, K. A «Male microchimerism in the human female brain» (en anglès). PLOS ONE, 7(9), setembre 2012. Bibcode: 2012PLoSO...745592C. DOI: 10.1371/journal.pone.0045592. PMC: 3458919. PMID: 23049819.
- Chaturvedi, Vandana; Ertelt, James M.; Jiang, Tony T.; Kinder, Jeremy M.; Xin, Lijun «CXCR3 blockade protects against Listeria monocytogenes infection–induced fetal wastage» (en anglès). Journal of Clinical Investigation, 125(4), abril 2015. DOI: 10.1172/JCI78578. PMC: 4396484. PMID: 25751061.
- Confavreux, Christian; Hutchinson, Michael; Hours, Martine Marie; Cortinovis-Tourniaire, Patricia; Moreau, Thibault «Rate of Pregnancy-Related Relapse in Multiple Sclerosis» (en anglès). New England Journal of Medicine, 339(5), juliol 1998. DOI: 10.1056/NEJM199807303390501. PMID: 9682040.
- Coussens, L. M; Werb, Z «Inflammation and cancer» (en anglès). Nature, 420(6917), desembre 2002. Bibcode: 2002Natur.420..860C. DOI: 10.1038/nature01322. PMC: 2803035. PMID: 12490959.
- Dhimolea, E; Denes, V; Lakk, M; Al-Bazzaz, S; Aziz-Zaman, S «High male chimerism in the female breast shows quantitative links with cancer» (en anglès). International Journal of Cancer, 133(4), agost 2013. DOI: 10.1002/ijc.28077. PMID: 23390035.
- Dubernard, Gil; Aractingi, Sélim; Oster, Michel; Rouzier, Roman; Mathieu, Marie-Christine «Breast cancer stroma frequently recruits fetal derived cells during pregnancy» (en anglès). Breast Cancer Research, 10(1), febrer 2008. DOI: 10.1186/bcr1860. PMC: 2374970. PMID: 18271969.
- Dubernard, G; Oster, M; Chareyre, F; Antoine, M; Rouzier, R «Increased fetal cell microchimerism in high grade breast carcinomas occurring during pregnancy» (en anglès). International Journal of Cancer, 124(5), març 2009. DOI: 10.1002/ijc.24036. PMID: 19065666.
- Endo, Y.; Negishi, I; Ishikawa, O «Possible contribution of microchimerism to the pathogenesis of Sjogren's syndrome» (en anglès). Rheumatology, 41(5), maig 2002. DOI: 10.1093/rheumatology/41.5.490. PMID: 12011370.
- Erlebacher, A; Vencato, D; Price, K. A; Zhang, D; Glimcher, L. H «Constraints in antigen presentation severely restrict T cell recognition of the allogeneic fetus» (en anglès). The Journal of Clinical Investigation, 117(5), maig 2007, pàg. 1399–411. DOI: 10.1172/JCI28214. PMC: 1849983. PMID: 17446933.
- Evans, Paul C.; Lambert, Nathalie; Maloney, Sean; Furst, Dan E.; Moore, James M. «Long-Term Fetal Microchimerism in Peripheral Blood Mononuclear Cell Subsets in Healthy Women and Women With Scleroderma» (en anglès). Blood, 93(6), març 1999, pàg. 2033–2037. DOI: 10.1182/blood.V93.6.2033.406k18_2033_2037. PMID: 10068676.
- Florim, G. M; Caldas, H. C; Baptista, M. A; Fernandes, I. M «Fetal microchimerism in kidney biopsies of lupus nephritis patients may be associated with a beneficial effect» (en anglès). Arthritis Research & Therapy, 17(1), abril 2015. DOI: 10.1186/s13075-015-0615-4. PMC: 4416327. PMID: 25889410.
- Fujishiro, A; Kawakura, K; Miyake, Y. I; Kaneda, Y «A fast, convenient diagnosis of the bovine freemartin syndrome using polymerase chain reaction» (en anglès). Theriogenology, 43(5), abril 1995. DOI: 10.1016/0093-691X(95)00039-B. PMID: 16727678.
- Gadi, V. K; Nelson, J. L «Fetal microchimerism in women with breast cancer» (en anglès). Cancer Research, 67(19), octubre 2007. DOI: 10.1158/0008-5472.CAN-06-4209. PMID: 17909006.
- Gadi, V. K; Malone, K. E; Guthrie, K. A; Porter, P. L; Nelson, J. L «Case-control study of fetal microchimerism and breast cancer» (en anglès). PLOS ONE, 3(3), març 2008. Bibcode: 2008PLoSO...3.1706G. DOI: 10.1371/journal.pone.0001706. PMC: 2248618. PMID: 18320027.
- Gammill, H.S; Nelson J. L «Naturally acquired microchimerism» (en anglès). The International Journal of Developmental Biology, 54(2)-54(3), 2010, pàg. 531-543. DOI: 10.1387/ijdb.082767hg. PMC: 2887685. PMID: 19924635.
- Gilliam, A. C «Microchimerism and skin disease: true-true unrelated?» (en anglès). The Journal of Investigative Dermatology, 126(2), febrer 2006. DOI: 10.1038/sj.jid.5700061. PMID: 16418731.
- Hallum, Sara; Jakobsen, Marianne Antonius; Gerds, Thomas Alexander; Pinborg, Anja; Tjønneland, Anne «Male origin microchimerism and ovarian cancer» (en anglès). International Journal of Epidemiology, 50(1), 2020. DOI: 10.1093/ije/dyaa019. ISSN: 0300-5771. PMID: 32065627.
- Jiang, Tony T.; Chaturvedi, Vandana; Ertelt, James M.; Kinder, Jeremy M.; Clark, Dayna R. «Regulatory T Cells: New Keys for Further Unlocking the Enigma of Fetal Tolerance and Pregnancy Complications» (en anglès). The Journal of Immunology, 192(11), juny 2014, pàg. 4949–4956. DOI: 10.4049/jimmunol.1400498. PMC: 4030688. PMID: 24837152.
- Johnson, K. L; McAlindon, T. E; Mulcahy, E; Bianchi, D. W «Microchimerism in a female patient with systemic lupus erythematosus» (en anglès). Arthritis and Rheumatism, 44(9), setembre 2001. DOI: 10.1002/1529-0131(200109)44:9<2107::AID-ART361>3.0.CO;2-9. PMID: 11592373.
- Johnson, K. L; Bianchi, D. W «Fetal cells in maternal tissue following pregnancy: what are the consequences?» (en anglès). Human Reproduction Update, 10(6), 2004. DOI: 10.1093/humupd/dmh040. PMID: 15319378.
- Khosrotehrani, K; Johnson, K. L; Lau, J; Dupuy, A; Cha, D. H «The influence of fetal loss on the presence of fetal cell microchimerism: a systematic review» (en anglès). Arthritis and Rheumatism, 48(11), novembre 2003. DOI: 10.1002/art.11324. PMID: 14613289.
- Khosrotehrani, K; Johnson, K. L; Cha, D. H; Salomon, R. N; Bianchi «Transfer of fetal cells with multilineage potential to maternal tissue» (en anglès). JAMA, 292(1), juliol 2004. DOI: 10.1001/jama.292.1.75. PMID: 15238593.
- Kinder, Jeremy M.; Stelzer, Ina A.; Arck, Petra C.; Way, Sing Sing «Immunological implications of pregnancy-induced microchimerism» (en anglès). Nature Reviews. Immunology, 17(8), 2017. DOI: 10.1038/nri.2017.38. PMC: 5532073. PMID: 28480895.
- Kruchen, Anne; Stahl, Tanja; Gieseke, Friederike; Binder, Thomas M. C; Oezcan, Zakir «Fetomaternal Microchimerism Is Associated with Better Outcome in Haploidentical Hematopoietic Stem Cell Transplantation» (en anglès). Blood, 124(21), desembre 2014, pàg. 1242. DOI: 10.1182/blood.V124.21.1242.1242.
- Lepez, T; Vandewoestyne, M; Deforce, D «Fetal microchimeric cells in autoimmune thyroid diseases: harmful, beneficial or innocent for the thyroid gland?» (en anglès). Chimerism, 4(4), maig 2013. DOI: 10.4161/chim.25055. PMC: 3921191. PMID: 23723083.
- Loubière, L. S; Lambert, N. C; Flinn, L. J; Erickson, T. D; Yan, Z «Maternal microchimerism in healthy adults in lymphocytes, monocyte/macrophages and NK cells» (en anglès). Laboratory Investigation; A Journal of Technical Methods and Pathology, 86(11), novembre 2006. DOI: 10.1038/labinvest.3700471. PMID: 16969370.
- Mahmood, Uzma; O’Donoghue, Keelin «Microchimeric fetal cells play a role in maternal wound healing after pregnancy» (en anglès). Chimerism, 5(2), abril 2014. DOI: 10.4161/chim.28746. PMC: 4199806. PMID: 24717775.
- Mold, Jeff E.; Michaëlsson, Jakob; Burt, Trevor D.; Muench, Marcus O.; Beckerman, Karen P. «Maternal Alloantigens Promote the Development of Tolerogenic Fetal Regulatory T Cells in Utero» (en anglès). Science, 322(5907), desembre 2008. Bibcode: 2008Sci...322.1562M. DOI: 10.1126/science.1164511. PMC: 2648820. PMID: 19056990.
- Müller, A. C; Jakobsen, M. A; Barington, T; Vaag, A. A; Grunnet, L. G «Microchimerism of male origin in a cohort of Danish girls» (en anglès). Chimerism, 6(4), octubre 2015, pàg. 65-71. DOI: 10.1080/19381956.2016.1218583. PMC: 5293315. PMID: 27623703.
- Naik, Rupali; Shrivastava, Sandhya; Suryawanshi, Hema; Gupta, Neha «Microchimerism: A new concept» (en anglès). Journal of Oral and Maxillofacial Pathology. Medknow, 23(2), 2019, pàg. 311. DOI: 10.4103/jomfp.jomfp_85_17. ISSN: 0973-029X. PMC: 6714269. PMID: 31516258.
- Nancy, P; Tagliani, E; Tay, C. S; Asp, P; Levy, D. E «Chemokine Gene Silencing in Decidual Stromal Cells Limits T Cell Access to the Maternal-Fetal Interface» (en anglès). Science, 336(6086), juny 2012. Bibcode: 2012Sci...336.1317N. DOI: 10.1126/science.1220030. PMC: 3727649. PMID: 22679098.
- Nelson, J. L «Maternal-fetal immunology and autoimmune disease: is some autoimmune disease auto-alloimmune or allo-autoimmune?» (en anglès). Arthritis and Rheumatism, 39(2), febrer 1996. DOI: 10.1002/art.1780390203. PMID: 8849367.
- Nemescu, D; Ursu, R. G; Nemescu, E. R; Negura, L «Heterogeneous Distribution of Fetal Microchimerism in Local Breast Cancer Environment» (en anglès). PLOS ONE, 11(1), gener 2016. Bibcode: 2016PLoSO..1147675N. DOI: 10.1371/journal.pone.0147675. PMC: 4726590. PMID: 26808509.
- Nguyen Huu, S; Avril, M. F; Boitier, F; Mortier, L «Fetal microchimeric cells participate in tumour angiogenesis in melanomas occurring during pregnancy» (en anglès). The American Journal of Pathology, 174(2), febrer 2009. DOI: 10.2353/ajpath.2009.080566. PMC: 2630570. PMID: 19147820.
- Olson, Sara H.; Zauber, Ann G.; Tang, Jian; Harlap, Susan «Relation of Time since Last Birth and Parity to Survival of Young Women with Breast Cancer» (en anglès). Epidemiology, 9(6), novembre 1998. DOI: 10.1097/00001648-199811000-00019. PMID: 9799180.
- Østensen, Monika; Villiger, Peter M. «The remission of rheumatoid arthritis during pregnancy» (
 PDF) (en anglès). Seminars in Immunopathology, 29(2), maig 2007. DOI: 10.1007/s00281-007-0072-5. PMID: 17621703.
PDF) (en anglès). Seminars in Immunopathology, 29(2), maig 2007. DOI: 10.1007/s00281-007-0072-5. PMID: 17621703. - Owen, Ray D; Wood, Harold R; Foord, Alvin G; Sturgeon, Phillip; Baldwin, L. G «Evidence for actively acquired tolerance to Rh antigens» (en anglès). Proceedings of the National Academy of Sciences of the United States of America, 40(6), juny 1954. Bibcode: 1954PNAS...40..420O. DOI: 10.1073/pnas.40.6.420. PMC: 534062. PMID: 16589498.
- Pritchard, S; Wick, H. C; Slonim, D. K; Johnson, K. L; Bianchi, D. W «Comprehensive analysis of genes expressed by rare microchimeric fetal cells in the maternal mouse lung» (en anglès). Biology of Reproduction, 87(2), agost 2012, pàg. 42. DOI: 10.1095/biolreprod.112.101147. PMC: 3431427. PMID: 22674387.
- Reed, W; Lee, T. H; Norris, P. J; Utter, G. H; Busch, M. P «Transfusion-associated microchimerism: a new complication of blood transfusions in severely injured patients» (en anglès). Seminars in Hematology, 44(1), juny 2007. DOI: 10.1053/j.seminhematol.2006.09.012. PMID: 17198844.
- Rood, J. J. van; Loberiza, F. R; Zhang, M. J; Oudshoorn, M; Claas, F «Effect of tolerance to noninherited maternal antigens on the occurrence of graft-versus-host disease after bone marrow transplantation from a parent or an HLA-haploidentical sibling» (en anglès). Blood, 99(5), març 2002. DOI: 10.1182/blood.v99.5.1572. PMID: 11861270.
- Rosenberg, L; Thalib, L; Adami, H. O; Hall, P «Childbirth and breast cancer prognosis» (en anglès). International Journal of Cancer, 111(5), setembre 2004. DOI: 10.1002/ijc.20323. PMID: 15252849.
- Rowe, Jared H.; Ertelt, James M.; Xin, Lijun; Way, S. S «Pregnancy imprints regulatory memory that sustains anergy to fetal antigen» (en anglès). Nature, 490(7418), octubre 2012. Bibcode: 2012Natur.490..102R. DOI: 10.1038/nature11462. PMC: 3465465. PMID: 23023128.
- Sawicki, J. A «Fetal Microchimerism and Cancer» (en anglès). Cancer Research, 68(23), desembre 2008. DOI: 10.1158/0008-5472.CAN-08-3008. PMC: 2638004. PMID: 19047129.
- Shree, R; Harrington, We; Kanaan, S.; Forsyth, A; Cousin, E «Fetal microchimerism by mode of delivery: a prospective cohort study» (en anglès). BJOG, 126(1), gener 2019. DOI: 10.1111/1471-0528.15432. PMC: 6294652. PMID: 30102819.
- Shrivastava, Sandhya; Naik, Rupali; Suryawanshi, Hema; Gupta, Neha «Microchimerism: A new concept» (en anglès). Journal of Oral and Maxillofacial Pathology, 23(2), 2019. DOI: 10.4103/jomfp.JOMFP_85_17. PMC: 6714269. PMID: 31516258.
- Sunami, Rei; Komuro, Mayuko; Yuminamochi, Tsutomu; Hoshi, Kazuhiko; Hirata, Shuji «Fetal cell microchimerism develops through the migration of fetus-derived cells to the maternal organs early after implantation» (en anglès). Journal of Reproductive Immunology, 84(2), març 2010, pàg. 117–123. DOI: 10.1016/j.jri.2009.11.006. PMID: 20116109.
- Tan, X. W; Liao, H; Sun, L; Okabe, M; Xiao, Z. C «Fetal microchimerism in the maternal mouse brain: a novel population of fetal progenitor or stem cells able to cross the blood-brain barrier?» (en anglès). Stem Cells, 23(10), novembre 2005. DOI: 10.1634/stemcells.2004-0169. PMID: 16091558.
- Warren Andersen, S; Newcomb, P. A; Hampton, J. M; Titus-Ernstoff, L; Egan, K. M «Reproductive factors and histologic subtype in relation to mortality after a breast cancer diagnosis» (en anglès). Breast Cancer Research and Treatment, 130(3), desembre 2011. DOI: 10.1007/s10549-011-1666-0. PMC: 4306414. PMID: 21769659.
- Xin, Lijun; Ertelt, James M.; Rowe, Jared H.; Jiang, Tony T.; Kinder, Jeremy M. «Cutting Edge: Committed Th1 CD4 + T Cell Differentiation Blocks Pregnancy-Induced Foxp3 Expression with Antigen-Specific Fetal Loss» (en anglès). The Journal of Immunology, 192(7), abril 2014. DOI: 10.4049/jimmunol.1302678. PMC: 3972488. PMID: 24591368.
- Zeng, Xiao Xia; Tan, Kian Hwa; Yeo, Ailing; Sasajala, Piriya; Tan, Xiaowei «Pregnancy-Associated Progenitor Cells Differentiate and Mature into Neurons in the Maternal Brain» (en anglès). Stem Cells and Development, 19(12), desembre 2010. DOI: 10.1089/scd.2010.0046. PMID: 20707697.
