Curi
| Per a altres significats, vegeu «Curi (desambiguació)». |
| Curi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
96Cm
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Platejat Curi fluorescent  Línies espectrals del curi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Curi, Cm, 96 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Actínids | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | n/d, 7, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | (247) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Rn] 5f7 6d1 7s2 2, 8, 18, 32, 25, 9, 2 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
13,51 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.613 K, 1.340 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 3.383 K, 3.110 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | ? 15 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 4, 3 (òxid amfòter) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,3 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia d'ionització | 1a: 581 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 174 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 169±3 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal empaquetada compacta 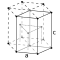
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Antiferromagnètic→transició paramagnètica a 52 K[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | 1,25[1] µΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-51-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del curi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El curi és l'element químic de símbol Cm i nombre atòmic 96. Es tracta d'un actinoide.[2] Fou descobert el 1944, essent el tercer transurànid a ser sintetitzat,[3] pels científics estatunidencs Glenn T. Seaborg, Ralph A. James i Albert Ghiorso i fou anomenat en honor de Marie i Pierre Curie, pioners en la recerca sobre la radioactivitat.[4] S'ha emprat per sintetitzar per primera vegada elements de major nombre atòmic (californi i livermori), com a combustible en alguns generadors termoelèctrics de radioisòtops (RTG) emprats en satèl·lits i vehicles d'exploració espacial i com a font de partícules alfa en espectròmetres de raigs X de partícules α (APXS), també de vehicles espacials.
Història
[modifica]
El curi fou descobert pels científics estatunidencs Glenn T. Seaborg (1912-1999), Ralph A. James (1920-1973) i Albert Ghiorso (1915-2010) el 1944 en el Laboratori Metal·lúrgic de la Universitat de Chicago quan treballaven pel Projecte Manhattan, com a resultat d'un experiment que havien dut a terme al Laboratori Nacional de Lawrence Berkeley, de la Universitat de Califòrnia a Berkeley.[5] Aquests investigadors bombardejaren plutoni 239 amb partícules alfa al ciclotró de 150 cm d'aquest centre de recerca. La reacció nuclear duta a terme es pot simbolitzar com:[6]

També bombardejarem americi 241 amb neutrons i aconseguiren el mateix isòtop segons les reaccions:[7][6]
Els descobridors proposaren anomenar l'element curi, símbol Cm, en honor del matrimoni de físics Pierre Curie (1859-1906) i Maria Skłodowska-Curie (1867-1934), investigadors de la radioactivitat i descobridors del radi i del poloni.[6]

El 1947 Louis B. Werner (1921-2007) i Isadore Perlman (1915-1991), a la Universitat de Califòrnia a Berkeley, aconseguiren obtindre 30 μg d'hidròxid de curi(III) de l'isòtop curi 242.[8] El 1950, W.W.T. Crane, J.C. Wallmann i B.B. Cunningham determinaren que la susceptibilitat magnètica del fluorur de curi(III) era igual a la del fluorur de gadolini(III) —el gadolini està situat just damunt del curi a la taula periòdica—. Aquests investigadors aconseguiren aïllar curi elemental el 1951 i també el grup de Werner.[9][10][11]
Estat natural i obtenció
[modifica]
Malgrat el llarg període de semidesintegració d'alguns isòtops ( i ), de l'ordre de milions d'anys, aquests temps són molt curts si se'ls compara en l'edat de la Terra (4 540 milions d'anys), per la qual cosa el curi primordial que podria haver existit en formar-se la Terra ja s'hauria desintegrat completament. Tanmateix, s'ha demostrat l'existència de petites quantitats de curi en dipòsits d'urani a conseqüència d'una seqüència de captures de neutrons i emissions β–. Aquests isòtops es produïren durant centenars de milers d'anys en reactors nuclears naturals que començaren a funcionar fa uns 1 800 milions d'anys, seguint processos geològics naturals que concentraven l'urani. Això donà lloc al fet que setze reactors nuclears naturals entrassin en funcionament a Oklo, Gabon, a l'Àfrica. En aquests reactors operaven de manera contínua i, mitjançant processos de captura de neutrons i desintegracions β, i produïren els elements transurànics dels nombres atòmics 83 (neptuni) al 100 (fermi), inclòs el curi (vuit isòtops del curi 242 al curi 249).[12] Per exemple, les reaccions de captura de neutrons seguides de desintegració β que condueixen al curi 244 són:[13]
Els isòtops del curi 246 al curi 249 es produeixen per captura de neutrons dels isòtops de curi inferiors.[12]
La producció d'isòtops de curi actualment es duu a terme en reactors nuclears que generin un alt flux de neutrons seguin reaccions del tipus vist als reactors naturals d'Oklo. En el procés s'obtenen juntament amb altres actinoides i seguidament s'ha de realitzar una separació. La producció anual de curi és de l'ordre del kilogram.[13]
Propietats
[modifica]Propietats físiques
[modifica]El curi és un metall blanc platejat, de densitat 13,51 g/cm³ (calculada) i punt de fusió 1 345 °C.[11]
Propietats químiques
[modifica]El seu estat d'oxidació més comú és el +3, com ara al catió , de color groc pàl·lid en dissolució aquosa, com l'òxid de curi(III) i els trihalurs , , i . Les seves propietats són semblants als altres elements actinoides tripositius i als lantanoides. L'estat d'oxidació +4 apareix a l'òxid de curi(IV) negre i al catió complexat amb l'anió fluorur.[14]
Els compostos més habituals del curi contenen brom, clor, fluor, hidrogen, iode, oxigen, sulfur i seleni, en són exemples , , , , , i [15]
Isòtops
[modifica]Del curi s'han identificat vint isòtops i un isòmer nuclear. Un bon nombre d'ells s'ha observat com a producte de la desintegració dels nuclis més massius i amb nombre atòmic parell. Aquests nuclis es van desintegrant per emissió de partícules α i van generant nous nuclis que segueixen desintegrant-se. És el cas de l'element oganessó que en la desintegració del seu isòtop oganessó 293 produeix curi 249:[16]
L'isòtop més estable és el curi 247 que té un període de semidesintegració de 16 milions d'anys i es desintegra en plutoni 243 per emissió d'una partícula α:
Fins a l'isòtop curi 241 majoritàriament els nuclis de curi sofreixen desintegració β+ o es desintegren per captura electrònica, per exemple:[17]
Després fins al curi 248 predomina la desintegració α, com és el cas del curi 247, i els darrers sofreixen desintegració β–, com ara el curi 252:[17]
El curi 242 i el curi 244 es produeixen i estan disponibles per a la recerca. El curi 248 també s'obté, però en quantitats menors.[11]
Aplicacions
[modifica]
Generadors termoelèctrics de radioisòtops
[modifica]El curi s'utilitza com a combustible en alguns generadors termoelèctrics de radioisòtops (RTG) emprats en satèl·lits i vehicles d'exploració espacial. Els RTG són generadors elèctrics que produeixen energia a partir de la desintegració radioactiva. Normalment, la calor alliberada per la descomposició d'un material radioactiu adequat es converteix en electricitat per l'efecte Seebeck —on es genera un corrent elèctric a les cruïlles entre dos metalls diferents— mitjançant una sèrie de termoparells. Per a l'ús espacial, el combustible ha de ser prou radioactiu per produir grans quantitats d'energia per unitat de massa i volum. El radioisòtop produeix aproximadament 3 W/g d'energia tèrmica, semblant a les que produeixen els radioisòtops de plutoni que s'empren més habitualment.[18]

Espectròmetres de raigs X de partícules alfa
[modifica]També s'empra com a font de partícules alfa en espectròmetres de raigs X de partícules α (APXS), que són dispositius que analitzen la composició d'elements químics d'una mostra a partir de la dispersió de partícules α. Es basa en l'experiment de Rutherford i s'empren en les missions espacials. Els APXs tenen una llarga història en l'exploració espacial des de les missions Surveyor a missions com Mars Pathfinder, Mars 96, Rosetta i els Mars Exploration Rovers.[18]
Síntesi de nous elements
[modifica]Finalment, el curi s'utilitza en la producció d'elements transuranids i transactínids superiors.[19] És el cas de l'hassi que es pot obtenir bombardejant un blanc de curi 248 amb cations magnesi 26 a gran velocitat que han sigut accelerats en un accelerador de partícules. Primer s'obté hassi 247 que es desintegra en hassi 270 segons l'equació:[13]
El californi fou sintetitzat per primera vegada el 1950[20] pel mateix grup que havia sintetitzat el curi bombardejant un blanc de curi 242 amb partícules α i es produí el californi 244 segons la reacció:
Al juny del 2000, un equip de l'Institut Unificat de Recerca Nuclear, a la ciutat de Dubna, Rússia, dirigit pels científics russos Iuri Oganessian (1933) i Vladimir Utyonkov i l'estatunidenc Kenton J. Moody, realitzaren experiments que els permeteren sintetitzar l'isòtop livermori 292 mitjançant la reacció de fusió de curi 248 en ser bombardejats amb cations de calci 48 accelerats en un ciclotró.[21]
Toxicitat
[modifica]Els organismes que absorbeixen curi l'acumulen als ossos. La seva radiació destrueix el mecanisme de formació dels glòbuls vermells de la sang. La màxima dosi de curi-244 en els humans és de 0,3 μCi.[11]
Referències
[modifica]- ↑ 1,0 1,1 Schenkel, R «The electrical resistivity of 244Cm metal» (en anglès). Solid State Communications, 23, 6, 1977, pàg. 389. Bibcode: 1977SSCom..23..389S. DOI: 10.1016/0038-1098(77)90239-3.
- ↑ «curi». Gran Enciclopèdia Catalana. Grup Enciclopèdia Catalana. [Consulta: 5 agost 2021].
- ↑ Trifonov, D. N.; Trifonov, V. D.. «Transuranium elements». A: Chemical Elements - How They Were Discovered (en anglès). Moscou: MIR, 1982, p. 226-238.
- ↑ Enghag, Per. Encyclopedia of the Elements (en anglès). WILEY-VCH Verlag GmbH, 2008, p. 76. ISBN 3-527-30666-8.
- ↑ «96-Curi». Arxivat de l'original el 2008-02-03. [Consulta: 4 abril 2013].
- ↑ 6,0 6,1 6,2 Seaborg, Glenn T. Modern alchemy : selected papers of Glenn T. Seaborg. Singapore: World Scientific, 1994. ISBN 978-981-279-595-3.
- ↑ Seaborg, G. T.; James, R. A.; Ghiorso, A. The new element curium (atomic number 96). WORLD SCIENTIFIC, 1994-05, p. 53–70. ISBN 978-981-02-1440-1.
- ↑ Laurence, William L. «Curium, Man-Made Element 96, Is Isolated in Visible Quantity; Chemists at City Session Hear of the Violently Radioactive Solid -- Photo of Glowing Salt Solution Is Displayed ELEMENT CURIUM VISIBLY ISOLATED» (en anglès). The New York Times, 17-09-1947. ISSN: 0362-4331.
- ↑ Wallmann, J. C.; Crane, W. W. T.; Cunningham, B. B. «The Preparation and Some Properties of Curium Metal» (en anglès). Journal of the American Chemical Society, 73, 1, 1-1951, pàg. 493–494. DOI: 10.1021/ja01145a537. ISSN: 0002-7863.
- ↑ Werner, L. B.; Perlman, I. «First Isolation of Curium» (en anglès). Journal of the American Chemical Society, 73, 11, 11-1951, pàg. 5215–5217. DOI: 10.1021/ja01155a063. ISSN: 0002-7863.
- ↑ 11,0 11,1 11,2 11,3 William M. Haynes. CRC handbook of chemistry and physics (en anglès). 93a edició. Boca Raton, FL: CRC Press, 2016. ISBN 978-1-4398-8050-0.
- ↑ 12,0 12,1 Emsley, John. Nature's building blocks : an A-Z guide to the elements. Oxford: Oxford University Press, 2001. ISBN 0-19-850341-5.
- ↑ 13,0 13,1 13,2 Evans, John. Elements of a sustainable world. First edition. Oxford, United Kingdom: OUP Oxford, 2020. ISBN 978-0-19-256288-3.
- ↑ «Curium | chemical element» (en anglès). Encyclopædia Britannica. Encyclopædia Britannica, inc., 05-04-2019. [Consulta: 29 març 2020].
- ↑ Carl L., Yaws. Yaws Handbook of Properties of the Chemical Elements (en anglès). Knovel, 2011, p. 92. ISBN 1613443994.
- ↑ Whitby, Max. «Isotopes of oganesson». Periodictable.com. [Consulta: 20 març 2023].
- ↑ 17,0 17,1 «Z = 96». NuDat 3. National Nuclear Data Center (NNDC) at Brookhaven National Laboratory. [Consulta: 24 març 2023].
- ↑ 18,0 18,1 «Curium - Element information, properties and uses | Periodic Table». [Consulta: 1r abril 2020].
- ↑ «Curium (Cm) | AMERICAN ELEMENTS ®» (en anglès). [Consulta: 29 març 2020].
- ↑ Thompson, S. G.; Street, K.; Ghiorso, A.; Seaborg, G. T. «Element 98» (en anglès). Physical Review, 78, 3, 01-05-1950, pàg. 298–299. DOI: 10.1103/PhysRev.78.298.2. ISSN: 0031-899X.
- ↑ Oganessian, Yu. Ts.; Utyonkov, V. K.; Lobanov, Yu. V.; Abdullin, F. Sh.; Polyakov, A. N. «Observation of the decay of 292116». Physical Review C, 63, 1, 06-12-2000, pàg. 011301. DOI: 10.1103/PhysRevC.63.011301.
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||
































