Diòxid de carboni: diferència entre les revisions
Millores diverses |
→Gas: Làser |
||
| Línia 77: | Línia 77: | ||
El diòxid de carboni s'utilitza sovint com un gas pressuritzat barat, no inflamable. Els bots salvavides, sovint contenen bombones pressuritzades de diòxid de carboni per al seu inflament ràpid. També s'empra en armes de gas comprimit i en el [[paintball]] i per a inflar pneumàtics de bicicletes. La vaporització ràpida de CO<sub>2</sub> líquid s'utilitza per fer voladures en mines de carbó. |
El diòxid de carboni s'utilitza sovint com un gas pressuritzat barat, no inflamable. Els bots salvavides, sovint contenen bombones pressuritzades de diòxid de carboni per al seu inflament ràpid. També s'empra en armes de gas comprimit i en el [[paintball]] i per a inflar pneumàtics de bicicletes. La vaporització ràpida de CO<sub>2</sub> líquid s'utilitza per fer voladures en mines de carbó. |
||
El diòxid de carboni no és inflamable i extingeix flames. Alguns extintors dissenyats per a focs elèctrics contenen diòxid de carboni líquid a pressió. |
|||
El diòxid de carboni extingeix flames, i alguns extintors, especialment aquells dissenyats per a focs elèctrics, contenen diòxid de carboni líquid a pressió. El diòxid de carboni també troba ús com a atmosfera per soldar-se, encara que en l'arc de soldadura, reacciona per oxidar la majoria dels metalls. L'ús en la indústria d'automoció és comú malgrat que existeix evidència significativa que les soldadures fetes en diòxid de carboni siguin més trencadisses que els fets en atmosferes més inertes, i que aquestes soldadures es deterioren gradualment a causa de la formació d'àcid carbònic. Malgrat aquests inconvenients, s'utilitza com a gas de soldadura principalment perquè és molt menys car que altres gasos inerts com l'[[argó]] o l'[[heli]]. |
|||
La soldadura MAG (''Metal Active Gaswelding'') és un tipus de [[soldadura]] que utilitza un gas protector químicament actiu ([[diòxid de carboni]], [[argó]] més diòxid de carboni o argó més [[oxigen]]). El material d'aportació té forma de tija molt llarga i és subministrat contínuament i de manera automàtica per l'equip de soldadura. S'utilitza bàsicament per a acers no aliats o de baix aliatge. No es pot usar per a soldar acers inoxidables ni alumini o aliatges d'alumini.<ref name="Apostila ESAB">{{ref-web|url=http://www.esab.com.br/br/pt/education/apostilas/upload/1901104rev1_apostilasoldagemmigmag_nova.pdf|títol=Soldadura MIG/MAG|accés=14 de juny de 2016|autor=Fortes, Cleber|data=25 de gener de 2005|format={{PDF}}}}</ref> |
|||
=== Dissolvent === |
=== Dissolvent === |
||
| Línia 86: | Línia 88: | ||
=== Agricultura === |
=== Agricultura === |
||
Les plantes precisen de diòxid de carboni per realitzar la [[fotosíntesi]], i els [[Hivernacle|hivernacles]] poden enriquir les seves atmosferes amb CO<sub>2</sub> addicional per tal d'estimular el creixement de les plantes. A més els nivells alts de diòxid de carboni en l'atmosfera permeten exterminar eficaçment moltes plagues, per aquest motiu els hivernacles augmenten el nivell de CO<sub>2</sub> a 10 000 ppm (un 1%) durant unes quantes hores per eliminar plagues com la [[mosca blanca]], [[Àcar|àcars]] i altres. S'ha proposat emprar el diòxid de carboni que actualment s'emet en les centrals elèctriques és borbollejat a basses per cultivar algues que es podrien llavors convertir en [[biocombustible]] dièsel. |
Les plantes precisen de diòxid de carboni per realitzar la [[fotosíntesi]], i els [[Hivernacle|hivernacles]] poden enriquir les seves atmosferes amb CO<sub>2</sub> addicional per tal d'estimular el creixement de les plantes. A més els nivells alts de diòxid de carboni en l'atmosfera permeten exterminar eficaçment moltes plagues, per aquest motiu els hivernacles augmenten el nivell de CO<sub>2</sub> a 10 000 ppm (un 1%) durant unes quantes hores per eliminar plagues com la [[mosca blanca]], [[Àcar|àcars]] i altres. S'ha proposat emprar el diòxid de carboni que actualment s'emet en les centrals elèctriques és borbollejat a basses per cultivar algues que es podrien llavors convertir en [[biocombustible]] dièsel. |
||
=== Làser de CO<sub>2</sub>=== |
|||
[[Fitxer:Co2-fractional-laser-face-ama-regenerative-medicine.jpg|miniatura|Laser de CO<sub>2</sub> emprat en medicina]] |
|||
El [[làser de diòxid de carboni]] és un tipus de [[làser]] de gas destacable per la seva gran [[Potència física|potència]]. Fou un dels primers làsers de gas que es desenvoluparen i segueix sent un dels làsers més utilitzats ja que ofereixen la potència més alta en funcionament continu (no polsat). També és un dels làsers més eficients, amb una eficiència de fins al 20%. Emet en l'[[infraroig]] amb dues bandes principals a unes [[Longitud d'ona|longituds d'ona]] de 9,4 μmi 10,6 μm. S'utilitzen àmpliament en aplicacions industrials de tall i soldadura, com ara a la [[indústria automobilística]], i en [[Cirurgia|procediments quirúrgics]], ja que l'aigua dels teixits biològics absorbeix molt bé les freqüències infraroges del làser de diòxid de carboni.<ref>{{Ref-llibre|títol=The CO₂ laser|url=https://www.worldcat.org/oclc/610142217|editorial=Springer-Verlag|data=1987|lloc=Berlin|isbn=9783540477440|cognom=Witteman, W. J.}}</ref> |
|||
=== Altres === |
=== Altres === |
||
En medicina, el diòxid de carboni de fins a un 5% s'afegeix a oxigen pur per a l'estimulació de respirar després d'[[apnea]] i per estabilitzar l'equilibri d'O<sub>2</sub>/CO<sub>2</sub> en sang. |
En medicina, el diòxid de carboni de fins a un 5% s'afegeix a oxigen pur per a l'estimulació de respirar després d'[[apnea]] i per estabilitzar l'equilibri d'O<sub>2</sub>/CO<sub>2</sub> en sang. |
||
| ⚫ | |||
Un tipus comú de [[làser]] de gas industrial, el làser de diòxid de carboni, empra el diòxid de carboni com a molècula pel seu funcionament. |
|||
| ⚫ | |||
El diòxid de carboni s'injecta comunament a o adjacent a pous de [[petroli]] que produeixen. Servirà com a agent que pressuritza i, quan és dissolt al cru subterrani, redueix significativament la seva viscositat, permetent al petroli fluir més ràpidament a través de la terra fins al pou d'extracció. En jaciments petrolífers madurs, s'utilitzen extenses xarxes de canonades per portar el diòxid de carboni als punts d'injecció. |
El diòxid de carboni s'injecta comunament a o adjacent a pous de [[petroli]] que produeixen. Servirà com a agent que pressuritza i, quan és dissolt al cru subterrani, redueix significativament la seva viscositat, permetent al petroli fluir més ràpidament a través de la terra fins al pou d'extracció. En jaciments petrolífers madurs, s'utilitzen extenses xarxes de canonades per portar el diòxid de carboni als punts d'injecció. |
||
Revisió del 23:53, 19 set 2019
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 43,99 Da |
| Descobridor o inventor | Jan van Helmont, Joseph Black i Joseph Priestley |
| Trobat en el tàxon | |
| Rol | vasodilatador, conservant, agent fermentant, fluid refrigerant, gas hivernacle i metabòlit primari |
| Estructura química | |
| Fórmula química | CO₂ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Densitat | 1,9768 g/m³ (a 0 °C, gas) 925 g/m³ (a 0 °C, líquid) 1.560 g/m³ (a −78,5 °C, sòlid) |
| Velocitat del so | 259 m/s (0 °C, gas) |
| Solubilitat | 0,2 g/100 g (aigua, 25 °C) |
| Moment dipolar elèctric | 0 D |
| Temperatura de sublimació | −78,5 °C, −78 °C i −78,4 °C |
| Entropia molar estàndard | 213,7 J/(mol K) |
| Moment dipolar elèctric | 0 D |
| Entalpia estàndard de formació | 394 kJ/mol |
| Entalpia de vaporització | 16,7 kJ/mol |
| Pressió de vapor | 56,5 atm (a 20 °C) |
| Perill | |
| Límit d'exposició mitjana ponderada en el temps | 9.000 mg/m³ (10 h, Estats Units d'Amèrica) |
| Límit d'exposició a curt termini | 54.000 mg/m³ (cap valor) |
| IDLH | 72.000 mg/m³ |
| Potencial d'escalfament global | 1 |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
El diòxid de carboni (antigament anomenat biòxid de carboni i anhídrid carbònic) és una substància molecular constituïda per carboni i oxigen de fórmula química . A temperatura ambient es presenta en forma de gas incolor, inodor i insípid. No és tòxic, però la seva acumulació pot produir la mort per ofegament. És present a l'atmosfera de la Terra en baixa concentració i en les aigües dissolt en forma d'àcid carbònic, . És indispensable per a la vida, els vegetals amb clorofil·la mitjançant la fotosíntesi el redueixen per l'acció combinada amb la llum, i produeixen composts orgànics i oxigen. És un dels productes de la combustió dels materials orgànics i de la respiració, tant dels animals com dels vegetals. Per altra banda és un dels gasos de l'atmosfera que manté la temperatura de la Terra gràcies a l'efecte hivernacle, essent el segon gas hivernacle més important, després del vapor d'aigua. L'augment actual de la seva concentració atmosfèrica, deguda a l'ús de combustibles fòssils (carbó, petroli i gas natural) i la desforestació, està produint l'escalfament global del planeta. S'han establert normatives internacionals, com el Protocol de Kyoto, per a intentar reduir aquest augment, però són seguides per pocs països.
Història

Cap al 1630, el científic flamenc Jan Baptist van Helmont (1580-1644) descobrí que certs vapors es diferenciaven de l'aire, que en aquell moment es pensava que eren una sola substància o element químic. Van Helmont encunyà el terme gas (alteració del mot llatí chaos, 'caos') per descriure aquests vapors i recollí el que es produïa cremant llenya, anomenant-lo spiritus sylvestrus, per la qual cosa Van Helmont és reconegut com el descobridor del diòxid de carboni. Observà, també, que es produïa en la fermentació del vi i d'altres processos naturals. Poc temps després, altres científics detectaren similituds entre els processos de respiració i combustió. Així descobriren que la flama de les espelmes s’extingirà quan es tanca en una gerra amb un subministrament limitat d’aire, o que en les mateixes condicions moria un ocell o animal petit.[1]
Al 1756, el químic escocès Joseph Black (1728-1799) anomenà el diòxid de carboni aire fix, perquè és absorbit per una dissolució d'hidròxid de calci donant carbonat de calci segons l'equació:
El 1764 demostrà que es produïa per la respiració. Black pujà al sostre d’una església de Glasgow, que havia sigut ocupada durant unes deu hores de devoció religiosa per una congregació de 1500 persones, i mesurà l’àcid fix que havia exhalat la diligent i adormida congregació. Però fou el químic francès Antoine-Laurent Lavoisier (1743-1794) qui establí definitivament l'excreció de diòxid de carboni després de la seva formació en el metabolisme, tot i que pensà erròniament que es formava als pulmons.[2] Black descobrí, també, que està present a l’atmosfera, determinà que era un gas més pesant que l’aire i caracteritzà el seu comportament químic com el d’un àcid feble. El pioners treballs de van Helmont i Black motivaren altres científics en l'estudi dels gasos, com ara el químic i físic anglès Henry Cavendish (1731-1810), el químic suec Carl Wilhelm Scheele (1742-1786) ) i altres químics.[1]

El primer ús pràctic del diòxid de carboni fou inventat pel químic anglès Joseph Priestley (1733-1804) a mitjans dels anys 1700. Priestley havia repetit els experiments de Black mitjançant el gas produït per la fermentació de gra i demostrà que tenia les mateixes propietats que l'aire fix. Quan Priestley dissolgué el gas en l'aigua, trobà que creava una beguda refrescant amb un sabor lleugerament agre. Fou la primera aigua artificialment carbonatada, coneguda com a aigua gasosa o seltzer.[1]
El 1783, el científic francès, Pierre Simon de Laplace (1749-1827) utilitzà un conill de rata per demostrar quantitativament que l’oxigen de l’aire s’utilitza per cremar carboni emmagatzemat al cos i produeix diòxid de carboni en l’alè exhalat. A la dècada de 1770, el fisiòleg holandès Jan Ingen-Housz (1730-1799) establí els principis de la fotosíntesi que ajudaren a explicar la superstició antiga que les plantes purifiquen l’aire durant el dia i l’enverinen durant la nit.[1]
El químic anglès John Dalton (1766-1844) determinà el 1803 que la molècula de diòxid de carboni conté un àtom de carboni i dos àtoms d’oxigen.[1] El 1834 el francès Charles Thilorier (1797-1852) obtingué per primera vegada diòxid de carboni sòlid. El seu ús comercial s'inicià en la dècada del 1920. El 1924 l'empresa estatunidenca Prest Air Devices of Long Island encunyà el terme gel sec per referir-se al diòxid de carboni sòlid.[3]
Estructura

L'estructura química de la molècula de diòxid de carboni consta d'un àtom central de carboni unit amb dos dobles enllaços als dos àtoms d'oxigen, els tres alineats en línia recta segons el model . Malgrat els enllaços presenten polaritat no presenta dipol elèctric degut a la seva simetria que anul·la els dos moments dipolars oposats dels dos enllaços.
En estat sòlid se'l pot trobar formant diferents estructures o fases en les quals les molècules apolars de CO2 es troben unides mitjançant les febles forces de dispersió de London (dipol instantani - dipol induït), per la qual cosa la seva temperatura de fusió és molt baixa (–78,5 °C). Les fases d’alta pressió i temperatura són especialment importants per comprendre els interiors dels planetes i la formació d’estrelles. Fins al moment se'n han identificat 7 de diferents. Les fases I, III i VII són sòlids moleculars típics, mentre que les fases V i VI són fases esteses similars a les del silicat (SiO2). La fase II és una fase intermediària mal entesa i la fase IV encara no està ben estudiada.[4][5]
Propietats químiques i físiques

A temperatura ambient és un gas incolor, inodor i insípid la qual densitat a 25 °C és de 1,98 kg/m³, al voltant d'1,65 vegades la de l'aire, la qual cosa fa que aquest gas tingui tendència a acumular-se en les parts fondes. A temperatures per sota –78 °C el diòxid de carboni es troba en forma d'un sòlid blanc anomenat gel sec. El diòxid de carboni líquid es forma només a pressions superiors a 5,1 atm; a pressió atmosfèrica, passa directament de la fase sòlida a la fase gasosa en un procés anomenat sublimació.[3]
Com que ja està completament oxidat, no és gaire reactiu i, en particular, no és inflamable. Inhalat a altes concentracions produeix un gust àcid a la boca i una sensació picant al nas i la gola. Aquests efectes són produïts pel gas que es dissol en les membranes mucoses i a la saliva, formant una solució feble d'àcid carbònic, . La molècula de diòxid de carboni és apolar i sembla que hauria de ser poc soluble en aigua, però també és un àcid de Lewis, la qual cosa li permet acceptar una parella d'electrons de l'oxigen de l'aigua donant àcid carbònic incrementant la seva solubilitat. La reacció es pot representar per:[3]

L'àcid carbònic en dissolució experimenta dues dissociacions que donen lloc als equilibris químics:[3]
Les concentracions relatives de cada espècie química depenen del pH. En aigua neutra o una mica alcalina (pH > 6,5), la forma hidrogencarbonat predomina, mentre que en aigua molt alcalina l'anió predominant és el carbonat . L'hidrogencarbonat i el carbonat són molt solubles en aigua, de tal manera que l'aigua de l'oceà en equilibri amb l'aire (lleugerament alcalina amb un pH típic 8,2-8,5) conté al voltant de 120 mg d'hidrogencarbonat per litre, equivalent al contingut en 130 litres d'aire. L'aigua de pluja també duu dissolt diòxid de carboni, la qual cosa fa que tengui un pH àcid, al voltant d'un valor de 5,6. Aquesta acidesa produeix la dissolució de les roques calcàries donant lloc al modelat càrstic.[6]
Obtenció
Diferents mètodes s'empren per obtenir diòxid de carboni en quantitats industrials. Obtenir-lo directament de l'atmosfera no és viable degut a la seva baixa concentració.
1) Combustió del carbó de coc o d'altres composts de carboni. En aquest procés cal concentrar el diòxid de carboni i separar-lo d'altres gasos que també es produeixen mitjançant reaccions paral·leles d'impureses del carbó o si el reactiu no és carbó. L'equació és:

Usos
Indústria alimentària

El diòxid de carboni en estat líquid i sòlid (gel sec) s'empra majoritàriament com a refrigerant, especialment en el sector alimentari, durant el transport i emmagatzematge de gelats i altres aliments congelats. El diòxid de carboni s'utilitza també per produir begudes carbonatades bombollejant CO2 dins l'aigua, des de la dècada dels 1790 en que fou comercialitzada la primera beguda d'aquest tipus per l'industrial alemany Johann Jacob Schweppe (1740-1821).[3] El caramel anomenat Peta Zetas es pressuritza amb gas de diòxid de carboni a aproximadament 40 atm. Quan posem el caramel a la boca, es dissol (just com qualsevol altre caramel dur) i allibera les bombolles de gas amb un "pop" audible. La gasificació de la cervesa i el cava es produeix durant fermentació natural, però alguns fabricants carbonaten aquestes begudes artificialment, però el producte és d'inferior qualitat.
El diòxid de carboni també s'empra per fer més esponjoses de pans, coques i pastissos. S'empren llevats de dos tipus: els formats per microorganismes, com el llevat de forner que produeixen el diòxid de carboni per fermentació dels glúcids presents a la massa:
i els químics, que produeixen el diòxid de carboni per la descomposició d'hidrogencarbonat de sodi, a causa de l'escalfor o a l'exposició a àcids.
Indústria química

Un dels usos més importants del diòxid de carboni és la producció de carbonat de sodi monohidrat (sosa) . S'empra el procés Solvay que permet produir el carbonat de sodi mitjançant una sèrie de reaccions a partir de carbonat de calci i clorur de sodi intervinguent el diòxid de carboni en dues etapes. Del carbonat de sodi es pot obtenir l'hidrogencarbonat de sodi a partir de la reacció:[3]
Gas

El diòxid de carboni s'utilitza sovint com un gas pressuritzat barat, no inflamable. Els bots salvavides, sovint contenen bombones pressuritzades de diòxid de carboni per al seu inflament ràpid. També s'empra en armes de gas comprimit i en el paintball i per a inflar pneumàtics de bicicletes. La vaporització ràpida de CO2 líquid s'utilitza per fer voladures en mines de carbó.
El diòxid de carboni no és inflamable i extingeix flames. Alguns extintors dissenyats per a focs elèctrics contenen diòxid de carboni líquid a pressió.
La soldadura MAG (Metal Active Gaswelding) és un tipus de soldadura que utilitza un gas protector químicament actiu (diòxid de carboni, argó més diòxid de carboni o argó més oxigen). El material d'aportació té forma de tija molt llarga i és subministrat contínuament i de manera automàtica per l'equip de soldadura. S'utilitza bàsicament per a acers no aliats o de baix aliatge. No es pot usar per a soldar acers inoxidables ni alumini o aliatges d'alumini.[7]
Dissolvent
El diòxid de carboni en estat supercrític és un bon dissolvent per a molts composts orgànics, i s'utilitza per extreure la cafeïna del cafè i obtenir cafè descafeïnat. Primer, els grans de cafè verds es remullen a aigua i s'introdueixen per la part superior d'una columna de 21 metres d'alt. El diòxid de carboni a aproximadament 93 °C entra pel fons de la columna i la cafeïna es dissol en el diòxid de carboni, deixant els grans de cafè descafeïnats.
El diòxid de carboni ha començat a atreure atenció en les indústries de processament químiques farmacèutiques i altres com a alternativa menys tòxica als dissolvents organoclorats. És utilitzat per alguns tintorers per aquesta raó.
Agricultura
Les plantes precisen de diòxid de carboni per realitzar la fotosíntesi, i els hivernacles poden enriquir les seves atmosferes amb CO2 addicional per tal d'estimular el creixement de les plantes. A més els nivells alts de diòxid de carboni en l'atmosfera permeten exterminar eficaçment moltes plagues, per aquest motiu els hivernacles augmenten el nivell de CO2 a 10 000 ppm (un 1%) durant unes quantes hores per eliminar plagues com la mosca blanca, àcars i altres. S'ha proposat emprar el diòxid de carboni que actualment s'emet en les centrals elèctriques és borbollejat a basses per cultivar algues que es podrien llavors convertir en biocombustible dièsel.
Làser de CO2
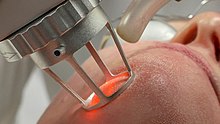
El làser de diòxid de carboni és un tipus de làser de gas destacable per la seva gran potència. Fou un dels primers làsers de gas que es desenvoluparen i segueix sent un dels làsers més utilitzats ja que ofereixen la potència més alta en funcionament continu (no polsat). També és un dels làsers més eficients, amb una eficiència de fins al 20%. Emet en l'infraroig amb dues bandes principals a unes longituds d'ona de 9,4 μmi 10,6 μm. S'utilitzen àmpliament en aplicacions industrials de tall i soldadura, com ara a la indústria automobilística, i en procediments quirúrgics, ja que l'aigua dels teixits biològics absorbeix molt bé les freqüències infraroges del làser de diòxid de carboni.[8]
Altres
En medicina, el diòxid de carboni de fins a un 5% s'afegeix a oxigen pur per a l'estimulació de respirar després d'apnea i per estabilitzar l'equilibri d'O2/CO2 en sang.
El diòxid de carboni també es pot combinar amb el limonè de les taronges o altres epòxids per crear polímers i plàstics.
El diòxid de carboni s'injecta comunament a o adjacent a pous de petroli que produeixen. Servirà com a agent que pressuritza i, quan és dissolt al cru subterrani, redueix significativament la seva viscositat, permetent al petroli fluir més ràpidament a través de la terra fins al pou d'extracció. En jaciments petrolífers madurs, s'utilitzen extenses xarxes de canonades per portar el diòxid de carboni als punts d'injecció.
Atmosfera

L'any 2007 la proporció de CO2 a l'atmosfera de la Terra estava al voltant d'un 0,0385% en volum (385 µL/L o ppmv)[9] o un 0,0582% en pes de CO2. Com que la massa de l'atmosfera és de 5,14×1018 kg[10] això representa aproximadament 3,0 x 1012 tones de CO2 en el conjunt de l'atmosfera. L'increment respecte a l'any anterior, 2006, ha estat de 19 mil milions de tones, un 0,6% en pes o de 2,4 ppmv.[9] A causa de l'àrea més gran de terra a l'hemisferi nord, i per tant a una major superfície vegetal en comparació amb l'hemisferi sud, hi ha una fluctuació anual d'aproximadament 5 µL/L, culminant el maig i arribant a un mínim l'octubre al final de l'estació de creixement de l'hemisferi nord, quan la quantitat de biomassa al planeta és més gran.

Malgrat la seva petita concentració, el CO2 és un component molt important de l'atmosfera de Terra, perquè absorbeix la radiació infraroja a les longituds d'ona de 4,26 µm i 14,99 µm i realça per tant l'efecte hivernacle.
Les emissions antropogèniques són actualment de 28 mil milions de tones, això representa només un 5% del flux de CO2 total a l'atmosfera, però és suficient per a crear una acumulació d'aquest gas, ja que no existeixen embornals suficients per a ell.

Des del començament de la revolució industrial, la concentració de CO2 atmosfèric ha augmentat en aproximadament 110 µL/L o aproximadament un 40%, la majoria d'aquest augment s'ha produït des de 1945. Les mesures mensuals preses a Mauna Loa[11] des de 1958 mostren un augment de 316 ppmv en aquell any a 384 ppmv el 2006, un augment global de 70 µL/L durant la història de 48 anys de les mesures. La crema de combustibles fòssils com carbó i petroli és la causa principal de l'augment del CO2 antropogènic; la desforestació és la segona causa essencial, especialment la produïda en països tropicals per a l'expansió de l'explotació forestal, l'agricultura, la ramaderia i en menor mesura la mineria. Per exemple els incendis forestals a Indonèsia de l'any 1997 poden haver alliberat per si sols una proporció del 13% al 40% de l'emissió de CO2 feta pels combustibles fòssils aquell any. No tot el CO2 emès roman en l'atmosfera; una part se n'absorbeix als oceans, a la biosfera i en les roques. La raó entre el CO2 emès i l'augment de CO2 atmosfèric es coneix com la fracció aerotransportada; aquesta varia en períodes curts de temps però és típicament d'un 57% en un període de 5 anys.
Per intentar frenar l'acumulació de CO2 S'han proposat diverses tècniques per evitar emetre diòxid de carboni a l'atmosfera i retenir-lo en embornals de diòxid de carboni: Emmagatzematge en pous de gas natural o petroli, injecció en aigües oceàniques profundes, en aqüífers de salmorra, en vetes de carbó, etc.
Variació en el passat
El mètode més directe per mesurar les concentracions de diòxid de carboni atmosfèriques per a períodes en què el mostreig directe no fou possible és analitzant les bombolles d'aire (fluid o inclusions de gas) atrapat als casquets glacials de l'Antàrtida o Groenlàndia. Els estudis més àmpliament acceptats s'han fet amb testimonis antàrtics i indiquen que els nivells de CO2 atmosfèrics es trobaven entre els 260-280 ppmv immediatament abans que les emissions industrials comencessin i s'havien mantingut en aquest nivell durant els darrers 10.000 anys.
El registre de gel més llarg prové d'Antàrtida Oriental, on s'ha extret gel d'una edat de 650.000 anys abans del present[12] (on el present es pren com 1950 per convenció). Durant aquest temps, la concentració de diòxid de carboni atmosfèrica ha variat entre 180-210 ppmv durant les glaciacions, augmentant fins a 280-300 µL/L durant els períodes interglacials més calents.
Alguns estudis han discutit l'afirmació que els nivells de CO2 s'han mantingut estables durant el present interglacial (els darrers 10.000 anys). Basat en una anàlisi de fulles fòssils, Wagner et al.[13] han discutit que els nivells de CO2 durant el període de 7.000 a 10.000 anys B.P. eren significativament més altes (~300 µL/L) i contenien substancials oscil·lacions que es poden relacionar amb variacions del clima. Altres han discutit tals declaracions, suggerint que és més probable que reflecteixin problemes de calibratge que els canvis reals en la concentració de CO2.[14] Pertinent a aquesta disputa és l'observació que els testimonis de gel de Groenlàndia sovint informin de nivells de CO2 més alts i més variables que mesures similars fetes a l'Antàrtida. Tanmateix, els grups responsables de tals mesures (p. ex., Smith et al.[15])) creuen que les variacions en els testimonis de Groenlàndia resulten de la descomposició in situ de la pols del carbonat de calci que es trobava en el gel. Quan els nivells de pols de carbonat en els testimonis de Groenlàndia són baixos, com gairebé sempre ho són en els testimonis de l'Antàrtic, els investigadors comuniquen que hi ha un bon acord entre les mesures de CO2 de Groenlàndia i l'Antàrtida.

Per a períodes de temps més remots, s'han utilitzat diferents mètodes per intentar determinar els nivells de diòxid de carboni atmosfèrics presents fa milions d'anys. Aquests inclouen les proporcions d'isòtops de bor i carboni en certs tipus de sediments marins, i el nombre d'estomes observat en fulles de plantes fòssils. Si bé aquestes mesures donen estimacions molt menys precises de la concentració de diòxid de carboni que els testimonis de gel, hi ha encara una forta evidència a favor de concentracions de CO2 molt altes (>3.000 ppmv) entre 600 i 400 m.a. BP i entre 200 i 150 m.a. BP.[16]
En escales de temps molt llargues, el contingut de CO2 atmosfèric està determinat per l'equilibri entre els processos geoquímics incloent-hi l'enterrament de carboni orgànic en sediments, la meteorització de les roques de silicat, i el vulcanisme. L'efecte net de desequilibris lleugers en el cicle de carboni durant milions d'anys ha estat reduir la concentració del CO2 atmosfèric. Les velocitats d'aquests processos són extremadament lentes; per això són de pertinència limitada per a resoldre el problema de l'exces de CO2 atmosfèric en períodes de cent anys.
En períodes més recents, la concentració de CO2 atmosfèrica va continuar caient després d'aproximadament 60 m.a. BP, i hi ha evidència geoquímica que les concentracions ja eren de <300 ppmv fa aproximadament 20 m.a. BP. Les concentracions de CO2 baixes poden haver estat l'estímul que hagi afavorit l'evolució de les plantes de C4, que van augmentar en gran manera la seva abundància en el període compres fa entre 7 i 5 m.a. BP. Si bé les concentracions de CO2 contemporànies són probablement les més altes dels darrers 20 milions d'anys,[17] encara no són tan elevades com varen ser fa uns 50 milions d'anys. Estudis actuals han intentat determinar com varen ser les condicions del planeta en el passat amb tan altes concentracions de CO2 i els resultats es poden classificar com a sorprenents: Una anàlisi dels sediments mostra que les aigües tropicals de l'Atlàntic tenien una temperatura d'uns 35 °C fa entre 100 i 84 milions d'anys, enfront dels 25 °C que tenen en l'actualitat.[18] Uns altres sondejos recents mostren que fa 55 milions d'anys l'Àrtic tenia una mitjana de temperatura d'uns 25 °C, i per tant gaudia d'un clima tropical com el de Florida.[19]
Oceans
Els oceans de la Terra contenen una quantitat enorme de diòxid de carboni en forma d'ions hidrogencarbonat i carbonat— molt més que la quantitat existent en l'atmosfera. L'hidrogencarbonat es produeix en reaccions químiques entre les roques, l'aigua, i el diòxid de carboni. Un exemple és la dissolució de carbonat de calci:
Aquestes reaccions tendeixen a amortir els canvis en el CO2 atmosfèric. Les reaccions entre diòxid de carboni i roques no-carbonatades com els silicats també afegeixen hidrogencarbonat als mars:
que poden més tard sofrir l'invers de la reacció citada per formar roques de carbonat, però alliberant només la meitat del CO2, consumida en la primera reacció. En el transcurs de centenars de milions d'anys això ha produït quantitats enormes de roques de carbonat, i ha enretirat la major part del diòxid de carboni de l'atmosfera. Si totes les roques de carbonat a l'escorça terrestre es convertissin de nou en diòxid de carboni, el diòxid de carboni resultant pesaria 40 vegades tant com la resta de l'atmosfera actual i l'atmosfera de la terra seria semblant a la del planeta Venus.
Contaminant

Es considera un contaminant atmosfèric i un gas hivernacle. L'augment progressiu de diòxid de carboni a l'aire pot conduir al canvi climàtic del planeta (vegeu efecte Callendar i efecte hivernacle). També és causa de la boira fotoquímica a les ciutats. Per això, en principi, al Protocol de Kyoto de 2005 els 192 països signants i ratificants s'havien compromès a disminuir-ne les emissions, tot i que la major part d'ells no ha complert la seva paraula.

Es troba a l'aire fresc considerat "net" en proporcions variables entre 0,036% i el 0,039%, però en concentracions grans, de l'ordre de cent vegades més, és mortal. Així, es tracta d'una substància tòxica per a les persones, que produeix efectes narcòtics i problemes respiratoris en una concentració del 2%. En una concentració superior al 3%, el màxim temps d'exposició humana és d'un quart d'hora. Provoca la mort immediata, per aturada respiratòria brusca, quan està al 25%. Una habitació no ventilada sol trobar-se amb un 0,3% a 0,4% de diòxid de carboni a l'aire, per això és important obrir les finestres almenys deu minuts ininterromputs al dia.
El diòxid de carboni antropogènic es produeix sobretot a les combustions completes (amb prou oxigen per fer-ho) de productes orgànics, com ara paper, fulles, fusta, menjar, deixalles orgàniques (sense prou oxigen, fan metà o biogàs), etc. La major part d'ell prové dels combustibles fòssils dels vehicles i de les centrals tèrmiques, on s'usen per a produir energia en forma d'electricitat.
Vegeu també
- Reacció Bosch
- Carbogen
- Cicle del carboni
- Monòxid de carboni
- Segrest del CO2
- Gel sec
- Escalfament global
- Gasos d'efecte hivernacle
- Gas industrial
- Identitat de Kaya
- Llac Kivu
- Llac Monoun
- Llac Nyos
- Llac meromíctic
- Champagne Pool
- Acidificació de l'oceà
Referències
- ↑ 1,0 1,1 1,2 1,3 1,4 «Carbon dioxide». The Gale Encyclopedia of Science [Consulta: 18 setembre 2019].
- ↑ «Carbon dioxide». The Oxford Companion to the Body, 18-09-2019.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 Myers, Richard L. (Richard Leroy), 1951-. The 100 most important chemical compounds : a reference guide. Westport, Conn.: Greenwood Press, 2007, p. 68-69. ISBN 9780313080579.
- ↑ Yoo, C. S.; Cynn, H.; Gygi, F.; Galli, G.; Iota, V. «Crystal Structure of Carbon Dioxide at High Pressure: “Superhard” Polymeric Carbon Dioxide» (en anglès). Physical Review Letters, 83, 26, 27-12-1999, pàg. 5527–5530. DOI: 10.1103/PhysRevLett.83.5527. ISSN: 0031-9007.
- ↑ Sun, J.; Klug, D. D.; Martonak, R.; Montoya, J. A.; Lee, M.-S. «High-pressure polymeric phases of carbon dioxide» (en anglès). Proceedings of the National Academy of Sciences, 106, 15, 14-04-2009, pàg. 6077–6081. DOI: 10.1073/pnas.0812624106. ISSN: 0027-8424.
- ↑ Gallego Picó, Alejandrina.. Contaminacion atmosférica.. UNED - Universidad Nacional de Educación a Distancia, 2000. ISBN 9788436265231.
- ↑ Fortes, Cleber. «Soldadura MIG/MAG» (
 PDF), 25-01-2005.
PDF), 25-01-2005.
- ↑ Witteman, W. J.. The CO₂ laser. Berlin: Springer-Verlag, 1987. ISBN 9783540477440.
- ↑ 9,0 9,1 «Carbon Dioxide, Methane Rise Sharply in 2007». NOAA, 2008. [Consulta: 24 abril].
- ↑ «Global atmospheric mass, surface pressure, and water vapor variations». JOURNAL OF GEOPHYSICAL RESEARCH, 2008. [Consulta: 24 abril].
- ↑ Keeling, C.D.; T.P. Whorf. «Atmospheric carbon dioxide record from Mauna Loa». [Consulta: 19 abril 2006].
- ↑ «Chemical & Engineering News: Latest News - Ice Core Record Extended».
- ↑ Wagner, Friederike; Bent Aaby and Henk Visscher «Rapid atmospheric O2 changes associated with the 8,200-years-B.P. cooling event». PNAS, 99, 19, 2002, pàg. 12011–12014. doi:10.1073/pnas.182420699.
- ↑ Indermühle, Andreas; Bernhard Stauffer, Thomas F. Stocker «Early Holocene Atmospheric CO2 Concentrations». Science, 286, 5446, 1999, pàg. 1815. doi:10.1126/science.286.5446.1815a [Consulta: May 26].
- ↑ Smith, H.J.; M Wahlen and D. Mastroianni «The CO2 concentration of air trapped in GISP2 ice from the Last Glacial Maximum-Holocene transition». Geophysical Research Letters, 24, 1, 1997, pàg. 1–4.
- ↑ «Climate Change 2001: The Scientific Basis».
- ↑ «Climate Change 2001: The Scientific Basis».
- ↑ «Ocean Was a Hot Tub in Dino Era | LiveScience».
- ↑ «BBC NEWS | Science/Nature | Arctic's tropical past uncovered».













![{\displaystyle {\ce {CaCO3_{(}s)->[\Delta ]\;CaO_{(}s)\;+\;CO2_{(}g)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/978007be714e6f8b6cd2091c5647a322452e0e8a)

![{\displaystyle {\ce {C6H12O6_{(}aq)\;->[ferment]\;2C2H5OH_{(}aq)\;+\;2CO2_{(}g)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7c20c5cedcd23cac4187740c6304d82396c0701e)



![{\displaystyle {\ce {2NaHCO3_{(}s)->[\Delta ]\;Na2CO3_{(}s)\;+\;H2O_{(}l)\;+\;CO2_{(}g)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c32a5d79bb0fb71b15aa6c59daece787b70d0277)




