Mercuri (element)
| Mercuri | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
80Hg
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Platejat Línies espectrals del mercuri | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Mercuri, Hg, 80 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 12, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 200,59(2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Xe] 4f14 5d10 6s2 2, 8, 18, 32, 18, 2 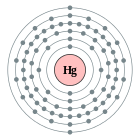
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Líquid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
13,534 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 234,32 K, −38,83 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 629,88 K, 356,73 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt crític | 1.750 K, 172,00 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 2,29 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 59,11 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 27,983 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 4, 2 (mercúric), 1 (mercurós) (òxid bàsic feble) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 2,00 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 1.007,1 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.810 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 3.300 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 151 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 132±5 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi de Van der Waals | 155 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Romboèdrica 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Diamagnètic[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (25 °C) 961nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 8,30 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 60,4 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so | (líquid. 20 °C) 1.451,4 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7439-97-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del mercuri | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El mercuri és l'element químic de símbol Hg i nombre atòmic 80. Té un nombre màssic de 201, és a dir, el seu nucli conté 80 protons i 121 neutrons. És un metall que es presenta en forma líquida[2] i pertany als metalls de transició. Se'l coneix igualment com a argent viu[3] i hidrargir.[4] El seu nom i símbol químic, Hg, procedeixen del llatí hydrargyrum, és a dir, argent líquid, el seu nom i símbol fan referència al seu aspecte argentat i a la seva forma líquida[5]. El nom llatí prové del grec ὑδράργυρος (hidràrgiros), dels mots hidro, que vol dir ‘aigua’, i argiros, ‘argent’.
El mercuri apareix en dipòsits a tot el món, principalment com a cinabri (sulfur de mercuri). El pigment vermell denominat vermelló s'obté triturant cinabri natural o sulfur de mercuri obtingut per síntesi.
El mercuri s'usa en termòmetres, baròmetres, manòmetres, esfigmomanòmetres, alguns tipus de vàlvules com les bombes de buit, els interruptors de mercuri, les làmpades fluorescents i altres dispositius, malgrat que la preocupació sobre la toxicitat de l'element ha portat els termòmetres i tensiómetres de mercuri a ser eliminats en gran mesura en entorns clínics en favor d'altres alternatives, com els termòmetres de vidre que utilitzen alcohol o galinstà, els termistors o els instruments electrònics basats en el mesurament de la radiació infraroja. De la mateixa manera, manòmetres mecànics i sensors de calibradors de tensió electrònics han substituït els esfigmomanòmetres de mercuri. El mercuri es manté en ús en aplicacions d'investigació científica i en amalgames odontològiques, encara utilitzades en alguns països. També s'utilitza en els llums fluorescents, en què l'electricitat que travessa un llum que conté vapor de mercuri a baixa pressió produeix radiació ultraviolada d'ona curta, que al seu torn provoca la fluorescència del fòsfor que recobreix el tub, produint llum visible.
L'enverinament per mercuri pot resultar de l'exposició a les formes solubles en aigua del mercuri (com el clorur mercúric o el metilmercuri), per la inhalació de vapor de mercuri, o per la ingestió de qualsevol de les formes.
Història
[modifica]
El mercuri ja era conegut a l'edat antiga, aquest element i el cinabri, la seva mena més abundant, es troben mencionats a manuscrits antics xinesos, indis, egipcis i grecs. La mostra més antiga de mercuri es va trobar a una tomba egípcia a Kurna, dins d'un petit contenidor de vidre i ha estat datada entre el segle xv aC i el segle xvi aC.[6] A la Xina s'utilitzava el mercuri abans de l'any 2000 aC.[7]. Cal esmentar que és relativament fàcil obtenir mercuri a partir del cinabri escalfant-lo i que també es troba en estat natiu a la natura amb una certa freqüència.[8]
El filòsof grec Teofrast (372 aC-287 aC) va descriure un mètode de preparació del mercuri a partir del cinabri amb vinagre. També va escriure que el mercuri es trobava a les mines de plata.[6]
Els dipòsits més importants de mercuri es troben a Almadén (Espanya) i van començar a ser explotats en temps de l'antiga Roma, a l'època de l'Imperi Romà se n'extreien 4,5 tones anualment.[8]
Durant l'edat mitjana el cinabri i el mercuri eren ben coneguts i emprats pels alquimistes com a ingredients de les preparacions destinades a aconseguir la pedra filosofal. També l'utilitzaven en la preparació d'elixirs destinats a curar malalties, tot i que segurament matarien els pacients perquè el mercuri és molt tòxic. També l'utilitzaven en els intents de convertir els metalls en or.
Les amalgames, una combinació de mercuri amb un o més metalls, on l'altre metall es dissol en el mercuri, s'han utilitzat des del segle xvi.[6] Els miralls es feien amb una amalgama, i el cinabri era molt utilitzat com a pigment. I abans de la invenció de la galvanització (electròlisi) s'utilitzava el mercuri per daurar i platejar objectes. S'aplicava una amalgama de mercuri i or o mercuri i plata sobre l'objecte a alta temperatura, quan s'evaporava el mercuri restava un capa prima d'or o plata.[8]
El mercuri va servir per a fer el descobriment de l'oxigen el 1774. Joseph Priestley (1733–1804) va escalfar mercuri a l'aire i es va formar una pols vermella d'òxid de mercuri (HgO), tot seguit va escalfar l'òxid de mercuri dins d'un tub i va obtenir petites gotes de mercuri i un gas que feia que altres substàncies cremessin més ràpidament.[7]
Característiques principals
[modifica]És un metall argentat que a temperatura estàndard és un líquid inodor. És un mal conductor de la calor comparat amb altres metalls, encara que no és mal conductor de l'electricitat. Es mescla fàcilment amb molts altres metalls com l'or o l'argent produint amalgames, excepte amb el ferro; és insoluble en aigua i soluble en àcid nítric. Quan augmenta la seva temperatura produeix vapors tòxics i corrosius, més pesants que l'aire. És perjudicial per inhalació, ingestió i contacte. Producte molt irritant per a la pell, ulls i vies respiratòries. És incompatible amb l'àcid nítric concentrat, l'acetilè, l'amoníac, el clor i els metalls.
Altres sinònims de mercuri són: mercuri elemental, mercuri metàl·lic, mercuri metall, argent líquid i argent viu. Per als estudiosos de l'alquímia, era el metall essencial del qual derivava la resta i, a l'Orient, es creia que servia per perllongar la vida.
El mercuri també es considera un mineral, pertanyent a la classe dels elements natius. Segons la classificació de Nickel-Strunz, el mercuri pertany a «01.AD - Metalls i aliatges de metalls, família del mercuri i amalgames» juntament amb els següents minerals: belendorffita, kolimita, eugenita, luanheïta, moschellandsbergita, paraschachnerita, schachnerita, weishanita, amalgames d'or, potarita i altmarkita.[9]
Propietats
[modifica]Propietats físiques
[modifica]
El mercuri és un metall blanc platejat i pesat. En comparació amb altres metalls, és un mal conductor de la calor, però un bon conductor de l'electricitat.[10][11] Presenta un punt de solidificació de -38,83°C i un punt d'ebullició de 356,73 °C,[12][13][14] ambdós excepcionalment baixos per a un metall. A més, el punt d'ebullició del mercuri de 629.88 K (356.73 °C) és el més baix de qualsevol metall.[15] Una explicació completa d'aquest fet s'endinsa profundament en el regne de la física quàntica, però es pot resumir de la següent manera: el mercuri té una configuració electrònica única, en què els electrons recobreixen tots els nivells disponibles 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d i 6s. Com que aquesta configuració resisteix considerablement a l'alliberament d'un electró, el mercuri es comporta de manera similar als gasos nobles, que formen enllaços febles i per tant es fonen a baixes temperatures. Després de la congelació, el volum del mercuri disminueix un 3,59% i la seva densitat canvia de 13,69 g/cm³ en estat líquid a 14,184 g/cm³ quan se solidifica. El coeficient d'expansió volumètric és de 181,59x10−6 a 0 °C, 181,71x10−6 a 20 °C i de 182,50x10−6 a 100 °C (per cada °C).
L'estabilitat de l'orbital 6s és deguda a la presència del nivell 4f ple. La capa f apantalla feblement la càrrega nuclear efectiva, la qual cosa augmenta l'atracció deguda a la força de Coulomb entre el nivell 6s i el nucli (vegeu contracció lantànida). L'absència d'un nivell interior f ple és la raó de la temperatura de fusió una mica més alta del cadmi i del zinc, encara que aquests dos metalls també fonen fàcilment i, a més, presenten punts d'ebullició inusualment baixos.
D'altra banda, l'or, que ocupa un espai a l'esquerra del mercuri a la taula periòdica, té àtoms amb un electró menys a la capa 6s que el mercuri. Aquests electrons s'alliberen amb més facilitat i són compartits entre els àtoms d'or, que formen un relativament fort enllaç metàl·lic.[12][13]
Propietats químiques
[modifica]El mercuri no reacciona amb la majoria dels àcids, tals com l'àcid sulfúric diluït, encara que els àcids oxidants com l'àcid sulfúric concentrat i l'àcid nítric o l'aigua règia ho dissolen per donar sulfat, nitrat, i clorur. Com la plata, el mercuri reacciona amb l'àcid sulfhídric atmosfèric. Així mateix, reacciona amb flocs de sofre sòlid, que s'utilitzen en els equips per absorbir el mercuri en cas de vessament (també s'utilitzen amb aquest mateix propòsit carbó activat) i zinc en pols).[16]
Amalgames
[modifica]
El mercuri dissol molts altres metalls com l'or i la plata[10] per formar amalgames. El ferro és una excepció, per la qual cosa tradicionalment s'han utilitzat recipients de ferro per al comerç de mercuri. Diversos altres elements de la primera fila dels metalls de transició (amb l'excepció del manganès, el coure i el zinc) són reticents a formar amalgames. Un altre element que no forma fàcilment amalgames amb el mercuri és el platí.[17][18] L'amalgama de sodi és un agent reductor comú a síntesi orgànica i també s'utilitza en les làmpades de làmpades de vapor de sodi d'alta pressió.
El mercuri es combina fàcilment amb l'alumini per formar una amalgama d'alumini quan els dos metalls purs entren en contacte. Aquesta amalgama destrueix la capa d'òxid d'alumini que protegeix l'alumini metàl·lic d'oxidar-se en profunditat (com passa al ferro davant l'aigua). Fins i tot petites quantitats de mercuri poden corroir greument l'alumini. Per aquesta raó, el mercuri no es permet a bord d'una aeronau sota la majoria de circumstàncies, a causa del risc de la formació d'una amalgama amb parts d'alumini exposades a l'aeronau.[19]
L'atac del mercuri sobre l'alumini és un dels tipus més comuns de fragilització per metall líquid.
Isòtops
[modifica]Hi ha set isòtops estables del mercuri, amb 202
Hg sent el més abundant (29,86%). Els radioisòtops més longeus són 194
Hg amb un període de semidesintegrament de 444 anys, i 203
Hg amb una vida mitjana de 46,612 dies. La majoria dels radioisòtops restants tenen vides mitjanes que són de menys d'un dia. 199
Hg i 201
Hg són els nuclis actius més sovint estudiats mitjançant ressonància magnètica nuclear, tenint espins de 1⁄2 i 3⁄2 respectivament.[11]
Obtenció
[modifica]La mena més important del mercuri és el cinabri, les majors reserves mineres del qual es troben a Espanya, a les mines d'Almadén.
Usos
[modifica]El seu ús més antic, a part de l'extracció d'or i argent, va ser en la confecció de miralls, que encara avui en dia s'aplica. S'utilitza també en instruments de mesura, endolls, fluorescents i com a catalitzador.
Altres usos del mercuri es dirigeixen a la indústria d'explosius. També ha estat notable el seu ús pels dentistes com a compost principal en els empastaments de queixals, però ha estat substituït fa poc de temps (en els països més desenvolupats) pel bismut, de propietats semblants però lleugerament menys tòxic. És molt coneguda també l'aplicació que va tenir en el passat en termòmetres, que va cessar a causa del perill d'intoxicació.
Paracels en va descobrir les propietats per a combatre la sífilis[20] i també ha tingut usos en medicina amb el mercoquinol (oxiquinolinsulfonat de mercuri) i l'hidrargirol (parafeniltoniat o parafenolsulfonat de mercuri), aquest últim com a antisèptic, igual que molts d'altres com ara l'hidrargol, l'hidrargiroseptol, el iodur mercúric, el cloroiodur mercúric, el mercuriol, etc.
Precaucions
[modifica]Es transporta en estat líquid, codi del A.D.R.: 8,66,c. Cal emmagatzemar-lo en àrees fredes, seques, ben ventilades, allunyades de la radiació solar i de fonts de calor i ignició, allunyat d'àcid nítric concentrat, acetilè, amoníac i clor. Ha d'emmagatzemar-se en recipients irrompibles de materials resistents a la corrosió i que hi siguen compatibles. Els contenidors han de tancar-se hermèticament. S'hi poden emprar contenidors d'acer, acer inoxidable, ferro, plàstics, vidre, porcellana. Cal evitar els contenidors de plom, alumini, coure, estany i zinc.
En l'etiquetatge, han d'incorporar-se les frases R: R 23 («Tòxic per inhalació») i R 33 («Perill d'efectes acumulatius»). També han d'incorporar-se les frases S: S 1/2 («Conserveu-lo sota clau i manteniu-lo fora de l'abast dels nens»), S 7 («Manteniu-lo en un recipient ben tancat») i S 45 («En cas d'accident o malestar consulteu immediatament el metge (si és possible, mostreu-li l'etiqueta)»).
Els efectes immediats que pot produir per inhalació són: coïssor de gola, mal de cap, nàusees, pèrdua de la gana i debilitat muscular. Per contacte amb ulls i pell: enrogiment i irritació. Per ingestió: vòmits, diarrea, pèrdua de la gana i debilitat muscular. Els termòmetres amb mercuri han passat a ser de venda prohibida a la Unió Europea el 2007.[21]
L'exposició prolongada o repetida pot provocar lesions en ronyons, cervell i sistema nerviós.
En cas d'accident, els primers auxilis a proporcionar són:
- En cas d'inhalació: traslladar la víctima a l'aire fresc. Buscar atenció mèdica.
- En cas de contacte amb la pell: portar la roba contaminada. Rentar l'àrea afectada amb aigua i sabó. Buscar atenció mèdica.
- En cas de contacte amb els ulls: rentar els ulls immediatament amb aigua. Buscar atenció mèdica.
- En cas d'ingestió: esbandir la boca amb aigua. Buscar atenció mèdica.
Les malalties o lesions associades al mercuri s'anomenen: hidrargirisme o mercurialisme i hidrargiria.
Altres característiques
[modifica]- Número CAS: 7439-97-6
- IPVS: 10 ppm - 81,9 mg/m3
- TLV-TWA: 0,025 ppm VLA-ED: 0,025 ppm
- Densitat relativa del líquid (aigua=1): 13,6
- Densitat relativa del gas (aire=1): 6,9
- Pressió de vapor: 0,0012 mmHg (molt poc volàtil)
Referències
[modifica]- ↑ "Magnetic susceptibility of the elements and inorganic compounds" a Lide, D. R. CRC Handbook of Chemistry and Physics (en anglès). 86a edició. CRC Press, 2005. ISBN 0-8493-0486-5.
- ↑ «mercuri». Diccionari de la llengua catalana de l'IEC. Institut d'Estudis Catalans.
- ↑ «argent». Diccionari de la llengua catalana de l'IEC. Institut d'Estudis Catalans.
- ↑ «hidrargir». Diccionari de la llengua catalana de l'IEC. Institut d'Estudis Catalans.
- ↑ Newton, 2010, p. 341.
- ↑ 6,0 6,1 6,2 Newton, 2010, p. 342.
- ↑ 7,0 7,1 Krebs, 2008, p. 169.
- ↑ 8,0 8,1 8,2 Trifónov i Trifónov, 1982, p. 34.
- ↑ «Mercury» (en anglès). Mindat. [Consulta: 7 gener 2016].
- ↑ 10,0 10,1 «mercurio». Diccionario de la lengua española. Real Academia Española (castellà).
- ↑ 11,0 11,1 Hammond, C. R The Elements in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ 12,0 12,1 Senese, F. «Why is mercury a liquid at STP?». Arxivat de l'original el 4 de abril de 2007. [Consulta: 1r maig 2007].
- ↑ 13,0 13,1 Norrby, L.J. «Why is mercury liquid? Or, why do relativistic effects not get into chemistry textbooks?». Journal of Chemical Education, 68, 2, 1991. 10.1021/ed068p1101991JChEd..68..110N.
- ↑ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5. Páginas=4.125–4.126}}
- ↑ http://www.ptable.com/#Property/State
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 0-08-037941-9.
- ↑ Gmelin, Leopold. Hand book of chemistry. Cavendish Society, p. 103 (Na), 110 (W), 122 (Zn), 128 (Fe), 247 (Au), 338 (Pt).
- ↑ Soratur. Essentials of Dental Materials. Jaypee Brothers Publishers.
- ↑ Vargel, C.. Corrosion of Aluminium. Elsevier.
- ↑ Úbeda y Correal, José; Fernández-Caro y Nouvilas, Ángel. Acciones químicas de las bacterias (en castellà). Real Academia Nac. Medicina, 1914, p. 115.
- ↑ Jones H. «EU bans mercury in barometers, thermometers». Reuters, 10-07-2007 [Consulta: 30 maig 2008].
Bibliografia
[modifica]- Newton, David E. Chemical Elements (en anglès). Segona edició. Gale, 2010. ISBN 9781414476087.
- Krebs, Robert E. The history and use of our earths chemical elements a reference (en anglès). Segona edició. Greenwood Press, 2008. ISBN 0–313–33438–2.
- Trifónov, D. N.; Trifónov, V. D.. Chemical Elements - How They Were Discovered (en anglès). Moscou: MIR, 1982.
Enllaços externs
[modifica]- webelements (anglès).
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||

