Cronologia de la química

La cronologia de la química és un llistat d'obres, descobriments, idees, invents i experiments importants que han canviat l'enteniment de la humanitat sobre la ciència en el camp de la química. La història de la química en la seva forma moderna va començar al segle XVI-XVII però les seves arrels són molt més antigues
Les primeres idees que es van incorporar a la ciència moderna provenen de dues fonts principalment. Primerament, dels filòsofs naturals (com Aristòtil i Demòcrit), qui feien servir raonaments deductius per intentar explicar el comportament del món. D'una altra banda, també s'inspira en els alquimistes (com ara Jàbir ibn Hayyān i Muhammad ibn Zakariya ar-Razi), qui feien servir tècniques experimentals en un intent d'allargar la vida o convertir materials barats en or.
Al segle xvii, les dues disciplines es van unir, aplicant principis «deductius»i «experimentals» alhora, donant lloc un procés anomenat mètode científic. Gràcies a la introducció del mètode científic, la versió moderna de la química va començar.
Coneguda com una ciència central, l'estudi de la química influencia i està influenciada per altres camps tecnològics. Moltes de les grans troballes en química es consideren també grans troballes d'altres camps, com ara la física, la biologia, l'astronomia, la geologia i la ciència de materials entre altres.[1]
Abans del segle xvii[modifica]



Prèviament a l'acceptació del mètode científic i la seva aplicació al camp de la química, és relativament controvertit anomenar a moltes de les persones aquí citades com a «químics», en el sentit modern de l'expressió. No obstant, les idees d'aquests pensadors, ja sigui per la seva influència o per la seva perspicàcia mereixen ser esmentades.
- c. 3000 aC
- Els formulen la teoria d'Ogdoad, o les forces primordials, de les quals es va formar tot. Aquests eren els 8 elements del caos i existien abans de la creació del Sol.[2]
- c. 1200 aC
- Tapputi-Belatekallim perfumista i química primitiva es anomenada en una taula cuneïforme a Mesopotàmia.[3]
- c. 450 aC
- Empèdocles afirma que tots els objectes estan formats de quatre elements primitius: terra, aire, foc i aigua, on dues forces actives i oposades, l'amor i l'odi o l'afinititat i l'antipatia, actuen sobre aquests elements i els combinen o separen en formes infinitament variades.[4]
- c. 440 aC
- Lèucip i Demòcrit proposen el concepte d'àtom, una partícula indivisible que conforma tota la matèria. Aquesta idea és rebutjada per la majoria de filòsofs naturals en favor de les idees d'Aristòtil.[5][6]
- c. 360 aC
- Plató encunya la paraula elements (stoicheia) al seu diàleg Timeu, que inclou la discussió de la composició dels cossos orgànics i inorgànics, sent un tractat rudimentari sobre química que assumeix que cada element té una geometria especial: tetrahèdre (foc), octahedre(aire), icosahedre (aigua) i cub (terra).[7]
- c. 350 aC
- Aristòtil, seguint les idees d'Empèdocles, proposa que les substàncies són una combinació de matèria i forma. Expandeix la teoria dels elements a: terra, aire, foc, aigua i èter. Aquesta teoria es va acceptar al món Occidental durant 1000 anys.[8]
- c. 300
- Zòsim de Panòpolis escriu algun dels llibres més antics sobre alquímia i la defineix com l'estudi de la composició de les aigües, els moviments, el creixement i l'eliminació dels esperits dels cossos, així com la unió dels esperits als cossos.[10]
- c. 770
- Abu Musa Jabir ibn Hayyan (Geber), un alquimista àrab/persa que és considerat per alguns el pare de la química,[11][12][13] desenvolupa un mètode científic primitiu per la químia, i aïlla nombrosos àcids, com ara l'àcid clorhídric, l'àcid nítric, l'àcid cítric, l'àcid acètic, l'àcid tàrtric, i l'aigua règia.[14]
- c. 1000
- Abū al-Rayhān al-Bīrūnī[15] i Avicenna,[16] ambdós químics perses, refuten la pràctica de l'alquímia i la teoria de la transmutació dels metalls.
- c. 1167
- Magister Salernus de l'Escola Mèdica Salernitana fa les primeres referències a la destil·lació del vi.[17]
- c. 1220
- Robert Grosseteste publica diversos comentaris aristotèlics on esbossa els fonaments del mètode científic.[18]
- c 1250
- Tadeo Alderotti desenvolupa la destil·lació fraccionada, de forma molt més eficient que els seus predecessors.[19]
- c 1260
- Sant Albert El Gran aïlla l'arsènic[20] i el nitrat de plata.[21] També va ser un dels primers en fer referència a l'àcid sulfúric.[22]
- c. 1267
- Roger Bacon publica Opus Maius, on proposa una forma primitiva del mètode científic i explica els seus experiments amb pólvora, entre d'altres.[23]
- c. 1310
- Pseudo-Geber, un alquimista espanyol anònim que escriviu sota el nom de Geber, publica diversos llibres que estableixen la teoria de que tots els metalls estan compostos de diverses proporcions de sulfur i mercuri.[24] És un dels primers a descriure l'àcid nítric, l'aigua règia i l'aqua fortis.[25]
- c. 1530
- Paracels desenvolupa la iatroquímica, una disciplina de l'alquímia que buscava allargar la vida, sent les arrels de la indústria farmacèutica moderna. Va ser el primer en fer servir la paraula química[10]
- 1597
- Andreas Libavius publica Alchemia, un propotip de llibre de text de química.[26]
Segle xvii i XVIII[modifica]
- 1605
- Sir Francis Bacon publica The Proficience and Advancement of Learning, que conté una descripció del que aviat es coneixeria com a mètode científic.[27]
- 1605
- Michal Sedziwój publica el tractat d'alquímia Una nova llum d'alquímica que proposa l'existència del «menjar de la vida» a l'aire, més tard reconegut com a oxigen.[28]
- 1615
- Jean Beguin publica el Tyrocinium Chymicum, un llibre de química primerenc, i hi dibuixa la primera equació química de la història.[29]
- 1637
- René Descartes publica el Discurs del mètode, que conté una descripció del mètode científic.[30]
- 1648
- Publicació pòstuma del llibre Ortus medicinae de Jan Baptist van Helmont, gran obra transicional entre l'alquímia i la química, que influencià Robert Boyle. El llibre conté els resultats de nombrosos experiments i estableix una versió primitiva de la llei de la conservació de la massa.[31]

- 1661
- Robert Boyle publica The Sceptical Chymist (El Químix Escèptic), un tractat que diferència la química de l'alquímica. Conté les primeres referències modernes a àtoms, molècules i reaccions químiques, marcant l'inici de la química moderna.[32]
- 1662
- Robert Boyle proposa la llei de Boyle, una descripció empírica del comportament dels gasos, especialment la relació entre la pressió i el volum.[32]
- 1735
- El químic suec Georg Brandt analitza un pigment blau fosc trobat en una mena de coure. Brandt demostra que es tracta d'un nou element, anomenat cobalt.[33][34]
- 1754
- Joseph Black isola el diòxid de carboni.[35]

- 1757
- Louis Claude Cadet de Gassicourt, investigant els compostos arsènics, crea el líquid fumant de Cadet, més tard es descobriria que era òxid de cacodil, considerant-lo el primer compost organometàl·lic sintetitzat.[36]
- 1758
- Joseph Black formula el concepte de calor latent per explicar els canvis de fase.[37]
- 1766
- Henry Cavendish descobreix l'hidrogen, un gas incolor, inodor i explosiu quan es barreja amb l'aire.[38]
- 1773–1774
- Carl Wilhelm Scheele i Joseph Priestley aïllen l'oxigen de forma independent. Priestley l'anomenava "aire deflogistat" i Scheele "aire de foc".[39][40]

- 1778
- Antoine Lavoisier, considerat "El Pare de la química moderna",[41] reconeix i anomena l'oxigen, i reconeix la seva importància a la combustió.[42]
- 1787
- Antoine Lavoisier publica Méthode de nomenclature chimique, el primer sistema modern de nomenclatura química.[42]
- 1787
- Jacques Charles proposa la llei de Charles, corolari de la llei de Boyle, descrivint la relació entre la temperatura i el volum d'un gas.[43]
- 1789
- Antoine Lavoisier publica el Traité Élémentaire de Chimie, el primer llibre de text ded química moderna. És un tractat complet de la química d'aquell temps, i hi inclou la primera definició concisa de la llei de conservació de massa, també fundant la disciplina de l'estequiometria o anàlisi química quantitativa.[42][44]
- 1797
- Joseph Proust proposa la llei de proporcions definides, que enuncia que els elements sempre es combinen en proporcions petites i senceres per formar compostos.[45]
- 1800
- Alessandro Volta inventa la primera pila voltaica, fundant així l'electroquímica.[46]
Segle xix[modifica]

- 1801
- John Dalton proposa la llei de Dalton, que descriu la relació entre els components d'una barreja de gasos i la pressió parcial de cadascun.[47]
- 1805
- Joseph-Louis Gay-Lussac descobreix que l'aigua està formada per dues parts d'hidrogen i una d'oxigen en volum.[48]
- 1808
- Joseph-Louis Gay-Lussac descobreix moltes propietats físiques i químiques de l'aire i altres gasos, incloent proves experimentals de les lleis de Boyle i Charles, i la relació entre la densitat i la composició dels gasos.[49]
- 1808
- John Dalton publica A New System of Chemical Philosophy (Un Nou Sistema de Filosofia Química), que conté una descripció moderna de la teoria atòmica, i una descripció clara de la llei de proporcions múltiples.[47]
- 1808
- Jöns Jakob Berzelius publica Lärbok i Kemien on proposa símbols químics moderns i una notació, a més d'un concepte de pes atòmic relatiu.[50]
- 1811
- Amedeo Avogadro proposa la llei d'Avogadro, que afirma que volums iguals de gasos a la mateixa pressió i temperatura contenen la mateixa quantitat de molècules.[51]

- 1825
- Friedrich Wöhler i Justus von Liebig duen a terme el primer descobriment i explicació dels isòmers, anomenats prèviament per Berzelius. Treballant amb àcid ciànic i àcid fulmínic, dedueixen correctament que l'isomerisme és causat per un arranjament diferent dels àtoms dins de la molècula.[52]
- 1827
- William Prout classifica les biomolècules en els grups models: carbohidrats, proteïnes i lípids.[53]
- 1828
- Friedrich Wöhler sintetitza urea, demostrant que els compostos orgànics es poden produir a partir de materials inorgànics, negant la teoria del vitalisme.[52]
- 1832
- Friedrich Wöhler i Justus von Liebig descobreixen i expliquen els grups funcionals i els radicals en química orgànica.[52]
- 1840
- Germain Hess proposa la llei de Hess, una versió anterior de la llei de la conservació de l'energia, que estrableix que els canvis d'energia en un procés químic depenen només de l'energia dels reactius i els productes i no del camí que es pren per viatjar entre els dos estats.[54]
- 1847
- Hermann Kolbe obté l'àcid acètic a partir de compostos inorgànics, negant el vitalisme.[55]
- 1848
- Lord Kelvin estableix el concepte de zero absolut, una temperatura on les molècules estan completament quietes.[56]
- 1849
- Louis Pasteur descobreix que la forma racèmica de l'àcid tàrtric és una barreja de les formes levògires i dextrògires, aclarint la natura de la rotació òptica i avançant el camp de l'esteroquímica.[57]
- 1852
- August Beer proposa la llei de Beer, que explica la relació entre la concentració d'una substància i la quantitat de llum que absorbeix. Es va basar parcialment en la feina de Pierre Bouguer i Johann Heinrich Lambert, establint les bases de la tècnica analítica de l'espectrofotometria.[58]
- 1855
- Benjamin Silliman, Jr. és pioner en el cracking del petroli, que fa possible la indústria petroquímica moderna.[59]
- 1856
- William Henry Perkin sintetitza la mauveïna, el primer pigment sintètic. Creat accidentalment mentre intentava sintetitzar quinina, un medicament contra la malària, va establir una base per la indústria de tints i va trobar el primer pigment porpra, sintètic o no, que es podien permetre les classes populars.[60]
- 1857
- Friedrich August Kekulé von Stradonitz afirma que el carboni és tetravalent, és a dir, que forma 4 enllaços químics.[61]
- 1859–1860
- Gustav Kirchhoff i Robert Bunsen estableixen els fonaments de l'espectroscòpia, una tècnica analítica, cosa que els va portar al descobriment del cesi i el rubidi. Aviat altres treballadors van fer servir la mateixa tècnica per descobrir l'indi, el tal·li i l'heli.[62]
- 1860
- Stanislao Cannizzaro, recuperant les idees d'Avogadro sobre molècules diatòmiques, fa una taula de pesos atòmics i la presenta al Karlsruhe Congress el 1860, acabant amb dècades de pesos atòmics contradictoris.[63]
- 1862
- Alexander Parkes exhibeix la parkesina, un dels primers polímers sintètics i precursor del cel·luloide, a l'International Exhibition in London. Aquesta descoberta és un dels fonaments de la indústria de plàstics moderna.[64]
- 1862
- Alexandre-Emile Béguyer de Chancourtois publica l'hèlix tel·lúric, una versió antiga i tridimensional de la taula periòdica.[65]
- 1864
- John Newlands proposa la llei dels vuitens, precursora de la llei periòdica.[65]
- 1864
- Lothar Meyer desenvolupa una versió precursora de la taula periòdica, amb els 28 elements organitzats per valència.[66]
- 1864
- Cato Maximilian Guldberg i Peter Waage, basant-se en les idees de Claude Louis Berthollet, enuncien la llei de l'acció de masses.[67][68][69]
- 1865
- Johann Josef Loschmidt determina el nombre exacte de molècules en un mol. Aquest nombre després es va anomenar nombre d'Avogadro.[70]
- 1865
- Friedrich August Kekulé von Stradonitz, basant-se en la feina de Loschmidt i altres, estableix l'estructura del benzè com un anell de 6 carbonis amb alternància de dobles i simples enllaços.[61]
- 1865
- Adolf von Baeyer comença a treballar en un tint indi, revolucionant la indústria dels tints.[71]

- 1869
- Dmitri Mendeléiev publica la primera taula periòdica moderna, que ordenava el 66 elements coneguts en aquell moment per pes atòmic. El punt fort de la seva taula és que podia predir les propietat d'elements que encara no s'havien descobert.[65][66]
- 1873
- Jacobus Henricus van 't Hoff i Joseph Achille Le Bel, treballant independentment, desenvolupen un model de l'enllaç químic que explica els experiments de Pasteur sobre la quiralitat i proporciona una causa física de l'activitat òptica dels compostos quirals.[72]
- 1876
- Josiah Willard Gibbs publica On the Equilibrium of Heterogeneous Substances (Sobre l'Equilibri de Substàncies Heterogènies), un recull de la seva feina sobre termodinàmica i física química, on introdueix per primer cop el concepte d'energia lliure per poder explicar l'equilibri químic.[73]
- 1877
- Ludwig Boltzmann demostra matemàticament molts conceptes físics i químics importants, com ara l'entropia i la distribució de velocitats en un gas.[74]
- 1883
- Svante Arrhenius desenvolupa la teoria dels ions per explicar la conductivitat dels electròlits.[75]
- 1884
- Jacobus Henricus van 't Hoff publica Études de Dynamique chimique, un estudi seminal sobre la cinètica química.[76]
- 1884
- Hermann Emil Fischer proposa l'estructura de la purina, clau per a entendre moltes biomolècules. També la va sintetitzar el 1898, a més d'iniciar estudis sobre la glucosa i altres sucres.[77]
- 1884
- Henry Louis Le Chatelier desenvolupa el principi de Le Chatelier, que explica els canvis en l'equilibri químic quan se sotmet a estímuls externs.[78]
- 1885
- Eugene Goldstein anomena els rajos catòdics, que més tard es va descobrir que es componien d'electrons, i els raigs anòdics, que més tard es va descobrir que eren ions d'hidrogen positius que havien perdut el seu electró al tub de rajos catòdics. Més tard, aquests ions es van anomenar protons.[79]
- 1893
- Alfred Werner descobreix l'estructura octahèdrica dels complexos de cobalt, iniciant el camp de la química de coordinació.[80]
- 1894–1898
- William Ramsay descobreix els gasos nobles, emplenant un buit inesperat de la taula periòdica i portant a nous models sobre l'enllaç químic.[81]
- 1897
- J. J. Thomson descobreix l'electró en un tub de rajos catòdics.[82]
- 1898
- Wilhelm Wien demostra que els rajos anòdics (feixos d'ions positius) canvien la seva trajectòria quan són exposats a camps magnètics, i que la quantitat de deflexió respon a la seva relació càrrega-massa. Aquesta troballa portaria al desenvolupament de l'espectroscopia de masses.[83]
- 1898
- Maria Sklodowska-Curie i Pierre Curie aïllen el radi i el poloni a partir de la pechblenda.[84]
- c. 1900
- Ernest Rutherford descobreix que la font de la radioactivitat és la desintegració atòmica, i posa nom a diferents tipus de radiació.[85]
Segle XX[modifica]
- 1903
- Mikhail Semyonovich Tsvet inventa la cromatografia, una important tècnica analítica.[86]
- 1904
- Hantaro Nagaoka proposa un model atòmic, on els electrons orbiten al voltant d'un nucli dens.[87]
- 1905
- Fritz Haber i Carl Bosch desenvolupen el procés de Haber-Bosch per sintetitzar amoníac a partir dels seus elements, un fet amb conseqüències molt importants per a l'agricultura.[88]
- 1905
- Albert Einstein explica el moviment brownià d'una forma que prova la teoria atòmica.[89]
- 1907
- Leo Hendrik Baekeland inventa la bakelita, un dels primers plàstics amb èxit comercial.[90]

- 1909
- Robert Millikan mesura la càrrega d'electrons individuals amb una precisió sense precedents gràcies a l'experiment de la gota d'oli, confirmant que tots els electrons tenen la mateixa càrrega i massa.[91]
- 1909
- S. P. L. Sørensen inventa el concepte de pH i desenvolupa un mètode de mesura de l'acidesa.[92]
- 1911
- Antonius van den Broek proposa la idea que els elements de la taula periòdica estarien millor ordenats per la càrrega del nucli i no pel pes atòmic.[93]
- 1911
- La primera Conferència Solvay té lloc a Brussel·les, apropant la majoria dels científics més prominents de l'època. Encara avui en dia es fan conferències de física i química periòdicament[94]
- 1911
- Ernest Rutherford, Hans Geiger, i Ernest Marsden duen a terme l'experiment de la làmina d'or, que prova el model nuclear de l'àtom amb un petit nucli dens i positiu envoltat d'un núvol electrònic difós.[85]
- 1912
- William Henry Bragg i William Lawrence Bragg proposen la llei de Bragg, base de la cristal·lografia de rajos X, una tècnica molt important per descobrir l'estructura cristal·lina d'una substància.[95]
- 1912
- Peter Debye desenvolupa el concepte de dipol per descriure la distribució de càrregues asimètrica d'algunes molècules.[96]

- 1913
- Niels Bohr introdueix conceptes de mecànica quàntica a l'estructura atòmica, proposant així el model atòmic de Bohr, on els electrons només poden trobar-se a orbitals atòmics estrictament definits.[97]
- 1913
- Henry Moseley, treballant amb la idea de Van den Broek, introdueix el concepte de nombre atòmic per arreglar els errors de la taula periòdica de Mendeléiev, basada en pes atòmic.[98]
- 1913
- Frederick Soddy proposa el concepte d'isòtops, elements amb el mateix nombre atòmic però diferent pes atòmic.[99]
- 1913
- J. J. Thomson, expandint la feina de Wien, demostra que les partícules subatòmiques carregades es poden separar per la seva relació càrrega-massa, amb una tècnica coneguda com a espectroscopia de masses.[100]
- 1916
- Gilbert N. Lewis publica "L'àtom i la molècula", fonament de la teoria d'enllaç de valència.[101]
- 1921
- Otto Stern i Walther Gerlach estableixen el concepte d'spin en partícules subatòmiques.[102]
- 1923
- Gilbert N. Lewis i Merle Randall publiquen Termodinàmica i l'energia lliure de les substàncies químiques, el primer tractat modern sobre termodinàmica química.[103]
- 1923
- Gilbert N. Lewis desenvolupa la teoria del parell d'electrons en reaccions àcid-base[101]
- 1924
- Louis de Broglie introdueix un model ondulatori de l'estructura atòmica, basant-se en la dualitat ona-partícula.[104]
- 1925
- Wolfgang Pauli desenvolupa el principi d'exclusió de Pauli, que diu que dos electrons del mateix nucli no poden tenir el mateix estat quàntic, descrit per 4 nombres quàntics.[105]

- 1926
- Erwin Schrödinger proposa l'equació d'Schrödinger, que proporciona una base matemàtica al model ondulatori de l'àtom.[106]
- 1927
- Werner Heisenberg desenvolupa el principi d'incertesa, que explica el moviment dels electrons al voltant dels nuclis, entre d'altres.[107]
- 1927
- Fritz London i Walter Heitler apliquen la mecànica quàntica per explicar l'enllaç covalent de la molècula de dihidrogen[108] iniciant el camp de la química quàntica.[109]
- 1929
- Linus Pauling publica les lleis de Pauling, principis claus per deduir l'estructura molecular a partir de la difracció de rajos X.[110]
- 1931
- Erich Hückel proposa la llei de Hückel, que prediu quan un anell planar en una molècula serà aromàtic.[111]
- 1931
- Harold Urey descobreix el deuteri mitjançant la destil·lació fraccionada d'hidrogen.[112]
- 1932
- James Chadwick descobreix el neutró.[113]
- 1932–1934
- Linus Pauling i Robert Mulliken quantifiquen l'electronegativitat, ideant les escales que porten el seus noms.[114]
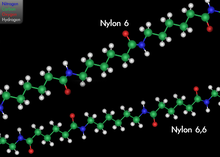
- 1935
- Wallace Carothers lidera un equip de químics a DuPont que inventa el nylon, un dels polímers sintètics més exitosos comercialment.[115]
- 1937
- Carlo Perrier i Emilio Segrè duen a terme la primera síntesi confirmada de tecneci, el primer element artificial, cobrint un forat a la taula periòdica. Encara que està disputat, es podria haver sintetitzat prèviament per Ida Noddack i Walter Noddack (entre d'altres) el 1925.[116]
- 1937
- Eugene Houdry desenvolupa un mètode de catàlisi a escala industrial pel cracking del petroli, donant lloc a les refineries de petroli modernes.[117]
- 1937
- Pyotr Kapitsa, John F. Allen i Don Misener produeixen heli superrefredat, el primer superfluïd amb viscositat zero, que mostra propietats quàntiques a escala macroscòpica.[118]
- 1938
- Otto Hahn descobreis la fissió nuclear en urani i tori.[119]
- 1939
- Linus Pauling publica La Natura de l'Enllaç Químic, una compilació de decàdes de treballs sobre l'enllaç químic. És un dels textos moderns de química més importants. Explica l'hibridació dels orbitals, l'enllaç covalent i l'iònic a través de l'electronegativitat i la ressonància, per poder explicar, entre d'altres, l'estructura del benzè.[110]
- 1940
- Edwin McMillan i Philip H. Abelson identifiquen el neptuni, el primer i més lleuger element transuranià, trobat en els productes de la fissió de l'urani. El laboratori de McMillan a Berkeley va trobar molts altres elements posteriorment [120]
- 1941
- Glenn T. Seaborg repren la feina de McMillan de crear elements nous mitjançant mètodes pioners com la captura de neutrons i altres reaccions nuclears. Seaborg va ser el descobridor o codescobridor de 9 elements químics i de dotzenes d'isòtops.[120]
- 1945
- Jacob A. Marinsky, Lawrence E. Glendenin, i Charles D. Coryell sintetitzen per primer cop el prometi, emplenant l'últim forat de la taula periòdica.[121]
- 1945–1946
- Felix Bloch i Edward Mills Purcell desenvolupen la ressonància magnètica nuclear, una tècnica analítica per elucidar l'estructura de les molècules, en especial de les orgàniques.[122]
- 1951
- Linus Pauling, mitjançant la cristal·lografia de raigs X, dedueix l'estructura secundària de les proteïnes.[110]
- 1952
- Alan Walsh comença el camp de l'espectroscopia d'absorció atòmica, una important tècnica quantitativa que ens permet conéixer la concentració d'una dissolució.[123]
- 1952
- Robert Burns Woodward, Geoffrey Wilkinson, i Ernst Otto Fischer descobreixen el ferrocè, una de les troballes fonamentals al camp de la química organometàl·lica.[124]
- 1953
- James D. Watson i Francis Crick proposen l'estructura del DNA, basant-se en la imatge de difracció de rajos X trobada per Rosalind Franklin, obrint les portes al camp de la biologia molecular.[125]
- 1957
- Jens Skou descobreix la bomba de sodi i potassi, el primer enzim de transport iònic.[126]
- 1958
- Max Perutz i John Kendrew fan servir la cristal·lografia de rajos X per elucidar l'estructura proteica de la mioglobina del catxalot.[127]
- 1962
- Neil Bartlett sintetitza l'hexafluoroplatinat de xenó, obtenint per primer cop un compost format per un gas noble.[128]
- 1962
- George Olah estudia els carbocations a partir de reaccions superàcides.[129]
- 1964
- Richard R. Ernst duu a terme experiments que donaran lloc al desenvolupament de la ressonància magnètica nuclear amb transformades de Fourier, incrementant la sensitivitat i obrint les portes a la imatgeria per ressonància magnètica.[130]
- 1965
- Robert Burns Woodward i Roald Hoffmann proposen les lleis de Woodward–Hoffmann, que expliquen l'estereoquímica de les reaccions a partir de la simetria dels orbitals moleculars.[124]
- 1966
- Hitoshi Nozaki i Ryōji Noyori descobreixen el primer exemple de catàlisi asimètrica.[131][132]
- 1970
- John Pople desenvolupa el programa Gaussian facilitant molt els càlculs de química computacional.[133]
- 1971
- Yves Chauvin aporta una explicació al mecanisme de reacció de les metàtesis d'olefines.[134]
- 1975
- Karl Barry Sharpless i el seu grup descobreixen reaccions d'oxidació estereoselectives.[135][136]

- 1985
- Harold Kroto, Robert Curl i Richard Smalley descobreixen els ful·lerens, una classe de grans molècules de carboni semblants a una cúpula geodèsica dissenyada per l'arquitecte R. Buckminster Fuller.[137]
- 1991
- Sumio Iijima, mitjançant la miscrocopia electrònica, descobreix els nanotubs de carboni. Aquest material és una part molt important de l'estudi de la nanociència.[138]
- 1994
- Se sintetitza totalment per primer cop el paclitaxel gràcies a Robert A. Holton i el seu grup.[139][140][141]
- 1995
- Eric Cornell i Carl Wieman creen el primer condensat de Bose-Einstein, una substància que mostra propietats quàntiques a escala macroscòpica.[142]
Referències[modifica]
- ↑ «Chemistry – The Central Science». The Chemistry Hall of Fame. York University. [Consulta: 12 setembre 2006].
- ↑ Griffiths, J. Gwyn «The Orders of Gods in Greece and Egypt (According to Herodotus)». The Journal of Hellenic Studies. The Society for the Promotion of Hellenic Studies, 75, 1955, pàg. 21–23. DOI: 10.2307/629164. JSTOR: 629164.
- ↑ Giese, Patsy Ann. «Women in Science: 5000 Years of Obstacles and Achievements». SHiPS Resource Center for Sociology, History and Philosophy in Science Teaching. Arxivat de l'original el 2006-12-13. [Consulta: 11 març 2007].
- ↑ Parry, Richard. «Empedocles». Stanford Encyclopedia of Philosophy. Metaphysics Research Lab, CSLI, Stanford University, 04-03-2005. [Consulta: 11 març 2007].
- ↑ Berryman, Sylvia. «Leucippus». Stanford Encyclopedia of Philosophy. Metaphysics Research Lab, CSLI, Stanford University, 14-08-2004. [Consulta: 11 març 2007].
- ↑ Berryman, Sylvia. «Democritus». Stanford Encyclopedia of Philosophy. Metaphysics Research Lab, CSLI, Stanford University, 15-08-2004. [Consulta: 11 març 2007].
- ↑ Hillar, Marian. «The Problem of the Soul in Aristotle's De anima». NASA WMAP, 2004. Arxivat de l'original el 2006-09-09. [Consulta: 10 agost 2006].
- ↑ «HISTORY/CHRONOLOGY OF THE ELEMENTS». [Consulta: 12 març 2007].
- ↑ Sedley, David. «Lucretius». Stanford Encyclopedia of Philosophy. Metaphysics Research Lab, CSLI, Stanford University, 04-08-2004. [Consulta: 11 març 2007].
- ↑ 10,0 10,1 Strathern, Paul. Mendeleyev's Dream – The Quest for the Elements. Berkley Books, 2000. ISBN 0-425-18467-6.
- ↑ Derewenda, Zygmunt S. «On wine, chirality and crystallography». Acta Crystallographica Section A, 64, 2007, p. 246–258 [247]. DOI: 10.1107/S0108767307054293.
- ↑ John Warren (2005). "War and the Cultural Heritage of Iraq: a sadly mismanaged affair", Third World Quarterly, Volume 26, Issue 4 & 5, p. 815-830.
- ↑ Zahoor, Dr. A. «JABIR IBN HAIYAN (Geber)». University of Indonesia, 1997. Arxivat de l'original el 2008-06-30. [Consulta: 14 març 2018].
- ↑ «Father of Chemistry: Jabir Ibn Haiyan». Famous Muslism. Famousmuslims.com, 2003. Arxivat de l'original el 2007-04-05. [Consulta: 12 març 2007].
- ↑ Marmura, Michael E. «An Introduction to Islamic Cosmological Doctrines. Conceptions of Nature and Methods Used for Its Study by the Ikhwan Al-Safa'an, Al-Biruni, and Ibn Sina by Seyyed Hossein Nasr». Speculum, 40, 4, 1965, pàg. 744–746. DOI: 10.2307/2851429.
- ↑ Robert Briffault (1938). The Making of Humanity, p. 196-197.
- ↑ Forbes, Robert James. A short history of the art of distillation: from the beginnings up to the death of Cellier Blumenthal. BRILL, 1970, p. 88. ISBN 978-90-04-00617-1 [Consulta: 29 juny 2010].
- ↑ «Robert Grosseteste». A: Charles Herbermann. Catholic Encyclopedia. Nova York: Robert Appleton Company, 1913.
- ↑ Holmyard, Eric John. Alchemy. Courier Dover Publications, 1990, p. 288. ISBN 0-486-26298-7.
- ↑ Emsley, John. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford: Oxford University Press, 2001, p. 43, 513, 529. ISBN 0-19-850341-5.
- ↑ Davidson, Michael W. «Molecular Expressions: Science, Optics and You — Timeline — Albertus Magnus». The Florida State University, 01-08-2003. [Consulta: 28 novembre 2009].
- ↑ Vladimir Karpenko, John A. Norris(2001), Vitriol in the history of Chemistry, Charles University
- ↑ O'Connor, J. J.; Robertson, E. F. «Roger Bacon». MacTutor. School of Mathematics and Statistics University of St Andrews, Scotland, 2003. Arxivat de l'original el 2008-03-07. [Consulta: 12 març 2007].
- ↑ Zdravkovski, Zoran; Stojanoski, Kiro. «GEBER». Institute of Chemistry, Skopje, Macedonia, 09-03-1997. Arxivat de l'original el 2012-04-22. [Consulta: 12 març 2007].
- ↑ Encyclopædia Britannica 1911, Alchemy Arxivat 2007-02-28 a Wayback Machine.
- ↑ «From liquid to vapor and back: origins». Special Collections Department. University of Delaware Library. [Consulta: 12 març 2007].
- ↑ Asarnow, Herman. «Sir Francis Bacon: Empiricism». An Image-Oriented Introduction to Backgrounds for English Renaissance Literature. University of Portland, 08-08-2005. Arxivat de l'original el 2007-02-01. [Consulta: 22 febrer 2007].
- ↑ «Sedziwój, Michal». infopoland: Poland on the Web. University at Buffalo. Arxivat de l'original el 2006-09-02. [Consulta: 22 febrer 2007].
- ↑ Crosland, M.P. «The use of diagrams as chemical 'equations' in the lectures of William Cullen and Joseph Black». Annals of Science, 15, 2, 1959, pàg. 75–90. DOI: 10.1080/00033795900200088.
- ↑ «René Descartes». A: Charles Herbermann. Catholic Encyclopedia. Nova York: Robert Appleton Company, 1913.
- ↑ «Johann Baptista van Helmont». History of Gas Chemistry. Center for Microscale Gas Chemistry, Creighton University, 25-09-2005. [Consulta: 23 febrer 2007].
- ↑ 32,0 32,1 Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ Georg Brandt va mostrar que el cobalt era un nou metall a: G. Brandt (1735) "Dissertatio de semimetallis" (Dissertació sobre semi-metalls), Acta Literaria et Scientiarum Sveciae, vol. 4, pages 1–10.
Vegeu també: (1) G. Brandt (1746) "Rön och anmärkningar angäende en synnerlig färg — cobolt" (Observations and remarks concerning an extraordinary pigment — cobalt), Kongliga Svenska vetenskapsakademiens handlingar (Transactions of the Royal Swedish Academy of Science), vol.7, pagina 119–130; (2) G. Brandt (1748) "Cobalti nova species examinata et descripta" (Cobalt, un nou element examinat i descrit), Acta Regiae Societatis Scientiarum Upsaliensis, 1era serie, vol. 3, pagina 33-41; (3) James L. Marshall and Virginia R. Marshall (Spring 2003) "Rediscovery of the Elements: Riddarhyttan, Sweden," Arxivat 2010-07-03 a Wayback Machine. The Hexagon (official journal of the Alpha Chi Sigma fraternity of chemists), vol. 94, no. 1, pages 3–8. - ↑ Wang, Shijie «Cobalt—Its recovery, recycling, and application». Journal of the Minerals, Metals and Materials Society, 58, 10, 2006, pàg. 47–50. Bibcode: 2006JOM....58j..47W. DOI: 10.1007/s11837-006-0201-y.
- ↑ Cooper, Alan. «Joseph Black». History of Glasgow University Chemistry Department. University of Glasgow Department of Chemistry, 1999. Arxivat de l'original el 2006-04-10. [Consulta: 23 febrer 2006].
- ↑ Seyferth, Dietmar «Cadet's Fuming Arsenical Liquid and the Cacodyl Compounds of Bunsen». Organometallics, 20, 8, 2001, pàg. 1488–1498. DOI: 10.1021/om0101947.
- ↑ Partington, J.R.. A Short History of Chemistry. Dover Publications, Inc, 1989. ISBN 0-486-65977-1.
- ↑ Cavendish, Henry «Three Papers Containing Experiments on Factitious Air, by the Hon. Henry Cavendish». Philosophical Transactions. The University Press, 56, 1766, pàg. 141–184. DOI: 10.1098/rstl.1766.0019 [Consulta: 6 novembre 2007].
- ↑ Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ «Carl Wilhelm Scheele». History of Gas Chemistry. Center for Microscale Gas Chemistry, Creighton University, 11-09-2005. [Consulta: 23 febrer 2007].
- ↑ "Lavoisier, Antoine." Encyclopædia Britannica. 2007. Encyclopædia Britannica Online. 24 July 2007 <http://www.britannica.com/eb/article-9369846>.
- ↑ 42,0 42,1 42,2 Weisstein, Eric W. «Lavoisier, Antoine (1743–1794)». Eric Weisstein's World of Scientific Biography. Wolfram Research Products, 1996. [Consulta: 23 febrer 2007].
- ↑ «Jacques Alexandre César Charles». Centennial of Flight. U.S. Centennial of Flight Commission, 2001. Arxivat de l'original el 2007-02-24. [Consulta: 23 febrer 2007].
- ↑ Burns, Ralph A. Fundamentals of Chemistry. Prentice Hall, 1999, p. 32. ISBN 0-02-317351-3.
- ↑ «Proust, Joseph Louis (1754–1826)». 100 Distinguished Chemists. European Association for Chemical and Molecular Science, 2005. Arxivat de l'original el 2008-05-15. [Consulta: 23 febrer 2007].
- ↑ «Inventor Alessandro Volta Biography». The Great Idea Finder. The Great Idea Finder, 2005. Arxivat de l'original el 2010-01-02. [Consulta: 23 febrer 2007].
- ↑ 47,0 47,1 Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ Error en el títol o la url.«». Chemical Heritage Foundation, 2005.
- ↑ «December 6 Births». Today in Science History. Today in Science History, 2007. [Consulta: 12 març 2007].
- ↑ Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ «Michael Faraday». Famous Physicists and Astronomers. [Consulta: 12 març 2007].
- ↑ 52,0 52,1 52,2 Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ «William Prout». Arxivat de l'original el 2007-09-26. [Consulta: 12 març 2007].
- ↑ «Hess, Germain Henri». Arxivat de l'original el 2007-02-09. [Consulta: 12 març 2007].
- ↑ «Kolbe, Adolph Wilhelm Hermann». 100 Distinguished European Chemists. European Association for Chemical and Molecular Sciences, 2005. Arxivat de l'original el 2008-10-11. [Consulta: 12 març 2007].
- ↑ Weisstein, Eric W. «Kelvin, Lord William Thomson (1824–1907)». Eric Weisstein's World of Scientific Biography. Wolfram Research Products, 1996. [Consulta: 12 març 2007].
- ↑ «History of Chirality». Stheno Corporation, 2006. Arxivat de l'original el 2007-03-07. [Consulta: 12 març 2007].
- ↑ «Lambert-Beer Law». Sigrist-Photometer AG, 07-03-2007. [Consulta: 12 març 2007].
- ↑ «Benjamin Silliman, Jr. (1816–1885)». Picture History. Picture History LLC, 2003. Arxivat de l'original el 2007-07-07. [Consulta: 24 març 2007].
- ↑ Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ 61,0 61,1 Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ O'Connor, J. J.; Robertson, E.F. «Gustav Robert Kirchhoff». MacTutor. School of Mathematics and Statistics University of St Andrews, Scotland, 2002. Arxivat de l'original el 2010-07-07. [Consulta: 24 març 2007].
- ↑ Eric R. Scerri, The Periodic Table: Its Story and Its Significance, Oxford University Press, 2006.
- ↑ «Alexander Parkes (1813–1890)». People & Polymers. Plastics Historical Society. Arxivat de l'original el 2008-06-25. [Consulta: 24 març 2007].
- ↑ 65,0 65,1 65,2 «The Periodic Table». The Third Millennium Online. [Consulta: 24 març 2007].
- ↑ 66,0 66,1 Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ C.M. Guldberg and P. Waage,"Studies Concerning Affinity" C. M. Forhandlinger: Videnskabs-Selskabet i Christiana (1864), 35
- ↑ P. Waage, "Experiments for Determining the Affinity Law" ,Forhandlinger i Videnskabs-Selskabet i Christiania, (1864) 92.
- ↑ C.M. Guldberg, "Concerning the Laws of Chemical Affinity", C. M. Forhandlinger i Videnskabs-Selskabet i Christiania (1864) 111
- ↑ «No. 1858: Johann Josef Loschmidt».
- ↑ «Adolf von Baeyer: The Nobel Prize in Chemistry 1905». Nobel Lectures, Chemistry 1901–1921. Elsevier Publishing Company, 1966. [Consulta: 28 febrer 2007].
- ↑ Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ O'Connor, J. J.; Robertson, E.F. «Josiah Willard Gibbs». MacTutor. School of Mathematics and Statistics University of St Andrews, Scotland, 1997. Arxivat de l'original el 2010-03-27. [Consulta: 24 març 2007].
- ↑ Weisstein, Eric W. «Boltzmann, Ludwig (1844–1906)». Eric Weisstein's World of Scientific Biography. Wolfram Research Products, 1996. [Consulta: 24 març 2007].
- ↑ Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ «Jacobus H. van 't Hoff: The Nobel Prize in Chemistry 1901». Nobel Lectures, Chemistry 1901–1921. Elsevier Publishing Company, 1966. [Consulta: 28 febrer 2007].
- ↑ «Emil Fischer: The Nobel Prize in Chemistry 1902». Nobel Lectures, Chemistry 1901–1921. Elsevier Publishing Company, 1966. [Consulta: 28 febrer 2007].
- ↑ «Henry Louis Le Châtelier». World of Scientific Discovery. Thomson Gale, 2005. [Consulta: 24 març 2007].
- ↑ «History of Chemistry». Intensive General Chemistry. Columbia University Department of Chemistry Undergraduate Program. [Consulta: 24 març 2007].
- ↑ «Alfred Werner: The Nobel Prize in Chemistry 1913». Nobel Lectures, Chemistry 1901–1921. Elsevier Publishing Company, 1966. [Consulta: 24 març 2007].
- ↑ «William Ramsay: The Nobel Prize in Chemistry 1904». Nobel Lectures, Chemistry 1901–1921. Elsevier Publishing Company, 1966. [Consulta: 20 març 2007].
- ↑ Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ «Alfred Werner: The Nobel Prize in Physics 1911». Nobel Lectures, Physics 1901–1921. Elsevier Publishing Company, 1967. [Consulta: 24 març 2007].
- ↑ Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ 85,0 85,1 «Ernest Rutherford: The Nobel Prize in Chemistry 1908». Nobel Lectures, Chemistry 1901–1921. Elsevier Publishing Company, 1966. [Consulta: 28 febrer 2007].
- ↑ «Tsvet, Mikhail (Semyonovich)». Compton's Desk Reference. Encyclopædia Britannica, 2007. Arxivat de l'original el 2012-06-30. [Consulta: 24 març 2007].
- ↑ «Physics Time-Line 1900 to 1949». Weburbia.com. Arxivat de l'original el 2007-04-30. [Consulta: 25 març 2007].
- ↑ Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ Cassidy, David. «Einstein on Brownian Motion». The Center for History of Physics, 1996. Arxivat de l'original el 2007-02-06. [Consulta: 25 març 2007].
- ↑ Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ «Robert A. Millikan: The Nobel Prize in Physics 1923». Nobel Lectures, Physics 1922–1941. Elsevier Publishing Company, 1965. [Consulta: 17 juliol 2007].
- ↑ Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ Parker, David. «Nuclear Twins: The Discovery of the Proton and Neutron». Electron Centennial Page. Arxivat de l'original el 2018-01-22. [Consulta: 25 març 2007].
- ↑ «Solvay Conference». Einstein Symposium, 2005. [Consulta: 28 març 2007].
- ↑ «The Nobel Prize in Physics 1915». Nobelprize.org. The Nobel Foundation. [Consulta: 28 febrer 2007].
- ↑ «Peter Debye: The Nobel Prize in Chemistry 1936». Nobel Lectures, Chemistry 1922–1941. Elsevier Publishing Company, 1966. [Consulta: 28 febrer 2007].
- ↑ «Niels Bohr: The Nobel Prize in Physics 1922». Nobel Lectures, Chemistry 1922–1941. Elsevier Publishing Company, 1966. [Consulta: 25 març 2007].
- ↑ Weisstein, Eric W. «Moseley, Henry (1887–1915)». Eric Weisstein's World of Scientific Biography. Wolfram Research Products, 1996. [Consulta: 25 març 2007].
- ↑ «Frederick Soddy The Nobel Prize in Chemistry 1921». Nobel Lectures, Chemistry 1901–1921. Elsevier Publishing Company, 1966. [Consulta: 25 març 2007].
- ↑ «Early Mass Spectrometry». A History of Mass Spectrometry. Scripps Center for Mass Spectrometry, 2005. Arxivat de l'original el 2007-03-03. [Consulta: 26 març 2007].
- ↑ 101,0 101,1 Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ «Electron Spin». [Consulta: 26 març 2007].
- ↑ LeMaster, Nancy; McGann, Diane. «GILBERT NEWTON LEWIS: AMERICAN CHEMIST (1875–1946)». Woodrow Wilson Leadership Program in Chemistry. The Woodrow Wilson National Fellowship Foundation, 1992. Arxivat de l'original el 2007-04-01. [Consulta: 25 març 2007].
- ↑ «Louis de Broglie: The Nobel Prize in Physics 1929». Nobel Lectures, Physics 1922–1941. Elsevier Publishing Company, 1965. [Consulta: 28 febrer 2007].
- ↑ «Wolfgang Pauli: The Nobel Prize in Physics 1945». Nobel Lectures, Physics 1942–1962. Elsevier Publishing Company, 1964. [Consulta: 28 febrer 2007].
- ↑ «Erwin Schrödinger: The Nobel Prize in Physics 1933». Nobel Lectures, Physics 1922–1941. Elsevier Publishing Company, 1965. [Consulta: 28 febrer 2007].
- ↑ «Werner Heisenberg: The Nobel Prize in Physics 1932». Nobel Lectures, Physics 1922–1941. Elsevier Publishing Company, 1965. [Consulta: 28 febrer 2007].
- ↑ Heitler, Walter; Londres, Fritz «Wechselwirkung neutraler Atome und homöopolare Bindung nach der Quantenmechanik». Zeitschrift für Physik, 44, 1927, pàg. 455–472. Bibcode: 1927ZPhy...44..455H. DOI: 10.1007/BF01397394.
- ↑ Ivor Grattan-Guinness. Companion Encyclopedia of the History and Philosophy of the Mathematical Sciences. Johns Hopkins University Press, 2003, p. 1266.; Jagdish Mehra, Helmut Rechenberg. The Historical Development of Quantum Theory. Springer, 2001, p. 540.
- ↑ 110,0 110,1 110,2 «Linus Pauling: The Nobel Prize in Chemistry 1954». Nobel Lectures, Chemistry 1942–1962. Elsevier, 1964. [Consulta: 28 febrer 2007].
- ↑ Rzepa, Henry S. «The aromaticity of Pericyclic reaction transition states». Department of Chemistry, Imperial College London. [Consulta: 26 març 2007].
- ↑ «Harold C. Urey: The Nobel Prize in Chemistry 1934». Nobel Lectures, Chemistry 1922–1941. Elsevier Publishing Company, 1965. [Consulta: 26 març 2007].
- ↑ «James Chadwick: The Nobel Prize in Physics 1935». Nobel Lectures, Physics 1922–1941. Elsevier Publishing Company, 1965. [Consulta: 28 febrer 2007].
- ↑ Jensen, William B. «Electronegativity from Avogadro to Pauling: II. Late Nineteenth- and Early Twentieth-Century Developments». Journal of Chemical Education, 80, 3, 2003, pàg. 279. Bibcode: 2003JChEd..80..279J. DOI: 10.1021/ed080p279.
- ↑ Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ «Emilio Segrè: The Nobel Prize in Physics 1959». Nobel Lectures, Physics 1942–1962. Elsevier Publishing Company, 1965. [Consulta: 28 febrer 2007].
- ↑ Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ «Pyotr Kapitsa: The Nobel Prize in Physics 1978». Les Prix Nobel, The Nobel Prizes 1991. Nobel Foundation, 1979. [Consulta: 26 març 2007].
- ↑ «Otto Hahn: The Nobel Prize in Chemistry 1944». Nobel Lectures, Chemistry 1942–1962. Elsevier Publishing Company, 1964. [Consulta: 7 abril 2007].
- ↑ 120,0 120,1 Error en el títol o la url.«». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation, 2005.
- ↑ «History of the Elements of the Periodic Table». AUS-e-TUTE. [Consulta: 26 març 2007].
- ↑ «The Nobel Prize in Physics 1952». Nobelprize.org. The Nobel Foundation. [Consulta: 28 febrer 2007].
- ↑ Hannaford, Peter. «Alan Walsh 1916–1998». AAS Biographical Memoirs. Australian Academy of Science. Arxivat de l'original el 2007-02-24. [Consulta: 26 març 2007].
- ↑ 124,0 124,1 Cornforth, Lord Todd, John; Cornforth, J.; T., A. R.; C., J. W. «Robert Burns Woodward. 10 April 1917-8 July 1979». Biographical Memoirs of Fellows of the Royal Society. JSTOR, 27, Nov., 1981, novembre 1981, pàg. 628–695. DOI: 10.1098/rsbm.1981.0025. JSTOR: 198111. note: authorization required for web access.
- ↑ «The Nobel Prize in Medicine 1962». Nobelprize.org. The Nobel Foundation. [Consulta: 28 febrer 2007].
- ↑ Skou, Jens «The influence of some cations on an adenosine triphosphatase from peripheral nerves.». Biochim Biophys Acta, 23, 2, 1957, pàg. 394–401. DOI: 10.1016/0006-3002(57)90343-8. PMID: 13412736.
- ↑ «The Nobel Prize in Chemistry 1962». Nobelprize.org. The Nobel Foundation. [Consulta: 28 febrer 2007].
- ↑ «Neil Bartlett and the Reactive Noble Gases». Societat Química Americana. Arxivat de l'original el 12 gener 2013. [Consulta: 5 juny 2012].
- ↑ G. A. Olah, S. J. Kuhn, W. S. Tolgyesi, E. B. Baker, J. Am. Chem. Soc. 1962, 84, 2733; G. A. Olah, lieu. Chim. (Bucharest), 1962, 7, 1139 (Nenitzescu issue); G. A. Olah, W. S. Tolgyesi, S. J. Kuhn, M. E. Moffatt, I. J. Bastien, E. B. Baker, J. Am. Chem. Soc. 1963, 85, 1328.
- ↑ «Richard R. Ernst The Nobel Prize in Chemistry 1991». Les Prix Nobel, The Nobel Prizes 1991. Nobel Foundation, 1992. [Consulta: 27 març 2007].
- ↑ H. Nozaki, S. Moriuti, H. Takaya, R. Noyori, Tetrahedron Lett. 1966, 5239;
- ↑ H. Nozaki, H. Takaya, S. Moriuti, R. Noyori, Tetrahedron 1968, 24, 3655.
- ↑ W. J. Hehre, W. A. Lathan, R. Ditchfield, M. D. Newton, and J. A. Pople, Gaussian 70 (Quantum Chemistry Program Exchange, Program No. 237, 1970).
- ↑ Catalyse de transformation des oléfines par les complexes du tungstène. II. Télomérisation des oléfines cycliques en présence d'oléfines acycliques Die Makromolekulare Chemie Volume 141, Issue 1, Date: 9 February 1971, Pages: 161–176 Par Jean-Louis Hérisson, Yves Chauvin doi:10.1002/macp.1971.021410112
- ↑ Katsuki, T.; Sharpless, K. B. J. Am. Chem. Soc. 1980, 102, 5974. (doi:10.1021/ja00538a077)
- ↑ Hill, J. G.; Sharpless, K. B.; Exon, C. M.; Regenye, R. Org. Syn., Coll. Vol. 7, p.461 (1990); Vol. 63, p.66 (1985). (Article)
- ↑ «The Nobel Prize in Chemistry 1996». Nobelprize.org. The Nobel Foundation. [Consulta: 28 febrer 2007].
- ↑ «Benjamin Franklin Medal awarded to Dr. Sumio Iijima, Director of the Research Center for Advanced Carbon Materials, AIST». National Institute of Advanced Industrial Science and Technology, 2002. Arxivat de l'original el 2007-04-04. [Consulta: 27 març 2007].
- ↑ First total synthesis of taxol 1. Functionalization of the B ring Robert A. Holton, Carmen Somoza, Hyeong Baik Kim, Feng Liang, Ronald J. Biediger, P. Douglas Boatman, Mitsuru Shindo, Chase C. Smith, Soekchan Kim, et al.; J. Am. Chem. Soc.; 1994; 116(4); 1597–1598. DOI Abstract
- ↑ First total synthesis of taxol. 2. Completion of the C and D rings Robert A. Holton, Hyeong Baik Kim, Carmen Somoza, Feng Liang, Ronald J. Biediger, P. Douglas Boatman, Mitsuru Shindo, Chase C. Smith, Soekchan Kim, and et al. J. Am. Chem. Soc.; 1994; 116(4) pp 1599–1600 DOI Abstract
- ↑ A synthesis of taxusin Robert A. Holton, R. R. Juo, Hyeong B. Kim, Andrew D. Williams, Shinya Harusawa, Richard E. Lowenthal, Sadamu Yogai J. Am. Chem. Soc.; 1988; 110(19); 6558–6560. Abstract
- ↑ «Cornell and Wieman Share 2001 Nobel Prize in Physics». NIST News Release. National Institute of Standards and Technology, 2001. Arxivat de l'original el 2007-06-10. [Consulta: 27 març 2007].
