Anticòs: diferència entre les revisions
| Línia 286: | Línia 286: | ||
== Variants d'anticossos en medicina i investigació == |
== Variants d'anticossos en medicina i investigació == |
||
En ocasions es necessita produir anticossos específics. Injectant un antigen en un [[mamífer]], com un [[ratolí]], una [[rata]] o un [[conill]] si es requereix poca quantitat; una [[cabra]], una [[ovella]] o un [[cavall]] si es requereixen grans quantitats. La sang aïllada d'aquests animals conté [[anticòs policlonal|anticossos policlonals]] -múltiples anticossos que s'uneixen al mateix antigen- en el sèrum sanguini, al qual es denomina [[antisèrum]]. També es poden injectar antígens en el rovell d'[[ou]] de [[gall]]ina per produir.<ref>{{cita libro |autor=Tini M, Jewell UR, Camenisch G, Chilov D, Gassmann M |títol=Generation and application of chicken egg-yolk antibodies |revista=Comp. Biochem. Physiol., Part a Mol. Integr. Physiol. |volumen=131 |número=3 |páginas=569–74 |año=2002 |pmid=11867282 |doi=}}</ref> Tanmateix, per a aplicacions analítiques és necessària una major especificitat, sobretot si es tracta de detectar molècules molt petites, així com quan s'usen en aplicacions terapèutiques en les que es vol bloquejar o detectar marcadors molt específics. Per això la tecnologia dels anticossos ha generat algunes variants, entre les quals es destaquen: |
|||
;Anticossos monoclonals |
|||
Si es desitja obtenir anticossos específics per a un únic epítop d'un antigen, s'aïllen limfòcits secretores d'anticossos d'un animal i es immortalitzen amb fusions amb una línia cel·lular cancerosa. Les cèl·lules fusionades es denominen [[hibridoma|hibridomes]] i continuaran creixent i secretant anticossos en el cultiu. S'aïllen les cèl·lules d'hibridoma individuals mitjançant clonat per dilució per generar clons que produeixin tots el mateix anticòs. A aquests anticossos se'ls anomena anticossos monoclonals.<ref>{{cita libro |autor=Cole SP, Campling BG, Atlaw T, Kozbor D, Roder JC |títol=Human monoclonal antibodies |revista=Mol. Cell. Biochem. |volumen=62 |número=2 |páginas=109–20 |año=1984 |pmid=6087121 |doi=}}</ref> |
|||
Els anticossos mono i policlonals generats es poden purificar utilitzant proteïna A/G o cromatografia d'afinitat a l'antigen.<ref>{{cita libro |autor=Kabir S |títol=Immunoglobulin purification by affinity chromatography using protein A mimetic ligands prepared by combinatorial chemical synthesis |revista=Immunol Invest |volumen=31 |número=3-4 |páginas=263–78 | año= 2002 |pmid=12472184 |doi=10.1081/IMM-120016245}}</ref> |
|||
| ⚫ | |||
| ⚫ | |||
;Anticossos de cadena senzilla |
|||
És possible generar artificialment un anticòs que compti només amb les regions variables de la cadena lleugera i pesada, unides per un petit [[pèptid]] o un sol [[aminoàcid]]. En aquest cas es tindran anticossos de cadena senzilla o scFv's. Actualment s'apliquen en tècniques com la citomètria de fluxe o la immunohistoquímica.<ref>{{cita libro| autor =Lennard, S| títol =Standard Protocols for the Construction of scFv Libraries | año =2001 | publicación = Springer protocols | volumen = | número = | id = DOI 10.1385/1-59259-240-6:059| url =http://www.springerprotocols.com/Abstract/doi/10.1385/1-59259-240-6:059}}</ref> |
|||
;Abzimes |
|||
La majoria dels anticossos es diferencien d'altres proteïnes per no presentar catàlisi enzimàtica en la seva funció, pel que tradicionalment es consideren proteïnes de reconeixement de superfícies moleculars. Tanmateix, en la dècada dels anys 90 del segle XX i a principis del segle XXI diversos estudis d'immunologia van trobar anticossos amb propietats catalítiques. Aquests anticossos han rebut el nom de [[abzima|abzimes]]. És possible trobar en quantitats baixes en el sèrum de persones sanes. Un exemple de l'existència de les abzimes en el cos humà va ser la detecció de abzimes contra ADN en la [[llet]] materna.<ref>{{cita libro| autor = Altria, KD | títol =Capillary Electrophoresis Guidebook Principles, Operation, and Applications, página 226 | año =1996 | editorial = Humana Press | id =ISBN 1-59259-538-3 }}</ref> Entre algunes d'aquestes activitats catalítiques detectades estan les de peptidasas inespecífiques i amilolítiques (degradació de [[midó]]). D'altra banda s'ha observat un increment en el nivell de abzimes en malalties de tipus autoimmunitàries. Tanmateix, normalment es fabriquen de forma artificial generant anticossos contra el compost intermediari d'una reacció per la que es vol crear un enzim. En algunes ocasions podrien tenir aplicacions terapèutiques i industrials.<ref>{{cita libro| autor =Blackburn, GM y colaboradores:| títol =Toward antibody-directed "abzyme" prodrug therapy, ADAPT: carbamate prodrug activation by a catalytic antibody and its in vitro application to human tumor cell killing | año =[[1996]] | publicación = [[PNAS]] | volumen =93 | número =2 | id =| url =http://www.pnas.org/content/93/2/799.full.pdf+html }}</ref><ref>{{cita libro| autor =Shiro Kobayashi, Helmut Ritter, David Kaplan | títol =Enzyme-Catalyzed Synthesis of Polymers, pág. 206 | año =2006 | editorial = Birkhäuser | id =ISBN 3-540-29212-8 }}</ref> |
|||
;Nanoanticossos |
|||
Hi ha propostes per a la utilització terapèutica d'anticossos monoclonals del [[camèlid]], també anomenats [[nanoanticòs|nanoanticossos]]. Aquests són excepcionals en el [[regne animal]], atès la seva reduïda mida, degut a que estan compostos únicament per dues cadenes pesades.<ref>Hamers-Casterman C, Atarhouch T, Muyldermans S, Robinson G, Hamers C, Songa EB, Bendahman N, Hamers R., Naturally occurring antibodies devoid of light chains, [[Nature]]. [[1993]] Jun 3;363(6428):446-8</ref> Tals peculiaritats els permeten accedir a localitzacions cel·lulars i d'antígens inaccessibles pels anticossos normals, a més de ser possible la seva administració oral.<ref>{{citar web|url =http://www.news-medical.net/?id=1477 |título =Nanobodies herald a new era in cancer therapy |fechaacceso =|añoacceso = |autor = |último = |primero = |enlaceautor =|coautores = |fecha = |año =2004 |mes =Mayo |formato =|obra =Medical News |editorial = |páginas = |idioma = |doi =|urlarchivo = |fechaarchivo = |cita = }}</ref> |
|||
;Faboteràpics |
|||
Per obtenir antídots contra verins de picades per animals com [[serp]]s o [[artròpode]]s, es fabriquen antiserums mitjançant sèrum cru o bé altament enriquit en immunoglobulines. Aquests procediments produeixen un gran nombre de reaccions [[al·lèrgia|al·lèrgiques]], com [[anafilaxia|anafilaxies]] o la [[malaltia del sèrum]]. Per evitar-ho, en els anys 40 i 50 es van realitzar estudis de proteòlisi per reduir al mínim la part de la molècula implicada en la neutralització del verí. Finalment es va trobar que el fragment F (ab') 2, resultant de la digestió amb [[papaïna]] dels anticossos, que manca de les zones efectores de la molècula, pot neutralitzar igualment verins. El professor [[Alejandro Alagón Cano]] va proposar per aquest enfocament terapèutic el nom de [[faboteràpia]], observant una incidència molt menor de reaccions adverses al sèrum, així com un millor abast del compartiment extravascular.<ref>{{citar web|url =http://www.smb.org.mx/XXVICONGRESO/text/Resumen-Invitados/ALAGON_ANTICUERPOS%20TERAPEUTICOS.pdf |título =ANTICUERPOS TERAPEUTICOS: EL CASO DE LOS ANTIVENENOS |fechaacceso =25 de agosto|añoacceso =2008 |autor =Cano, AA |último = |primero = |enlaceautor =|coautores = |fecha = |año = |mes = |formato =|obra = |editorial =Sociedad Mexicana de Bioquímica |páginas = |idioma = |doi =|urlarchivo = |fechaarchivo = |cita = }}</ref> |
|||
| ⚫ | |||
| ⚫ | |||
[[Fitxer:IgG molecular surface.jpg|thumb|205px|Superfície molecular de la IgG humana.]] |
[[Fitxer:IgG molecular surface.jpg|thumb|205px|Superfície molecular de la IgG humana.]] |
||
'''Propietats físiques:''' |
'''Propietats físiques:''' |
||
| Línia 307: | Línia 325: | ||
*S'uneix a receptors per Fc en els [[fagòcits]]. |
*S'uneix a receptors per Fc en els [[fagòcits]]. |
||
=== [[IgM]] === |
|||
[[Fitxer:IgM.png|thumb|205px|IgM (Immunoglobulina M) en forma de pentàmer.<br />1: Unitat bàsica. <br />2: Cadenes pesades.<br />3: Cadenes lleugeres.<br />4: Cadena J.<br />5: Ponts disulfur intermoleculars.]] |
[[Fitxer:IgM.png|thumb|205px|IgM (Immunoglobulina M) en forma de pentàmer.<br />1: Unitat bàsica. <br />2: Cadenes pesades.<br />3: Cadenes lleugeres.<br />4: Cadena J.<br />5: Ponts disulfur intermoleculars.]] |
||
'''Propietats físiques:''' |
'''Propietats físiques:''' |
||
| Línia 325: | Línia 343: | ||
*Actua com a receptor antigènic durant el desenvolupament dels limfòcits B. |
*Actua com a receptor antigènic durant el desenvolupament dels limfòcits B. |
||
=== [[IgA]] === |
|||
[[Fitxer:Immunglobulin_A_as_Dimer.png|thumb|right|205px|Dímer d'IgA.<br />1: Cadenes pesades. <br />2: Cadenes lleugeres.<br />3: Cadena J.<br />4: Peça secretora.]] |
[[Fitxer:Immunglobulin_A_as_Dimer.png|thumb|right|205px|Dímer d'IgA.<br />1: Cadenes pesades. <br />2: Cadenes lleugeres.<br />3: Cadena J.<br />4: Peça secretora.]] |
||
'''Propietats físiques:''' |
'''Propietats físiques:''' |
||
| Línia 343: | Línia 361: | ||
*La forma dimèrica conté la cadena J i el component secretor que li proporciona resistència a les [[proteasa|proteases]]. |
*La forma dimèrica conté la cadena J i el component secretor que li proporciona resistència a les [[proteasa|proteases]]. |
||
=== [[IgE]] === |
|||
'''Propietats físiques:''' |
'''Propietats físiques:''' |
||
*Massa molecular: 188.000 Da. |
*Massa molecular: 188.000 Da. |
||
Revisió del 16:59, 30 juny 2009
|
|
Aquest article o secció s'està elaborant i està inacabat. Un viquipedista hi està treballant i és possible que trobeu defectes de contingut o de forma. Comenteu abans els canvis majors per coordinar-los. Aquest avís és temporal: es pot treure o substituir per {{incomplet}} després d'uns dies d'inactivitat. |
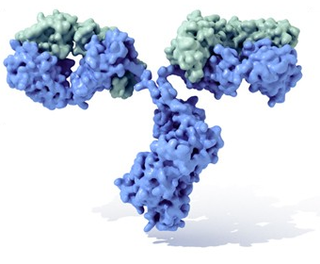
Els anticossos (també coneguts com a immunoglobulines[1]) són glucoproteïnes del tipus gamma globulina. Es poden trobar de forma soluble en la sang o en altres fluïts corporals dels vertebrats, disposant-los d'una forma idèntica que actua com a receptor dels linfòcits B i són usats pel sistema immunitari per identificar i neutralitzar elements estranys tals com:bacteris, virus o paràsits.
L'anticòs típic està constituït per unitats estructurals bàsiques, cada una d'elles amb dos grans cadenes pesades i dos cadenes lleugeres de menor mida, que formen, per exemple, monòmers amb una unitat, dímers amb dos unitats o pentàmers amb cinc unitats. Els anticossos són sintetitzats per un tipus de leucòcits denominats limfòcits B. Existeixen diferents tipus d'anticossos, isotips, basada en la forma de les cadenes pesades que posseeix. Es coneixen cinc tipus diferents d'isotips en els mamífers que desenvolupen funcions diferents, contribuint a dirigir la resposta immunitària adequada per cada diferent tipus de cos estrany que troben.[2]
Tot i que l'estructura general de tots els anticossos són molt similars, una petita regió de l'àpex de la proteïna és extremadament variable, la qual cosa permet l'existència de milions d'anticossos, cada un amb un extrem lleugerament diferent. A aquesta part de la proteïna se la coneix com la regió hipervariable. Cada una d'aquestes variants es pot unir a una "diana" diferent, que és el que es coneix com a antigen.[3] Aquesta enorme diversitat d'anticossos permet al sistema immunitari reconèixer una diversitat igualment elevada d'antígens. La única part de l'antigen reconeixible per l'anticòs es denomina epítet. Aquest epitets s'uneixen amb el seu anticòs en una interacció altament específica que es denomina adaptació induïda, que permet als anticossos identificar i unir-se solament al seu antigen únic en mig dels milions de molècules diferents que componen un organisme.
El reconeixement d'un antigen per un anticòs el marca per ser atacat per altres parts del sistema immunitari. Els anticossos també poden neutralitzar els seus objectius directament, mentre, que per exemple, la unió a una porció d'un patogen necessària per que aquest provoqui una infecció.
L'extensa població d'anticossos i la seva diversitat es genera per combinacions a l'atzar d'un joc de segments genètics que codifiquen diferents llocs de la unió de l'antigen (o paratops), que posteriorment pateixen mutacions al voltant en aquesta zona del gen de l'anticòs, la qual origina una diversitat major.[2][4] Els gens dels anticossos també es reorganitzen en un procés conegut com commutació de classe d'immunoglobulina que canvia la base de la cadena pesada per a una altre, creant un isòtip d'anticossos diferents que mentè la regió variable específica per l'antigen diana. Això possibilita que un sol anticòs pugui ser usat per les diferents parts del sistema immunitari. La producció d'anticossos és la funció principal del sistema immunitari humoral.[5]
Anticossos, immunoglobulines i gammaglobulines

En general, com ja s'ha dit a la introducció, es considera que les anticossos i la immunoglobulina són sinònims, fent referència el primer terme a la funció, mentre que el segon eludeix l'estructura. El terme gammaglobulina es deu a les propietats electroforètiques de les immunoglobulines solubles en suero sanguini, si bé algunes immunoglobulina migren amb les fraccions alfa, beta i fins i tot amb l'albúmina.
Història
El 1890 va començar l'estudi dels anticossos quan Emil Adolf von Behring i Shibasaburo Kitasato van descriure l'activitat dels anticossos contra la diftèria i la toxina tetànica. Behring i Kitasato van proposar la teoria de la immunitat humoral, que establia l'existència d'un mediador en el suero sanguini que podia reaccionar amb un antigen estrany, donant-li el nom d'anticossos.[6][7] La seva idea va portar el 1897 a Paul Ehrlich a proposar la teoria de la cadena lateral de la interacció entre antigen i anticòs i a llençar la hipòtesi que existeixen receptors (descrits amb "cadenes laterals") en la superfície de les cèl·lules que es podrien unir específicament a toxines en una interacció de tipus clau tancada i que aquesta reacciona d'acoblament era el desencadenant de la producció d'anticossos.[8]
El 1904, seguint la idea d'altres investigadors que els anticossos es trobaven lliures en la sang, Almroth Wright va suggerir que els anticossos solubles revestien els bacteris per senyalar-les per a la seva fagocitosi i destrucció en un procés denominat opsonització.[9]
En els anys 1920, Michael Heidelberger i Oswald Avery van descobrir la naturalesa dels postulats anticossos a l'observar que els antígens podien ser precipitats per ells i demostrant que aquests eren un tipus de proteïnes.[10]

A finals dels anys 1930 John Marrack va examinar les propietats bioquímiques de les unitats antigen-anticòs.[11] Després als anys 1940 va tenir lloc un gran avenç, quan Linus Pauling va confirmar la teoria de la clau amb pany proposada per Ehrlich va mostrar que les interaccions entre els anticossos i els antígens depenien més de la seva forma que de la seva composició química.[12] El 1948, Astrid Fagreaus va descobrir que els linfòcits B en la seva forma de plasmòcit eren responsables de la producció d'anticossos.[13]
Els següents treballs d'investigació es van concentrar en la caracterització de l'estructura molecular dels anticossos:
- A principis dels anys 1960 es produeix el principal avenç en aquest sentit, amb el descobriment per Gerald M. Edelman i Joseph Gally de la cadena lleugera,[14] i la comprensió que aquesta era idèntica a la proteïna de Bence Jones descrita el 1845 per Henry Bence Jones.[15] Edelman va continuar amb el descobriment que els anticossos estaven compostes per cadenes lleugeres i pesades unides per enllaços disulfurs.
- Per les mateixes idees, Rodney Porter va caracteritzar les regions d'unió de l'anticòs (Fab) i la cua de l'anticós (Fc) en el tipus IgG.[16] Conjuntament, aquests científics van deduir l'estructura i la seqüència completa del aminoàcids de la IgG, per la qual van rebre 'ex aequo el premi Nobel de fisiologia i medicina el 1972.[16]
- Mentre la majoria d'aquests primers estudis es van fixar en les IgM i IgG, s'identificaren altres isotips d'immunoglobulina en els anys 1960:Thomas Tomasi va descobrir els anticossos secretats (IgA)[17], David Rowe i John Fahey van identificar la IgD[18] i la IgE van ser identificades per Kikishige Ishizaka i Teruki Ishizaka com una classe d'anticossos implicats en reaccions al·lèrgiques.[19]
- El 1975 César Milstein i Georges J. F. Köhler van idear el mètode per la producció d'anticossos monoclonals.[20] El 1976, els estudis genètics van revelar la base de la vasta diversitat dels anticossos al ser identificada la recombinació dels gens d'immunoglobulina per Susumu Tonegawa.[21]
Formes dels anticossos

Els limfòcits B activats es diferencien o bé en plasmòcits, el paper dels quals és la producció d'anticossos solubles, o bé en limfòcits B de memòria, que sobreviuen en l'organisme durant els anys següents per possibilitar que el sistema immunitari reconeixi l'antigen i respongui més ràpidament a futures exposicions a l'agent immune.[22]
Els anticossos són, per tant, uns productors essencials del sistema immunitari adaptatiu que ensenyen i recorden les respostes a patogen invasors. Els anticossos es troben en dos formes: en forma soluble secretada en la sang i altres fluïts del cos i en forma unida a la membrana cel·lular que està anclada a la superfície d'un limfòcit B.
Forme soluble
Els anticossos solubles són secretats per un limfòcit B actiu (en la seva forma de plasmàtica) per unir-se a substàncies estranyes i senyalitzar-les per la seva destrucció per la resta del sistema immunitari. També se'ls pot dir anticossos lliures' (fins que s'uneixen a un antigen i acaben com a una part d'un complex antigen-anticòs o com anticossos secretats. En aquestes formes solubles s'uneixen a les immunoglobulines moleculars addicionals. En la IgM, per exemple, trobem una glucoproteïna unida a la fracció constant mitjançant ponts disulfurs d'uns 15 KD anomenats cadenes J. Al isotip IgA, a més, se li afegeix l'anomenada "peça de secreció", es tracta d'una glucoproteïna que es forma en les cèl·lules epitelials i en les glàndules exocrines, i que posteriorment s'uneix a la immunoglobulina per facilitar la seva secreció.
Forma anclada a membrana
La forma anclada a membrana d'un anticòs es pot anomenar immunoglobulina de superfície (sIg) o immunoglobulina de membrana (mIg), que no se secretat: sempre està associat a la membrana cel·lular. Forma part del receptor de limfòcit B (BCR), que li permet detectar quan un antigen específic està present en l'organisme, desencadenar l'activació del limfòcit B.[23] EL BCR es compon d'anticossos IgD o IgM units a la superfície de la membrana i als seus heterodímers associats a Ig-α i Ig-β que tenen capacitat de produir la transducció de senyal del reconeixement de l'anticòs a la cèl·lula.[24]Un limfòcit B humà típic té entre 50.000 i 100.000 anticossos unit a la superfície.[24] Després de l'acoblament de l'antigen, aquests s'agrupen en grans pedaços on el seu diàmetre pot excedir d'1μm en balses lipídiques que aïllen els BCRs (receptors de la cèl·lula B) de la major part dels restants receptors de senyalització cèl·lular.[24] Aquests pedaços podrien millorar l'eficiència de la resposta immune cel·lular.[25] En els éssers humans, la superfície cel·lular està lliure d'altres proteïnes al voltant dels receptors dels limfòcits B en distàncies d'alguns milers d'àngstroms,[24] el qual redueix de tal manera les influències que competeixen amb la seva funció, que fins i tot aïllen els BCRs.
Isotips, al·lotips i idiotips
| Nombre | Classes | Descripció | Complexos d'anticossos |
| IgA | 2 | Es troba en les mucoses, com el tub digestiu, el tracte digestiu i el tracte urogenital. Impedeix la seva col·lonització per patògens.[26] També es troba a la saliva, les llàgrimes i a la llet. | 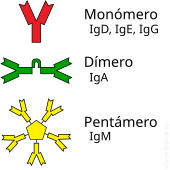
|
| IgD | 1 | La seva funció consisteix principalment en servir de receptor d'antígens en els limfòcits B que no han sigut exposats als antígens.[27] La seva funció està menys definida que en altres isotips. | |
| IgE | 1 | S'uneix a un al·lergogen i desencadenen la alliberació d'histamina dels mastòcits i basòfils i està implicada en l'al·lèrgia. També protegeix contra cucs paràsits.[5] | |
| IgG | 4 | Proporciona, en les seves quatre formes, la major part de la protecció immunitària basada en anticossos contra els patògens invasors.[5] És l'únic anticòs capaç de creuar la placenta per proporcionar el fetus una immunitat passiva. | |
| IgM | 1 | S'expressa en la superfície dels limfòcits B i en forma de secreció amb gran avidesa per la seva diana. Elimina els patògens en els estadis immediats de la resposta immunitària mitjançada pels limfòcits B (humoral) fins que existeixen suficients IgGs.[5][27] |
Els anticossos poden presentar-se en diferents varietats conegudes com a isotips o classes. En els mamífers existeixen cinc isotips d'anticossos coneguts com: IgA, IgD, IgE, IgG i IgM. S'anomenen mitjançant el prefix "Ig" que significa immunoglobulina i difereixen en les seves propietats biològiques, localitzacions funcionals i capacitat per reconèixer diferents tipus d'antígens com es mostra a la taula.[28]
Isotips
L'isotips canvia durant el desenvolupament i l'activació dels limfòcits B, abans de la seva maduració, quan encara no s'han exposat al seu antigen, es coneixen com a limfòcits B verges i només expressen l'isotips IgM en la seva forma anclada a la superfície cel·lular. Els limfòcits comencen a expressar tant IgM com IgD quan arriben a la maduració i en aquest moment estan llestos per respondre als seus antígens.[29] L'activació dels limfòcits B segueix a la trobada i unió d'aquest amb el seu antigen, el que estimula la cèl·lula per què es divideixi i es diferencii en una cèl·lula productora d'anticossos denominada cèl·lula plasmàtica. En aquesta forma activada, els limfòcits B comencen a secretar anticossos en lloc d'anclar-los a la membrana. Algunes cèl·lules filles dels limfòcits B activats pateixen un canvi isotòpic, un mecanisme que provoca que la producció d'anticossos en les formes IgM o IgD es transmuti als altres tipus, IgE, IgA o IgG, que desenvolupen diferents papers en el sistema immunitari.
Al·lotips
S'entén per al·lotip les petites diferències en la seqüència d'aminoàcids en la regió constant de les cadenes lleugeres i pesades dels anticossos produïts pels diferents individus d'una espècies.
En humans s'han descrit 3 tipus de determinants al·lotípics:
- El 1956 Grubb i Laurell van descriure el sistema Gm en la classe d'immunoglobulines IgG. Aquest sistema va posar de manifest els diversos al·lotips de les cadenes pesades. També permeten diferenciar quatre subclasses en aquestes molècules:IgG1, IgG2, IgG3 i IgG4 i són determinades genèticament.[30]
- Claude Ropartz i col·laboradors seus el 1961 van descobrir el sistema Km (anomenat al principi Inv), localitzat en la cadena lleugera Kappa. Aquest al·lotip està present en totes les classes d'immunoglobulines.
- També existeix el sistema ISf, situat en la cadena pesada γ1 de la IgG1. L'expressió d'aquesta especificitat augmentada amb l'edat, sent d'un 25% dels subjectes abans dels 20 anys fins un 60% després dels 70 anys en els caucàsics.
- Els al·lotips defensats pel sistema Am se situa en les IgA, i més precisament en les cadenes α2. Existeixen dos isotips, α1 i α2, que caracteritzen les subclasses Am1 i Am2 de les IgA.
Idiotip
El idiotip és l'epítet propi d'una molècula pretenent a un clon en particular. Aquest element forma part o està molt pròxim al lloc de reconeixement de l'antigen, i està situat en la porció variable Fab. En altres paraules, és el paratop, o la regió propera d'una immunoglobulina pot ser reconegut amb un epitep per certs limfòcits. Segons la Teoria de Jerne, la formació d'anticossos antiidiotip formaria una xarxa (xarxa de Jerne) on la seva funció seria la regulació de la síntesi de noves immunoglobulines.
Estructura
Els anticossos són proteïnes plasmàtiques globulars pesades (~150kDa), també coneguts com a immunoglobulines. Tenen cadenes de sucres unides a alguns del seus residus aminoàcids.[31] En altres paraules, els anticossos són glucoproteïnes. La unitat bàsica funcional de cada anticossos és el monòmer d'immunoglobulina, que conté una sola unitat de Ig. Els anticossos secretats també poden ser dímers amb dos unitats Ig, en el cas de les IgA, tetramèrics, amb quatre unitats Ig, en el cas de les IgM de teleosteics, o pentamèrics amb cinc unitats de IgM, com en el cas de les IgM dels mamífers.[32]

Primers treballs
Els primeres investigacions sobre l'estructura dels anticossos van ser realitzats mitjançant senzilles digestions amb pepsina i papaïna per Rodney Robert Porter i Gerald M. Edelman, seguides d'electroforesi. Ambdós van rebre el Premi Nobel de medicina el 1972. També va ser important la figura d'Alfred Nisonoff:
- En els anys 1950, Porter va procedir a fer una digestió suau amb papaïna, obtenint tres fragments, dos dels quals retenien l'especificitat de l'antigen (Fab), mentre que el tercer no mostrava activitat d'unió, mentre que es podia cristal·litzar (Fc).
- El 1959, Edelman, utilitzant 2-mercaptoetanol urea, seguint d'electroforesi, va aconseguir aïllar les cadenes lleugeres i pesades, al dissociar les seves enllaços disulfurs i no covalents.
- En aquell mateix any, Porter va identificar els components de les cadenes llegueres i pesades que es trobaven en els seus fragments de papaïna i pepsina, i d'aquesta manera va aconseguir els seus pesos moleculars.
- El 1960, Nisonoff va demostrar que la digestió amb pepsina d'IgG produida un fragment bivalent, que en realitat està format per altres dos i el va denominar F (ab')2 .[34]
Dominis de la immunoglobulina
El monòmer d'Ig és una molècula en forma d' "Y" que consta de dues cadenes de polipèptids; dos cadenes pesades idèntiques i dos cadenes lleugeres idèntiques connectades per enllaços disulfurs.[28] Cada cadena es compon de dominis estructurals anomenats dominis Ig. Aquests dominis contenen entre 70 i 110 aminoàcids i es classifiquen en diferents categories, per exemple en variables (IgV) i constants (IgC) d'acord amb la seva mida i funció.[35] Té un "plec immunoglobulina" característiques en la qual dos làmines beta generen una forma d'"entrapà", permanent juntes per interaccions entre cisteïnes ben conservades al llarg de l'evolució, així com altres aminoàcids carregats.
Cadena pesada
Hi ha cinc tipus d'Ig en els mamífers que es nombren per lletres greges:α, δ, ε, γ y μ.[3] El tipus de cadena pesada present defineix la classe de l'anticòs. Aquestes cadenes es troben en els anticossos IgA, IgD, IgE, IgG i IgM respectivament. Les diferents cadenes pesades es diferencien en la mida i en la composició:α i γ contenen aproximadament 450 aminoàcids, mentre que μ i ε posseeixen aproximadament 550 aminoàcids.[3]

2. Regió Fc
3. Cadena pesada amb un domini constant (CH1), una regió bisagra, i dues més constants, els dominis (CH2 y CH3).
4. cadena lleugera amb un domini variable (VL) i una constant (CL)
5. LLoc d'unió a l'antigen (paratop)
6. Regions bisagra.
Les cadenes pesades γ, α i δ tenen una regió constant composta de tres dominis estructurals Ig en tàndem i una regió bisagra per proporcionar-li flexibilitat.[28] Les cadenes pesades μ i ε tenen una regió constant composta per quatre dominis immunoglobulinics.[3] La regió variable de la cadena pesada difereix pel mateix limfòcit B o per la seva línia clonal. La regió variable de cada cadena pesada és d'aproximadament 110 aminoàcids i està compost per un únic domini Ig.
Recentment s'ha pogut determinar la topologia in vitro del gen de la cadena pesada, Igh, sent aquest un dels primers estudis en aquest camp. El resultat és que la cromatina es disposa formant girs successius units per "linkers", donant lloc a formes similars a una flor. La posició relativa dels diferents segments varien dràsticament al llarg del desenvolupament del limfòcit B, permetent així un major rang d'interaccions genòmiques.[36]
Cadena lleugera
En els mamífers hi ha dos tipus de cadenes lleugeres, anomenades lambda (λ) i kappa (κ).[3] Una cadena lleugera conté dos dominis successius: un domini constant i un domini variable. La longitud aproximada de la cadena lleugera és d'entre 211 a 217 aminoàcids.[3] Cada anticòs conté dos cadenes lleugeres que són sempre idèntiques. Només un tipus de cadena lleugera, κ o λ, està present dins del mateix anticòs en els mamífers. Altres tipus de cadenes lleugeres com la cadena iota (ι), es troben en els vertebrats inferiors com en els condrictis i en els telesoteis.
Regions Fab i Fc
Algunes parts de l'anticòs tenen funcions úniques. Els extrems de la "Y", per exemple, contenen el lloc que s'uneix a l'antigen i per tant, reconeixen elements estranys específics. Aquesta regió de l'anticòs es diu Fragment d'unió a l'antigen o regió Fab. Està compost d'un domini constant i un altre variable de cada una de les cadenes (lleugera i pesada) de l'anticòs.[37] El paratop està conformat pels dominis variables de la cadena pesada i lleugera en l'extrem amino terminal del monòmers de l'anticòs. El paper que desenvolupa la bade de la "Y" consisteix en modular l'activitat de la cèl·lula immunitària. Aquesta regió es diu Fragment cristal·litzable o Fc i està composta per dos o tres dominis constant d'ambdues cadenes pesades, depenent de la classe de l'anticòs.[3] Mitjançant la unió a proteïnes específiques la regió Fc s'assegura que cada anticòs genera una resposta immune apropiada per un antigen donat.[38] La regió Fc també s'uneix a diversos receptors cel·lulars com el receptor del Fc i altres molècules del sistema immunitari com les proteïnes del complement. Al efectuar-ho, es donen diferents efectes fisiològics inclús la opsonització, lisis cel·lular i desgranulació de les mastòcits, basòfils i eosinòfils.[39]
Funció
Donat que els anticossos es donen de forma lliure en el torrent sanguini, es diu que són part del sistema immunitari humoral. Els anticossos circulants són produïts per línies clonals dels limfòcits B que responen específicament a un antigen que pot ser un fragment de proteïna de la càpsida viral, per exemple. Els anticossos contribueixen a la immunitat de tres maneres diferents: poden impedir que els agents patògens entrin a les cèl·lules o les malmetin alhora d'unir-se a elles. Poden estimular l'eliminació d'un patogen pels macròfags i altres cèl·lules revistin al patogen i poden desencadenar la destrucció (lisi) directa del patogen estimulant altres respostes immunes com la via del complement.[40]
Activació del complement
Els anticossos que es poden unir a la superfície dels antígens, per exemple, en un bacteri, atrauen els primers components de la cascada del complement mitjançant la seva regió Fc i iniciant l'activació del sistema "clàssic" del complement.[40] Això acaba amb la mort del bacteri de dues maneres:[5] Primer, la unió de les molècules del complement amb l'anticòs marca al microorganisme per la posterior ingestió pels fagòcits en un procés anomenat opsonització. Aquests fagòcits són atrets per certes molècules del complement. En segon lloc, alguns components dels sistema del complement formen un complex d'atac a la membrana per ajudar als anticossos a matar el bacteri mitjançant la lisi.[41]
Activació de cèl·lules efectores
Per combatre als agents patògens que es repliquen a l'exterior de les cèl·lules, els anticossos s'uneixen als patògens per embassar-los junts provocant el seu aglutinament. Donat que un anticòs té al menys dos paratops es poden unir a més d'un antigen acoblant-se als epítops idèntics portadors en les superfícies d'aquests antígens. Revestint al patogen, els anticossos estimulen les funcions efectores contra aquesta en les cèl·lules que reconeixen la regió Fc.[5]
Aquelles cèl·lules que reconeixen els agents patògens revestits tenen receptors del Fc que, com el seu nom indica, interactuen amb la regió Fc dels anticossos IgA, IgG i IgE. L'acoblament d'un anticòs particular amb el receptor Fc d'una determinada cèl·lula desencadena en ella una funció efectora: els fagòcits realitzaran la fagocitosi, les cèl·lules cebades alliberen citoquines i molècules citotòxiques que finalment acabaran amb la destrucció del microbi invasor. Els receptor Fc són específics de l'isotip, el que dóna una major flexibilitat al sistema immunitari, afectant només el mecanisme immune adequat pels diferents patògens.[3]

Diversitats de les immunoglobulines
Pràcticament tots els microorganismes poden desencadenar la resposta dels anticossos. El reconeixement i la eradicació amb èxit de tipus molt diferents d'aquests últims requereixen que els anticossos posseeixen una enorme diversitat. La seva composició d'aminoàcids varia per permetre'ls interactuar amb antígens molt diferents.[42] S'ha estimat que els éssers humans generen uns 10 mil milions d'anticossos diferents, cada uno d'ells capaç d'unir-se a un epítop diferent.[43] Tot i que generen un enorme repertori de diferents anticossos d'un mateix individu, el número de gens disponibles per fabricar aquestes proteïnes és limitat. En els vertebrats han evolucionat diferents mecanismes genètics complexos per permetre que els limfòcits B generin aquesta diversitat a partir d'un número relativament petit de gens d'anticossos.[44]
Varietat de dominis

La regió (locus) del cromosoma que codifica un anticòs és gran i conté diversos gens diferents per cada domini del anticòs - el locus que conté els gens per les cadenes pesades (IGH@) es troben en humans en el cromosoma 14 i els loci que contenen els gens lambda i kappa de la cadena lleugera (IGL@) i IGK@) es troben en els cromosomes 22 i 2. Un d'aquests dominis es conegut com "domini variable", que està present en totes les cadenes lleugeres i pesades dels anticossos, però poden ser diferents entre els diferents anticossos generats per les variades línies dels limfòcits B. Les diferències entre els dominis variables es localitzen en tres bucles conegudes com regions hipervariables (HV-1, HV-2 i HV-3) o regions determinants de la complementarietat (CDR1, CDR2 i CDR3). Les CDRs es mantenen entre els dominis variables per regions del marc conservat. El locus de la cadena pesada conté uns 65 gens de domini variable diferents, que difereixen en els seus CDRs. Combinant aquests gens amb diversos gens d'altres dominis es genera un gran contingent d'anticossos amb un alt grau de variabilitat. A aquesta combinació se la denomina "recombinació V (D) J", que s'explica més endavant.[45]
Recombinació V (D) J

La recombinació somàtica de les immunoglobulines, coneguda també com Recombinació V (D) J, consisteix en la generació d'una regió variable d'immunoglobulina exclusiva. La regió variable de cada immunoglobulina pesada està codificada per diverses parts, que es coneixen com segments. Aquests són coneguts com segment variables (V), diversos (D) i d'acoblament (J).[44] Els segments V, D i J es troben en les cadenes pesades. En les lleugeres només es troben els segments V i J. Hi ha múltiples copies de tots aquests segments organitzats en tàndem en el genoma dels mamífers. En la medul·la òssia cada limfòcit B en desenvolupament ensamble la regió variable de la seva immunoglobulina seleccionant i combinant a l'atzar un segment V amb un D i un altre J (o bé un V i un altre J en les cadena lleugera). Donat que existeixen múltiples copies lleugerament diferents per cada seqüència genètica dels segments, es donaria diferents combinacions que mitjançant aquest procés generen un elevat número de paratops i també diferents especificitats de l'antigen.[2]
Després de la producció d'una immunoglobulina funcional per un limfòcit B durant la recombinació V (D) J no es pot expressar cap regió variable diferent (a aquests procés se'l coneix com exclusió al·lèlica). Així doncs, cada limfòcit B només pot produir anticossos que continguin un sol tipus de cadena variable.[46][3]
Hipermutació somàtica i maduració de l'afinitat
Un altre mecanisme que genera diversitat en els anticossos tenen lloc en els limfòcits B madurs. Després de l'activació per antígens, els limfòcits B comencen a proliferar ràpidament. En aquestes cèl·lules de ràpida divisió, els seus gens que codifiquen els dominis variables de les cadenes pesades i lleugeres pateixen una gran taxa de mutacions puntuals mitjançant un procés anomenat hipermutació somàtica (SHM). Aquesta produeix aproximadament el canvi d'un nucleòtid per un gen variable.[4] Com a conseqüència, qualsevol cèl·lula filla d'una línia de limfòcits B adquireix una lleugera diferència en la seqüència d'aminoàcids dels dominis variables de les seves cadenes d'anticossos.
La hipermutació somàtica serveix per incrementar la diversitat del reservori d'anticossos i influir en l'afinitat d'unió entre l'antigen i l'anticòs.[47] Algunes mutacions puntuals acaben per produir anticossos que tenen interaccions més dèbils (sota afinitat) amb el seu antigen que l'anticòs original, mentre que altres generen anticossos amb una interacció més forta (alt afinitat).[48]
Els limfòcits B que expressen anticossos d'elevada afinitat en la seva superfície reben una forta senyal per que sobrevisquin durant les interaccions amb altres cèl·lules, metre que les que expressen anticossos de baixa afinitat moriran per apoptosi.[48]
Així doncs, els limfòcits B que expressen anticossos amb una afinitat més elevada pel seu antigen competiran amb avantatge contra aquells de menor afinitat en la seva funció i supervivència. El procés de generació d'anticossos amb afinitat augmentada progressivament es diu maduració de l'afinitat. La maduració de l'afinitat té lloc en els limfòcits B madurs després de la recombinació V (D) J i és dependent del suport que rebrà dels limfòcits T col·laboradors.[49]

Canvi de classe
La commutació de la classe de la immunoglobulina és un procés biològic que té lloc després de l'activació dels limfòcits B, la qual cosa li permet la producció de diferents classes d'anticossos (IgA, IgE, o IgG).[2] Aquestes classes estan definides per les regions constants (C) de la cadena pesada de la immunoglobulina. Inicialment els limfòcits B verges expressen només IgM i IgD de superfície amb regions d'unió a l'anticòs idèntic.
Cada isotip està adaptat per una funció diferent i per tant, després de l'activació, es necessita un anticòs amb un efector IgG, IgA o IgE per l'eliminació eficaç de l'antigen. La commutació de classe permet a la progenie d'un sol limfòcit B produir anticossos de diferents isotips. Només la regió constant de la cadena pesada de l'anticòs canvia durant la commutació de classe. Les regions variables, i per tant l'especificitat de l'antigen, perdura invariable. D'aquesta manera es produeixen efectors amb la funció adequada per cada amenaça de l'antigen. La commutació de classe es iniciada per les citoquines. L'isotip generat depèn que les citoquines estiguin presents en l'entorn del limfòcit B.[50]
El procés té lloc en un gen de la cadena pesada per un mecanisme conegut com a recombinació de commutació de classe ("class switch recombination" o CSR).Aquest mecanisme es basa en seqüències de nucleòtids conservades, anomenades regions de commutació (Regions switch o S), que es troben en un punt de la seqüència de l'ADN anterior als gens de la regió constant (excepte en la cadena δ). L'hebra d'ADN s'escindeix per l'activitat de certs enzims en dos regions S concretes.[51][52] L'exó del domini variable es torna a empalmar mitjançant un procés anomenat unió d'extrems no homòlegs ("non-homologous end joining" o NHEJ) a la regió constant elegida (γ, α o ε). Aquests procés conclou formant un gen d'immunoglobulina que codifica un anticòs d'un isotip diferent.[53]
Conversió genètica
La conversió genètica és un intercanvi no recíproc, en la qual la seqüència donada no es modifica, mentre que el gen acceptor adquireix un segment del donant per recombinació homòloga. Tot i que aquest mecanisme per generar diversitat en els anticossos es coneixia, no se li havia donat la suficient rellevància fins ara. Se sap que és molt important en aus, les quals usen en les seves cadenes lleugeres i pesades un gran nombre de pseudògens similars a les seqüències D, situades al principi de la seqüència del gen de les cadenes d'immunoglobulina. Posteriorment, aquests segments canvien somàticament la única regió V, poden també estar sotmeses a hipermutació.[54] Aquest mecanisme, curiosament, també està present en alguns mamífers, com els conills.[55]
Fases finals de la síntesi d'immunoglobulines
Un cop reagrupats tots els segments, es produeix un sol ARNm, que es poliadenila. Aquest ARN abandona el nucli, dirigint-se als ribosomes del reticle endoplasmàtic rugós, on comença la seva traducció. Posteriorment es produeix la glicosilació dels mateixos en la part luminal del RER i l'assemblatge, aquest procés és el següent: H+H → H2+L → H2L2. Constitueix una excepció la IgM, unint-se primer una cadena pesada amb una lleugera. El seu destí final, com receptor o bé ser secretada, depèn si posseeix o no un fragment afegit de 19 aminoàcids en la zona N-terminal. Aquest pèptid s'incorpora a la síntesi mitjançant un procés d'splicing. La seva presencia determina una regió hidrofòbica capaç d'anclar-se a la membrana cel·lular.
Evolució de les immunoglobulines
El desenvolupament d'organismes complexos, amb teixits i diverses línies cel·lulars necessàries pel desenvolupament de noves molècules per assegurar, per una banda, que les cèl·lules s'adhereixen a altres de la mateixa colònia i per una altre, per la defensa enfront a possibles intrusos patògens. Tres tipus de molècules, les lectines, les LLR's i les immunoglobulines, han estat utilitzades al llarg de l'evolució en el desenvolupament de sistemes immunitaris. Els seus patrons operatius es mesclen en ocasions per combinar les seves propietat, tot i que existeixen poques molècules que contenen els tres, com és el cas del gen de la malaltia poliquística renal (PKD1).[56]
Molts estudis aporten proves important que la superfamília de les immunoglobulines tenen representant entre els bacteris i els arqueobacteris o que al menys les presents en aquest grup i les eucariotes podrien tenir un avantpassat en comú, des del qual evolucionaren de forma divergent. Així, s'han atribuït a aquest grup de proteïnes "similars a l'immunoglobulina" bacterianes (Big's) al receptor de la Fc de Ig en Streptococcus agalactiae, i la endoglucanasa C de Cellumonas fimi.[57] També existeixen altres exemples com la invasina de Yersinia pseudotuberculosi o les Lig (Leptospiral Ig-like) de diverses espècies de leptospira.[58][59] Després del descobriment de l'Streptococcus es va descobrir una proteïna en el fag T4. En aquesta ocasió es va destacar que el seu paper estava relacionat amb l'adhesivitat cel·lular.[60]
Les proteïnes amb dominis Ig són comunes en eucariotes unicel·lulars, i fins a cert punt la seva estructura és una característica conservadora.[61] Un exemple d'ell seria les alfa aglutinines en Saccharomyces cerevisiae. Es tracta de molècules que medeixen l'adhesió cel·lular i que guarden grans homologies amb els grups CD2 - CD4 en humans, el seu paper és en part similar, intervenint en aquest últim cas l'adhesió dels limfòcits T amb les cel·lules presentadores d'antígens i les cèl·lules diana.[62]

Animals pluricel·lulars
No obstant això, és en els grups d'animals pluricel·lulars més primitius, els parazoa, on els científics intenten trobar respostes a l'origen del sistema immunitari adaptatiu.[64]
En aquest sentit, s'han dirigit diversos treballs d'investigació cap aquest grup, i en especial cap a les esponges considerades com a fòssils vivents, Geodia cydonium i també Suberites domuncula. En aquest primer es troben molts dels tipus de proteïnes que també estan implicades en la immunitat dels mamífers. En especial, hi ha dos tipus de la superfamília de les immunoglobulines diferents, les unitats a receptors tirosin kinasa, i les molècules no enzimàtiques d'adhesió de les esponges. Curiosament, els dominis corresponents ja demostren polimorfisme, i encara més, tot i complir papers que són simultàniament de receptors i de molècules d'adherència cel·lular, se sobreregulen en experiments de trasplantament. [65]
En definitiva, la superfamília de les immunoglobulines intervé en el sorgiment de la multicel·lularitat al mantenir la integritat estructural dels organismes distingint del propi de l'aliè. Això és degut a que gràcies a les seves capacitats de generar mòduls, d'unir-se específicament a altres proteïnes i de formar bastons, així com d'oligomeritzar-se i de generar diversitat per splicing alternatiu a partir de material genètic limitat, es converteixen en ideals per mitjançar l'adherència cel·lular i com a receptors de superfície de membrana. [66][67]
En la busqueda de precedents del sistema immunològic adaptatiu, trobem diversos exemples de proteïnes de la superfamília de les Ig en protòstoms que compleixen un paper en la defensa immunitària, com l'hemolina en les cucs de seda, o la proteïna Dscam en la Drosophila melanogaster, així com proteïnes relacionades amb el fibrinogen amb dominis Ig (FREPs) en els gasteròpodes. Algunes d'aquestes proteïnes, que representen una barrera de tipus innat, poden tenir isofromes solubles i ancorades a la membrana i generar diversitat per splicing alternatiu i en zones de la molècula diferents a les cadenes variables de vertebrats.[68]
Deuteròstoms
Molts dels elements del sistema immunitari adaptatiu, incloses les cèl·lules especialitzades, estan ja preconfigurades en els organismes més basals dels deuteròstoms. S'han realitzat treballs en l'eriçó de mar (Strongylocentrotus purpuratus), trobant un ric sistema immunològic amb homòlegs d'importants reguladors immunitaris i hematopoètics de vertebrats, alguns d'ells crítics. S'especula per això que la pressió evolutiva clau per al desenvolupament del complex sistema immunològic en deuteròstoms no va ser tant l'amenaça de patògens com l'existència d'una rica varietat d'organismes simbiotics, circumstància que els propis éssers humans posem en evidència en la nostra flora intestinal.[69] Com a il·lustració d'aquest punt, s'ha vist que el 60% de les espècies d'equinoderms s'associen amb bacteris per simbiosi.[70] En tunicats continua l'augment de la complexitat del sistema immune. A la ascídies Botryllus schlosseri, durant experiments d'empelts no compatibles, es van detectar moltes proteïnes que revelen un complex sistema immunitari innat i algunes proteïnes amb domini immunoglobulina.[71][72] I el que resulta més sorprenent, també es pot trobar un homòleg convincents d'RAG1, contigu a una estructura similar a RAG2.[73] Tanmateix, és en cefalocordats on trobem les primeres empremtes de les nostres actuals immunoglobulines. S'han realitzat múltiples estudis en el amfiox Branchiostoma floridae, trobant unes curioses proteïnes, anomenades VCBP (per Proteïnes tipus V que contenen dominis que s'uneixen a quitina) amb grans homologies amb les regions V (variables) de les immunoglobulines, certament implicades en la resposta immunitària, però mancats de la seva variabilitat. Estudis cristal·logràfics han demostrat que probablement es tracta d'una molècula semblant al ancestre de les actuals regions variables de vertebrats.[74][75][76]
En els actuals àgnats es donen algun dels trets que identifiquen un modern sistema immunitari adaptatiu, mentre que altres estan absents. D'una banda, hi ha cèl·lules que ja contenen gran part de la maquinària molecular dels limfòcits. Això suggereix una evolució d'aquest tipus cel·lular en els vertebrats més basals, i possiblement en un protocordat. Hi ha diverses proteïnes Ig amb dominis semblants a V, que fins i tot contenen regions V i J, encara que estan codificats en un únic exó i no és reorganitzar. Tanmateix, no tenen un sistema immunitari com el dels vertebrats, basat en els clàssics anticossos solubles, receptors de membrana, reorganització i empalmament per RAG. En comptes d'això, aquesta funció és assumida per una sèrie de proteïnes riques en repeticions de leucina, que fins i tot poden patir una complexa Recombinació, a resultes de la qual s'obté una variabilitat equiparable a la dels anticossos (1014). Això constitueix un extraordinari exemple d'evolució paral·lela.[77]
Gnatostomats
Tots els autors revisats en aquest article coincideixen que l'emergència del modern sistema immunitari va haver de succeir fa 500 milions d'anys, durant l'explosió cambriana. Probablement ho farien dins d'un context en el qual hi hauria moltes formes i combinacions de mòduls de proteïnes de les que moltes desapareixerien per les pressions selectives. En aquest sentit, una de les qüestions que suscita l'apartat anterior és que si l'evidència paleontològica indica que els peixos mandibulars actuals procedeixen dels àgnats, i aquests manquen del mateix sistema recombinació dels moderns sistemes immunitaris. Segurament degué existir un avantpassat comú, un ostracodermi ancestral que fos propietari d'ambdós sistemes. D'acord amb aquest punt de vista, el sistema de recombinació V (D) J probablement representa un desenvolupament evolutiu convergent en una branca dels ostracodermis que va precedir la línia dels gnatòstomos.[78]
Pel que fa a les classes de les immunoglobulines, en peixos trobem anàlegs a la classe IgM, així com la IgD, identificada en moltes espècies de teleostis;[79] També hi ha moltes exclusives, com les que contenen les cadenes pesades ζ i τ. Possiblement són isotipus anteriors a la IgM en l'evolució.[80][81] En el cas dels condrictis també trobem isotipus exclusius, a més de IgM. Es tracta de les IGW (IgX o IgNARC) i les IgNAR.[82]
El tipus IgG sorgeix en amfibis i continua en rèptils, mentre que el tipus IgA aparentment sorgeix en un avantpassat comú entre aus i mamífers. El tipus IgE sembla ser exclusiu de mamífers.
Aplicacions mèdiques
Diagnòstic de malalties
En molts diagnòstics és comú la detecció d'anticossos com a prova per la confirmació de la patologia. Per a això es realitza una prova serològica.[83] Com per exemple: en assaigs bioquímics per al diagnòstic de malalties, s'estima la títol d'anticossos contra el virus d'Epstein-Barr o contra la malaltia de Lyme.[84] Si no es troben aquests anticossos significa que la persona no està infectada o que ho va estar fa molt de temps i els limfòcits B que generaven aquests anticossos s'han reduït de forma natural.
A la immunologia clínica es valora per nefelometria (o turbidimetría) els nivells de les diferents classes d'immunoglobulines per caracteritzar el perfil d'anticossos del pacient.[85] Per exemple, una observació en elevació del títol de les diferents classes de immunoglobulina pot ser útil en ocasions per determinar la causa del dany hepàtic mitjançant un diagnòstic diferencial. En aquest sentit, un títol elevat de IgA indicaria cirrosi alcohòlica; si el que està elevat són les IgM es sospita d'hepatitis viral i cirrosi biliar primària, mentre que la IgG està elevada en hepatitis vírica, autoimmune i cirrosi.
Les malalties autoimmunitàries es poden diagnosticar per anticossos que s'uneixen a epítops del propi organisme; molts d'ells es poden detectar mitjançant l'anàlisi de sang. Un exemple seria el cas dels anticossos dirigits contra els antígens de superfície de eritròcits en l'anèmia hemolítica controlada pel sistema immunitari, que es detecten mitjançant la prova de Coombs.[86] Aquesta prova també s'utilitza per rastrejar anticossos en la preparació de transfusions de sang i també en les dones en el període prenatal.[86]
A la pràctica existeixen molts mètodes immunodiagnòstics basats en la detecció de complexos antigen-anticòs que s'utilitzen en el diagnòstic de malalties infeccioses, per exemple l'ELISA, la immunofluorescència, el Western blot, la immunodifusió i la immunoelectroforesi.
Tractaments terapèutics
La teràpia d'anticossos monoclonals s'empra en el tractament de malalties com l'artritis reumatoide,[87] esclerosi múltiple,[88] psoriasi, [89] i moltes formes de càncer, incloent el limfoma no Hodgkin,[90] càncer col·lorectal, càncer de cap i coll i càncer de mama.[91] Algunes immunodeficiències, com la agammaglobulinemia lligada al cromosoma X i la hipogammaglobulinemia consisteixen en una manca parcial o completa d'anticossos..[92] Aquestes malalties es tracten a vegades induint una immunitat a curt termini anomenada immunitat passiva. Aquesta s'adquireix a través de la infusió d'anticossos "prefabricats" en forma de sèrum humà o animal, immunoglobulina intravenosa o anticossos monoclonals en l'individu afectat.[93]
Teràpia prenatal
Les trucades Rho (D) Inmunoglobulines o inmunoglobulilas anti-RhD són específiques de l'antigen humà Rhesus D també conegut com a factor Rhesus.[94] D'aquests anticossos anti-RhD es coneixen diverses marques comercials, com RhoGAM, BayRHo-D, Gamulin Rh, HypRho-D, i WinRho SDF. El factor Rhesus és un antigen que es troba en els eritròcits. Els individus Rhesus-positiu (Rh +) exhibeixen aquest anticòs en el glicocàlix dels seus eritròcits, mentre que els individus (Rh-) manquen d'ell. Durant un naixement normal, la sang fetal pot passar a la mare per traumatismes en el part o complicacions de l'embaràs. En el cas d'incompatibilitat Rh entre la mare i el fill, la consegüent barreja de sangs pot sensibilitzar una mare Rh-contra l'antigen Rh del fill, el que fa que en els següents embarassos corrin risc d'eritroblastosi fetal.[95] Els Anti-RhD s'administren com a part del tractament prenatal per prevenir la sensibilització que pogués tenir lloc per evitar-ho. Al tractar a la mare amb anticossos anti-RhD abans i immediatament després del part destrueix l'antigen Rh del fetus en el cos de la mare. Un tema important és que això succeeix abans que el antigen pugui estimular els limfòcits B materns que més tard podrien "recordar" a l'antigen Rh generant limfòcits B amb memòria. Per tant, el seu sistema humoral immunitari no fabricarà anticossos anti-Rh i no atacarà els antígens Rhesus del seu nadó actual o futur.[94]
Aplicacions en la investigacions científiques

En recerca, els anticossos purificats s'utilitzen en moltes aplicacions. Són molt habituals per a identificar i localitzar proteïnes intra i extracel·lulars. Els anticossos s'usen en la citomètria de fluxe per diferenciar els tipus cel·lulars per les proteïnes que expressen; dels diferents tipus cel·lulars expressen també diferents combinacions de molècules del cúmul de diferenciació (CD) a la seva superfície i produeixen diferents proteïnes intracel·lulars, extracel·lulars i excretes.[96] També s'usen en Immunoprecipitació per separar les proteïnes i qualsevol cosa que estigui lligada a elles (co-Immunoprecipitació) d'altres molècules en un lisat de cèl·lules,[97] en anàlisi Western blot per identificar proteïnes separades per electroforesi,[98] i en immunohistoquímica o immunofluorescència per examinar l'expressió de proteïnes en seccions de teixits o localitzar proteïnes a l'interior de les cèl·lules amb l'auxili d'un microscopi.[99][96] Les proteïnes també es poden detectar i quantificar amb anticossos, utilitzant tècniques ELISA i ELISPOT.[100][101]
Variants d'anticossos en medicina i investigació
En ocasions es necessita produir anticossos específics. Injectant un antigen en un mamífer, com un ratolí, una rata o un conill si es requereix poca quantitat; una cabra, una ovella o un cavall si es requereixen grans quantitats. La sang aïllada d'aquests animals conté anticossos policlonals -múltiples anticossos que s'uneixen al mateix antigen- en el sèrum sanguini, al qual es denomina antisèrum. També es poden injectar antígens en el rovell d'ou de gallina per produir.[102] Tanmateix, per a aplicacions analítiques és necessària una major especificitat, sobretot si es tracta de detectar molècules molt petites, així com quan s'usen en aplicacions terapèutiques en les que es vol bloquejar o detectar marcadors molt específics. Per això la tecnologia dels anticossos ha generat algunes variants, entre les quals es destaquen:
- Anticossos monoclonals
Si es desitja obtenir anticossos específics per a un únic epítop d'un antigen, s'aïllen limfòcits secretores d'anticossos d'un animal i es immortalitzen amb fusions amb una línia cel·lular cancerosa. Les cèl·lules fusionades es denominen hibridomes i continuaran creixent i secretant anticossos en el cultiu. S'aïllen les cèl·lules d'hibridoma individuals mitjançant clonat per dilució per generar clons que produeixin tots el mateix anticòs. A aquests anticossos se'ls anomena anticossos monoclonals.[103]
Els anticossos mono i policlonals generats es poden purificar utilitzant proteïna A/G o cromatografia d'afinitat a l'antigen.[104]
- Anticossos de cadena senzilla
És possible generar artificialment un anticòs que compti només amb les regions variables de la cadena lleugera i pesada, unides per un petit pèptid o un sol aminoàcid. En aquest cas es tindran anticossos de cadena senzilla o scFv's. Actualment s'apliquen en tècniques com la citomètria de fluxe o la immunohistoquímica.[105]
- Abzimes
La majoria dels anticossos es diferencien d'altres proteïnes per no presentar catàlisi enzimàtica en la seva funció, pel que tradicionalment es consideren proteïnes de reconeixement de superfícies moleculars. Tanmateix, en la dècada dels anys 90 del segle XX i a principis del segle XXI diversos estudis d'immunologia van trobar anticossos amb propietats catalítiques. Aquests anticossos han rebut el nom de abzimes. És possible trobar en quantitats baixes en el sèrum de persones sanes. Un exemple de l'existència de les abzimes en el cos humà va ser la detecció de abzimes contra ADN en la llet materna.[106] Entre algunes d'aquestes activitats catalítiques detectades estan les de peptidasas inespecífiques i amilolítiques (degradació de midó). D'altra banda s'ha observat un increment en el nivell de abzimes en malalties de tipus autoimmunitàries. Tanmateix, normalment es fabriquen de forma artificial generant anticossos contra el compost intermediari d'una reacció per la que es vol crear un enzim. En algunes ocasions podrien tenir aplicacions terapèutiques i industrials.[107][108]
- Nanoanticossos
Hi ha propostes per a la utilització terapèutica d'anticossos monoclonals del camèlid, també anomenats nanoanticossos. Aquests són excepcionals en el regne animal, atès la seva reduïda mida, degut a que estan compostos únicament per dues cadenes pesades.[109] Tals peculiaritats els permeten accedir a localitzacions cel·lulars i d'antígens inaccessibles pels anticossos normals, a més de ser possible la seva administració oral.[110]
- Faboteràpics
Per obtenir antídots contra verins de picades per animals com serps o artròpodes, es fabriquen antiserums mitjançant sèrum cru o bé altament enriquit en immunoglobulines. Aquests procediments produeixen un gran nombre de reaccions al·lèrgiques, com anafilaxies o la malaltia del sèrum. Per evitar-ho, en els anys 40 i 50 es van realitzar estudis de proteòlisi per reduir al mínim la part de la molècula implicada en la neutralització del verí. Finalment es va trobar que el fragment F (ab') 2, resultant de la digestió amb papaïna dels anticossos, que manca de les zones efectores de la molècula, pot neutralitzar igualment verins. El professor Alejandro Alagón Cano va proposar per aquest enfocament terapèutic el nom de faboteràpia, observant una incidència molt menor de reaccions adverses al sèrum, així com un millor abast del compartiment extravascular.[111]
Estructura i propietats de les Ig humanes
IgG

Propietats físiques:
- Massa molecular: 150.000 Da.
- Nombre d'aminoàcids: 450.
- Dominis de la cadena pesada: 3.
- Forma molecular: Sempre monòmer.
- Quatre subclasses (IgG1, IgG2, IgG3 i IgG4). Difereixen en el nombre i l'organització dels enllaços disulfur i en les seves activitats biològiques.
- Semivida: 23 dies.
- Concentració en sèrum: 10 mg /ml.
- Llocs d'unió per l'antigen: 2.
Propietats biològiques:
- Ig majoritària al sèrum (80%).
- Predominant en la resposta secundaria.
- Pot travessar la barrera placentària.
- Activa el complement.
- S'uneix a receptors per Fc en els fagòcits.
IgM

1: Unitat bàsica.
2: Cadenes pesades.
3: Cadenes lleugeres.
4: Cadena J.
5: Ponts disulfur intermoleculars.
Propietats físiques:
- Massa molecular: 900.000 Da (pentàmer).
- Forma molecular: pentàmer (o hexàmer) en sèrum; monòmer en membrana.
- Nombre d'aminoàcids (monòmer): 550.
- Dominis CH monòmer: 4.
- Semivida: 5 dies.
- Concentració al sèrum: 1,5 mg /ml.
- Cadenes polipeptídiques diferents: 3 (H,L,J).
- llocs d'unió per l'antigen: 10 (pentàmer).
Propietats biològiques:
- 5-10% de les Ig del sèrum.
- Predominant en la resposta primària.
- Primer isotip produït en el nounat.
- Activa el complement.
- Actua com a receptor antigènic durant el desenvolupament dels limfòcits B.
IgA

1: Cadenes pesades.
2: Cadenes lleugeres.
3: Cadena J.
4: Peça secretora.
Propietats físiques:
- Massa molecular: 150.000-600.000 Da.
- Monòmer, dímer, trímer o tetràmer.
- Dues subclasses: IgA1 i IgA2.
- Nombre d'aminoàcids (monòmer): 470.
- Dominis cadena pesada (monòmer): 3
- Semivida: 6 dies.
- Concentració al sèrum: 3 mg /ml.
- Cadenes polipeptídiques diferents: 4 en la forma secretada (H,L,J i peça secretora)
- Llocs d'unió a l'Ag: 4 (dímer)
Propietats biològiques:
- 15-20% de les Ig del sèrum.
- Predominant en les secrecions mucoses.
- Present en la llet materna.
- La forma dimèrica conté la cadena J i el component secretor que li proporciona resistència a les proteases.
IgE
Propietats físiques:
- Massa molecular: 188.000 Da.
- Forma molecular: monòmer.
- Nombre d'aminoàcids (monòmer): 550.
- Dominis cadena pesada monòmer: 4.
- Semivida: 1-5 dies.
- Concentració al sèrum: molt baixa.
- Cadenes polipeptídiques diferents: 2.
- Determinants antigènics: 2.
Propietats biològiques:
- Concentració en sèrum molt baixa.
- Nivells augmentats en pacients al·lèrgics.
- Important en la defensa contra paràsits (en especial cucs helmints).
Referències
- ↑ Litman GW, Rast JP, Shamblott MJ, et al Mol. Biol. Evol.. PMID: 8450761.
- ↑ 2,0 2,1 2,2 2,3 Eleonora Market, F. Nina Papavasiliou (2003) V(D)J Recombination and the Evolution of the Adaptive Immune System PLoS Biology1(1): e16.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 Janeway CA, Jr et al. Immunobiology.. 5th ed.. Garland Publishing, 2001.
- ↑ 4,0 4,1 Diaz M, Casali P Curr Opin Immunol. DOI: 10.1016/S0952-7915(02)00327-8. PMID: 11869898.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 Pier GB, Lyczak JB, Wetzler LM. Immunology, Infection, and Immunity. ASM Press, 2004.
- ↑ Error en el títol o la url.«».
- ↑ AGN Canadian Medical Association Journal.
- ↑ Winau F, Westphal O, Winau R Microbes Infect.. DOI: 10.1016/j.micinf.2004.04.003. PMID: 15207826.
- ↑ Silverstein AM Nat. Immunol.. DOI: 10.1038/ni0503-425. PMID: 12719732.
- ↑ Van Epps HL J. Exp. Med.. DOI: 10.1084/jem.2031fta. PMID: 16523537.
- ↑ Marrack, JR. Chemistry of antigens and antibodies. 2nd ed.. London: His Majesty's Stationery Office, 1938. OCLC 3220539.
- ↑ Error en el títol o la url.«».
- ↑ Silverstein AM Nat. Immunol.. DOI: 10.1038/ni1140. PMID: 15549122.
- ↑ Edelman GM, Gally JA J. Exp. Med.. PMID: 13889153.
- ↑ Stevens FJ, Solomon A, Schiffer M Biochemistry. PMID: 2069946.
- ↑ 16,0 16,1 Raju TN Lancet. PMID: 10501404.
- ↑ Tomasi TB Immunol. Today. PMID: 1343085.
- ↑ Preud'homme JL, Petit I, Barra A, Morel F, Lecron JC, Lelièvre E Mol. Immunol.. PMID: 11282392.
- ↑ Johansson SG Allergy and asthma proceedings : the official journal of regional and state allergy societies. PMID: 16722325.
- ↑ The Lancet. DOI: 10.1016/S0140-6736(05)72025-0. PMID: 10615922.
- ↑ Hozumi N, Tonegawa S Proc. Natl. Acad. Sci. U.S.A.. PMID: 824647.
- ↑ Borghesi L, Milcarek C Immunol Res. DOI: 10.1385/IR:36:1:27. PMID: 17337763.
- ↑ Parker D Annu Rev Immunol. DOI: 10.1146/annurev.iy.11.040193.001555. PMID: 8476565.
- ↑ 24,0 24,1 24,2 24,3 Wintrobe, Maxwell Myer. Wintrobe's clinical hematology. John G. Greer, John Foerster, John N Lukens, George M Rodgers, Frixos Paraskevas. 11. Hagerstwon, MD: Lippincott Williams & Wilkins, 2004, p. 453-456.
- ↑ Tolar P, Sohn HW, Pierce SK Immunol. Rev.. DOI: 10.1111/j.1600-065X.2008.00583.x. PMID: 18275475.
- ↑ Underdown B, Schiff J Annu Rev Immunol. DOI: 10.1146/annurev.iy.04.040186.002133. PMID: 3518747.
- ↑ 27,0 27,1 Geisberger R, Lamers M, Achatz G Immunology. PMID: 16895553.
- ↑ 28,0 28,1 28,2 Woof J, Burton D Nat Rev Immunol. DOI: 10.1038/nri1266. PMID: 15040582.
- ↑ Goding J Contemp Top Immunobiol. PMID: 357078.
- ↑ Grubb, R. , and Laurell, A. B. , Acta Path. Microb. Scand., 39, 390 (1956). PMID: 13381487
- ↑ Mattu T, Pleass R, Willis A, Kilian M, Wormald M, Lellouch A, Rudd P, Woof J, Dwek R J Biol Chem. DOI: 10.1074/jbc.273.4.2260. PMID: 9442070.
- ↑ Roux K Int Arch Allergy Immunol. DOI: 10.1159/000024226. PMID: 10545762.
- ↑ Error en el títol o la url.«».
- ↑ Error en el títol o la url.«».
- ↑ Barclay A Semin Immunol. DOI: 10.1016/S1044-5323(03)00047-2. PMID: 14690046.
- ↑ Murre C, y otros:. The 3D structure of the immunoglobulin heavy-chain locus: implications for long-range genomic interactions. Cell, 2008. PMID 18423198.
- ↑ Putnam FW, Liu YS, Low TL. Primary structure of a human IgA1 immunoglobulin. IV. Streptococcal IgA1 protease, digestion, Fab and Fc fragments, and the complete amino acid sequence of the alpha 1 heavy chain, 1979, p. 2865–74.
- ↑ Huber R. Spatial structure of immunoglobulin molecules, 1980, p. 1217–31.
- ↑ Heyman B. Complement and Fc-receptors in regulation of the antibody response, 1996, p. 195–9.
- ↑ 40,0 40,1 Ravetch J, Bolland S. IgG Fc receptors, 2001, p. 275–90.
- ↑ Rus H, Cudrici C, Niculescu F. The role of the complement system in innate immunity, 2005, p. 103–12.
- ↑ Mian I, Bradwell A, Olson A. Structure, function and properties of antibody binding sites, 1991, p. 133–51.
- ↑ Fanning LJ, Connor AM, Wu GE. Development of the immunoglobulin repertoire, 1996, p. 1–14.
- ↑ 44,0 44,1 Nemazee D. Receptor editing in lymphocyte development and central tolerance, 2006, p. 728–40.
- ↑ Peter Parham. "The Immune System. 2nd ed. Garland Science: New York, 2005. pg.47-62
- ↑ Bergman Y, Cedar H. A stepwise epigenetic process controls immunoglobulin allelic exclusion, 2004, p. 753–61.
- ↑ Honjo T, Habu S. Origin of immune diversity: genetic variation and selection, 1985, p. 803–30.
- ↑ 48,0 48,1 Or-Guil M, Wittenbrink N, Weiser AA, Schuchhardt J. Recirculation of germinal center B cells: a multilevel selection strategy for antibody maturation, 2007, p. 130–41.
- ↑ Neuberger M, Ehrenstein M, Rada C, Sale J, Batista F, Williams G, Milstein C. Memory in the B-cell compartment: antibody affinity maturation, 2000, p. 357–60.
- ↑ Stavnezer J, Amemiya CT. Evolution of isotype switching, 2004, p. 257–75.
- ↑ Durandy A. Activation-induced cytidine deaminase: a dual role in class-switch recombination and somatic hypermutation, 2003, p. 2069–73.
- ↑ Casali P, Zan H. Class switching and Myc translocation: how does DNA break?, 2004, p. 1101–3.
- ↑ Lieber MR, Yu K, Raghavan SC. Roles of nonhomologous DNA end joining, V(D)J recombination, and class switch recombination in chromosomal translocations, 2006, p. 1234–45.
- ↑ Weill, JC y otros:. Somatic hyperconversion diversifies the single VH gene of the chicken with a high incidence in the D region. Cell, 1989.
- ↑ Knight, KL:. Restricted VH gene usage and generation of antibody diversity in rabbit.. annu. Rev. immunol., 1992.
- ↑ Litman, G; Cannon, JP y Dishaw, LJ:. Reconstructing immune phylogeny:new perspectives. Nature, noviembre 2005.
- ↑ Bateman, A; Eddy, SR y Chothia, C. Members of the immunoglobulin superfamily in bacteria. Protein Science, 1996. PMID 8880921.
- ↑ Dersch P, Isberg RR.. An immunoglobulin superfamily-like domain unique to the Yersinia pseudotuberculosis invasin protein is required for stimulation of bacterial uptake via integrin receptors.. Infect Immun, 2000. PMID 10768991.
- ↑ ,Matsunaga, J; Ko, AI y colaboradores:. Pathogenic Leptospira species express surface-exposed proteins belonging to the bacterial immunoglobulin superfamily. Mol Microbiol, 2005. PMCID PMC1237129.
- ↑ ateman A, Eddy SR, Mesyanzhinov VV:. A member of the immunoglobulin superfamily in bacteriophage T4. Virus Genes, 1997. PMID 9237357.
- ↑ Wojciechowicz D, Lu CF, Kurjan J, Lipke PN. Cell surface anchorage and ligand-binding domains of the Saccharomyces cerevisiae cell adhesion protein alpha-agglutinin, a member of the immunoglobulin superfamily. Mol Cell Biol, 1993. PMID 8455628.
- ↑ Grigorescu A, Chen MH, Zhao H, Kahn PC, Lipke PN. A CD2-based model of yeast alpha-agglutinin elucidates solution properties and binding characteristics. IUBMB Life, 2000. PMID 11185954.
- ↑ Nick Matzke. «Postulated intermediates in the molecular evolution of the Ig and TCR loci». Annotated Bibliography on the Evolutionary Origin of the Vertebrate Immune System, 28 abril. [Consulta: 22 agosto].
- ↑ Müller CI, Blumbach B, Krasko A, Schröder HC. Receptor protein-tyrosine phosphatases: origin of domains (catalytic domain, Ig-related domain, fibronectin type III module) based on the sequence of the sponge Geodia cydonium. Gene, 2001. PMID 11179687.
- ↑ Kubrycht J, Borecký J, Soucek P, Jezek P. Sequence similarities of protein kinase substrates and inhibitors with immunoglobulins and model immunoglobulin homologue: cell adhesion molecule from the living fossil sponge Geodia cydonium. Mapping of coherent database similarities and implications for evolution of CDR1 and hypermutation. Folia Microbiol, 2004. 3 PMID 15259763.
- ↑ Brümmendorf, T y Lemmon, V:. Immunoglobulin superfamily receptors: cis-interactions, intracellular adapters and alternative splicing regulate adhesion. Current opinion in cell biology, 2001. doi 10.1016/S0955-0674(00)00259-3.
- ↑ Strecker, G y otros:. Molecular recognition between glyconectins as an adhesion self-assembly pathway to multicellularity. J Biol Chem., 2004. PMID 14701844.
- ↑ The Evolution of Adaptative Immune Systems. Cell, 2006. DOI 10.1016/j.cell.2006.02.001.
- ↑ Litman, GW y otros:. Genomic Insights into the Immune System of the Sea Urchin. Science, 2006. DOI 10.1126/science.1134301.
- ↑ Noverr, MC y Huffnagle, GB.. Does the microbiota regulate immune responses outside the gut?. Trends Microbiol. PMID.
- ↑ Oren M, Douek J, Fishelson Z, Rinkevich B:. Identification of immune-relevant genes in histoincompatible rejecting colonies of the tunicate Botryllus schlosseri. Dev Comp Immunol, 2007. PMID 17287019.
- ↑ Pancer Z, Diehl-Seifert B, Rinkevich B, Müller WE:. A novel tunicate (Botryllus schlosseri) putative C-type lectin features an immunoglobulin domain. DNA Cell Biol., 1997. PMID 9212174.
- ↑ Kapitonov, VV;Jurka, J:. RAG1 core and V(D)J recombination signal sequences were derived from Transib transposons. PLoS Biol., 2005.
- ↑ Cannon JP, Haire RN, Litman GW:. Identification of diversified genes that contain immunoglobulin-like variable regions in a protochordate. Nat Immunol, 2002. PMID 12415263.
- ↑ Hernández Prada JA, Haire RN, Allaire M, Jakoncic J, Stojanoff V, Cannon JP, Litman GW, Ostrov DA:. [16799561 Ancient evolutionary origin of diversified variable regions demonstrated by crystal structures of an immune-type receptor in amphioxus]. Nature immunology, 2006. PMID.
- ↑ Litman GW, Cannon JP, Dishaw LJ, Haire RN, Eason DD, Yoder JA, Prada JH, Ostrov DA:. Immunoglobulin variable regions in molecules exhibiting characteristics of innate and adaptive immune receptors. Immunol Res., 2007. PMID 17917037.
- ↑ Cooper, MD y Alder, MN. The Evolution of Adaptive Immune Systems. Cell, 2006. DOI 10.1016/j.cell.2006.02.001.
- ↑ Janvier, P. Catching the first fish. Nature, 1999. PMID.
- ↑ Stein Tore Solem and Jørgen Stenvik. Antibody repertoire development in teleosts--a review with emphasis on salmonids and Gadus morhua L. Developmental & Comparative Immunology, Volume 30, Issues 1-2, Antibody repertoire development, 2006, Pages 57-76.
- ↑ J.D. Hansen, E.D. Landis and R.B. Phillips. Discovery of a unique Ig heavy-chain isotype (IgT) in rainbow trout: Implications for a distinctive B cell developmental pathway in teleost fish. Proceedings of the National Academy of Sciences U S A. Volume 102, Issue 19, 2005, pages 6919-24.
- ↑ N. Danilova, J. Bussmann, K. Jekosch, L.A Steiner. The immunoglobulin heavy-chain locus in zebrafish: identification and expression of a previously unknown isotype, immunoglobulin Z. Nature Immunology, Volume 6, Issue 3, 2005, pages 295-302.
- ↑ H. Dooley and M.F. Flajnik. Antibody repertoire development in cartilaginous fish. Developmental & Comparative Immunology, Volume 30, Issues 1-2, Antibody repertoire development, 2006, Pages 43-56.
- ↑ «Animated depictions of how antibodies are used in ELISA assays». Cellular Technology Ltd.—Europe. [Consulta: 8 maig 2007].
- ↑ «Animated depictions of how antibodies are used in ELISPOT assays». Cellular Technology Ltd.—Europe. [Consulta: 8 maig 2007].
- ↑ Stern P. Current possibilities of turbidimetry and nephelometry, 2006, p. 146–151.
- ↑ 86,0 86,1 Dean, Laura. «Chapter 4: Hemolytic disease of the newborn». A: Blood Groups and Red Cell Antigens. NCBI Bethesda (MD): National Library of Medicine (US),, 2005.
- ↑ Feldmann M, Maini R. Anti-TNF alpha therapy of rheumatoid arthritis: what have we learned?, 2001, p. 163–96.
- ↑ Doggrell S. Is natalizumab a breakthrough in the treatment of multiple sclerosis?, 2003, p. 999–1001.
- ↑ Krueger G, Langley R, Leonardi C, Yeilding N, Guzzo C, Wang Y, Dooley L, Lebwohl M. A human interleukin-12/23 monoclonal antibody for the treatment of psoriasis, 2007, p. 580–92.
- ↑ Plosker G, Figgitt D. Rituximab: a review of its use in non-Hodgkin's lymphoma and chronic lymphocytic leukaemia, 2003, p. 803–43.
- ↑ Vogel C, Cobleigh M, Tripathy D, Gutheil J, Harris L, Fehrenbacher L, Slamon D, Murphy M, Novotny W, Burchmore M, Shak S, Stewart S. First-line Herceptin monotherapy in metastatic breast cancer, 2001, p. 37–42.
- ↑ LeBien TW. Fates of human B-cell precursors, 2000, p. 9–23.
- ↑ Ghaffer A. «Immunization». Immunology - Chapter 14, 26-03-2006. [Consulta: 6 juny 2007].
- ↑ 94,0 94,1 Fung Kee Fung K, Eason E, Crane J, Armson A, De La Ronde S, Farine D, Keenan-Lindsay L, Leduc L, Reid G, Aerde J, Wilson R, Davies G, Désilets V, Summers A, Wyatt P, Young D. Prevention of Rh alloimmunization, 2003, p. 765–73.
- ↑ Urbaniak S, Greiss M. RhD haemolytic disease of the fetus and the newborn, 2000, p. 44–61.
- ↑ 96,0 96,1 Brehm-Stecher B, Johnson E. Single-cell microbiology: tools, technologies, and applications, 2004, p. 538–59.
- ↑ Williams N. Immunoprecipitation procedures, 2000, p. 449–53.
- ↑ Kurien B, Scofield R. Western blotting, 2006, p. 283–93.
- ↑ Scanziani E. Immunohistochemical staining of fixed tissues, p. 133–40.
- ↑ Reen DJ.. Enzyme-linked immunosorbent assay (ELISA), 1994, p. 461–6.
- ↑ Kalyuzhny AE. Chemistry and biology of the ELISPOT assay, 2005, p. 15–31.
- ↑ Tini M, Jewell UR, Camenisch G, Chilov D, Gassmann M. Generation and application of chicken egg-yolk antibodies, 2002, p. 569–74.
- ↑ Cole SP, Campling BG, Atlaw T, Kozbor D, Roder JC. Human monoclonal antibodies, 1984, p. 109–20.
- ↑ Kabir S. Immunoglobulin purification by affinity chromatography using protein A mimetic ligands prepared by combinatorial chemical synthesis, 2002, p. 263–78.
- ↑ Lennard, S. Standard Protocols for the Construction of scFv Libraries. Springer protocols, 2001. DOI 10.1385/1-59259-240-6:059.
- ↑ Altria, KD. Capillary Electrophoresis Guidebook Principles, Operation, and Applications, página 226. Humana Press, 1996. ISBN 1-59259-538-3.
- ↑ Blackburn, GM y colaboradores:. Toward antibody-directed "abzyme" prodrug therapy, ADAPT: carbamate prodrug activation by a catalytic antibody and its in vitro application to human tumor cell killing. PNAS, 1996.
- ↑ Shiro Kobayashi, Helmut Ritter, David Kaplan. Enzyme-Catalyzed Synthesis of Polymers, pág. 206. Birkhäuser, 2006. ISBN 3-540-29212-8.
- ↑ Hamers-Casterman C, Atarhouch T, Muyldermans S, Robinson G, Hamers C, Songa EB, Bendahman N, Hamers R., Naturally occurring antibodies devoid of light chains, Nature. 1993 Jun 3;363(6428):446-8
- ↑ Error en el títol o la url.«». Medical News.
- ↑ Error en el títol o la url.Cano, AA. «».
Biografia
- Janeway, CA; Staff, VV. Traducción de Eva Sanz. Inmunobiología: el sistema inmunitario en condiciones de salud y enfermedad. Elsevier España, 2003. ISBN 978-84-458-1176-4.
- Peña Martínez, J (Coordinador). Inmunología. Pirámide, 1998. ISBN 84-368-1213-1. Disponible una versió online en http://www.uco.es (castellà)
Vegeu també
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Anticòs |
