Antimoni: diferència entre les revisions
m Tipografia |
→Aplicacions: Ampliació amb referències |
||
| Línia 32: | Línia 32: | ||
== Aplicacions == |
== Aplicacions == |
||
L'antimoni té una creixent importància en la indústria de [[semiconductors]] en la producció de [[díode]]s, [[detector infraroig|detectors infraroigs]] i dispositius d'[[efecte Hall]]. |
|||
=== Indústria química === |
|||
Usat com aliant, aquest semimetall incrementa molt la duresa i força mecànica del plom. També s'empra en distints aliatges com [[peltre]], [[metall antifricció]] (aliat amb [[Estany (element)|estany]]), [[metall anglès]] (format per [[zinc]] i antimoni), etc. |
|||
El principal ús de l'antimoni, en concret l'[[òxid d'antimoni(III)]] <chem>Sb2O3</chem>, és la producció de [[Retardant de flama|retardants de flama]] usats en pintures, coles, plàstics (per a cobertes d'ordinadors i televisors, entre d'altres) i en el tractament de teixits ignífugs (telons de teatre). Tot i que l'òxid antimoni(III) no és un retardant per si mateix, quan es combina amb halògens (com el brom) en els polímers, la barreja resultant suporta i redueix la propagació de les flames.<ref name=":0">{{Ref-publicació|article=Antimony: a flame fighter|url=http://pubs.er.usgs.gov/publication/fs20153021|data=2015|lloc=Reston, VA|pàgines=2|doi=10.3133/fs20153021|nom=Niki E.|cognom=Wintzer|nom2=David E.|cognom2=Guberman|publicació=USGS Mineral Resources Program}}</ref> |
|||
També s'utilitza l'òxid d'antimoni(III) com a [[catalitzador]] en la fabricació de plàstics ([[PET]] per a ampolles d'aigua i d'altres).<ref name=":07">{{Ref-llibre|títol=Elements i recursos minerals: aplicacions i reciclatge|url=http://worldcat.org/oclc/1120317169|isbn=978-84-9880-666-3|cognom=Sanz Balagué|nom=J.|edició=3a|data=2017|editorial=Iniciativa Digital Politècnica|cognom2=Tomasa Guix|nom2=O.}}</ref> |
|||
Algunes aplicacions més específiques: |
|||
* [[bateria elèctrica|bateries]] i [[acumulador]]s |
|||
* tipus d'impremta |
|||
* recobriment de cables |
|||
* coixinets i rodaments |
|||
=== Indústria de bateries === |
|||
Compostos d'antimoni en forma d'òxids, sulfurs, antimoniats i halogenurs d'antimoni s'empren en la fabricació de materials resistents al foc, [[esmalt]]s, [[vidre]]s, [[pintura|pintures]] i [[ceràmica|ceràmiques]]. El triòxid d'antimoni és el més important i es fa servir principalment com [[retardant de flama]] en tèxtils, joguets o cobertes de seients. |
|||
[[Fitxer:Diamond Energie car battery.jpg|miniatura|Bateria de cotxe.]] |
|||
Els aliatges d’antimoni i [[plom]] (entre l'1 % i el 10 % d'antimoni) proporcionen propietats elèctriques millorades a les bateries. Els [[Elèctrode|elèctrodes]] de bateries recoberts amb aliatges de plom tenen una recàrrega més eficient i es poden drenar plenament en diverses ocasions amb un rendiment sostingut. Molts telèfons mòbils utilitzen bateries que porten antimoni.<ref name=":0" /> |
|||
=== Indústria electrònica === |
|||
L'antimoni puríssim es fa servir en la fabricació de semiconductors.<ref name=":07" /> |
|||
=== Indústria metal·lúrgica === |
|||
L'antimoni aliat amb l'estany s'usa en soldadures, i aliat amb el zinc aporta duresa a l'aliatge. La [[munició]] feta amb aliatges de plom d’antimoni (entre l'1 % i el 10 % d'antimoni) és capaç de penetrar diferents armadures.<ref name=":0" /> |
|||
=== Altres camps === |
|||
La indústria de la ceràmica, dels plàstics i de les gomes industrials consumeixen sals d’antimoni.<ref name=":07" /> |
|||
== Referències == |
== Referències == |
||
Revisió del 12:40, 2 març 2023
| Antimoni | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
51Sb
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||
Gris platejat brillant  Línies espectrals de l'antimoni | |||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||
| Nom, símbol, nombre | Antimoni, Sb, 51 | ||||||||||||||||||||||||
| Categoria d'elements | Metal·loides | ||||||||||||||||||||||||
| Grup, període, bloc | 15, 5, p | ||||||||||||||||||||||||
| Pes atòmic estàndard | 121,760(1) | ||||||||||||||||||||||||
| Configuració electrònica | [Kr] 4d10 5s2 5p3 2, 8, 18, 18, 5 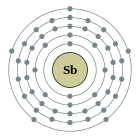
| ||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
6,697 g·cm−3 | ||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
6,53 g·cm−3 | ||||||||||||||||||||||||
| Punt de fusió | 903,78 K, 630,63 °C | ||||||||||||||||||||||||
| Punt d'ebullició | 1.860 K, 1.587 °C | ||||||||||||||||||||||||
| Entalpia de fusió | 19,79 kJ·mol−1 | ||||||||||||||||||||||||
| Entalpia de vaporització | 193,43 kJ·mol−1 | ||||||||||||||||||||||||
| Capacitat calorífica molar | 25,23 J·mol−1·K−1 | ||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||
| Estats d'oxidació | 5, 3, -3 | ||||||||||||||||||||||||
| Electronegativitat | 2,05 (escala de Pauling) | ||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 834 kJ·mol−1 | ||||||||||||||||||||||||
| 2a: 1.594,9 kJ·mol−1 | |||||||||||||||||||||||||
| 3a: 2.440 kJ·mol−1 | |||||||||||||||||||||||||
| Radi atòmic | 140 pm | ||||||||||||||||||||||||
| Radi covalent | 139±5 pm | ||||||||||||||||||||||||
| Radi de Van der Waals | 206 pm | ||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||
| Estructura cristal·lina | Trigonal simple 
| ||||||||||||||||||||||||
| Ordenació magnètica | Diamagnètic[1] | ||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 417 nΩ·m | ||||||||||||||||||||||||
| Conductivitat tèrmica | 24,4 W·m−1·K−1 | ||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 11 µm·m−1·K−1 | ||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 3.420 m·s−1 | ||||||||||||||||||||||||
| Mòdul d'elasticitat | 55 GPa | ||||||||||||||||||||||||
| Mòdul de cisallament | 20 GPa | ||||||||||||||||||||||||
| Mòdul de compressibilitat | 42 GPa | ||||||||||||||||||||||||
| Duresa de Mohs | 3,0 | ||||||||||||||||||||||||
| Duresa de Brinell | 294 MPa | ||||||||||||||||||||||||
| Nombre CAS | 7440-36-0 | ||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||
| Article principal: Isòtops de l'antimoni | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
L'antimoni és l'element químic de símbol Sb i nombre atòmic 51. Se situa en el grup 15 de la taula periòdica dels elements. El seu símbol prové del llatí stibium. L'antimoni i molts dels seus compostos són tòxics.
Aquest element semimetàlic té quatre formes al·lotròpiques. La seva forma estable és un metall blanc blavós. L'antimoni negre i el groc són formes no metàl·liques inestables. Principalment s'empra en aliatges metàl·lics i alguns dels seus compostos per a donar resistència contra el foc, en pintures, ceràmiques, esmalts, vulcanització del cautxú i focs d'artifici.
Història

L'antimoni era conegut pels xinesos i babilonis cap al 3000 a. de C. El sulfur d'antimoni va ser emprat com a cosmètic i amb objectius medicinals.
La relació entre el nom actual de l'antimoni i el seu símbol és complexa; el nom copte de la pols cosmètica de sulfur d'antimoni va ser pres pel grec, i d'aquest va passar al llatí, resultant el nom stibium. El químic Jöns Jacob Berzelius va usar una abreviatura d'aquest nom en els seus escrits i es va convertir en el símbol comunament emprat Sb.
L'antimoni és àmpliament tractat per l'alquímia. Hi ha escrits sobre aquest element de Georg Bauer (Georgios Agrícola), i Basilius Valentinus és l'autor d'El carro triomfal de l'antimoni, un tractat sobre l'element.
Abundància i obtenció

Les estimacions sobre l'abundància d'antimoni en l'escorça terrestre van des de 0,2 a 0,5 ppm. L'antimoni es troba en la naturalesa en nombrosos minerals, encara que és un element poc abundant. Encara que és possible trobar-lo lliure, normalment està en forma de sulfurs; la principal mena d'antimoni és l'antimonita (també anomenada estibinita), Sb₂S₃.
Per mitjà de la torrada del sulfur d'antimoni s'obté òxid d'antimoni (III), Sb₂O₃, que es pot reduir amb carbó de coc per a l'obtenció d'antimoni.[2]
- 2Sb₂O₃ + 3C → 4Sb + 3CO₂
També es pot obtindre per reducció directa del sulfur, per exemple amb ferralla de ferro:
- Sb₂S₃ + 3Fe → 2Sb + 3fes
Altres minerals d'antimoni són la quermesita (Sb₂S₂O₂), l'estibarseni (AsSb), etc.
Característiques principals
L'antimoni en la seva forma elemental és un sòlid cristal·lí, fusible, trencadís, blanc argentat que presenta una conductivitat elèctrica i tèrmica baixa i s'evapora a baixes temperatures. Aquest element semimetàl·lic s'assembla als metalls en el seu aspecte i propietats físiques, però no es comporta químicament com un metall. També pot ser atacat per àcids oxidants i halogens.
L'antimoni és calcòfil, i està present juntament amb sofre i altres metalls com el plom, el coure i l'argent.
Compostos
Els seus estats d'oxidació més comuns són el 3 i el 5. Es coneixen tots els seus trihalogenurs, SbX₃, i el pentafluorur i pentaclorur, SbX₅. El trifluorur s'empra com fluorant. El pentafluorur junt amb HSO₃F forma un sistema SbF₅-FSO₃H amb propietats de superàcid. Amb aquests halogenurs es poden preparar distints complexos. Es coneix l'hidrur SbH₃, anomenat estibà (antigament anomenat estibina), però és poc estable i es descompon amb molta facilitat. Es coneix el triòxid d'antimoni, Sb₂O₃ i el pentaòxid, Sb₂O₅.
Aplicacions
Indústria química
El principal ús de l'antimoni, en concret l'òxid d'antimoni(III) , és la producció de retardants de flama usats en pintures, coles, plàstics (per a cobertes d'ordinadors i televisors, entre d'altres) i en el tractament de teixits ignífugs (telons de teatre). Tot i que l'òxid antimoni(III) no és un retardant per si mateix, quan es combina amb halògens (com el brom) en els polímers, la barreja resultant suporta i redueix la propagació de les flames.[3]
També s'utilitza l'òxid d'antimoni(III) com a catalitzador en la fabricació de plàstics (PET per a ampolles d'aigua i d'altres).[4]
Indústria de bateries

Els aliatges d’antimoni i plom (entre l'1 % i el 10 % d'antimoni) proporcionen propietats elèctriques millorades a les bateries. Els elèctrodes de bateries recoberts amb aliatges de plom tenen una recàrrega més eficient i es poden drenar plenament en diverses ocasions amb un rendiment sostingut. Molts telèfons mòbils utilitzen bateries que porten antimoni.[3]
Indústria electrònica
L'antimoni puríssim es fa servir en la fabricació de semiconductors.[4]
Indústria metal·lúrgica
L'antimoni aliat amb l'estany s'usa en soldadures, i aliat amb el zinc aporta duresa a l'aliatge. La munició feta amb aliatges de plom d’antimoni (entre l'1 % i el 10 % d'antimoni) és capaç de penetrar diferents armadures.[3]
Altres camps
La indústria de la ceràmica, dels plàstics i de les gomes industrials consumeixen sals d’antimoni.[4]
Referències
- ↑ Magnetic susceptibility of the elements and inorganic compounds, a Handbook of Chemistry and Physics, 81a edició, CRC press (en anglès)
- ↑ Hiorns, Arthur Horseman. Practical metallurgy and assaying: a text-book for the use of teachers, students, and assayers. Macmillan, 1906.
- ↑ 3,0 3,1 3,2 Wintzer, Niki E.; Guberman, David E. «Antimony: a flame fighter». USGS Mineral Resources Program [Reston, VA], 2015, pàg. 2. DOI: 10.3133/fs20153021.
- ↑ 4,0 4,1 4,2 Sanz Balagué, J.; Tomasa Guix, O. Elements i recursos minerals: aplicacions i reciclatge. 3a. Iniciativa Digital Politècnica, 2017. ISBN 978-84-9880-666-3.
Vegeu també
Enllaços externs
- Los Alamos National Laboratory - Antimoni (anglès)
- webelements.com - Antimoni (anglès)
- environmentalchemistry.com - Antimoni (anglès)
- Etimologia i multidiccionari - Antimoni (anglès)
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||


