Rodi
| Rodi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
45Rh
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Blanc platejat metàl·lic Rodi en pols, premsat i fos  Línies espectrals del rodi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Rodi, Rh, 45 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 9, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 102,90550 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Kr] 5s1 4d8 2, 8, 18, 16, 1 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
12,41 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
10,7 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 2.237 K, 1.964 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 3.968 K, 3.695 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 26,59 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 494 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 24,98 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 6, 5, 4, 3, 2, 1[1], -1 (òxid amfòter) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 2,28 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 719,7 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.740 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 2.997 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 134 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 142±7 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Cúbica centrada en la cara 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (0 °C) 43,3 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 150 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 8,2 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 4.700 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 380 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 150 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 275 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 6,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Vickers | 1.246 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 1.100 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-16-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del rodi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El rodi és un element químic de nombre atòmic 45 situat en el grup 9 de la taula periòdica dels elements. El seu símbol és Rh. És un metall de transició, poc abundant, del grup del platí. Es troba normalment en menes de platí i s'empra en alguns aliatges de platí. Alguns dels seus compostos i també com a metall finament dividit o suportat sobre diverses matrius es fa servir com a catalitzador en processos industrials importants, tals com la carbonilació del metanol i la hidrogenació i la hidroformilació d'alquens.
Història[modifica]


El rodi fou descobert l'any 1803 pel científic anglès William Hyde Wollaston (1766–1828). Wollanston participà amb el també químic anglès Smithson Tennant (1761–1815) en una empresa comercial, part de la qual era produir platí pur per a la venda a partir de platí impur obtingut a Sud-amèrica. El primer pas del procés per aïllar el platí fou dissoldre el platí normal en aigua règia (una dissolució d'àcid nítric i àcid clorhídric en la proporció d'1 a 3). Malgrat que aquesta dissolució és capaç de dissoldre l'or i el platí, no tota la mostra emprada es dissolgué i quedà un residu negre que Tennant investigà descobrint dos nous elements, l'osmi i l'iridi. Per la seva part, Wollaston estudià la solució que sabia que contenia platí i pal·ladi. Neutralitzà la dissolució amb hidròxid de sodi i, després precipità el platí amb clorur d'amoni, i amb cianur de mercuri(I) eliminà el pal·ladi. La dissolució quedà de color vermell i aconseguí precipitar uns cristalls de color vermell rosa de clorur de rodi i sodi . A partir d'ells, finalment mitjançant reducció amb gas d'hidrogen produí una mostra de rodi.[3]
Wollaston anomenà el nou element rhodium ‘rodi’, a partir del mot grec ῥόδον rhodon 'rosa', pel color d'algunes sals d'aquest metall, i del llatí científic –ium '–i'., pel color d'algunes solucions d'aquest metall.[4]
Estat natural i obtenció[modifica]

El rodi és extremadament rar a l'escorça de la Terra. Ocupa la posició 72a dels elements quant a abundància amb una concentració mitjana de 0,2 ppb. No se'n troba ni a l'aigua ni a l'atmosfera.[5]
El rodi es troba natiu amb altres metalls de platí a les sorres dels rius dels Urals i a Amèrica del Nord i del Sud. També es troba amb altres metalls de platí als minerals de sulfur de coure i níquel de la regió de Sudbury, Ontario. Tot i que la quantitat que es produeix aquí és molt petita, els grans tonatges de níquel processat fan que la recuperació sigui comercialment factible.[6] La producció mundial de rodi arribà a prop de 21 tones mètriques el 2020, el valor més baix des d'almenys el 2016. La producció de rodi de Sud-àfrica ascendí a gairebé 17 tones mètriques el 2020 i, per tant, fou el país amb el volum més gran de producció de metall. El seguiren Rússia i Zimbàbue, amb una producció de rodi d'aproximadament 1,8 i 1,4 tones mètriques, respectivament.[7] S'han descrit vint minerals que el contenen, la majoria amb elevades proporcions. Els minerals que el contenen en més d'un 50% en massa són: miassita 78,43%, prassoïta 78,43%, polkanovita 70,19%, rodi nadiu 61,28%, cherepanovita 57,87%, rodarsenur 54,64 % i cuprorodsita 51,76%.[8]
Propietats[modifica]

Propietats físiques[modifica]
El rodi és un metall dúctil de color blanc argentat. El seu punt de fusió és de 1.964 °C, el d'ebullició 3.695 °C i la seva densitat és de 12,41 g/cm³ a 20 °C.[6]
Propietats químiques[modifica]
La configuració electrònica del rodi és [Kr] 4d85s1. És un metall del bloc d de la taula periòdica, un metall de transició. Els seus estats d'oxidació són +2, +3, +4, +5 i +6.[6] Tanmateix, la química del rodi se centra principalment en els estats d'oxidació +1 i +3. Tots els compostos de rodi es redueixen o es descomponen fàcilment mitjançant l'escalfament per produir el metall en pols o esponjós.[9]
No es dissol en àcids, ni tan sols en aigua règia, encara que finament dividit sí que s'hi pot dissoldre, i també en àcid sulfúric concentrat i en calent, i en àcid clorhídric concentrat que conté perclorat de sodi a 125–150 °C. Es dissol en hidrogensulfat de potassi fos per produir un sulfat de rodi(III) i potassi dodecahidratat , que és soluble en aigua.[9]
El rodi és en gran part immune als atacs atmosfèrics. En escalfar-se amb oxigen a 600 °C, el rodi metàl·lic dona òxid de rodi(III) , de color gris fosc, segons la reacció:[10]
El rodi metàl·lic reacciona directament amb el gas fluor per formar el fluorur de rodi(VI) altament corrosiu . Aquest compost, amb cura, es pot escalfar per formar fluorur de rodi(V), que té l'estructura tetramèrica i és de color vermell fosc.[10]

Els trihalurs fluorur de rodi(III) , clorur de rodi(III) i bromur de rodi(III) , es poden formar mitjançant la reacció directa del metall amb l'halogen en condicions anhidres. Les reaccions són:[10]

Entre aquests composts, el triclorur de rodi és un dels més importants. Proporciona un material de partida per a molts dels altres composts de rodi en diversos estats d'oxidació. En emulsions aquoses pot catalitzar una sèrie de reaccions orgàniques útils.[9]
El rodi forma el tetraacetat de dirodi i diversos derivats que contenen dos lligands addicionals (per exemple, aigua, piridina o trifenilfosfina) en estat d'oxidació +2. Els complexos en estat d'oxidació +1 contenen principalment monòxid de carboni, olefines i fosfines com a lligands.[9]
Isòtops[modifica]
Es coneixen trenta-nou isòtops del rodi que van dels nombres màssics 89 a 127, però només el rodi 103 és estable i és l'únic present a la natura.[11]
Utilització[modifica]
Catalitzador[modifica]

El principal ús industrial del rodi (81% l'any 2007) és com a component dels convertidors catalítics dels vehicles amb motors de combustió interna per eliminar gasos tòxics. En els convertidors de tres vies s'empra platí i rodi en una proporció de 5:1. El platí catalitza les reaccions d'oxidació (monòxid de carboni a diòxid de carboni) i el rodi les de reducció del monòxid de nitrogen a nitrogen:[12]
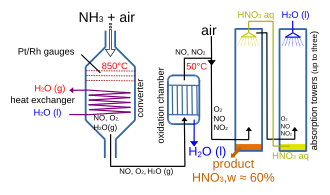
Les xarxes utilitzades per a l'oxidació catalítica de l'amoníac a àcid nítric en el procediment Ostwald es fabriquen normalment a partir dels aliatges de platí amb entre el 5% i el 10% de rodi, perquè són mecànicament més fortes i tenen una activitat catalítica més alta que el platí pur.[13] Aquest catalitzador s'empra en la primera etapa que consisteix en l'oxidació de l'amoníac a monòxid de nitrogen:[14]

El procediment Andrussow per convertir metà i amoníac en àcid cianhídric funciona a temperatures més altes en la regió de 900 a 1.200 °C. Tot i que el rodi-platí té la mateixa eficiència de conversió que el platí pur en aquest procés, els aliatges de rodi del 5–10% s'utilitzen invariablement simplement a causa de les seves propietats superiors a alta temperatura. La reacció és:[13]
Té una gran aplicació el catalitzador de Wilkinson que s'obté per reacció en el si d'etanol de la trifenilfosfina amb el triclorur de rodi(III) . Fou el primer agent actiu conegut per a la hidrogenació en fase homogènia d'olefines i alquins en condicions suaus de pressió i temperatura. El seu ús fou introduït l'any 1966 pel Premi Nobel de Química de 1973 Geoffrey Wilkinson (1921–1996). És també actiu en processos de descarbonilació.[15]
Altres usos[modifica]

El rodi és un element molt usat en joieria. Normalment, l'or blanc es galvanitza amb una capa externa de rodi de 0,05–0,5 μm de gruix, tot i que el gruix ideal seria una capa de 2,0 μm perquè duri més temps.[16]
Aliatges de rodi fàcilment amb platí en totes les proporcions, tot i que la treballabilitat de l'aliatge resultant disminueix ràpidament amb l'augment del contingut de rodi. Els aliatges que contenen fins a un 40% de rodi, però, són viables i troben nombroses aplicacions. Els aliatges que contenen més d'un 40% de rodi, encara que són molt difícils de fabricar, són gairebé immunes als atacs dels àcids oxidants. L'aliatge Pt–10Rh és particularment resistent a l'atac del clor humit lliure com el produït per la combustió de vapors orgànics halogenats.[17]

L'aliatge de rodi al 10%, que té una resistència elèctrica més alta i un coeficient de temperatura més baix que el platí pur, s'utilitza en grans quantitats com a bobinatge durador dels forns. El contingut de rodi augmenta el punt de fusió, redueix la velocitat de volatilització i minimitza la velocitat d'atac dels materials siliciosos. Els forns de laboratori d'alta temperatura fan servir sovint bobinatges que contenen fins a un 40% de rodi.[13]
La resistència dels aliatges de rodi i platí a la corrosió és aproximadament la mateixa o lleugerament millor que la del platí pur, però són molt més estables a altes temperatures. Tenen una excel·lent resistència a la fluència per sobre de 1.000 °C, un factor que determina en gran manera el seu ús extensiu a la indústria del vidre, on es troben temperatures contínues que de vegades superen els 1.500 °C. Les addicions de rodi al platí redueixen de manera apreciable la volatilització del platí pur a altes temperatures.[17] Els gresols de laboratori que contenen fins a un 5% de rodi són més forts i més resistents als atacs químics que els de platí pur.[13]
Un cable de l'aliatge 10% de rodi i 90% de platí unit a un cable de platí pur forma un excel·lent termoparell per mesurar altes temperatures en una atmosfera oxidant. L'escala de temperatura internacional es defineix a la regió de 660 °C a 1.063 °C per la força electromotriu d'aquest termoparell.[9]
Perillositat[modifica]
Com a metall pur, el rodi és completament inert i no representa risc per a la salut humana. No obstant això, els compostos de rodi són altament tòxics i cancerígens.[18] Si es troba en forma de pols, és bàsic mantenir-lo allunyat d'espurnes o flames, ja que presenta risc d'explosió. Així mateix, cal evitar la inhalació d'aquesta pols.
Referències[modifica]
- ↑ «Rhodium: rhodium(I) fluoride compound data». OpenMOPAC.net. [Consulta: 10 desembre 2007].
- ↑ Magnetic susceptibility of the elements and inorganic compounds, a Handbook of Chemistry and Physics, 81a edició, CRC press.
- ↑ «Rhodium - Element information, properties and uses | Periodic Table». Royal Society of Chemistry, 2023. [Consulta: 20 febrer 2023].
- ↑ «rodi». Gran Diccionari de la Llengua Catalana. Barcelona: Grup Enciclopèdia Catalana. [Consulta: 20 febrer 2023].
- ↑ Emsley, John. Nature's building blocks : an A-Z guide to the elements. Oxford: Oxford University Press, 2001. ISBN 0-19-850341-5.
- ↑ 6,0 6,1 6,2 W.M. Haynes. CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data.. 2016-2017, 97a edició. Boca Raton, Florida: CRC Press, 2017. ISBN 978-1-4987-5429-3.
- ↑ «Rhodium global production volume by country» (en anglès). [Consulta: 21 febrer 2023].
- ↑ Barthelmy, David. «Mineral Species sorted by the element Rh Rhodium». Mineralogy Database. [Consulta: 20 febrer 2023].
- ↑ 9,0 9,1 9,2 9,3 9,4 «rhodium». Encyclopedia Britannica. Britannica, The Editors of Encyclopaedia, 16-12-2022. [Consulta: 21 febrer 2023.].
- ↑ 10,0 10,1 10,2 Winter, Mark. «WebElements Periodic Table » Rhodium » reactions of elements». [Consulta: 21 febrer 2023].
- ↑ «Z = 45». NuDat 3.0. National Nuclear Data Center (NNDC) at Brookhaven National Laboratory. [Consulta: 21 febrer 2023].
- ↑ Schäfer, Fred. Reduced Emissions and Fuel Consumption in Automobile Engines. Vienna: Springer Vienna, 1995. ISBN 978-3-7091-3806-9.
- ↑ 13,0 13,1 13,2 13,3 Darling, A.S.; Mech, A.M.I. «Rhodium-Platinum Alloys. A Critical Review of their Constitution and Properties». Platinum Metals Rev., 5, 3, 1961, pàg. 97.
- ↑ Anju, Anju; Sharma, Rakesh K. Green Chemistry for Beginners. CRC Press, 2021. ISBN 978-1-000-40105-9.
- ↑ «Rodi». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ Sanz Balagué, J.; Tomasa Guix, O. Elements i recursos minerals: aplicacions i reciclatge. 3a. Iniciativa Digital Politècnica, 2017. ISBN 978-84-9880-666-3.
- ↑ 17,0 17,1 Lyon, S.B.. Corrosion of Noble Metals* (en anglès). Elsevier, 2010, p. 2205–2223. DOI 10.1016/b978-044452787-5.00109-8. ISBN 978-0-444-52787-5.
- ↑ Efectes del rodi sobre la salut
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||















![{\displaystyle {\ce {[RhF5]4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ed491f18e01557820c33a6183e8d4675b13f76d9)
![{\displaystyle {\ce {Rh(s)\,+\,3F2(g)->RhF6(s)\quad [negre]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/91eac6711f7705c2050f124e95104a3f0e675c53)



![{\displaystyle {\ce {2Rh(s)\,+\,3F2(g)->2RhF3(s)\quad [vermell]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5b66e4d01e485e2e3e36fc73079a54e6a7f7cbda)
![{\displaystyle {\ce {2Rh(s)\,+\,3Cl2(g)->2RhCl3(s)\quad [vermell]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f8afe53156c48309f2d5e7a94c01b138a1e5c386)
![{\displaystyle {\ce {2Rh(s)\,+\,3Br2(g)->2RhBr3(s)\quad [vermell\;fosc]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6229310270d1ddfa71f0a5386a52c64e1ecff76f)













