Vanadi: diferència entre les revisions
m neteja i estandardització de codi |
→Rol biològic: Referències |
||
| Línia 75: | Línia 75: | ||
El vanadi és un [[element químic essencial]] en alguns organismes. En humans no està demostrada la seva essencialitat, tot i que existixen compostos de vanadi que imiten i potencien l'activitat de la [[insulina]]. |
El vanadi és un [[element químic essencial]] en alguns organismes. En humans no està demostrada la seva essencialitat, tot i que existixen compostos de vanadi que imiten i potencien l'activitat de la [[insulina]]. |
||
Es troba en alguns [[enzims]] en distints éssers vius. Per exemple, en les [[haloperoxidasa|haloperoxidasses]] (generalment bromoperoxidasses) d'algunes [[algues]], que redueixen [[peròxid]]s i alhora [[halogen]]en un substrat orgànic. Els [[ascídies|ascidis]] (uns organismes marins del [[subembrancament]] dels [[tunicats]]) emmagatzemen altes concentracions de vanadi, al voltant d'un milió de vegades més altes que l'aigua que els envolta, el qual s'acumula en una molècula anomenada [[hemovanadina]]. En aquests organismes el vanadi s'emmagatzema en unes [[cèl·lula|cèl·lules]] anomenades [[vanadocits]].<ref>{{Ref-publicació|article=The Mechanism of Accumulation of Vanadium by Ascidians: Some Progress towards an Understanding of this Unusual Phenomenon|url=http://i0289-0003-13-4-489.pdf/|publicació=Zoological Science|data=1996-08|issn=0289-0003|pàgines=489–502|volum=13|exemplar=4|doi=10.2108/zsj.13.489|llengua=en|nom=Hitoshi|cognom=Michibata}}</ref><ref>{{Ref-publicació|article=Vanadocytes, cells hold the key to resolving the highly selective accumulation and reduction of vanadium in ascidians|url=https://onlinelibrary.wiley.com/doi/10.1002/jemt.10042|publicació=Microscopy Research and Technique|data=2002-03-15|issn=1059-910X|pàgines=421–434|volum=56|exemplar=6|doi=10.1002/jemt.10042|llengua=en|nom=Hitoshi|cognom=Michibata|nom2=Taro|cognom2=Uyama|nom3=Tatsuya|cognom3=Ueki|nom4=Kan|cognom4=Kanamori}}</ref> |
|||
Es troba en alguns [[enzims]] en distints éssers vius. Per exemple, en les [[haloperoxidasa|haloperoxidasses]] (generalment bromoperoxidasses) d'algunes [[algues]], que redueixen [[peròxid]]s i alhora [[halogen]]en un substrat orgànic. |
|||
També acumula altes concentracions de vanadi el [[reig de fageda]], formant, en aquest [[fong]], un complex amb un lligant [[ionòfor]] anomenat [[amavadina]].<ref>{{Ref-llibre|títol=Amavadine, a Vanadium Compound in Amanita Fungi|url=http://link.springer.com/10.1007/978-94-007-0913-3_2|editorial=Springer Netherlands|data=2012|lloc=Dordrecht|isbn=978-94-007-0912-6|pàgines=35–49|doi=10.1007/978-94-007-0913-3_2|llengua=en|nom=José A. L.|cognom=da Silva|nom2=João J. R. Fraústo|cognom2=da Silva|nom3=Armando J. L.|cognom3=Pombeiro}}</ref> |
|||
Els [[ascídies|ascidis]] (uns organismes marins del [[subembrancament]] dels [[tunicats]]) emmagatzemen altes concentracions de vanadi, al voltant d'un milió de vegades més altes que l'aigua que els envolta, el qual s'acumula en una molècula anomenada ''hemovanadina''. En aquests organismes el vanadi s'emmagatzema en unes [[cèl·lula|cèl·lules]] anomenades ''vanadocits''. |
|||
També acumula altes concentracions de vanadi el [[reig de fageda]], formant, en aquest [[fong]], un complex amb un lligant [[ionòfor]] anomenat ''amavadina''. |
|||
== Precaucions == |
== Precaucions == |
||
Revisió del 10:13, 21 abr 2023
| Vanadi | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
23V
| ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||||||||||||||
Metall blau-gris platejat Vanadi sòlid vist amb un microscopi  Línies espectrals del vanadi | ||||||||||||||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Vanadi, V, 23 | |||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | |||||||||||||||||||||||||||||||||
| Grup, període, bloc | 5, 4, d | |||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 50,9415(1) | |||||||||||||||||||||||||||||||||
| Configuració electrònica | [Ar] 3d3 4s2 2, 8, 11, 2 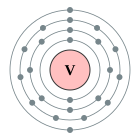
| |||||||||||||||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||||||||||||||
| Fase | Sòlid | |||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
6,0 g·cm−3 | |||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
5,5 g·cm−3 | |||||||||||||||||||||||||||||||||
| Punt de fusió | 2.183 K, 1.910 °C | |||||||||||||||||||||||||||||||||
| Punt d'ebullició | 3.680 K, 3.407 °C | |||||||||||||||||||||||||||||||||
| Entalpia de fusió | 21,5 kJ·mol−1 | |||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 459 kJ·mol−1 | |||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 24,89 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||
| Pressió de vapor | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 5, 4, 3, 2, 1, -1 (òxid amfòter) | |||||||||||||||||||||||||||||||||
| Electronegativitat | 1,63 (escala de Pauling) | |||||||||||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 650,9 kJ·mol−1 | |||||||||||||||||||||||||||||||||
| 2a: 1.414 kJ·mol−1 | ||||||||||||||||||||||||||||||||||
| 3a: 2.830 kJ·mol−1 | ||||||||||||||||||||||||||||||||||
| Radi atòmic | 134 pm | |||||||||||||||||||||||||||||||||
| Radi covalent | 153±8 pm | |||||||||||||||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Cúbica centrada en la cara 
| |||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic | |||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 197 nΩ·m | |||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 30,7 W·m−1·K−1 | |||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 8,4 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 4.560 m·s−1 | |||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 128 GPa | |||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 47 GPa | |||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 160 GPa | |||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,37 | |||||||||||||||||||||||||||||||||
| Duresa de Mohs | 6,7 | |||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-62-2 | |||||||||||||||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del vanadi | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
El vanadi és l'element químic de símbol V i nombre atòmic 23. Es tracta d'un metall de transició dúctil de color gris argentat. Està situat en el grup 5 de la taula periòdica dels elements.[1] És un metall bla i poc abundant. Es troba en distints minerals i s'empra principalment en alguns aliatges. Fou descobert per Andrés Manuel del Río Fernández el 1801 a una mina de Mèxic.
Història

El vanadi fou descobert pel mineralogista espanyol Andrés Manuel del Río Fernández (1764-1849), en el laboratori del Real Seminario de Minería de la Ciudad de México, Nova Espanya, el 1801, en un mineral de plom d'una mina de Zimapán, Hidalgo, que anomenà «plom terrós de Zimapán» o «zimapanio» i que actualment s'anomena vanadinita, de fórmula . Primer l'anomenà pancromo, dels mots grecs παν– pan–, ‘totalitat’ i χρῶμα chrôma ‘color’, perquè les seves sals presentaven tots els colors —del Río no coneixia en aquell moment el descobriment del crom per Louis Nicolas Vauquelin (1763-1829) el 1798—; i després eritronio, del grec ἐρυθρο– erythro–, ‘roig’, a causa del color de que les seves sals es tornaven roges en escalfar-les.[2]

Del Río donà una mostra del mineral a Alexander von Humboldt (1769-1859) quan el visità a Mèxic i aquest, quan retornà a Europa el 1805, demanà al químic francès Hippolyte Victor Collet-Descotils (1773-1815) que l'analitzés. Aquest qüestionà el descobriment d'un nou element indicant que realment es tractava de crom impur, element el descobriment del qual ell havia confirmat. Això provocà que del Río es retractés públicament del seu descobriment, ja que els francesos dominaven la recerca en química en aquells anys.[2]

En la dècada del 1820, el suec Nils Gabriel Sefström (1787-1845) el redescobrí en un òxid que trobà mentre treballava en unes menes de ferro a la mina de Falun i li donà el nom d'«odinium», en honor del déu nòrdic Odin. Jöns Jacob Berzelius (1779-1948), que dirigia els treballs de recerca de Sefström, li canvià el nom pel d'«erianum». El 1831, el químic alemany Friedrich Wöhler (1800-1882) arribà a la conclusió que es tractava del mateix element descobert el 1801 i el reanomenà «sefströnium», abans que, el mateix Sefström li donés el nom que rep actualment. El nom de vanadi deriva del nòrdic antic Vanadís 'Vanadis', 'senyora dels Vanir' i deessa de la fertilitat en la mitologia escandinava, coneguda també com a Freia.[1]
El vanadi metàl·lic no es fou preparat fins a l'any 1867, per Henry Enfield Roscoe (1833-1915),[1] per mitjà de la reducció de triclorur de vanadi amb hidrogen.
Estat natural i obtenció

El vanadi és el vintè element més abundant a l'escorça terrestre. És rar trobar-lo en estat natiu, però està present en dos-cents setze minerals diferents. Els que el contenen en més d'un 55 % són: karelianita (67,98 %), oxivanita (65,64 %), paramontroseïta (61,42 %), shcherbinaïta (56,02 %) i häggita (55,10 %). També es troba en la bauxita, així com en dipòsits que contenen carboni, com per exemple en carbó, petrolis, cru i quitrà. S'extreu del petroli emprant porfirines. A més, s'obté pentaòxid de divanadi, V₂O₅, recuperant-lo de la combustió del vanadi.
Els vanadats es dissolen per mitjà d'una fusió alcalina. Al medi àcid i després d'altres processos s'obté el V₂O₅, que es redueix parcialment amb carboni, i després amb calci en atmosfera d'argó per a obtindre vanadi metàl·lic.
En el cas que no es partisca d'un mineral que continga el vanadat, sinó d'un sulfur, aquest s'oxida per a obtindre el vanadat i es realitza el mateix procediment per a obtindre vanadi.
Si es vol obtindre vanadi més pur, s'empra el mètode Van Arkel-de Boer (formació d'un compost volàtil i la seva posterior descomposició).
Característiques principals
El vanadi és un metall de transició blanc, dúctil i brillant. Aquest metall, presenta una alta resistència a les bases, a l'àcid sulfúric (H₂SO₄) i a l'àcid clorhídric (HCl). S'obté de distints minerals, així com del petroli. També es pot obtindre de la recuperació de l'òxid de vanadi (V) (V₂O₅) en pols procedent de processos de combustió. Té algunes aplicacions nuclears a causa de la seua baixa secció de captura de neutrons. És un element essencial en alguns éssers vius, com els tunicats, encara que no es coneix la seva funció.
En els seus compostos presenta variats estats d'oxidació, sent els més comuns +2, +3, +4 i +5.
Compostos
- Presenta variats estats d'oxidació, amb distints colors. Per mitjà d'un experiment senzill es pot apreciar: partint de vanadat d'amoni (NH₄VO₄), i emprant zinc metàl·lic en medi àcid, es produeix la sèrie de reaccions següent:
- VO₄3- (incolor) → [VO(OH₂)₅]2+ (blau) → [V(OH₂)₆]3+ (verd) → [V(OH₂)₆]2+ (violeta)
- El pentaòxid de divanadi, V₂O₅, que se sol obtindre com un sòlid polsós de color taronja, és un agent oxidant, i s'empra com a catalitzador i com colorant.

- El catió vanadil, VO2+, on el vanadi està en estat d'oxidació +4, sent l'enllaç V=O doble, es pot trobar en distints complexos de vanadi, generalment amb quatre lligants més, formant una piràmide de base quadrada. Poden presentar un lligant més en posició trans al lligant oxo, però aquesta posició és prou làbil. Generalment els complexos d'aquest tipus són blau. En l'estat d'oxidació +5, també forma complexos amb lliguands oxo.
Isòtops
En la naturalesa es pot trobar un isòtop estable, el vanadi-51. S'han caracteritzat quinze radioisòtops, sent els més estables el vanadi-50, amb un període de semidesintegració d'1,4 x 1017 anys, el vanadi-49, de 330 dies, i el vanadi-48, de 15,9735 dies. La resta tenen períodes inferiors a una hora, essent la majoria de menys de deu segons. A més, aquest element presenta un metaestat.
El pes atòmic dels isòtops de vanadi va des de 43,981 uma (vanadi-43) fins a 59,959 uma (vanadi-59). El principal mode de decaïment abans de l'isòtop més estable, vanadi-51, és la captura d'electrons (sent els principals productes de decaïment isòtops de l'element 22, titani), mentre que després d'aquest, és la desintegració beta (donant com principals productes de decaïment isòtops de l'element 24, crom).
Aplicacions
Indústria metal·lúrgica

La principal aplicació del vanadi —el 80 %— és la formació de l'aliatge ferrovanadi que s'utilitza com a additiu en la fabricació d'acers per a millorar les propietats mecàniques del ferro: eines, eixos i cigonyals de vehicles, ganivets, engranatges, blindatge de vehicles, etc.[1]
El vanadi, afegit a aliatges de titani i alumini, en millora la resistència mecànica i hi proporciona estabilitat a altes temperatures; aquests aliatges s'empren en la fabricació dels motors dels avions.[1]
Indústria química

La segona principal aplicació és en forma de òxid de vanadi(V), que s'utilitza com a catalitzador químic, això és, ajudant a accelerar la reacció química sense consumir-se. Destaca el seu ús en la producció d'àcid sulfúric, tant en el procés de contacte i com en el procés humit, on accelera l'oxidació amb oxigen del diòxid de sofre a triòxid de sofre:
Els pigments grocs de vanadat de bismut són respectuosos amb el medi ambient i es poden utilitzar com a substitut del groc de cadmi i el groc de crom, tòxics.Tenen un bon rendiment i s'utilitzen per a plàstics, gomes, ceràmica, pintura i tintes d'impressió. Es fan servir especialment per a la pintura groga per a cotxes i per a recobriments arquitectònics d'alt rendiment.[3]
Indústria del vidre
El pentaòxid de vanadi s'afegeix en un 0,02 % al vidre per prevenir la transmissió de raigs ultraviolats d'alta energia que poden danyar els ulls i esvair els colors dels teixits. El vanadi també s'utilitza en vidre groc-verdós, on el vidre verd es fa afegint una barreja d'òxid de vanadi i òxid de cesi per reduir la intensitat de la radiació UV.[3]
Indústria de bateries

S'utilitza en bateries redox de vanadi recarregables, que poden acumular grans quantitats d'energia elèctrica, per a compensar variacions en la sortida de potència de fonts renovables com l'energia eòlica.[1] S'està estudiant l'ús de parells redox de vanadi per a les bateries recarregables d'ió liti, que podria suposar una capacitat d'emmagatzematge superior a la de les bateries de liti tradicionals.
Altres

És un important estabilitzador de carburs en la fabricació d'acers. S'empra en alguns components de reactors nuclears. Forma part, com aliatge , d'alguns imants superconductors.
El vanadat de bismut s'utilitza com a pigment indicador de temperatura. A 25 °C, el pigment és groc o groc clar, a 140 °C és taronja-vermell, mentre que a 350 °C és taronja-vermellós a rosa; no obstant això, no hi ha una temperatura de transició clara.[3]
Els òxids i vanadats s'utilitzen en la producció d'una tinta d'impressió que reacciona per produir un recobriment de resina negre. L'addició de vanadat d'amoni pot produir tinta de secat ràpid. També s'utilitza una petita quantitat de pentaòxid de vanadi en la indústria de la impressió tèxtil. El vanadi ajuda a oxidar l'anilina i a produir un tint negre fort que no es descoloreix.[3]
Els critalls de vanadat d'itri dopats amb neodimi són emprats en raigs làser.[3]
Rol biològic
El vanadi és un element químic essencial en alguns organismes. En humans no està demostrada la seva essencialitat, tot i que existixen compostos de vanadi que imiten i potencien l'activitat de la insulina.
Es troba en alguns enzims en distints éssers vius. Per exemple, en les haloperoxidasses (generalment bromoperoxidasses) d'algunes algues, que redueixen peròxids i alhora halogenen un substrat orgànic. Els ascidis (uns organismes marins del subembrancament dels tunicats) emmagatzemen altes concentracions de vanadi, al voltant d'un milió de vegades més altes que l'aigua que els envolta, el qual s'acumula en una molècula anomenada hemovanadina. En aquests organismes el vanadi s'emmagatzema en unes cèl·lules anomenades vanadocits.[4][5]
També acumula altes concentracions de vanadi el reig de fageda, formant, en aquest fong, un complex amb un lligant ionòfor anomenat amavadina.[6]
Precaucions
La pols metàl·lica és pirofòrica, i els compostos de vanadi han de ser considerats com a altament tòxics. La seva inhalació pot causar càncer de pulmó.
L'Administració de Seguretat i Salut Ocupacional (OSHA) ha establert un límit d'exposició per a la pols de pentaòxid de divanadi de 0,05 mg/m3, i de 0,1 mg/m³ per al gas de pentaòxid de divanadi en l'aire del lloc de treball per a una jornada de 8 hores, 40 hores a la setmana.
L'Institut Nacional de Salut i Seguretat Ocupacional (NIOSH) recomana que ha de considerar-se perillós per a la salut i la vida un nivell de 35 mg/m³ de vanadi. Aquest nivell correspon al que pot causar problemes permanents de salut o mort.
Referències
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 Challoner, Jack. los elementos. La nueva guía de los componentes básicos del universo. (en castellà). Alcobendas: LIBSA, 2018, p. 45,46. ISBN 9788466236669.
- ↑ 2,0 2,1 Salas, José Alfredo Uribe «Historia del vanadio, 1801-1831. Disputa por la autoria del descubrimiento» (en castellà). Asclepio, 72, 2, 17-11-2020, p322–p322. DOI: 10.3989/asclepio.2020.23. ISSN: 1988-3102.
- ↑ 3,0 3,1 3,2 3,3 3,4 Yang, Baoxiang. Vanadium: extraction, manufacturing and applications. Amsterdam: Elsevier Science, 2020. ISBN 0-12-818899-5.
- ↑ Michibata, Hitoshi «The Mechanism of Accumulation of Vanadium by Ascidians: Some Progress towards an Understanding of this Unusual Phenomenon» (en anglès). Zoological Science, 13, 4, 8-1996, pàg. 489–502. DOI: 10.2108/zsj.13.489. ISSN: 0289-0003.
- ↑ Michibata, Hitoshi; Uyama, Taro; Ueki, Tatsuya; Kanamori, Kan «Vanadocytes, cells hold the key to resolving the highly selective accumulation and reduction of vanadium in ascidians» (en anglès). Microscopy Research and Technique, 56, 6, 15-03-2002, pàg. 421–434. DOI: 10.1002/jemt.10042. ISSN: 1059-910X.
- ↑ da Silva, José A. L.; da Silva, João J. R. Fraústo; Pombeiro, Armando J. L.. Amavadine, a Vanadium Compound in Amanita Fungi (en anglès). Dordrecht: Springer Netherlands, 2012, p. 35–49. DOI 10.1007/978-94-007-0913-3_2. ISBN 978-94-007-0912-6.
Enllaços externs
- webelements.com - Vanadi (anglès)
- environmentalchemistry.com - Vanadi (anglès)
- AMM.com Perfil del Vanadi Arxivat 2005-03-05 a Wayback Machine. (anglès)
- Mineral Information Institute - Vanadium Arxivat 2006-03-08 a Wayback Machine. (anglès)
- ATSDR - ToxFAQs: Vanadium (anglès)
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||









![{\displaystyle {\ce {2SO2(g) + O2(g) ->[V_2O_5] 2SO3(g)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6ecd305e30a00041ca26c9b57e1102e9fcaa9d06)


